Hojas de datos EPA: Óxidos de Nitrógeno (NOx), ¿Por Qué y Cómo Se Controlan?
- Creado por admin
- El 11 agosto, 2005
- 0
|
Óxidos de Nitrógeno (NOx), ¿Por Qué y Cómo Se Controlan?
|
||||||||||||||||||||||||
|
“Cuando tratamos de observar sólo una cosa en la Naturaleza, nos damos cuenta que está conectada a todo lo demás.” John Muir Los óxidos de nitrógeno (NOx) son una familia muy interesante e importante de compuestos químicos que contaminan el aire. Este boletín explica por qué los NOx son importantes contaminantes del aire y cómo los NOx se forman y reaccionan en la atmósfera. Este boletín también discute los principios en que están basadas todas las tecnologías de control y prevención de la contaminación por NOx; las tecnologías de control de NOx disponibles para varias fuentes de combustión; y el rendimiento y costo de las tecnologías de control de NOx. |
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||
|
¿Por qué debemos controlar los NOx?
|
||||||||||||||||||||||||
| Los NOx representan a una familia de siete compuestos. En realidad, la EPA regula sólo el bióxido de nitrógeno (NO2) como un suplente para esta familia de compuestos porque es la forma más predominante de NOx en la atmósfera que es generada por actividades antropogénicas (humanas). El NO2 no es sólo un contaminante importante del aire por sí sólo, sino que también reacciona en la atmósfera para formar ozono (O3) y lluvia ácida. Es importante notar que el ozono que deseamos minimizar es el ozono troposférico; esto es, el ozono en el aire ambiental que respiramos. No estamos hablando acerca del ozono en la atmósfera superior que no podemos respirar. El ozono estratosférico nos protege y protege a la tropósfera de la radiación ionizadora proveniente del sol.
La EPA ha establecido las National Ambient Air Quality Standards – NAAQS (Normas Nacionales de Calidad del Aire Ambiental), para el NO2 y el ozono troposférico. Las NAAQS definen los niveles de calidad del aire que son necesarios, con un margen razonable de seguridad, para proteger la salud pública (norma primaria) y el bienestar público (norma secundaria) de cualquier efecto adverso conocido o anticipado de la contaminación. La norma primaria y secundaria para el NO2 es de 0.053 partes por millón (ppm) (100 microgramos por metro cúbico) de concentración anual aritmética promedio. El ozono troposférico ha sido y sigue siendo un problema significativo de contaminación del aire en los Estados Unidos y es el principal constituyente del smog (la niebla visible que es el resultado de polución aérea contiene oxidantes fotoquímicos). Grandes porciones del país no cumplen con las normas NAAQS para el ozono y por lo tanto exponen a grandes segmentos de la población a niveles poco saludables de ozono en el aire. El NO2 reacciona en la presencia del aire y la luz ultravioleta (UV) bajo la luz del sol para formar ozono y óxido nítrico (NO). A su vez, el NO reacciona con radicales libres en la atmósfera, que también son creados por la acción de la luz UV sobre compuestos orgánicos volátiles (COV). A su vez, los radicales libres reciclan NO a NO2. De esta manera, cada molécula de NO puede producir ozono un múltiplo de veces.40 Esto continuará hasta que los COV sean reducidos a compuestos de cadenas cortas de carbón que dejan de ser fotoreactivos (una reacción causada por la luz). Una molécula de COV puede por lo general realizar esto unas 5 veces. |
||||||||||||||||||||||||
|
¿Qué es un Óxido de Nitrógeno?
|
||||||||||||||||||||||||
|
El nitrógeno molecular diatómico (N2) es un gas relativamente inerte que compone alrededor del 80% del aire que respiramos. Sin embargo, el elemento químico nitrógeno (N), en forma monoatómica, puede ser reactivo y poseer niveles de ionización (llamados estados de valencia) desde más uno a más cinco. Por esto el nitrógeno puede formar varios óxidos diferentes. Usando el modelo Niels Bohr del átomo, el estado de valencia se relaciona al número de electrones que están deficientes (valencia positiva) o en exceso (valencia negativa) en el ion en comparación con la molécula neutral. La familia de compuestos NOx y sus propiedades se enumeran en la Tabla 1.. Tabla 1. Óxidos de Nitrógeno (NOx)
Los iones oxígeno se encuentran siempre con una valencia de menos 2. Dependiendo del número de iones de oxígeno (siempre balanceados por el estado de valencia del nitrógeno), los NOx pueden reaccionar ya sea para agotar o para incrementar las concentraciones de ozono. El ion nitrógeno en estos óxidos en realidad efectúa una danza en la que tiene (en ocasiones diversas) varios números de iones de oxígeno como compañeros. El nitrógeno cambia sunúmero de compañeros cuando cambia su nivel de energía de ionización, Esto sucede siempre que el NOx: (1) es golpeado con un fotón de radiación ionizadora (UV o luz de longitud de onda corta); (2) es golpeado con suficientes fotones como para transferir juntos la energía suficiente para cambiar su nivel de ionización; (3) es catalizado; (4) es estimulado suficientemente por energía termal infraroja (IR); (5) reacciona con un radical químicamente oxidante o reductor (un fragmento ionicado de una molécula); o (6) reacciona con un ion químicamente oxidante o Cuando cualquiera de estos óxidos se disuelve en agua y se descompone, forma ácido nítrico (HNO3) o ácido nitroso (HNO2). El ácido nítrico forma sales de nitrato cuando es neutralizado. El ácido nitroso forma sales de nitrito. De esta manera, los NOx y sus derivados existen y reaccionan ya sea como gases en el aire, como ácidos en gotitas de agua, o como sales. Estos gases, gases ácidos y sales contribuyen en conjunto a los efectos de contaminación que han sido observados y atribuidos a la lluvia ácida. El óxido nitroso (N2O), el NO, y el NO2 son los óxidos de nitrógeno más abundantes en el aire. El N2O (también conocido como gas hilarante) es producido abundantemente por fuentes biogénicas tales como las plantas y levaduras. Es sólo levemente reactivo, y es un analgésico (o sea, a diferencia de un anestésico aún siente usted dolor, pero se siente tan bien que no le molesta). El N2O es una sustancia agotadora de nitrógeno que reacciona con el O3 tanto en la tropósfera (o sea, por debajo de los 10,000 pies sobre el nivel del mar) como en la estratósfera (50,000 – 150,000 pies). El N2O tiene un largo período de vida, estimado entre 100 y 150 años. La oxidación del N2O por el O3 puede ocurrir a cualquier temperatura y genera a la vez oxígeno molecular (O2) y NO o dos moléculas de NO unidas como su dímero, el bióxido de dinitrógeno (N2O2). Después el NO o N2O2 se oxida rápidamente (en alrededor de dos horas) a NO2. El NO2 a su vez crea una molécula de ozono a partir de una molécula de oxígeno (O2) cuando es golpeado por un fotón de energía ionizadora proveniente de la luz solar. El N2O es también un “Gas de Invernadero” que, como el bióxido de carbono (CO2), absorbe la radiación infraroja de longitud de onda larga para retener el calor que irradia la Tierra, y de esa manera contribuye al calentamiento global. Las emisiones de NOx provenientes de la combustión son principalmente en la forma de NO. De acuerdo a las ecuaciones Zeldovich, el NO es generado hasta el límite del oxígeno disponible(alrededor de 200,000 ppm) en el aire a temperaturas por encima de 1300-C (2370-F). A temperaturas menores de 760-C (1,400-F), el NO es generado a concentraciones mucho más bajas o no se genera en absoluto. El NO de combustión es generado en función de la relación aire a combustible y es más pronunciado cuando la mezcla está del lado magro en combustible de la relación estequiométrica 50 (la relación de las sustancias químicas que entran en reacción). Las ecuaciones Zeldovich son: N2 + O – NO + N A excepción del NO proveniente del suelo, los relámpagos, y los incendios naturales, el NO es antropogénico (o sea, generado por la actividad humana) en su mayor parte. Se cree que las fuentes biogénicas son responsables de menos del 10% de las emisiones totales de NO. El NO produce la misma interrupción en la absorción del oxígeno por la sangre que el monóxido de carbono (CO). Sin embargo, puesto que el NO es sólo geramente soluble en agua, no presenta amenaza real alguna excepto a infantes e individuos muy sensibles. El NO2 se encuentra presente en la atmósfera y en la lluvia ácida. Produce ácido nítrico (HNO3) al disolverse en agua. Cuando el NO2 reacciona con un fotón para hacer que el O2 se vuelva O3, el NO2 se transforma en NO. Este NO es a su vez oxidado en cuestión de horas a NO2 por medio de radicales provenientes de la fotoreacción de COV. Por lo tanto, nuestra concentración actual de ozono es el producto de la contaminación tanto de NOx como de COV. El trióxido de dinitrógeno (N2O3) y el tetróxido de dinitrógeno (N2O4) existen en concentraciones muy bajas en el gas de chimenea. Sin embargo, existen en concentraciones tan bajas en la atmósfera que tanto su presencia como su efecto son ignorados con frecuencia. El N2O4 es un par de moléculas de NO2 unidas (otro dímero) y reacciona como el NO2; así, la presencia de N2O4 puede ser enmascarada por el más abundante NO2. El pentóxido de dinitrógeno (N2O5) es la forma más altamente ionizada de óxido de nitrógeno. Es generado en el aire en una concentración muy baja, a menos que sea emitido por algún proceso (tal como una instalación productora de ácido nítrico) que esté diseñada específicamente para generarlo. El N2O5 es altamente reactivo, y forma ácido nítrico (HNO3) cuando se descompone en el agua. Algunos expertos creen que el NO2 es un buen suplente para los NOx porque el NO se convierte rápidamente en NO2, y el N2O tiene un período de vida tan largo porque no es tan altamente reactivo. Otros creen que debido a su participación en la formación del ozono, tanto el NO como el NO2 deben ser considerados NOx. Aún otros creen que todos los óxidos de nitrógeno (incluyendo el N2O) necesitan ser reglamentados. El NO y el NO2 son ciertamente las formas más abundantes de NOx y provienen en su mayor parte (pero no exclusivamente) de fuentes antropogénicas. El N2O es biogénico en su mayor parte, y como tal no está sujeto a regulación. Para propósitos ambientales, el uso de la concentración de NO2 como un suplente de la concentración de NOx ha parecido ser suficiente, debido a que es el precursor para el ozono. |
||||||||||||||||||||||||
|
¿De dónde provienen los NOx? |
||||||||||||||||||||||||
|
Los automóviles y otras fuentes móviles contribuyen alrededor de la mitad de los NOx que son emitidos. Las calderas de las plantas termoeléctricas producen alrededor del 40% de las emisiones de NOx provenientes de fuentes estacionarias. Además, también se añaden emisiones sustanciales provenientes de fuentes antropogénicas tales como las calderas industriales, incineradores, turbinas de gas, motores estacionarios de diesel y de encendido por chispa, fábricas de hierro y acero, manufactura de cemento, manufactura de vidrio, refinerías de petróleo, y manufactura de ácido nítrico. Las fuentes naturales o biogénicas de óxidos de nitrógeno incluyen los relámpagos, incendios forestales, incendios de pastos, árboles, arbustos, pastos, y levaduras.1 Estas fuentes diversas producen diferentes cantidades de cada óxido. Las fuentes antropogénicas se pueden mostrar aproximadamente como:
|
||||||||||||||||||||||||
|
Esto muestra una representación gráfica de las emisiones de nuestras dos mayores fuentes de NOx. Si pudiéramos reducir las emisiones de NOx provenientes de sólo estas dos categorías principales, podríamos vivir con el resto. Sin embargo, no espere usted que cualquiera de estas categorías se vuelvan cero en un futuro cercano. No podemos esperar que el automóvil, camión, autobús, y avión desaparezcan. El automóvil con cero emisiones todavía está sobre la mesa de diseño y no en la línea de producción. Además, los hábitos sociales tendrán que cambiar antes de que el consumo de electricidad pueda ser reducido. En toda combustión hay tres oportunidades para la formación de NOx. Estos NOx son: 1. NOx Termales – La concentración de “NOx termales” es controlada por las concentraciones molares de nitrógeno y oxígeno y la temperatura de combustión. La combustión a temperaturas bien por debajo de 1,300-C (2,370-F) forma concentraciones mucho más bajas de NOx termales. 2. NOx Combustibles– Los combustibles que contienen nitrógeno (como el carbón) crean “NOx combustibles” que resultan de la oxidación del nitrógeno ya ionizado contenido en el combustible. 3. NOx Inmediatos – Los NOx inmediatos son formados a partir del nitrógeno molecular en el aire combinándose con combustible en condiciones ricas en combustible que existen, hasta cierto punto, en toda combustión. Este nitrógeno a su vez se oxida junto con el combustible y se convierte en NOx durante la combustión, de la misma manera que los NOx combustibles. La abundancia de NOx inmediatos es disputada por los diversos escritores de artículos y reportes – probablemente porque cada uno de ellos está considerando combustibles que contienen intrínsecamente cantidades muy grandes o muy pequeñas de nitrógeno, o considerando quemadores intencionados para tener o no tener regiones ricas en combustible en la llama. |
||||||||||||||||||||||||
|
¿Cómo afectan los NOx el medio Ambiente?
|
||||||||||||||||||||||||
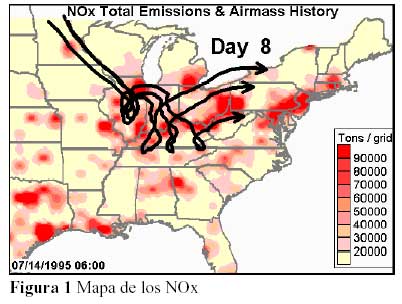
Debido a que los NOx son transparentes a la mayoría de las longitudes de onda de la luz (aunque el NO2 tiene un color café y el escaso N2O3 es negro), permiten que la vasta mayoría de los fotones atraviesen y, por tanto, tienen un período de vida de por lo menos varios días. Debido a que el NO2 es reciclado a partir del NO por medio de la fotoreacción de COV para producir más ozono, el NO2 parece poseer un período de vida aún más largo y es capaz de viajar distancias considerables antes de crear ozono. Los sistemas meteorológicos generalmente viajan sobre lasuperficie de la tierra y permiten que los efectos atmosféricos se muevan viento abajo por varios cientos de millas. Esto fue asentado en reportes de la EPA hace más de veinte años. Estos reportes encontraron que cada ciudad principal en la costa occidental de los Estados Unidos cuenta con una pluma de ozono que se extiende más de cien millas mar adentro antes de que las concentraciones disminuyan a 100 partes por mil millón (ppb). Otro reporte cita el mismo fenómeno para la ciudad de St. Louis. Por lo tanto, este problema no existía únicamente en la costa occidental. Puesto que el ozono en el aire limpio tiene un período de vida de sólo unas pocas horas, este fenómeno es una medida del efecto y la persistencia de tanto los COV como los NOx. Las diferencias en las predicciones de las distancias entre la emisión de NOx y la generación de ozono pueden relacionarse con las diferencias en las velocidades (del viento) de transporte de la pluma tanto como otros factores meteorológicos y de calidad del aire. Es importante notar que, bajo las condiciones adecuadas, las plumas de las termoeléctricas pueden recorrer distancias relativamente largas durante la noche con poca pérdida de COV, NO y NO2. Estos contaminantes pueden de este modo estar disponibles y participar en reacciones fotoquímicas en ubicaciones distantes al día siguiente. La figura 1 muestra un mapa de la concentración de NOx dibujado por el Center for Air Pollution Impact and Trend Analysis – CAPITA (Centro de Impacto y Análisis de Tendencias de la Contaminación del Aire), en la Universidad de Washington en St. Louis y reportado al Ozone Transport Assessment Group – OTAG (Grupo de Evaluación del Transporte de Ozono), un grupo nacional de trabajo que trató el problema del ozono al nivel del suelo (smog) y el transporte a largo plazo de la contaminación del aire a través de la parte occidental de los Estados Unidos. |
||||||||||||||||||||||||
 |
||||||||||||||||||||||||
|
El OTAG fue producto de una asociación entre la EPA, el Environmental Council of the States – ECOS (Consejo Ambiental de los Estados), y varios grupos ambientales y de la industria con el objetivo de producir una evaluación a conciencia y un consenso para reducir el ozono al nivel del suelo y los contaminantes que lo causan. La versión animada de la figura 1 muestra la trayectoria de emisiones de NOx desplazándose con el clima durante un período de 8 días. La figura 2 es un mapa de la concentración de ozono que muestra la misma trayectoria durante el período de 8 días. La versión animada muestra las concentraciones de NOx y ozono a la vez, moviéndose con el clima a lo largo de varios cientos de millas.
|
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||
|
El ozono es el constituyente principal del smog. Entre 1970 y 1990, nosotros en los Estados Unidos hemos intentado controlar el ozono principalmente por medio del control de las emisiones de COV, Sin embargo, hemos obtenido resultados mixtos, puesto que aunque algunas zonas disminuyeron sus emisiones de COV y lograron sus objetivos de ozono, otras no los lograron. Ahora parece ser que las comunidades que fracasaron en el logro de sus objetivos de ozono pudieran no ser completamente culpables, ya que parecen afectadas por las emisiones de NOx y COV en el aire que les llega. Para alcanzar las NAAQS del ozono, la EPA debe ahora reglamentar las emisiones de NOx regionalmente. |
||||||||||||||||||||||||
|
¿Existen otros asuntos relacionados con los NOx?
|
||||||||||||||||||||||||
|
Sí. Los problemas de enriquecimiento de nutrientes (eutroficación) ocurren en cuerpos de agua cuando la disponibilidad ya sea de los nitratos o de los fosfatos se vuelve demasiado grande. Como resultado, la relación de nitrógeno a fósforo, silicio, y hierro y otros nutrientes es alterada. Esta alteración puede inducir cambios en el fitoplancton, producir brotes algáceos tóxicos o nocivos de color café o rojos (llamados “marea roja”), o estimular otro crecimiento vegetal. Los brotes algáceos y el crecimiento vegetal producen una sombra y causan la muerte de otras plantas en el agua, lo que agota el contenido de oxígeno en el agua (hipoxia) cuando las plantas mueren, se hunden y se descomponen. Tal eutroficación puede volver inhabitables a los estratos de agua del fondo tanto para los animales marinos (tales como los peces y los mariscos) como para las plantas acuáticas. Puede proseguir virtualmente hasta la profundidad completa del agua. Se estima que entre el 12% y el 44% de la carga de nitrógeno de los cuerpos de agua de la costa provienen del aire.40 Los lagos interiores también son afectados de esta manera. Otra dimensión del problema es que la combustión a alta temperatura puede convertir el azufre en el combustible en SO2 y SO3. Mientras el SO2 es tóxico y forma ácido sulfuroso al ser disuelto en agua, el SO3 es tóxico e higroscópico (absorbente de agua) a la vez y forma ácido sulfúrico combinándose con la humedad en la atmósfera. El SO2 y el SO3 forman sulfitos y sulfatos cuando sus ácidos son neutralizados. Ambos ácidos pueden formar partículas sólidas reaccionando con el amoníaco en el aire. El SO2 y el SO3 también contribuyen a los cambios de pH (acidez) en el agua, los que pueden afectar adversamente tanto a la vida terrestre como a la acuática. Por eso, tanto los NOx como los SOx provenientes de la combustión pueden aniquilar plantas y animales. CAPITA ha demostrado que existen cantidades aproximadamente iguales por peso de sulfato/sulfito, nitrato y partículas orgánicas componiendo el 90% de la Materia Particulada menor de 2.5 micras de diámetro aerodinámico (MP-2.5). Esto fue confirmado por investigadores de la Universidad BrighamYoung. El Estudio de Seis Ciudades, publicado en New England Journal of Medicine en 1990, ha demostrado que la enfermedad y muerte prematura se correlacionan cercanamente con la cantidad de MP-2.5 en el aire. Por lo tanto, existe información epidemiológica denunciando a los óxidos de nitrógeno, óxidos de azufre, y/o compuestos orgánicos como aerosoles de MP-2.5. Actualmente no existe evidencia que examine por separado los efectos en la salud de cada una de estas sustancias. La MP-2.5 generalmente aparece como smog, humo, nublado blanco, neblina o niebla que no se aclara cuando el aire se tibia. El smog café toma su color del bióxido de nitrógeno. Debido a que el ácido nítrico, ácido sulfuroso y ácido sulfúrico reaccionan con el amoníaco del aire para formar cristales sólidos que son mucho menores de 2.5 micras y pueden ser sitios de formación de nucleos para el crecimiento de las partículas, necesitamos preocuparnos por cada uno La deposición ácida ocurre a partir de los compuestos ácidos o acidificantes suspendidos en el aire, principalmente sulfatos (SO4-2) y nitratos (NO3-1), que pueden ser transportados a través de grandes distancias antes de regresar a la Tierra. Esto ocurre a través de la lluvia o nieve (deposición en húmedo), niebla o agua de niebla (deposición nebulosa), o transferencia de gases o partículas (deposición en seco). Mientras la severidad del daño depende de la sensibilidad del receptor, la deposición ácida y los NOx “representan una amenaza a los recursos naturales, ecosistemas, visibilidad, materiales, y salud pública.” (sección 401(a)(1) del Clean Air Act – Acta de Aire Limpio). |
||||||||||||||||||||||||
|
¿Cuales principios de reducción y control son aplicables?
|
||||||||||||||||||||||||



0 comentarios on Hojas de datos EPA: Óxidos de Nitrógeno (NOx), ¿Por Qué y Cómo Se Controlan?