Viabilidad de un Proceso para la Eliminación conjunta de H2S Y NH3 contenido en Efluentes Gaseosos. Parte 12
 |
Martín Ramírez Muñoz TESIS DOCTORAL |
La presente Tesis ha sido co-dirigida por los Doctores D. Domingo Cantero Moreno, Catedrático de Ingeniería Química y D. José Manuel Gómez Montes de Oca, Profesor Titular de Ingeniería Química de la Universidad de Cádiz, y cumple los requisitos exigidos por la legislación vigente.
Fdo.: Dr. D. Domingo Cantero Moreno Fdo.: Dr. D. José Manuel Gómez Montes de Oca
Fdo.: Dr. D. José María Quiroga Alonso
Director del Dpto. de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente
Universidad de Cádiz
4.3. ELIMINACIÓN CONJUNTA DE MEZCLAS H2S/NH3 EN AIRE
4.3.1. Estudio del desarrollo de biopelículas mixtas
Para esta primera fase de estudio, se formuló un medio mixto de crecimiento que cumpliese los requerimientos mínimos necesarios para ambas especies microbianas. De esta forma, se formuló un medio con el 50% de la concentración de tiosulfato utilizada en el medio ATTC290 y una concentración de 30 mM de amoniaco (ver composición detallada en el apartado Material y Métodos de esta memoria).
En la Figura 89 se ha representado la evolución temporal del pH, las concentraciones de tiosulfato, sulfato, azufre (calculada mediante balance de materia) y biomasa total.
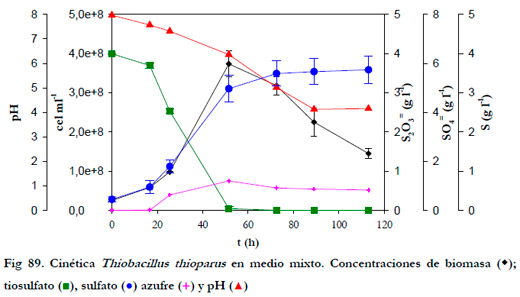 |
La concentración de biomasa inicial fue de 2,5·107 cel ml-1 y el pH evolucionó desde 8,0 hasta 4,1. Puede observarse que, a las 50 horas se alcanza el máximo de crecimiento (3,7·108 cel ml-1) y el agotamiento del sustrato. Para calcular las velocidades de consumo de tiosulfato y producción de sulfato se ha supuesto una variación lineal de la concentración en la fase exponencial de crecimiento, obteniéndose una velocidad de consumo de tiosulfato de 0,103 gl¯1h¯1 y de producción de sulfato de 0,117 g l-1h-1. Los coeficientes de regresión (r2) fueron de 0,995 y 0,998, respectivamente.
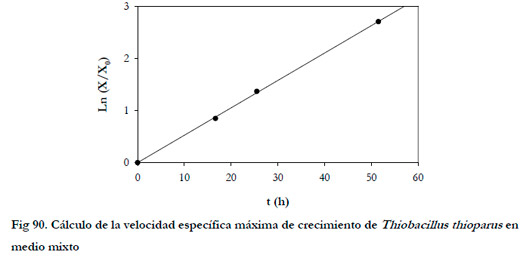
La velocidad específica máxima de crecimiento se puede obtener representando el logaritmo neperiano del cociente entre la concentración de biomasa en cada instante y la concentración de biomasa inicial frente al tiempo (Figura 90). De esta forma, se obtuvo una velocidad específica máxima de crecimiento (μmax) de 0,0526 h-1, con un coeficiente de regresión lineal (r2) de 0,9996. Este valor representa la mitad del obtenido con el medio de la ATCC (0,0971 h-1).
 |
Para la cepa de Nitrosomonas europaea no se obtuvo ningún crecimiento, por lo que no se considera adecuado el uso de este medio mixto para el crecimiento de ambas especies bacterianas. La ausencia de crecimiento por parte de esta bacteria puede deberse a la presencia de iones sodio en el medio, que aporta el tiosulfato necesario para el crecimiento de Thiobacillus thioparus, que provoca un aumento de la presión osmótica con la consiguiente disminución de la actividad de Nitrosomonas europaea (Hunik et al., 1992).
4.3.2. Eliminación en dos etapas en serie
Desde el punto de vista ingenieril, el objetivo general en cualquier proceso es obtener el máximo de rendimiento con el menor coste posible. En este sentido, la gran mayoría de los estudios realizados para el tratamiento de efluentes gaseosos contaminados con NH3 y H2S, han empleado biofiltros en una única etapa con cultivos mixtos de bacterias amonio y azufre oxidantes.
En la mayoría de estos estudios de eliminación conjunta, se han encontrado fenómenos de inhibición de la actividad metabólica de las bacterias amonio oxidantes por la presencia de H2S (2000; Chung et al., 2001; Kim et al., 2002a; Lee et al., 2002; Malhautier et al., 2003a; Chung et al., 2005). Para evitar este inconveniente, se hace necesario disponer de un sistema de biofiltración en serie en dos etapas, empleando una cepa inmovilizada en cada uno de ellas.
En los estudios realizados por Chung et al. (2007) estudian un sistema con un primer biofiltro con Thiobacillus thioparus y un segundo biofiltro con Nitrosomonas europaea, ya que el objetivo es eliminar el H2S, para que éste no inhiba la eliminación de NH3 en el segundo biofiltro. En nuestro caso, esta disposición no es válida, puesto que al tener un biofiltro de escurrimiento con un alto caudal líquido de recirculación, si el primer biofiltro fuese el de eliminación de H2S en el se absorbería todo el amoniaco dada su alta solubilidad en agua.
Cada biofiltro se ha alimentado con su propio medio de recirculación, el tiempo de residencia del gas fue de 60 segundos, la carga de alimentación de amoniaco fue de 10 gNm¯3h¯1 (296 ppmv), el pH se mantuvo entre 7,4-7,5 en el biofiltro con Thiobacillus thioparus (BTT) y entre 7,5 y 7,6 para el biofiltro con Nitrosomonas europaea (BNE). La carga de ácido sulfhídrico se fue aumentando progresivamente desde 2,89 hasta 15,82 gS m-3h-1, rango que abarca valores de concentración desde 37,5 hasta 204,7 ppmv.
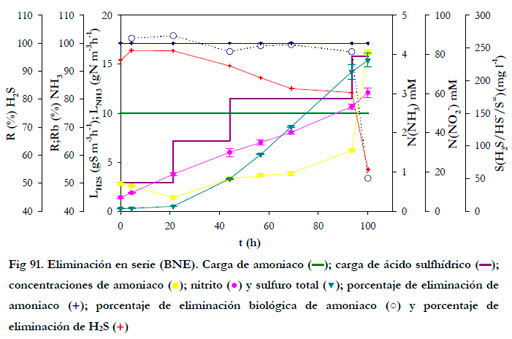
En la Figura 91, se ha representado la variación respecto del tiempo de las cargas de alimentación, así como, de las concentraciones de amoniaco, nitrito y sulfuro total en el medio de recirculación; los porcentajes de eliminación y eliminación biológica para el amoniaco y el ácido sulfhídrico en el primer biofiltro (BNE).
La concentración de sulfuro total representa la suma de las 3 especies que se forman al absorberse el H2S en la fase líquida. Para un pH de 7,5 en el medio líquido, el 73,4% del total se encuentra como HS-, el 24,3% como H2S y sólo el 0,003% como S=.
 |
No se ha representado la evolución de la concentración de sulfato puesto que en este primer biofiltro no hay bacterias azufre oxidantes y, por tanto, el ácido sulfhídrico no puede ser oxidado. A pesar de ello, la eliminación alcanzada respecto al H2S fue bastante alta, y se pensó en una posible contaminación del biofiltro por bacterias azufre oxidantes. Por tanto, se realizaron medidas de la concentración de sulfato en el medio líquido que resultaron negativas.
De ahí que la única posibilidad para la eliminación del ácido sulfhídrico se deba a una absorción, favorecida por el pH de trabajo por encima del pKa1 (7,02). Se observa además, que al aumentar la carga de H2S, el porcentaje de eliminación de este compuesto disminuye hasta un 54,8%, aumentando linealmente la concentración de sulfuro en el medio líquido.
Se puede observar que no se detecta amoniaco a la salida del primer biofiltro, por tanto, la eliminación de amoniaco fue siempre del 100%. A pesar de ello, la eliminación biológica no fue siempre del 100% para el rango de valores estudiados, aunque si se alcanzaron valores por encima del 99% para cargas de H2S iguales o menores de 11,5 gS m-3h-1. Cabe resaltar que para el último valor de la carga de alimentación de ácido sulfhídrico ensayada, la eliminación biológica de amoniaco disminuyó bruscamente hasta alcanzar un 52%. Este efecto sobre la eliminación de amoniaco como consecuencia del aumento de la carga de H2S ha sido observado por otros autores; así, Chung et al. (2000; 2001) encontraron fenómenos de inhibición a partir de 120 ppmv de H2S; Kim et al. (2002a) observaron que la disminución en la eliminación de NH3 se produce para concentraciones de H2S mayores de 200 ppmv.
La caída del porcentaje de eliminación de amoniaco ocurre cuando tenemos una concentración de H2S en la fase gas de 204,7 ppmv. En función de la solubilidad del H2S y de las condiciones hidrodinámicas de la columna tendremos una concentración de H2S en la fase líquida, la cual se disocia en función del pH en HS- y S=. La concentración de sulfuro total en el medio líquido fue de 231,4 mgS l-1, concentración 100 veces mayor a la teórica que se alcanzaría en un sistema agua/aire-H2S. Para una concentración en fase gas de 204,7 ppmv las concentraciones en equilibrio con fase acuosa serían de 0,64 mg l-1 de H2S, 1,91 mg l-1 de HS- y 6,65·10-5 mg l-1 de S=, lo que supone una concentración total de 2,45 mgS l-1. Las concentraciones anteriores de equilibrio son para un sistema ideal cerrado agua/aire-H2S; en nuestro caso tenemos un medio líquido compuesto por una gran cantidad de sales, por lo que la acumulación se ha de deber a una reacción con el sodio presente en las sales del medio y del bicarbonato de sodio empleado para el control de pH, formándose NaSH.
Este efecto inhibitorio de la oxidación del amoniaco por la presencia de ácido sulfhídrico ha sido encontrado por varios autores. Así, Beccari et al. (1980) encontraron que la velocidad de nitrificación se reduce en un 28%, 67% y 76%, respectivamente, para concentraciones de sulfuro de 1, 5 y 10 mgS l-1. Bentzen et al. (1995) estudiaron el efecto de la adición de nitrato para prevenir la formación de H2S, encontrando un aumento del 10% de la actividad nitrificante cuando se reduce la concentración desde 5,5 a 2 mgS l-1. Æsøy et al. (1998) observaron que se produce una inhibición en la velocidad de nitrificación cuando la concentración de sulfuro es de 0,5 mg l-1. Todos estos estudios se han realizado para el tratamiento de aguas residuales, pero no hay ninguno referido al caso del tratamiento de gases contaminados por ambas especies.
En nuestro caso, la concentración de sulfuro total (suma de las tres especies) es muy alta con respecto a los datos anteriores, siendo de 231,4 mgS l-1, y además, en este estudio se dispone de un cultivo puro de bacterias amonio oxidantes y en los estudios anteriores se han utilizado cultivos mixtos con efluentes líquidos provenientes de aguas residuales, donde coexisten gran cantidad de compuestos. Así, un factor importante a tener en cuenta es que la inhibición por la presencia de sulfuro va a depender de la composición de la biomasa, del grado de aclimatación, de la concentración de H2S, así como, del contenido de materia orgánica e inorgánica (Æsøy et al., 1998). Lo que si es indiscutible es su efecto inhibidor, que en nuestro caso, provoca una brusca disminución a partir de los 213 mgS l-1, disminuyendo el porcentaje de eliminación biológica de NH3 del 97% al 52%.
La corriente gaseosa a la salida del BNE pasó a ser la alimentación del siguiente biofiltro (BTT), llegando a éste una corriente con ausencia de amoniaco y con el resto del ácido sulfhídrico que no fue absorbido en el BNE.
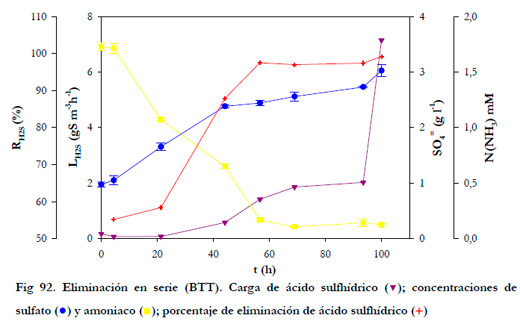
En la Figura 92 se ha representado la carga de entrada de ácido sulfhídrico, las evoluciones temporales de las concentraciones de amoniaco y sulfato, así como, el porcentaje de eliminación de ácido sulfhídrico.
Se puede observar que al poco tiempo de comenzar la alimentación se produjo una disminución de la concentración de amoniaco en el medio de recirculación. Esta disminución se puede deber a la contaminación del BTT por bacterias procedentes del primer biofiltro, ya que la corriente gaseosa de salida del BNE contiene bacterias. Esta hipótesis no pudo confirmarse debido a que las concentraciones de nitrito estuvieron siempre por debajo del límite de detección de la técnica analítica empleada.
En cuanto a la concentración de sulfato, ésta fue aumentando debido a la oxidación del H2S en el biofiltro. Como consecuencia del aumento de la carga de H2S en el BNE se produjo un incremento de la carga a la entrada del BTT. Se puede observar que para las cargas más pequeñas, el porcentaje de eliminación se situó sobre el 60%, alcanzándose valores próximos al 100% para las dos últimas cargas de alimentación.
 |
Esta configuración de los biofiltros es poco eficiente dado que, como se ha comentado anteriormente, el ácido sulfhídrico se absorbe en el primer biofiltro, lo que impide su eliminación biológica y, ocasionando un importante efecto inhibitorio de las bacterias amonio oxidantes, como consecuencia del aumento de la concentración de sulfuro total en el medio de recirculación. Por tanto, una posible solución sería trabajar en el primer biofiltro a un pH por debajo del pKa1, así se evitaría la absorción del ácido sulfhídrico por desplazamiento del equilibrio, pero al mismo tiempo, se dificultaría la eliminación de amoniaco, dado que está altamente influenciada por los valores de pH (Anthonisen et al., 1976; Hunik et al., 1992; Sakuma et al., 2004; Baquerizo et al., 2005).
4.3.3. Eliminación en serie co-inmovilizando ambos microorganismos
Para poder solucionar los problemas encontrados en los experimentos anteriores se puede pensar en una co-inmovilización de ambos microorganismos, con el objetivo de evitar la acumulación del ácido sulfhídrico.
La co-inmovilización de ambas especies bacterianas se llevó a cabo eliminando uno de los depósitos de recirculación de nutrientes, dejando uno sólo con un medio común para ambos biofiltros, con un 50% de los dos tipos de medio (ATCC 290 y ATCC #2265). La alimentación de la corriente gaseosa a tratar continuó realizándose con ambos biofiltros en serie, primero el BNE y, a continuación, el BTT. En la Figura 93 se expone una foto del sistema de eliminación en serie mediante la co-inmovilización de ambos microorganismos.
 |
Como puede verse, se dispone de un medio de recirculación común para ambos BTF y se ha protegido de la luz el segundo biofiltro para permitir la colonización del biofiltro por Nitrosomonas europaea.
Se trabajó en un rango de cargas de 2,89 a 7,19 gSm-3h-1 (37,5 a 92,9 ppmv) para el H2S y desde 1,24 hasta 10,00 gN m-3h-1 (36,7 a 296 ppmv) para el NH3, con un tiempo de residencia del gas de 60 segundos. El pH del medio de recirculación se mantuvo entre 7,5 y 7,6.
Los experimentos realizados fueron los siguientes (Tabla 39):
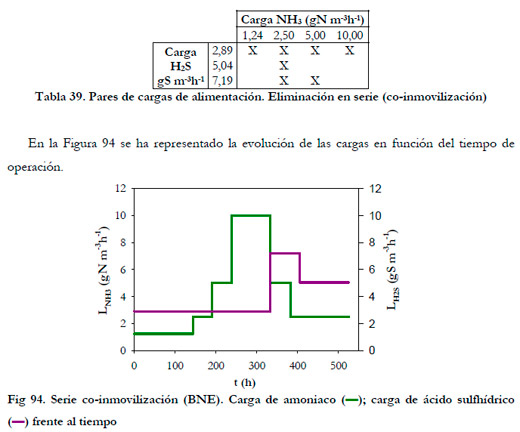 |
Como se puede observar, se comenzó con una carga constante de H2S de 2,89 gS m-3h-1 (37,4 ppmv H2S) y se fue aumentado la carga de NH3. A continuación, se aumentó la carga de H2S hasta 7,19 gS m-3h-1 (93,0 ppmv de H2S), para una carga intermedia de NH3 de 5,00 y 2,50 gN m-3h-1 (147,9 y 73,9 ppmv de NH3, respectivamente). Posteriormente, se disminuyó la carga de H2S a 5,00 gS m-3h-1 (64,7 ppmv de H2S), para una carga de NH3 de 2,5 gN m-3h-1 (73,9 ppmv de NH3). De todas las etapas, la inicial fue la más larga (144 h) para conseguir una buena adaptación de las bacterias a las nuevas condiciones de operación. En las Figuras 95 y 96 se ha representado la evolución temporal de las concentraciones de los productos de oxidación, así como la acumulación de sustrato en el medio de recirculación.
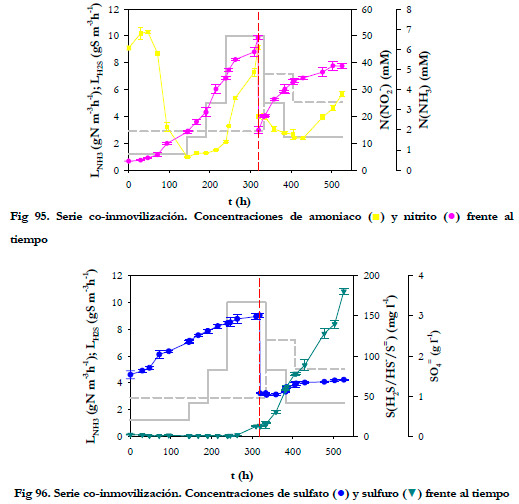 |
Se realizó una reposición del medio de recirculación a las 318,5 horas de operación (marcada en los gráficos anteriores por una línea roja discontinua), ya que se produjo un aumento muy acusado de la concentración de amoniaco en el medio líquido. En este caso tenemos dos etapas, la primera de 318,5 h y la segunda desde las 318,5 horas hasta las 529,5 horas (tiempo final del experimento). Consideramos una etapa como el periodo que transcurre entre cada reposición del medio de recirculación.
Las concentraciones máximas alcanzadas de los productos derivados de la oxidación en cada etapa fueron de 3,01 y 1,43 g l-1 de sulfato y de 49,5 y 39,0 mM de N(NO2 -), respectivamente. En cuanto a la concentración de sulfuro total, los datos de la Figura anterior representan, al igual que anteriormente, la suma de las 3 especies que se forman al absorberse el H2S de la fase gaseosa a la líquida, aunque en este caso la medida ha de tomarse con cautela, puesto que como producto intermedio en la oxidación de H2S se puede formar sulfito (Buisman et al., 1990; Kelly 1999a) e incluso tiosulfato (Peck 1962), compuestos éstos que son reactivos frente al yodo.
En ambas etapas, transcurrido cierto tiempo de operación, se observa un fenómeno de acumulación (positiva) del compuesto. Este hecho se produce para las siguientes concentraciones de los productos derivados de la oxidación y sulfuro total (Tabla 40):
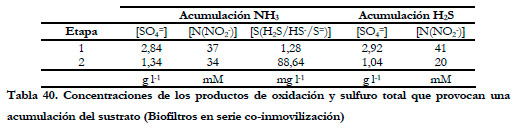 |
Es de destacar que, en la primera etapa, la acumulación de amoniaco esta relacionada con la concentración alcanzada de nitrito, puesto que la acumulación se produce para concentraciones muy similares de nitrito y muy distintas de sulfato y sulfuro total; por tanto, se puede decir que, en estas condiciones de operación con ambos microorganismos coinmovilizados, se produce una inhibición de la oxidación de amoniaco a concentraciones de nitrito mucho mas bajas que las obtenidas en la eliminación de amoniaco por la cepa pura de Nitrosomonas europaea de forma aislada (100 mM de Nitrito). La incorporación de una nueva especie en el biofiltro, así como la presencia de nuevos metabolitos (azufre, sulfato) modifica la biopelícula y, por tanto, la actividad de ésta, siendo en este caso más sensible a las concentraciones de nitrito. En cuanto a la concentración de sulfuro total, en el experimento anterior de dos biofiltros independientes se observó la inhibición a partir de 213 mgS l-1; en este caso, la acumulación de amoniaco se produce para valores más bajos y muy distintos, 1,28 y 88,6 mgS l-1, por lo que nuevamente cabe pensar en la presencia del nitrito como responsable de esta inhibición.
En cuanto a la acumulación de H2S, no se puede asegurar claramente si se debe a la presencia de sulfato o nitrito en el medio de recirculación. En la primera etapa, coincide con el valor de la concentración de nitrito que produce la acumulación de amoniaco; mientras que en la segunda etapa, la acumulación se produjo a valores muy bajos de ambos productos de la oxidación.
Tal y como se recoge en los estudios realizados de eliminación conjunta, se produce un efecto de disminución de la eliminación de amoniaco al aumentar la concentración de H2S (Chung et al., 2000; 2001; Lee et al., 2002; 2003b; Chung et al., 2004a; 2004; 2005). En nuestro estudio, el amoniaco fue eliminado completamente en el BNE, consiguiéndose en algún momento, para todo el rango de trabajo, un porcentaje de eliminación biológica mayor del 100% (Figura 97).
En el estudio realizado para una carga constante de amoniaco de 2,5 gN m-3h-1 (73,9 ppmv), no se encontró inhibición en la eliminación de amoniaco para un rango de la carga entre 2,89 y 7,19 gS m-3h-1 (37,4 a 93 ppmv).
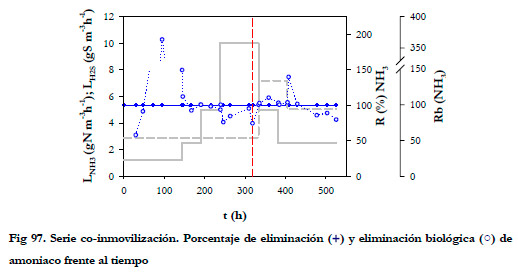 |
Para la carga más alta de amoniaco (10 gN m-3h-1), la eliminación biológica empieza a disminuir ya que se empezó a acumular el amoniaco en el medio de recirculación. Esta disminución del porcentaje de eliminación se recupera cuando se repone el medio de recirculación y se consigue disminuir la concentración de nitrito. Se puede pensar que esta inhibición se deba a la concentración de sulfato, dado que, tal y como se ha comentado anteriormente, en la segunda etapa se observa este mismo fenómeno a concentraciones de sulfato muy inferiores, y no sería posible atribuirlo a la concentración de sulfuro total, puesto que al final de la primera etapa su concentración es muy baja; anteriormente no se alcanzo inhibición hasta concentración de 213 mgS l-1. Hay que tener en cuenta, que el BTT también está contribuyendo a la eliminación de amoniaco, puesto que el medio de recirculación es el mismo para ambos biofiltros y pueden estar presentes ambos microorganismos en los dos biofiltros. Por tanto, puede decirse que la capacidad de eliminación de amoniaco no se ve afectada por la carga de entrada de H2S en el rango de trabajo estudiado; sin embargo, la eliminación biológica puede disminuir como consecuencia del aumento de la concentración de amoniaco en el medio líquido, cuando la concentración de nitrito supera los 34-37 mM. Por tanto, teniendo en cuenta todas estas premisas, se hace necesario realizar un adecuado control del valor de la concentración de nitrito en el medio de recirculación para evitar la acumulación del amoniaco.
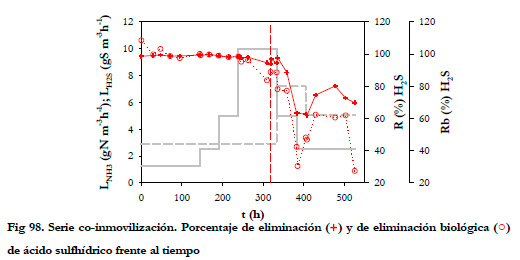
En cuanto a la eliminación de H2S, en la Figura 98 se han representado los porcentajes de eliminación considerando los dos biofiltros conjuntamente, es decir, la concentración de entrada al BNE y la salida del BTT.
Se observa que, a partir de la primera reposición de medio, se produce un aumento de la concentración de sulfuro total en el medio líquido, que provoca una disminución de ambos porcentajes de eliminación; caída del porcentaje de eliminación biológica por el aumento de la concentración de sulfuro total en el medio de recirculación y de la eliminación global por problemas de absorción física del H2S, al tener una alta concentración en el medio líquido. Hay que resaltar que el H2S es mucho menos soluble que el amoniaco.
 |
La concentración de salida de ácido sulfhídrico del BNE fue muy baja, como se puede observar en la Figura 99, donde se ha representado la carga de alimentación del BTT y los porcentajes de eliminación alcanzados en el BTT.
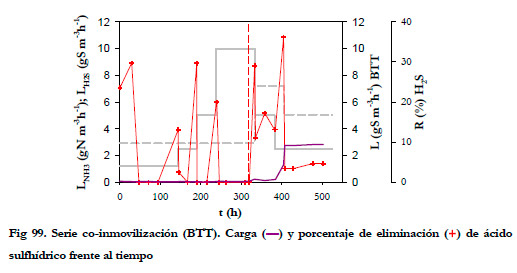 |
La eliminación en el BTT se situó siempre por debajo del 40% para todo el rango de trabajo. Hay que considerar que para estas cargas y concentraciones tan pequeñas, tienen mucha importancia las resistencias a la transferencia de materia, puesto que el gradiente de concentración es muy pequeño. En caso de tener una acumulación del H2S en el medio de recirculación podría incluso producirse un gradiente en sentido opuesto. Por otra parte, es necesario remarcar que el BTT está consumiendo ácido sulfhídrico disuelto en el medio de recirculación y, por tanto, su aportación a la eliminación global es muy alta. Este hecho se puede comprobar ya que desde los primeros instantes de operación se alcanza una alta eliminación de ácido sulfhídrico y ésta sólo es atribuible al BTT, puesto que en el BNE no hay inicialmente bacterias azufre oxidantes.
En la Tabla 41 aparecen los valores de los porcentajes de eliminación y eliminación biológica mínimos, máximos y los valores medios integrales para la eliminación de H2S, para una carga constante de H2S de 2,89 gS m-3h-1.
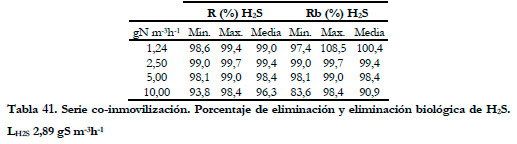 |
Aunque la caída de los valores máximos de eliminación alcanzados no es muy significativa, se observa que, al aumentar la carga de amoniaco, se provoca una pequeña disminución de los porcentajes de eliminación de H2S, coincidiendo con los estudios realizados de eliminación conjunta, en los cuales se concluyó que la presencia de amoniaco no afectaba significativamente a la eliminación de H2S (Chung et al., 2000; 2001; Lee et al., 2002; 2003b; Chung et al., 2004a; 2004; 2005).
El porcentaje de eliminación alcanzado para la eliminación conjunta con una carga de 2,89 gS m-3h-1 en el BTT, en las mismas condiciones de operación (excepto pH de 7,1-7,2), fue del 97,9%, por lo que se puede decir que la variación no es significativa, alcanzándose valores de eliminación incluso mayores para este caso.
Para valores más altos de concentración de H2S si se produjo una disminución del porcentaje de eliminación de H2S. En la Tabla 42 se presentan los valores mínimos, máximos y medios integrales del porcentaje de eliminación de ácido sulfhídrico, obtenidos para una carga de amoniaco constante de 2,5 gN m-3h-1.
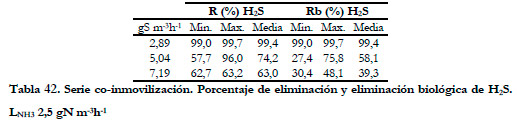 |
El estudio realizado con las cargas de 5,0 y 7,2 gS m-3h-1 se realizó en la segunda etapa, donde la concentración de sulfuro total en el medio líquido aumentó hasta 183,4 mgS l-1. En toda ella, la concentración de sulfato fue menor de 1,43 g l-1, por lo que puede suponerse que no existirá inhibición por parte de este compuesto. Por otra parte, dado que la concentración de nitrito se mantuvo entre 20 y 33 mM, para la carga de 7,2 gS m-3h-1, y entre 30 y 33 mM, para la carga de 5,0 gS m-3h-1, se puede decir que la presencia de nitrito es responsable de la inhibición del metabolismo de la bacteria Thiobacillus thioparus, disminuyendo su capacidad de eliminación. En los trabajos de eliminación conjunta que emplean estas mismas cepas, los valores de concentraciones máximas de nitrito alcanzadas son menores y, de ahí, que no se observe inhibición de la eliminación de amoniaco. Así Chung et al. (2000) trabajando con un biofiltro de escurrimiento con estas mismas especies alcanzaron una concentración máxima de nitrito de 386 mg l-1 (28,3 mM), y en estudios posteriores Chung et al. (2007), trabajando con las mismas cepas obtienen concentraciones máximas de nitrito de 0,31 g l-1 (6,74 mM).
Para los valores de carga de 5,0 y 7,2 gS m-3h-1, no se realizaron ensayos en el estudio de eliminación de H2S de forma independiente (apartado 4.1.3.5 de la presente Tesis), ya que se estudiaron a tiempos de residencia del gas de 60 segundos con dos cargas de 2,89 y 11,50 gSm¯3h¯1. Los porcentajes de eliminación obtenidos para las cargas anteriores de 2,89 y 11,50 gSm¯3h¯1 fueron de 97,9 y 94,8 % respectivamente, por tanto puede suponerse que para cargas intermedias el porcentaje de eliminación estaría comprendido entre estos dos valores. Por lo que puede decirse que, en este caso, los valores alcanzados de los porcentajes de eliminación fueron bastante inferiores de 74,2 y 63,0% para 5,0 y 7,2 gS m-3h-1 respectivamente (valores medios de la Tabla 42).
4.3.4. Eliminación en paralelo
Una vez finalizado el estudio de eliminación conjunta con ambos biofiltros conectados en serie, se inició el estudio del comportamiento de ambos biofiltros por separado, una vez contaminado un biofiltro con el otro. El objetivo de este tipo de experimentos es estudiar el comportamiento de ambos biofiltros para el tratamiento de efluentes contaminados con los dos compuestos. En la Figura 100 se expone una fotografía de ambos biofiltros, BNE a la izquierda de la foto y BTT a la derecha. Los dos biofiltros aparecen protegidos de la luz.
 |
4.3.4.1.Biofiltro BNE
Para realizar este estudio, el tiempo de residencia del gas se estableció en 60 segundos y el pH del medio de recirculación se mantuvo en un rango entre 7,5 y 7,6.
La alimentación de H2S se realizó mediante el sistema de generación descrito en el Apartado de Material y Métodos de la presente memoria, salvo para la carga más alta de H2S, que si hizo a partir de una botella de gas licuado. Igualmente para alimentar NH3 se empleó el sistema de generación y la botella de gases licuados.
En la Figura 101, se han representado los valores utilizados para las cargas de alimentación de amoniaco y ácido sulfhídrico. Inicialmente, se mantuvo la carga de amoniaco en torno a valores de 3,3 gN m-3h-1 (98 ppmv NH3) y se fue variando la carga de H2S (3,5; 7,7; 3,5; 6,4 y 10 gS m-3h-1, que representan concentraciones desde 45 hasta 129 ppmv de H2S).
Posteriormente, se fue aumentando la carga de amoniaco manteniendo constante la carga de H2S en 10 gS m-3h-1, desde 3,3 gN m-3h-1 (98 ppmv NH3) hasta valores de 10,9 gN m-3h-1 (322 ppmv NH3) y, por último, se disminuyó ésta hasta 3,9 gN m-3h-1 (115 ppmv NH3). En la Figura 101 aparece un punto singular a las 719 h, donde se produjo un corte del suministro de amoniaco debido a un fallo eléctrico.
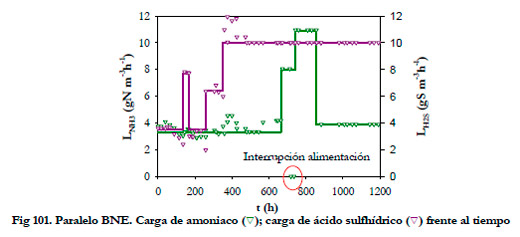 |
La evolución de las concentraciones de los productos de oxidación, así como de la acumulación de sustratos se han representado en las Figuras 102 y 103. Se realizaron 4 reposiciones del medio de recirculación a las 184,5; 423,8; 640,7 y 879,8 horas, respectivamente. Las concentraciones máximas alcanzadas de los productos derivados de la oxidación fueron de 2,55; 4,15; 4,10; 3,86 y 3,67 g l-1 de sulfato y de 47,4; 46,8; 30,6; 74,9 y 76,0 mM de N(NO2-), estando en todo momento la concentración de sulfuro total por debajo de los 70 mgS l-1. Al ser la concentración de sulfuro total mucho menor de 213 mgS l-1, se descartarán posibles fenómenos de inhibición de la oxidación de amoniaco por este compuesto.
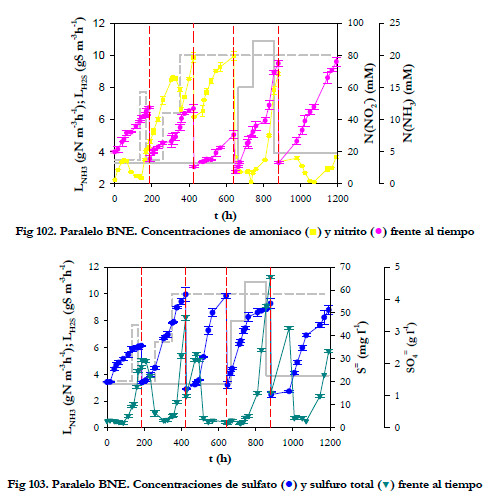 |
En la Tabla 43 se recogen los valores de las concentraciones de sulfato y nitrito que provocan una acumulación de la concentración de amoniaco y ácido sulfhídrico. Se puede observar que, excepto en la tercera etapa, en todas ellas se produce un aumento de la concentración de los sustratos.
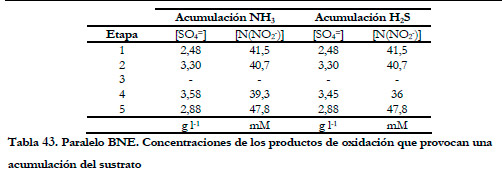 |
En la tercera etapa la concentración máxima de nitrito alcanzada fue de 30,6 mM y, a estos valores de concentración, no se acumuló el H2S en el medio de recirculación, sino que, por el contrario, disminuyó hasta un valor constante. Este hecho confirma la hipótesis que se había expuesto en el apartado anterior, sobre la inhibición del metabolismo de la especie Thiobacillus thioparus por la presencia de nitrito. En este caso, se repuso el medio de recirculación, ya que la concentración de sulfato era de 4,10 g l-1.
Para las etapas 1, 2 y 5 coinciden los valores de concentraciones en los que comienzan a acumularse ambos sustratos, aunque para la 4ª etapa ocurre un poco antes la acumulación de sulfuro total, siendo las concentraciones muy similares. Al igual que en el estudio anterior, parece que la concentración de sulfato no tiene un efecto considerable, siendo la concentración de nitrito la responsable de la acumulación; produciéndose a valores en el rango de los 40 mM N(NO2 -), la acumulación tanto del ácido sulfhídrico como del amoniaco en el medio de recirculación.
El porcentaje de eliminación de amoniaco fue del 100% (Figura 104), pero el porcentaje de eliminación biológica fue variable. La eliminación biológica aumentó rápidamente al reponer el medio de recirculación, logrando disminuir la concentración de nitrito por debajo de 40 mM y alcanzando valores superiores al l00% en todas las etapas o valores próximos a éste. En la cuarta etapa no se alcanzó el 100% por llegarse rápidamente a la concentración inhibitoria de nitrito, dado que la velocidad de generación fue mucho más alta al tener una mayor carga de amoniaco.
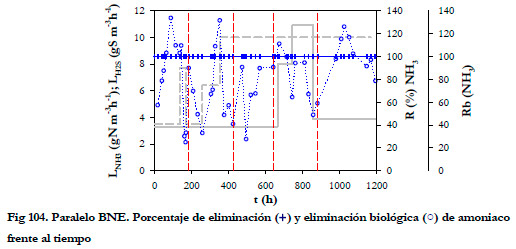 |
Con respecto a la eliminación de ácido sulfhídrico ocurre el mismo fenómeno que se había observado anteriormente; al aumentar la concentración de sulfuro en el medio líquido, no sólo disminuye el porcentaje de eliminación biológica sino que también lo hace el porcentaje de eliminación. En este caso, esta disminución ocurre a concentraciones de nitrito muy similares, en torno a 40 mM. Cuando se alcanza esta concentración de nitrito, el sulfuro se acumula y disminuye el porcentaje de eliminación biológica de H2S. Al tener una alta concentración de sulfuro total en el medio líquido, se disminuye la transferencia de materia, lo que provoca que la concentración a la salida de H2S del biofiltro aumente, con la consiguiente disminución del porcentaje de eliminación. En la tercera etapa la concentración máxima de nitrito fue de 30,6 mM y no disminuyó el porcentaje de eliminación de H2S.
En la Figura 105 se han representado la evolución de los porcentajes de eliminación y eliminación biológica frente al tiempo y en la Tabla 44 aparecen los valores mínimos, máximos y medios de estos porcentajes para la eliminación de H2S, con una carga constante de H2S de 10,0 gS m-3h-1.
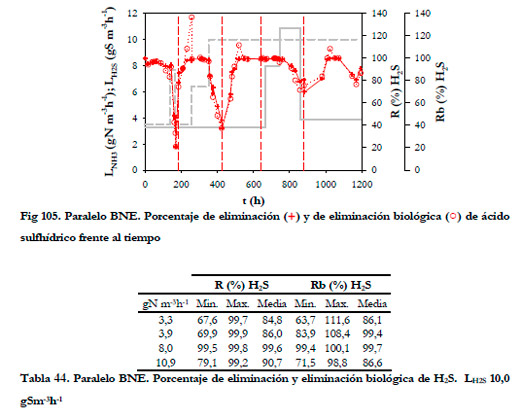 |
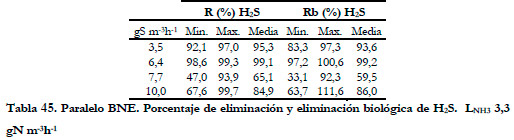
El aumento de la carga de amoniaco no afecta directamente a la eliminación de H2S, pero si lo hace de forma indirecta al aumentar la concentración de nitrito. En la Tabla 45 se muestran los valores obtenidos de los porcentajes de eliminación y eliminación biológica mínimos, máximos y los valores medios integrales para la eliminación de H2S para una carga constante de NH3 de 3,3 gN m-3h-1.
Los valores obtenidos son bastante altos llegándose incluso al 99,7% de eliminación para la carga más alta de H2S, cuando la concentración de nitrito es menor de 40 mM.
 |
4.3.4.2.Biofiltro BTT
Al igual que para el BNE, una vez finalizada la eliminación con ambos biofiltros en serie, se comenzó a alimentar el BTT con una corriente de una mezcla de H2S y NH3. El tiempo de residencia del gas fue de 60 segundos y el pH del medio de recirculación se mantuvo en un rango de 7,5-7,6.
Para alimentar el sistema con H2S se empleó la botella de gases licuados y para el suministro de amoniaco se utilizó el sistema de generación. En la Figura 106, se han representado los valores utilizados para las cargas de alimentación de amoniaco y ácido sulfhídrico.
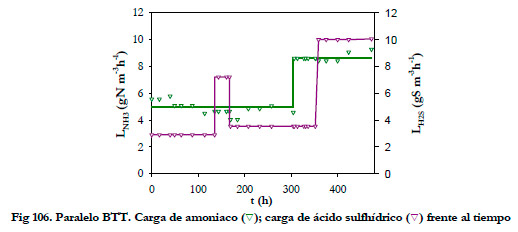 |
Inicialmente, se mantuvo la carga de amoniaco en torno a 5 gN m-3h-1 (148 ppmv NH3) y se fue variando la carga de H2S (2,9; 7,2; 3,5 y 10 gS m-3h-1, rango de concentraciones desde 38 hasta 129 ppmv H2S); a continuación, se aumentó la carga de amoniaco hasta 8,6 gN m-3h-1 (254 ppmv NH3) para las cargas de 3,5 y 10 gS m-3h-1, 45 y 129 ppmv H2S respectivamente. La evolución de las concentraciones de los productos de oxidación, así como de la acumulación de sustratos se representan en las Figuras 107 y 108.
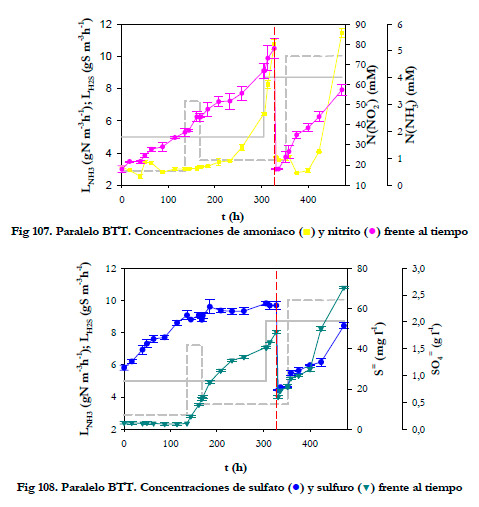 |
Se llevó a cabo un cambio del medio de recirculación a las 327,3 horas. Las concentraciones máximas alcanzadas de los productos derivados de la oxidación fueron de 2,31 y 1,93 g l-1 de sulfato; y 77,9 y 57,4 mM de N(NO2 -) y la concentración de sulfuro total máxima alcanzada fue de 70,4 mgS l-1. Por tanto, al ser la concentración de sulfuro total inferior a 213 mgS l-1, se descartaron posibles efectos inhibitorios de la oxidación de amoniaco por este compuesto.
Se han realizado 2 etapas en las que se obtienen un aumento de las concentraciones de amoniaco y sulfuro para unas determinadas concentraciones de los productos de oxidación.
Dichos valores aparecen recogidos en la Tabla 46.
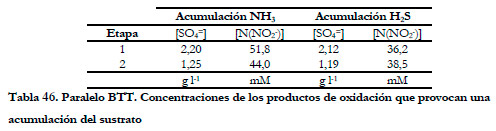 |
Al igual que en el estudio anterior parece que la concentración de sulfato no tiene un efecto considerable, siendo la concentración de nitrito la responsable de la acumulación; produciéndose a valores cercanos a los 40 mM N(NO2 -) la acumulación del ácido sulfhídrico y entre 44-50 mM N(NO2 -) la acumulación del amoniaco en el medio de recirculación.
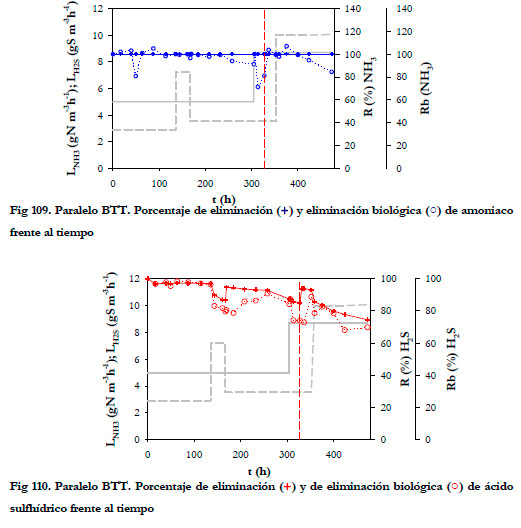
El porcentaje de eliminación de amoniaco fue del 100% (Figura 109), pero el porcentaje de eliminación biológica fue variable, disminuyendo cuando la concentración de amoniaco aumentó en el medio de recirculación para los valores de nitrito y sulfato expuestos en la Tabla 46.
Con respecto a la eliminación de sulfhídrico (Figura 110), ocurre el mismo fenómeno que se observó anteriormente, al aumentar la concentración de sulfuro en el medio líquido no sólo disminuye el porcentaje de eliminación biológica sino que también lo hace el porcentaje de eliminación. En este caso, esta disminución ocurre a concentraciones de nitrito muy similares y cercanas a los 40 mM. Cuando se alcanza esta concentración de nitrito, el ácido sulfhídrico se acumula en el medio de recirculación y disminuye el porcentaje de eliminación de H2S.
 |
En la Tabla 47 aparecen reflejados los valores de los porcentajes de eliminación y eliminación biológica mínimos, máximos y los valores medios integrales para la eliminación de H2S, para una carga constante de H2S de 3,5 gS m-3h-1.
 |
Al aumentar la carga de H2S, se observa una disminución de la eliminación para ambas cargas de amoniaco, y el valor más alto obtenido para la carga más alta de H2S fue del 93,9%, mientras que para el BNE se alcanzaron valores mucho más altos del 99,7% para cargas incluso mayores.
Finalmente puede afirmarse que ambas configuraciones son válidas para eliminar efluentes contaminados con ácido sulfhídrico y amoniaco. El BTT ha demostrado una resistencia algo mayor a las concentraciones de nitrito y el BNE, aunque es más sensible a las concentraciones de nitrito, alcanza mayores porcentajes de eliminación de ácido sulfhídrico que el BTT.
Durante los estudios realizados de eliminación de ambos compuestos, tanto de forma aislada como conjunta, no se ha profundizado en el estudio de la biopelícula, cuyo papel es fundamental para poder llegar a conocer y dar explicación a los fenómenos que ocurren durante la oxidación de estos compuestos. Como parámetro, para el seguimiento del estado de la biomasa, se han realizado medidas de las concentraciones de sustrato y productos de oxidación, de tal manera que es de suponer un buen estado de la biopelícula, si los productos derivados de la oxidación aumentan disminuyendo las concentraciones del NH3 y H2S en la corriente gaseosa de salida del BTF y no se produce acumulación de éstos en el medio de recirculación. Igualmente, aunque no se han mostrado los datos, se realizaron medidas puntuales de la biomasa viable cada cierto intervalo de tiempo, así como para cada una de las configuraciones ensayadas, a partir de muestras de la biopelícula tomadas del soporte presente en el biofiltro. A partir de estas siembras se determinó el número de CFU (colony forming unit) por gramo de soporte y, mediante recuento en microscopio óptico, se determinó la concentración total de bacterias inmovilizadas. Los valores obtenidos para el BTT se situaron en el rango comprendido entre 1,19 y 1,91·1011 células por gramo de soporte y de 1,10 a 5,65·1010 CFU por gramo de soporte de Thiboacillus thioparus. En el caso del BNE, la cantidad de bacterias totales inmovilizadas por gramo de soporte fue un orden de magnitud menor, situándose entre 2,06 y 4,97·1010 y la cantidad de CFU de Nitrosomonas europaea por gramo entre 1,22 y 2,28·109
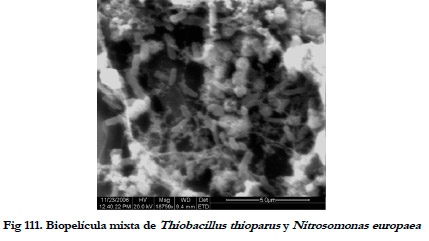
Al contaminar ambos biofiltros se logró una biopelícula mixta, de forma que el máximo de CFU de Nitrosomonas europaea alcanzada en el BTT fue de 1,24·109 y el máximo de CFU de Thiobacillus thioparus alcanzado en el BNE de 1,92·1010. En Figura 111 se muestra una imagen de microscopía electrónica de barrido donde pueden verse ambos tipos de bacterias sobre el soporte.
 |