Viabilidad de un Proceso para la Eliminación conjunta de H2S Y NH3 contenido en Efluentes Gaseosos. Parte 11
 |
Martín Ramírez Muñoz TESIS DOCTORAL |
La presente Tesis ha sido co-dirigida por los Doctores D. Domingo Cantero Moreno, Catedrático de Ingeniería Química y D. José Manuel Gómez Montes de Oca, Profesor Titular de Ingeniería Química de la Universidad de Cádiz, y cumple los requisitos exigidos por la legislación vigente.
Fdo.: Dr. D. Domingo Cantero Moreno Fdo.: Dr. D. José Manuel Gómez Montes de Oca
Fdo.: Dr. D. José María Quiroga Alonso
Director del Dpto. de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente
Universidad de Cádiz
4.2.2.3.Adaptación de la biopelícula
En la fase de adaptación de la biopelícula, se eliminó la fuente de sustrato del medio de recirculación, pasando a alimentar amoniaco incorporado en una corriente de aire. El caudal de alimentación se fijó en 120 l h-1, que se corresponde a un tiempo de residencia de 30 segundos. El pH del medio de recirculación fue controlado entre 7,5 y 7,6, siendo el caudal de recirculación de nutrientes de 445 ml min-1.
En la Figura 78 se han representado dos valores del porcentaje de eliminación; por un lado, el porcentaje de eliminación considerando la diferencia entre la concentración de entrada y salida de amoniaco del biofiltro, por otra, el porcentaje de eliminación biológica (Rb).
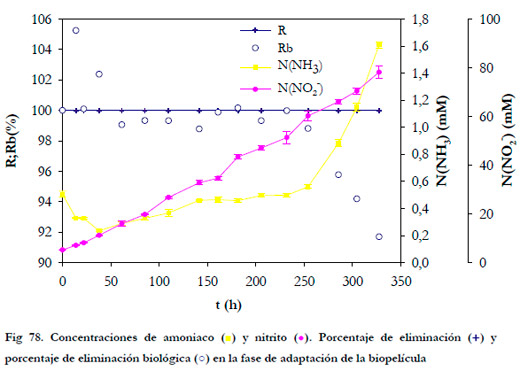 |
Con la carga de alimentación inicial de 3,38 gN m-3h-1 (50 ppmv de NH3) se alcanzó un porcentaje de eliminación del 100% muy rápidamente, por lo que el tiempo de aclimatación fue nulo. En estudios anteriores realizados por Chung and Huang (1998) empleando esta misma cepa no fue necesaria una fase de aclimatación del cultivo, obteniéndose eliminaciones mayores del 95% desde el primer instante y hasta un 99% en 4 días con concentraciones de entrada de 10 y 20 ppmv. Cuando no se emplean cultivos puros es necesaria una fase de aclimatación, siendo el tiempo necesario para ésta una función del tipo de inóculo empleado. Así Liang et al. (2000) necesitaron un periodo de 2 semanas de aclimatación, Gracian et al. (2002) de 3 a 4 semanas y Shahmansouri et al. (2005) hasta 3 meses.
El incremento de la concentración de amoniaco en el medio provocó una disminución del porcentaje de eliminación biológica y la concentración de nitrito alcanzó una concentración de 78 mM a las 327 h. Esta concentración de nitrito causó el incremento de la concentración de amoniaco en el medio líquido y la consecuente disminución del porcentaje de eliminación biológica hasta un 92%. Es conocido que, tanto el amoniaco en la forma disociada como el nitrito inhiben la nitrificación (Anthonisen et al., 1976).
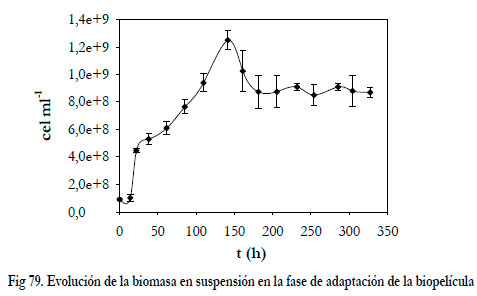
La concentración de biomasa en suspensión alcanzó valores de 1,25·109 células por mililitro de medio a las 141 horas, para posteriormente disminuir hasta un valor constante de 8,8·108 células por mililitro (Figura 79). Esta disminución sólo puede tener su explicación por un aumento de la cantidad de biomasa inmovilizada.
 |
Pasadas 327 horas se repuso el medio por medio fresco, para comenzar la siguiente etapa de estudio de la influencia de las variables de operación.
4.2.3. Estudio del efecto de las principales variables de operación sobre la eficacia del proceso en la degradación de NH3. Determinación de las capacidades y eficacias de eliminación
4.2.3.1. Estudio del efecto del caudal de recirculación de nutrientes
Para los tres caudales de recirculación ensayados (445, 237 y 83 ml min-1 que se corresponden a velocidades superficiales de líquido de 8,57; 4,55 y 1,59 m h-1) no se observó variación alguna de la capacidad de eliminación de amoniaco en el biofiltro; por tanto, puede considerarse que no se trata de una variable a tener en cuenta en el rango de trabajo estudiado.
Son muy pocos los estudios realizados de eliminación de amoniaco mediante el empleo de un biofiltro de escurrimiento, reduciéndose a cuatro los trabajos encontrados (Kanagawa et al., 2004; Melse and Mol 2004; Sakuma et al., 2004; Chou and Wang 2007).
Kanagawa et al. (2004) estudiaron el efecto del caudal de recirculación de líquido, encontrando que el mantenimiento de la recirculación es un factor importante, ya que cuando se produce un corte en el suministro se produce un efecto negativo en el funcionamiento del reactor. Al operar con flujos intermitentes (corte de la recirculación durante uno o dos minutos) encuentran una disminución de la actividad del 10%, trabajando con una velocidad superficial durante la operación en continuo de 4,58 m h-1. Describen su reactor como un biofiltro, pero dado que realizan parte de la experimentación con un caudal constante de líquido y puesto que el soporte empleado no es orgánico (cerámica) es más apropiado emplear el nombre de biofiltro de escurrimiento. Sakuma et al. (2004) emplearon una velocidad superficial muy baja, de 0,053 m h-1, siendo el soporte empleado también de tipo cerámico.
Melse and Mol (2004) utilizaron como soporte tubos de plástico unidos y dispuestos verticalmente, realizando una purga del medio de recirculación para evitar la acumulación de los productos de oxidación; sin embargo, no muestran los datos de caudales empleados. Chou and Wang (2007) sí realizaron un estudio del efecto del caudal de recirculación en un biofiltro de escurrimiento empaquetado con coque, a velocidades superficiales entre 0 y 2,86 mh-1, obteniendo el mayor porcentaje de eliminación para el valor de 1,90 m h-1, aunque la diferencia es mínima cuando la recirculación está activada.
4.2.3.2.Estudio del efecto inhibitorio de la concentración de nitrito
De acuerdo con los estudios publicados, las dos especies químicas que causan la inhibición del metabolismo de Nitrosomonas europaea son el amoniaco (NH3) y el ácido nitroso (HNO2) (Anthonisen et al., 1976; Sakuma et al., 2004; Baquerizo et al., 2005), aunque otros factores como el aumento de la presión osmótica, debido a altas concentraciones de sales, inhiben su actividad (Hunik et al., 1992). Hunik et al. (1992) estudiaron la inhibición debida a la concentración de diversas sales (NH4 +, K+, Na+, NO3 – y NO2 -), encontrando una disminución lineal de la actividad respecto a la concentración de sales, sin observar diferencias significativas en función del tipo de compuesto. A partir de estos datos, llegaron a concluir que Nitrosomonas europaea presenta una inhibición de su crecimiento con respecto a la concentración total de sales presentes en el medio, que llega a provocar un aumento de la presión osmótica. Al mismo tiempo, encontraron que el nitrito es un compuesto inhibitorio, sobre todo a pH bajos, por lo que sugieren que la forma desionizada (HNO2) sea la responsable del efecto tóxico (la disminución de la actividad a pH 7,5 es aproximadamente del 50% para 100mM de nitrito).
Sin embargo, otros estudios han encontrado los efectos inhibitorios a concentraciones en rango menores, entre 5 y 20 mM (Stein and Arp 1998b), siendo la pérdida de actividad más acusada en condiciones alcalinas (pH 7 a 8) que en condiciones ácidas (pH 5,5 a 6,5).
De igual forma, otros compuestos que pueden estar presentes en la corriente gaseosa pueden disminuir la eliminación como consecuencia de la inhibición o inactivación de la enzima amonio monooxigenasa (AMO). Muchos de estos compuestos pueden ser sustratos alternativos, así encontramos compuestos como el metano (Hyman and Wood 1983), el etileno (Hyman and Wood 1984), hidrocarburos halogenados (Rasche et al., 1990), compuestos aromáticos (Chang et al., 2002), el acetileno, que es un inactivador irreversible (Hyman and Wood 1985; Wrage et al., 2004) u otros compuestos sulfurados como DMS, DMDS, CS2 y tioéteres (Juliette et al., 1993).
En cualquier medio acuoso, las concentraciones de amoniaco (NH3) o ión amonio (NH4 +), así como de nitrito (NO2 -) o ácido nitroso (HNO2) dependerán del pH del medio.
Las constantes ácidas de disociación del amoniaco han sido obtenidas por Clegg and Brimblecombe (1989), siendo el pKa=9,249 a 25ºC. Estos autores propusieron la siguiente ecuación para obtener los valores de la constante básica de disociación (Kb)
|
|
Donde a=16,932; b=-4411,025 y c=-0,0440 estando T en grados K. Para 30ºC, el valor de la constante ácida de disociación sería de 9,259.
Considerando un valor del pKa de 9,259 para el amoniaco a un pH de 7,5, sólo el 1,712% del amonio total estaría como amoniaco libre disociado.
En cuanto al valor de la constante de disociación del ácido nitroso, el valor más aceptado del pKa ha sido de 3,27 a 25ºC (Park and Lee 1988); sin embargo en la literatura se encuentran valores en el rango de 2,3 a 5,22 (Das Gracas Gomes et al., 1993). Recientemente, Riordan et al. (2005) han obtenido un valor de la constante de disociación de 1,7 a 25ºC.
Si se considera un valor del pKa de 3,276 a un pH de 7,5, sólo el 0,006% estaría como ácido nitroso y si fuese el valor del pKa de 1,7, el porcentaje de ácido nitroso sería tan solo del 0,00016%.
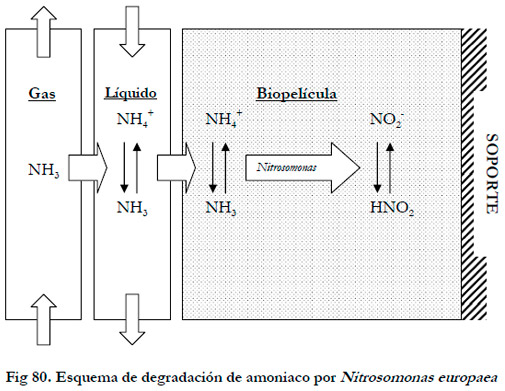
El proceso de oxidación biológica se puede esquematizar según la Figura 80. Inicialmente ocurre una absorción del amoniaco desde la fase gas a la película líquida, cuya velocidad de absorción vendrá determinada por las condiciones hidrodinámicas de la columna, así como, por la constante de Henry de solubilidad, teniendo en cuenta que se trata de un compuesto muy soluble en agua. Una vez absorbido, se establece el equilibrio químico entre el amoniaco y el catión amonio, cuyas concentraciones vienen determinadas por la constante de disociación.
La oxidación biológica del amoniaco ocurre fundamentalmente en la biopelícula, aunque también se puede dar en el medio en recirculación en menor medida, ya que al retirar este medio no se produce una disminución de la oxidación biológica. Cuando el amoniaco es oxidado a nitrito se da lugar al equilibrio químico entre el nitrito y el ácido nitroso.
 |
Algunos autores han encontrado una proporción 1:1 entre el amoniaco que es metabolizado por el microorganismo y el absorbido como amonio en el medio de recirculación (Smet et al., 2000; Kanagawa et al., 2004; Pagans et al., 2005). La acumulación del amoniaco en el medio líquido es perjudicial para el microorganismo, ya que para cierto rango de concentraciones está demostrada la existencia de inhibición por parte de éste. Por tanto, se debe trabajar en un rango de concentraciones de nitrito que no produzcan inhibición del crecimiento microbiano y la consiguiente acumulación de amoniaco en el medio líquido.
Teniendo en cuenta estas premisas, el control de la concentración de nitrito se convierte en un parámetro fundamental en la operación de los sistemas de biofiltración de amoniaco.
Kanagawa et al. (2004) encontraron una disminución del 50% de la actividad de las bacterias amonio oxidantes cuando la concentración de nitrito fue de 0,5 gN l-1 (35,7 mM N(NO2 -)); en cuanto al amoniaco no encuentran una inhibición significativa para concentraciones por debajo de 2 gN l-1 (142,8 mM N(NH3)), siendo inhibitorio a concentraciones de 5 gN l-1 (357,1 mM N(NH3)), con una disminución del 40% de la actividad.
Baquerizo et al. (2005) han propuesto dos ecuaciones para calcular las constantes de inhibición por amoniaco libre y ácido nitroso libre de las especies amonio oxidantes y nitrito oxidantes. Para el caso de las bacterias amonio oxidantes las ecuaciones son las siguientes:
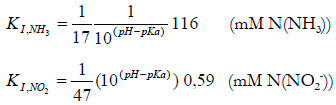 |
Como se puede observar, estos autores proponen una dependencia de las constantes con respecto al pH, donde conocidos los pKa del amoniaco y del ácido nitroso se pueden calcular las constantes de inhibición. Para el pH de trabajo (7,5), los valores de las constantes son de 392 mM de N(NH3) y 210 mM de N(NO2 -), considerando valores de pKa de 3,276 y 9,259 para el ácido nitroso y el amoniaco, respectivamente. En la ecuación global de consumo de amoniaco propuesta en el modelo, una concentración de nitrito o amoniaco igual a la constante de inhibición supone una reducción del 50% de la velocidad de consumo de amoniaco.
Chou and Wang (2007) encontraron que a partir de una concentración de 10 mg l-1 de amoniaco libre, la especie Nitrosomonas sufre inhibición. Una concentración de amoniaco libre de 10 mg l-1, al pH de trabajo medio de este estudio (6,68), supone una concentración de nitrógeno amoniacal total de 223,7 mM de N(NH3).
Una vez finalizada la etapa de aclimatación y refrescado el medio de recirculación, la siguiente variable estudiada fue el efecto inhibitorio de la concentración de nitrito. En la Figura 81, se han representado las variaciones temporales de las concentraciones de nitrito y amoniaco en el medio de recirculación. El tiempo de residencia del gas fue de 30 segundos, la carga de alimentación de 6,76 gN m-3h-1, el caudal de recirculación de 445 ml min-1 y el pH se mantuvo entre 7,5 y 7,6.
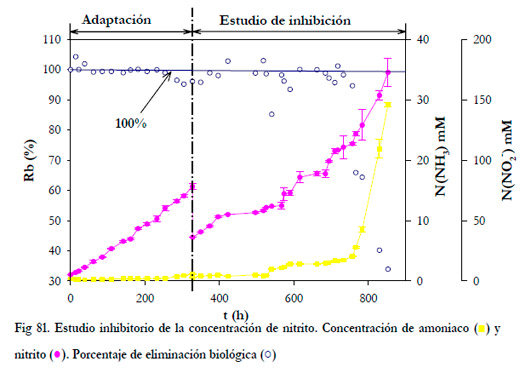 |
La concentración de amoniaco a la salida del biofiltro fue cero dada la alta solubilidad de éste. En la Figura anterior se ha representado el porcentaje de eliminación biológica, cuyo valor disminuye cuando el amoniaco comienza a acumularse en el medio de recirculación. Para el experimento representado en la Figura, este hecho comienza a notarse para una concentración de 114 mM N(NO2 -), y se registró una velocidad de acumulación de amoniaco promedio de 0,278 mM h-1 N(NH3). Experimentalmente, se llegó hasta un máximo de 173 mM N(NO2 -), valor para el cual, el porcentaje de eliminación biológica disminuyó hasta el 34%.
En estudios posteriores, la concentración de nitrito alcanzó valores de hasta 300 mM, y se pudo comprobar que, para valores superiores a 100 mM, la eliminación biológica disminuye como consecuencia del aumento de la concentración de amoniaco en el medio de recirculación. A pesar de esto, durante el tiempo de operación del biofiltro se pudo observar que el microorganismo se fue adaptando a las nuevas condiciones y se registró un descenso menor del porcentaje de eliminación.
Por tanto, para un valor constante del pH a 7,5, la inhibición que se produce al aumentar la concentración de nitrito se puede deber a la concentración total de iones presentes más que a la propia concentración del ácido nitroso.
Según la ecuación propuesta por Hunik et al. (1992):
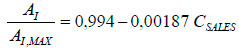 |
Siendo: AI la actividad de Nitrosomonas europaea (μmol O2 s-1 m-3); AI,MAX la actividad máxima de Nitrosomonas europaea (μmol O2 s-1 m-3) y CSALES la concentración total de sales (mM), las disminuciones de actividad serían del 77% y 61%, teniendo en cuenta la suma de las concentraciones de amoniaco y nitrito.
4.2.3.3.Estudio del efecto del pH
El control del pH es fundamental para obtener resultados satisfactorios en el tratamiento de efluentes gaseosos contaminados con amoniaco. Las bacterias amonio oxidantes y nitrito oxidantes tienen un óptimo de 7,0-8,0 y 6,5-8,5, respectivamente (Yani et al., 1998a). Hunik et al. (1992) encontraron que para la especie Nitrosomonas europaea se alcanza la máxima actividad biológica para valores de pH entre 7,5 y 8,5.
La carga de alimentación se mantuvo constante en 6,10 gN m-3h-1, siendo la concentración de entrada de 90 ppmv de NH3 y el tiempo de residencia de 30 segundos. La concentración de nitrito se mantuvo por debajo de 100 mM N(NO2 -) para evitar fenómenos de inhibición.
En la Figura 82 se representa la evolución de las concentraciones de nitrito y amoniaco en el medio de recirculación, así como el pH en función del tiempo de operación.
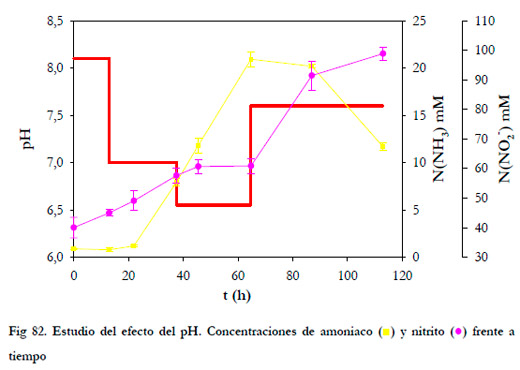 |
Para estudiar como afecta el pH a la eliminación, es necesario diferenciar entre los dos tipos de porcentajes de eliminación. En la Figura 83, se han representado ambos valores.
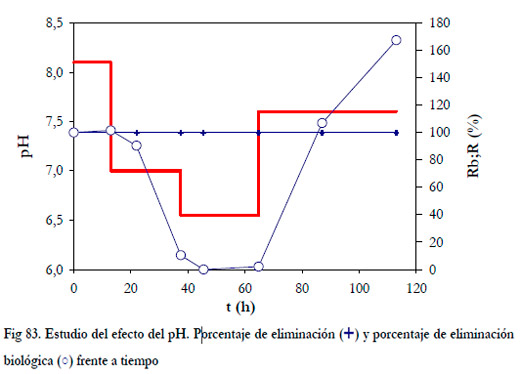 |
Como puede observarse el porcentaje de eliminación de calculado considerando las concentraciones de entrada y salida del biofiltro se mantiene en el 100%, pero la eliminación biológica es mucho menor para valores de pH entre 7,0 y 6,5, llegando a ser nulo. A un pH de 6,5, se produce una absorción del amoniaco en el medio líquido, hecho éste que se puede comprobar por el mantenimiento de la concentración de nitrito en el medio de recirculación.
Durante la oxidación del amoniaco se liberan protones que provocan la acidificación del medio, esta bajada del pH tiene como consecuencia una disminución de la concentración de amoniaco, un aumento de la concentración de ión amonio y disminución de la concentración de sustrato disponible. Se ha de tener en cuenta que la especie Nitrosomonas europaea emplea como sustrato el amoniaco libre pero no puede oxidar el ión amonio (Suzuki et al.,1974).
Durante el periodo que se mantuvo el pH a 6,5, la concentración de amoniaco total en el medio líquido aumentó desde 7,92 a 20,93 mM N(NH3), que se corresponde con concentraciones de amoniaco libre de 0,234 y 0,619 mg l-1 de NH3 (sólo el 0,174% del nitrógeno amoniacal total). La concentración de nitrito se mantuvo constante en 61 mM N(NO2 -), que se corresponde con una concentración de ácido nitroso de 1,71 mg l-1 de HNO2 y 2804 mg l-1 de NO2 -, considerando un pKa de 3,276. En la siguiente Tabla se comparan los valores de las concentraciones de cada especie a pH de 6,5 y 7,5. 37
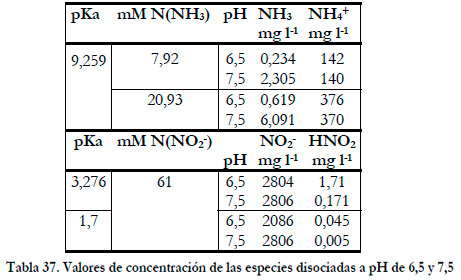 |
Un incremento de una unidad de pH equivale a un aumento de 10 veces en la concentración de amoniaco y una disminución de 10 veces de la concentración de ácido nitroso.
Por tanto, a la vista de los resultados obtenidos, se puede concluir que el pH óptimo de trabajo es de 7,5 y que su control es fundamental en el proceso de eliminación de NH3. Este valor de pH es el mismo obtenido por Chung and Huang (1998), que habían trabajado con esta misma bacteria inmovilizada en esferas de alginato de calcio.
4.2.3.4.Estudio del efecto de la carga de alimentación
Para minimizar los posibles efectos de transferencia de materia del amoniaco, se trabajó con un tiempo de residencia muy alto (150 segundos) al objeto de determinar el máximo de degradación biológica. El pH se mantuvo entre 7,5 y 7,6 y el caudal de recirculación de nutrientes fue constante de 445 ml min-1.
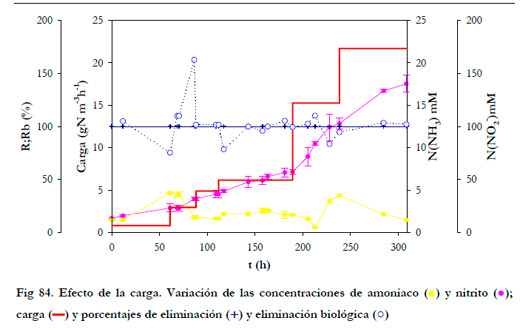
En la Figura 84 se han representado las variaciones temporales de las concentraciones de amoniaco y nitrito en el medio de recirculación, así como de la carga de alimentación y de los porcentajes de eliminación.
Se comenzó con una carga de alimentación de 0,89 gN m-3h-1 y mediante 5 incrementos se alcanzó un valor máximo de 21,7 gN m-3h-1, rango éste que abarca concentraciones desde 60 hasta 1600 ppmv.
El porcentaje de eliminación se mantuvo en el 100%, siendo el porcentaje de eliminación biológica el que presentó algunas fluctuaciones. En cualquier caso, se alcanzó para todas las cargas de trabajo, una vez establecido el estado estacionario, un porcentaje de eliminación biológica mayor del 100% (momento en que se produce una disminución de la concentración de amoniaco en el medio de recirculación). La concentración de nitrito no superó la concentración de 150 mM. En el estudio de inhibición de nitrito discutido anteriormente, para 114 mM de nitrito se producía una acumulación de amoniaco en el medio de recirculación; en este caso, aún siendo mayor no disminuye la eliminación biológica, lo que indica que la cepa se puede ir adaptando progresivamente a concentraciones cada vez más altas de nitrito.
 |
Para todos los tiempos de residencia ensayados, se alcanzó un porcentaje de eliminación del 100% y, una vez alcanzado el estado estacionario, el porcentaje de eliminación biológica fue mayor del 100%. Para evitar fenómenos de inhibición por la concentración de nitrito, se realizó una reposición del medio de recirculación a las 143 horas de operación.
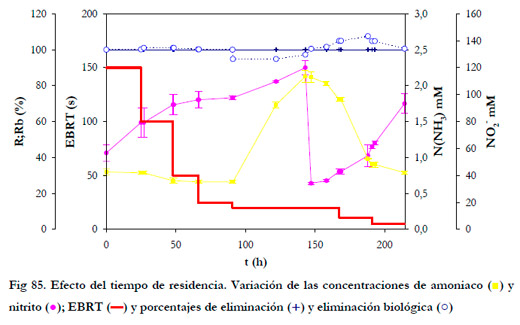 |
En los estudios realizados sobre el efecto del tiempo de residencia, Liang et al. (2000) encontraron que una disminución del tiempo de residencia del gas no produce una disminución significativa de la eliminación. En la mayoría de los estudios realizados con biofiltros, los autores encuentran una disminución de la eliminación al disminuir el tiempo de residencia, así Chung et al. (1997b) observaron una disminución del 97% al 67% al pasar de un tiempo de residencia de 70 a 12 segundos, justificando esta disminución por problemas de transferencia de materia del amoniaco de la fase gas a la líquida. En los trabajos realizados con biofiltros de escurrimiento este problema de transferencia de materia se ve minimizado, tal y como muestran los resultados experimentales obtenidos, siendo el amoniaco absorbido en su totalidad en el medio líquido de recirculación. Al igual que en nuestro caso, Chou and Wang (2007) han estudiado el efecto del tiempo de residencia del gas con valores desde 236 a 30 segundos, siendo el porcentaje de eliminación del 99% y del 96%, para los tiempos de 59 y 30 segundos respectivamente. Por tanto, queda demostrado que el empleo de un biofiltro de escurrimiento es mucho más apropiado para el tratamiento de efluentes gaseosos contaminados con amoniaco, puesto que se mejora la transferencia de materia de la fase gas a la líquida siendo poco acusado el efecto del tiempo de residencia del gas.
Debido a que a todos los tiempos de residencia se obtuvo un porcentaje de eliminación del 100% para la carga de trabajo empleada, se programó una experiencia manteniendo un tiempo de residencia del gas fijo de 11 segundos, con objeto de determinar en que momento la eliminación puede estar por debajo del 100%. Para ello, se fue aumentando progresivamente la carga de alimentación desde 24,7 hasta 270 gN m-3h-1, cargas que abarcan un rango de concentraciones de entrada de 134 a 1464 ppmv, rango éste suficientemente amplio como para poder tratar efluentes provenientes de plantas de compostaje (Haug 1993; Smet et al., 2000) y de plantas fertilizantes donde se alcanzan concentraciones mayores de 1000 ppmv (Williams and Miller 1992).
Los resultados obtenidos se muestran en la Figura 86. El porcentaje de eliminación fue del 100% en todo momento dada la alta solubilidad del amoniaco en el medio de recirculación. El porcentaje de eliminación biológica se situó por encima del 100% para cada carga, cuando la concentración de nitrito se mantuvo por debajo de 100 mM. Para concentraciones por encima de 100 mM, la eliminación disminuye y se registra un aumento del amoniaco en el medio líquido.
Esta eliminación se recupera al sustituir el medio de recirculación por medio fresco y, por tanto, disminuir la concentración de nitrito en el medio. Cuando las cargas son altas, la velocidad de generación de nitrito es muy alta, y por tanto se alcanzan en breve espacio de tiempo los niveles de inhibición, produciéndose una disminución de la eliminación biológica.
La acumulación de nitrito se podría evitar con un sistema de purga y alimentación continua del medio, que sería necesario implementar al biofiltro.
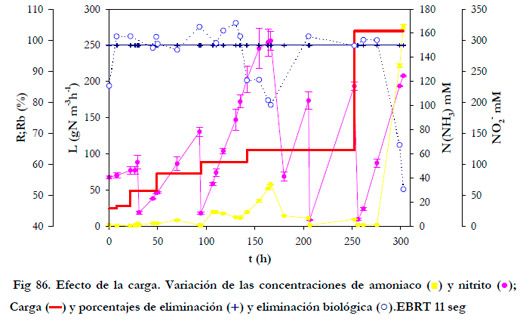 |
La capacidad de eliminación crítica alcanzada fue de 270 gN m-3h-1, para un tiempo de residencia del gas de 11 segundos, para concentraciones de nitrito menores de 100 mM. Éste valor supera 4,5 veces el valor máximo encontrado en estudios anteriores (Kanagawa et al., 2004).
4.2.3.6.Estudio del efecto de la pérdida de carga
Al igual que en el estudio de eliminación de H2S, se evaluó la pérdida de carga para cada tiempo de residencia del gas.
La pérdida de carga por metro de columna fue muy pequeña siendo para los tiempos de residencia del gas de 11 y 5 segundos de 6,2 y 25,9 cm de agua por metro de columna. En la Figura 87 se ha representado la pérdida de carga por metro de altura de columna frente a la velocidad superficial del gas, correspondiente a los tiempos de residencia de 150, 100, 50, 25, 20, 11 y 5 segundos.
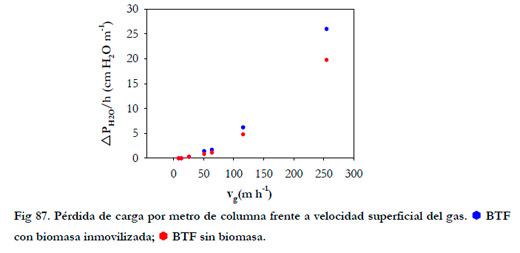 |
Al igual que en el estudio de eliminación de H2S se ha utilizado la ecuación de Ergun, agrupando los términos de su ecuación en dos constantes alfa y beta, para analizar los datos obtenidos (Ergun 1952; Ramirez et al., 2003):
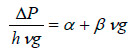 |
En la Figura 88 se han representado las linealizaciones de la ecuación anterior para el BTF con y sin biomasa.
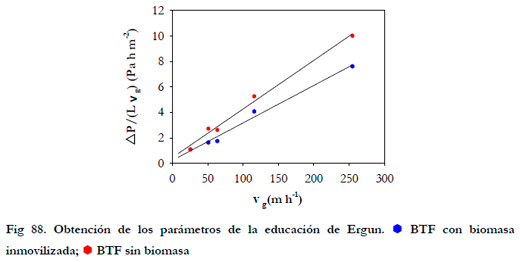 |
En la Tabla 38 se exponen los valores alfa y beta así como los coeficientes de regresión lineal de cada ajuste (r2).
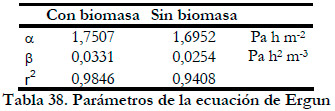 |
Estos datos apenas difieren de los valores obtenidos en el estudio de la pérdida de carga en el biofiltro de eliminación de amoniaco, siendo tan solo algo mayor el valor alfa correspondiente a la ordenada en el origen. El valor más alto de alfa se podría justificar porque en este caso tenemos un caudal de recirculación del medio líquido mayor y por tanto la resistencia al paso del gas va a ser más alta. Para cada caudal de líquido tendríamos unos valores de las constantes alfa y beta de la ecuación, puesto que la ecuación de Ergun sólo contempla el movimiento de una fase fluida (Ergun 1952). Los valores obtenidos son, al igual que en el estudio del biofiltro de eliminación de H2S, mucho menores que los obtenidos con otros soportes (Ramirez et al., 2003).