Remediación de suelos contaminados con fenantreno por oxidación química: efecto de la concentración de oxidante
Palabras claves: fenantreno, biorremediación, persulfato
RESUMEN
Los hidrocarburos policíclicos aromáticos (PAH), son principalmente producidos por fuentes antropogénicas e implican un riesgo para el ambiente debido a sus propiedades tóxicas y carcinogénicas. La oxidación química en suelos y aguas contaminadas con PAH, es efectiva para superar las limitaciones de la biorremediación, especialmente en mezclas complejas.
En este trabajo se estudió la eficiencia de la degradación de fenantreno con persulfato de sodio (PS) como oxidante, en microcosmos de suelo prístino contaminado artificialmente.
Se prepararon microcosmos contaminados con fenantreno (130 mg/kgTIERRA SECA) y se trataron con diferentes concentraciones de PS ([PS]0: 0.83; 4.17; 8.33; 21.00 y 41.70 g/kgTIERRA SECA). Como controles se reservaron microcosmos contaminado con fenantreno (BioD) y microcosmos de suelo estéril, con fenantreno y PS (ChemD).
Todos los sistemas se estudiaron por triplicado. Los microcosmos fueron incubados a 24°C por 28 días. Se determinó el pH, la concentración de fenantreno ([FEN]) y las matrices de excitación emisión de fluorescencia de los extractos acuosos alcalino (MExEm).
Se observó que el tratamiento oxidativo no produce cambios inmediatos (24 hs) en la concentración residual de fenantreno ([FEN]R). Luego de 7 días, sólo el microcosmo con mayor [PS]0 muestra un porcentaje significativamente menor de [FEN]R con respecto a BioD.
Sin embargo, al final del experimento (28 días), la eliminación de fenantreno en los microcosmos con [PS]0 ≤ 8.33 g/kgTIERRA SECA alcanzó un 60-80%, sin mostrar diferencias significativas con BioD. En los microcosmos con [PS] ≥ 21.00 g/kgTIERRA SECA se observó una inhibición sobre los procesos de degradación, que podría deberse en parte al significativo descenso de pH observado, alcanzando niveles de eliminación de fenantreno significativamente menores (20-35%).
El microcosmo ChemD no mostró una disminución significativa en la [FEN]R (90 %, a los 28 días).
Las MExEm fueron similares en todos los casos: se observan dos zonas con máximos de intensidad correspondientes a las sustancias húmicas y a la presencia de fenantreno.
INTRODUCCIÓN
Los hidrocarburos policíclicos aromáticos (PAH), son principalmente producidos por fuentes antropogénicas, incluyendo la combustión incompleta de combustibles fósiles y biomasa, el tráfico vehicular y la liberación de productos del petróleo y sus derivados. En consecuencia, la concentración de PAH en el ambiente se ha incrementado considerablemente desde la última centuria. Los PAH constituyen un riesgo para el hombre y los animales, debido a sus propiedades tóxicas y carcinogénicas.
La biorremediación tiene una aplicabilidad limitada cuando se trata de suelos contaminados con mezclas complejas de PAH, altamente hidrofóbicos. La oxidación química, utilizando oxidantes fuertes en suelos y aguas contaminadas con PAH, es una estrategia que ha sido considerada efectiva para superar las limitaciones de la biorremediación.
En este trabajo se aplicaron cinco concentraciones diferentes de persulfato (PS) para la degradación de fenantreno en microcosmos artificialmente contaminados, en condiciones controladas (temperatura, humedad del suelo, disponibilidad de oxígeno) que permitan un proceso biológico simultáneo.
MARCO TEORICO
El suelo es esencial para la sociedad humana. Es la base para el 90% de todos los alimentos humanos, piensos para el ganado, fibra y combustible, además de servir de apoyo a los asentamientos humanos y proporcionar materias primas y aguas subterráneas. La contaminación del suelo es consecuencia de las industrias extractivas, actividad industrial y agrícola y el vertido de residuos, que se han desarrollado durante años con poca consideración sobre el impacto sobre el ecosistema suelo. Además, el depósito de residuos industriales y basurales puede generar la contaminación de las aguas subterráneas (Oprea et al., 2009).
A nivel mundial y con el objetivo de revertir los efectos negativos de la contaminación, se han propuesto acercamientos de tipo polifásicos, incluyendo i) leyes rigurosas para la producción y el uso de sustancias químicas complejas, ii) pretratamiento y disposición segura de desechos tóxicos químicos y iii) la restauración de sitios contaminados y ambientes (Robinson et al., 2001; Felsot et al., 2003).
Respecto del último enfoque, se han desarrollado numerosos estudios aplicando métodos fisicoquímicos y/o biológicos para el tratamiento de ambientes contaminados (Udell et al., 1995; Bonaventura & Johnson, 1997; Lodolo et al., 2001; Scullion, 2006).
De todos ellos, la biorremediación ha tenido una aceptación general por ser una medida ecológica, eficiente y económica para la eliminación del contaminante y la restauración de sitios contaminados (Pandey et al., 2009). Sin embargo, el proceso tiene una aplicabilidad limitada ya que requiere intervalos mayores de tiempo que las técnicas térmicas y fisicoquímicas (Sutton et al., 2011).
La oxidación química, utilizando oxidantes fuertes en suelos y aguas contaminadas con PAH, es una estrategia que ha sido considerada efectiva para superar las limitaciones de la biorremediación.
METODOLOGIA
El suelo seleccionado para la preparación de microcosmos fue un suelo no contaminado de un área cercana a la ciudad de La Plata, Argentina. Se analizó en el Laboratorio de Edafología de la Universidad de La Plata y mostró las siguientes propiedades fisicoquímicas: pH de 6.6; 4.67 % de carbono orgánico (Walkley-Black); 8.05 % de materia orgánica (MO(%)=1.724 x C (%)); 3.890 mg/kg de nitrógeno total (Micro Kjeldahl); 4.0 mg/kg de fósforo disponible (Bray Kurtz nº1); conductividad eléctrica de 3.3 ± 0.3 dS m-1 (en extracto de pasta saturada) y 109.9± 0.9 ppm de Fe (extraído con EDTA, determinación según método EPA 7950). Se prepararon microcosmos contaminados con fenantreno (130 mg/kgTIERRA SECA). A las dos horas de efectuada la contaminación, los microcosmos se trataron con diferentes concentraciones de persulfato de sodio (PS) 0.83; 4.17; 8.33; 21.00 y 41.70 g/kgTIERRA SECA y se denominaron PS1, PS2, PS3, PS4 y PS5, respectivamente. La incorporación de PS se realizó utilizando soluciones acuosas. Como controles se reservaron microcosmos contaminados con fenantreno sin el agregado de PS, donde se evaluó el efecto de la atenuación natural (BioD), y microcosmos de suelo estéril, con fenantreno y PS en concentración 8.61 gPS/kgTIERRA SECA (ChemD).
Todos los tratamientos se realizaron por triplicado y se incubaron a 24 °C por 28 días. Se tomaron muestras periódicamente. En cada una de ellas se determinó el contenido de humedad, el pH y la concentración de fenantreno ([FEN]) por HPLC (Hewlett–Packard HPLC model 1050 Ti series, columna C18 Restek Pinacle II, solvente de corrida mezcla metanol/agua/ H3PO4 80/20/0.1 (v/v/v)).
Se obtuvieron las matrices de excitación-emisión de fluorescencia (MExEm) de los extractos acuosos alcalinos (Swift, 1996), para lo cual se utilizó un espectrofluorómetro Perkin-Elmer LS-50B, y se excitó entre 200 y 550 nm con incrementos de 5 nm. Para preparar el extracto se mezcló 2.5 g de suelo de en un tubo de policarbonato (volumen de 15 ml) con 12.5 ml de agua y NaOH hasta llegar a un valor de pH de 12. Luego, la mezcla se agitó durante 2 horas y se filtro con papel de filtro y después a través de una membrana de celulosa (0.45 μm de tamaño de poro). El pH de la solución se llevo a 7 por agregado de HCLO4. Las soluciones se diluyeron (con agua bidestilada) hasta obtener una absorbancia de 0.05 a 550 nm. Los espectros obtenidos se corrigen por la respuesta del instrumento y se graficaron en 3 dimensiones para obtener las MExEm.
RESULTADOS Y DISCUSIÓN
En la Figura 1 se presenta el efecto de la concentración inicial de PS ([PS]0) sobre la concentración residual de fenantreno ([FEN]R) para los sistemas estudiados. % de Fenantreno residual
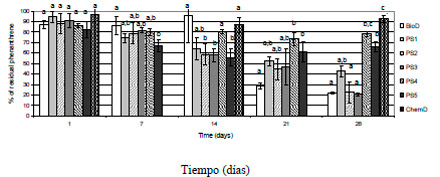 |
Figura 1. Porcentajes de fenantreno residual vs. tiempo (días) en los microcosmos estudiados durante 28 días de tratamiento, con diferentes concentraciones de PS. Los valores con la misma letra no presentan diferencias significativas al nivel del 5%.(dos colas ANOVA, Tukey test).
El control biológico BioD mostró una significativa degradación de fenantreno luego de 21 días de tratamiento, alcanzando una eliminación del 80% del contaminante luego de los 28 días.
El control químico ChemD no mostró degradación significativa de fenantreno. En ausencia de un proceso biológico se observó una baja eficiencia del tratamiento oxidativo ([PHEN]R del 90% al final del tratamiento), indicando que la [PS]0 utilizada alcanza a degradar una pequeña proporción del fenantreno presente.
En los tratamientos oxidativos PS1, PS2, PS3, PS4 y PS5 no se observaron cambios inmediatos (24 horas) en la [FEN]R. El microcosmo PS5 fue el único que presentó una [PHEN]R significativamente menor (P<0.05) que el control BioD a los 7 días de incubación, pero no se observaron variaciones posteriores ([PHEN]R ~ 20-35% al final del tratamiento).
Luego de 14 días, la [PHEN]R para PS2 y PS3 fue significativamente menor (P<0.05) que el control BioD. Al final del tratamiento, [PHEN]R para PS1, PS2 y PS3 no mostraron diferencias significativas con BioD, ([PHEN]R ~ 60-80 % al final del tratamiento).
Este comportamiento podría ser explicado por la concentración residual de PS luego de 2 y 4 días de tratamiento en el microcosmo PS3 (0.14 gPS/kgTIERRA SECA y 0.12 gPS/kgTIERRA SECA respectivamente) y PS5 (1.13 gPS/kgTIERRA SECA, y 0.70 gPS/kgTIERRA SECA respectivamente). Es decir, luego de 7 días de incubación, la [PS] disminuye a un 10% o menos de su valor inicial, lo que indica que la degradación de fenantreno luego de 7 días se debe a un proceso biológico. En consecuencia la disminución en la [PHEN]R encontrada en el microcosmo P5 a los 7 días de tratamiento puede considerarse como una “auténtica” oxidación química del fenantreno.
Por otro lado, la diferencia significativa de [PHEN]R entre los tratamientos oxidativos PS1, PS2, PS3 y el control BioD, indica un efecto bioestimulador indirecto del PS. La materia orgánica del suelo esta compuesta por una gran diversidad de moléculas (carbohidratos, aminoácidos, proteínas, lípidos, ácidos nucleicos, compuestos húmicos) que pueden ser sensibles a la oxidación (Sirguey et al., 2008), por ejemplo, por la acción del radical sulfato (David Gara et al., 2008). Estas reacciones producen compuestos de bajo peso molecular que actúan como nutrientes de las población biológicas (Bosio et al., 2008).
En la Tabla1 se presentan los valores iniciales y finales de pH determinados en los diferentes microcosmos. Se observó una disminución de pH en los microcosmos a los que se le había agregado PS, respecto al control BioD.
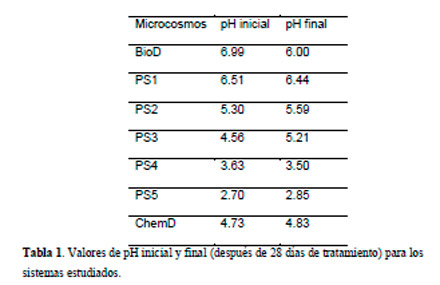 |
El PS utilizado contiene agua y ácido como impurezas (< 0.3 %) (Rosso et al., 1999), y por lo tanto, las soluciones acuosas de PS son ácidas (por ejemplo, para una solución de concentración similar al PS3, el pH sería 2.9). Sin embargo, los valores medidos son más altos que lo esperado, debido a la capacidad buffer del suelo para amortiguar este efecto (Foth, 1990). En los microcosmos PS4 y PS5, la cantidad de PS rompe esa capacidad buffer dando como resultado un pH extremadamente ácido durante todo el experimento. La disminución de pH puede resultar en una perturbación significativa del ambiente que pueden limitar la supervivencia y actividad de los microorganismos y en consecuencia la biodegradación. Por lo tanto, la baja eliminación de fenantreno en los microcosmos PS4 y PS5, luego de 28 días de tratamiento podría explicarse por el deterioro de la comunidad bacteriana del suelo, producto de efecto del pH.
En las Figuras 2a,b,c se presentan las MExEm, correspondientes a tierra “limpia”, tierra contaminada con fenantreno sin tratar (BioD inicial) y luego de 28 días de tratamiento con PS (PS3·a los 28 días), respectivamente.
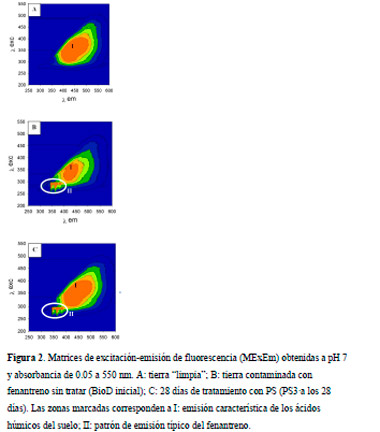 |
CONCLUSIONES
En los microcosmos con concentraciones de PS ≤ 8.33 g/kg (PS1, PS2, PS3) si bien no se observó eliminación de fenantreno que pueda ser considerada exclusivamente de origen químico (primeros 7 días de tratamiento), mostraron una estimulación en la degradación de fenantreno a los 14 días de tratamiento que podría deberse a un proceso bioestimulatorio causado por la oxidación parcial de la materia orgánica del suelo. Estas concentraciones de PS produjeron un bajo impacto sobre el pH, evidenciando un posterior proceso biológico que produjo la eliminación del 80% del fenantreno.
Mayores concentraciones de PS no produjeron una mayor eliminación del hidrocarburo, pero si una fuerte disminución en el pH. En estos microcosmos fue eliminado solo un 30% del fenantreno, mostrando un impacto negativo sobre los procesos de biodegradación.
Las matrices de excitación-emisión obtenidas indicarían que la calidad de las sustancias húmicas del suelo no parece verse demasiado afectada por la presencia de fenantreno ni por el tratamiento con PS.
REFERENCIAS BIBLIOGRAFICAS
Bonaventura C &Johnson FM. 1997. Healthy environments for healthy people: bioremediation today and tomorrow. Environ Health Perspect 105(suppl 1): 5–20
Bosio GN, David Gara P, García Einschlag FS, Gonzalez MC, Del Panno MT & Mártire DO. 2008. Photodegradation of Soil Organic Matter and its Effect on Gram-negative Bacterial Growth. Photochemistry and Photobiology, 84: 1126– 1132
David Gara PM, Bosio GN, Gonzalez MC & Mártire DO. 2008. Kinetics of the sulfate radical-mediated photo-oxidation of humic substances. International Journal of Chemical Kinetics, 40 (1): 19–24
Felsot AS, Racke KD & Hamilton DJ. 2003. Disposal and degradation of pesticide waste. Rev Environ Contam Toxicol, 177: 123-200
Foth H D. 1990. Fundaments of soil science, John Wiley and Sons INC (ISBN 0- 471-26792-9)
Lodolo A, Gonzalez-Valencia E & Miertus S. 2001. Overview of remediation technologies for persistent toxic substances. Arh Hig Rada Toksikol, 52: 253–280
Oprea I, Badea A, Ziglio G, Ragazzi M, Andreottola G, Ferrarese E & Apostol T. 2009. The remediation of contaminated sediments by chemical oxidation. UPB Sci. Bull. Series C: Electrical Engineering, 71: 131-142
Pandey J, Chauan A and Jain RK. 2009. Integrative approaches for assessing the ecological sustainability of in situ bioremediation. FEMS Microbiol Rev 33: 324– 375
Robinson T, McMullan G, Marchant R & Nigam P. 2001. Remediation of dyes in textile effluent: a critical review on current treatment technologies with a proposed alternative. Bioresources Technology, 77: 247–255
Rosso JA, Allegretti P, Mártire DO & Gonzalez MC. 1999. Reaction of sulphate and phosphate radicals with – trifluorotoluene. Journal Chemical Society, Perkin Trans, 2: 205–210
Sirguey C, Silva P, Schwartz C & Simonnot MO. 2008. Impact of chemical oxidation on soil quality. Chemosphere, 72: 282–289
Sutton NB, Grotenhuis TC, Langenhoff AAM & Rijnaarts HHM. 2011. Efforts to improve coupled in situ chemical oxidation with bioremediation: a review of optimization strategies. J Soils Sediment, 11: 129–140
Swift RS. 1996. Organic matter characterization. P 1018 – 1020 En: Sparks D L (ed) Methods of soil analysis. Part 3. Chemical methods. Soil Science Society of America Book Series, Número 5. Soil Science Society of America, Madison, USA
Udell KS, Grubb DG & Sitar N. 1995. Technologies for in situ cleanup of contaminated sites. Cent Eur J Public Health 3: 67–76
Por: Verónica C Moraa, Marina Peluffob, Janina A Rosso
Maria T Del Pannoa, Irma S. Morelli
Fuente: Universidad Nacional de la Plata
VER ARCHIVO DE ARTÍCULO