Posibilidades sobre el uso de residuos de la industria del acero en la eliminación de metales de efluentes líquidos
Resumen
Se estudia la eliminación de metales presentes en efluentes acuosos empleando un residuo de la industria del acero denominado cascarilla de laminación. La cascarilla se puede considerar como un material barato para la eliminación de metales tóxicos por su alto contenido en óxidos de hierro y hierro metálico. Se ha realizado un estudio de la eliminación de los iones Cd 2+, Zn 2+, Pb 2+ y Cu 2+ contenidos en soluciones acuosas, estudiándose diversas variables que afectan al proceso. La eliminación de cadmio, cinc y plomo correspondiente a un proceso de adsorción superficial, se ha evaluado aplicando las teorías de Langmuir y Freundlich. La eliminación de cobre ocurre por un proceso de oxidación-reducción o cementación (Cu 2+/Fe 0 ). Se han ensayado, también, las posibilidades de desorción.
Palabras clave: Cascarilla de laminación. Eliminación. Metales pesados. Cementación. Isotermas de adsorción.
1. INTRODUCCIÓN
La cascarilla de laminación es un subproducto siderúrgico, procedente del proceso de laminación en caliente del acero, constituido fundamentalmente por hierro y óxidos de hierro y con contenidos variables de grasas y aceites. Su producción específica es de unos 35-40 Kg/t de acero. En España se generan alrededor de 0,044 Mt/año de cascarilla [1]. La cascarilla gruesa se recicla, prácticamente al 100 %, vía planta de sinterización y la cascarilla más fina o lodo de cascarilla, que está más contaminada de aceites, acaba en el vertedero. Se considera reutilizable al sinter, sin pretratamiento, la cascarilla con tamaño de partícula entre 0,5 y 5 mm y un contenido en aceites menor de 1 %. La cascarilla con un contenido en aceites mayor de 3 % debe de ser tratada previamente.
Gran cantidad de industrias (producción de hierro y acero, industria de metales no-ferrosos, minería, manufactura de pigmentos, etc.) son responsables de contaminar el medio ambiente a través de los metales pesados contenidos en sus aguas residuales. Existen numerosas técnicas para la purificación del agua y eliminación de metales contenidos en efluentes acuosos (resinas de cambio iónico [2-5], adsorción con diferentes adsorbentes [ 6 y 7], precipitación y ósmosis inversa han sido algunas de las más empleadas). La utilización de residuos industriales como materiales adsorbentes en procesos de retención o eliminación de metales en efluentes acuosos ha empezado a utilizarse recientemente, con objeto de buscar rutas alternativas para el reciclado de los residuos y de buscar materiales baratos que puedan reemplazar, en determinados estadios, a materiales adsorbentes convencionales y de mayor coste económico [8-15].
En este trabajo se realiza un estudio acerca de la capacidad que tiene la cascarilla de laminación para retener ciertos iones metálicos (Cd2+, Zn2+, Pb2+ y Cu2+), contenidos en solución acuosa.
2. MATERIALES Y PROCEDIMIENTO EXPERIMENTAL
La cascarilla utilizada en este trabajo procede del tren de laminación en caliente de una acería eléctrica del norte de España. La cascarilla se secó a 80 °C durante 24 h. La humedad inicial fue de 5 %. La cascarilla se pasó por un tamiz eligiendo para los ensayos la fracción menor de 0,5 mm, por ser ésta no reutilizable al sinter.
La composición química de la cascarilla se determinó mediante análisis por fluorescencia de rayos X por dispersión de longitudes de onda (FRX) en un espectrómetro Philips PW-1404, realizándose posteriormente un análisis de los principales elementos contenidos en la muestra (fracción < 0,5 mm), por espectrofotometría de absorción atómica (EAA), en un espectrofotómetro Varian SpectrAA-220FS. Los análisis de carbono y azufre totales se realizaron mediante combustión en un horno Leco CS-244 y detección por infrarrojos. La determinación del hierro contenido en la cascarilla (Fe3+, Fe2+ y Fe0) se ha realizado valorando con K 2Cr 2 O 7 0,1 N (disolución patrón), utilizando difenilamina-sulfonato de bario (CH 12H 10NO3S) 2 Ba) como indicador [16 y 17].
La composición en fases mineralógicas se determinó por difracción de rayos X (DRX) utilizando un difractómetro D-5000 (radiación Cu Ka ).
Se determinó la isoterma de adsorción de N 2 a 77 K, en una muestra de cascarilla previamente desgasificada a 60 °C y 10 -5 torr durante 120 min, utilizando un equipo Coulter SA-3100. A partir de los datos de la isoterma se determinó el valor de la superficie específica (S BET).
Para los ensayos de eliminación de los metales, las soluciones de estos se prepararon a partir de la disolución del nitrato correspondiente y NaNO 3 en agua destilada (0,85 g de NaNO 3 por litro de agua destilada) para ajustar la fuerza iónica de la disolución. Se adicionaron a 10 g de cascarilla, 100 ml de solución del metal correspondiente, cuya concentración varió entre 0,005 y 8,0 g/l para el cobre y 0,015 y 3,0 g/l para el resto de metales.
Se realizaron ensayos a diferentes temperaturas (20-80 °C) a un tiempo de equilibrio de 5 h. Los ensayos de desorción se han llevado a cabo a partir de muestras de cascarilla cargadas con metales procedentes de los procesos de eliminación anteriormente estudiados (0,86 mg/g Cd (II), 0,99 mg/g Zn (II), 1,00 mg/g Pb (II) y 5,97 mg/g Cu (II)). Se adicionaron a 0,5 g de cascarilla cargada, 25 ml de solución del desorbente para los tres primeros metales y 1 g de cascarilla a 25 ml de la solución del desorbente para el caso del cobre. Se realizaron ensayos a diferentes tiempos de reacción. Los procesos se realizaron manteniendo las suspensiones en continua agitación mediante un agitador termostático Lauda MS-20 B. Las suspensiones resultantes se centrifugaron en una centrifugadora Jouan C-312 durante 5 min a 5000 rpm y se analizaron las soluciones mediante espectrofotometría de adsorción atómica (EAA), en un espectrofotómetro Varian SpectrAA-220FS. La cantidad de ión metálico adsorbido (eliminado) sobre la cascarilla se determinó por diferencia entre la concentración inicial y la concentración en el equilibrio. El porcentaje de metal desorbido de la cascarilla se ha determinado midiendo la concentración de éste en solución a cada tiempo.
El estudio de la dependencia de la capacidad de adsorción de la cascarilla con la concentración de los cationes metálicos (Cd 2+, Zn 2+ y Pb 2+) en el equilibrio, se llevó a cabo empleando las ecuaciones de Langmuir (Ec. 1) y Freundlich (Ec. 2) [18]:
C/X = 1/X m b + C/X m (1)
log X = log a + (1/n) log C (2)
donde C es la concentración del catión en el equilibrio, X es la cantidad de ión metálico adsorbido por unidad de masa de cascarilla, a y X m indican la capacidad de adsorción de la cascarilla y b y n son constantes relacionadas con la intensidad de adsorción.
3. RESULTADOS Y DISCUSIÓN
3.1. Caracterización de la cascarilla
|
|
La cascarilla de laminación utilizada en este trabajo es un material de morfología laminar y baja superficie específica (S BET = 0,43 m2/g). Está constituida principalmente por una mezcla de óxidos de hierro: wustita (FeO), hematites (α-Fe 2O 3), magnetita (Fe 2O 3) y hierro metálico. El contenido de Fe es del 68,8 % (Fe 2+ = 51,4 %, Fe3+ = 10,2 % y Fe 0 = 7,2 %). También contiene otros elementos: Cu (0,54 %), Mn (0,47 %), Zn (0,01 %), así como 0,19 % de C y 0,026 % de S. En la cascarilla existe un 2 %, aproximadamente, de aceites y grasas procedentes de la lubricación del proceso de laminación.
3.2. Ensayos de adsorción
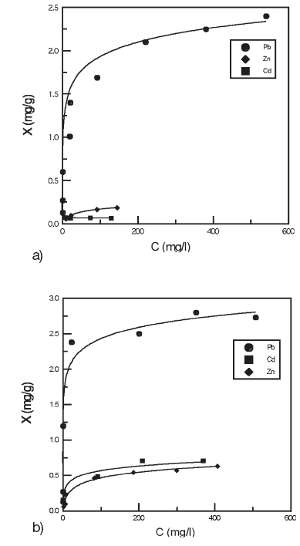
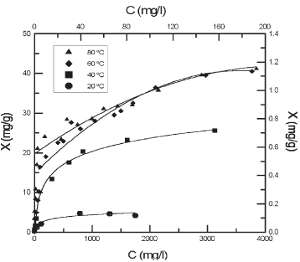
Las figuras 1 y 2 muestran la relación entre las diferentes cantidades de iones metálicos adsorbidos por unidad de masa de cascarilla y la concentración de equilibrio de los iones considerados, para una concentración de cascarilla de 100 g/l y un tiempo de equilibrio previamente determinado de 5 h, a diferentes temperaturas. Se observa que la cantidad de ión metálico adsorbido (o ión eliminado) por unidad de masa de cascarilla es mayor para las concentraciones más altas de ión metálico en solución. La capacidad de adsorción (o eliminación) de la cascarilla aumenta considerablemente con la temperatura en los casos del Zn (II), Cd (II) y Cu (II), estando especialmente favorecida para el caso del Cu (II), a partir de 60 °C. La fracción de masa adsorbida en el caso del Pb 2+ se mantiene prácticamente constante con el aumento de temperatura.
El proceso de eliminación de Cd 2+, Zn 2+ y Pb 2+ corresponde a un proceso de adsorción superficial, que se ha evaluado aplicando, comparativamente, las isotermas de Langmuir y Freundlich en los intervalos de concentración y temperatura estudiados. Los datos experimentales obtenidos se ajustan mejor a la isoterma de Langmuir (R2 > 0,994, 0,986 y 0,970 para plomo, cadmio y cinc, respectivamente) que a la de Freundlich (R2 > 0,501, 0,673 y 0,969 para plomo, cadmio y cinc) (Tabla I). Según la isoterma de Langmuir, la capacidad de adsorción de la cascarilla es mayor para el plomo que para el cadmio y el cinc. La adsorción máxima, obtenida de la isoterma de Freundlich, aumenta con la temperatura para los tres cationes.
En las soluciones de equilibrio del proceso de eliminación de Cu (II) se observa la existencia de hierro en solución. La concentración de hierro aumenta con el aumento de la temperatura. La cantidad de hierro metálico existente en la cascarilla después del proceso de eliminación, disminuye al aumentar la cantidad de metal adsorbido sobre la cascarilla.
Estos resultados indican que, durante el proceso de eliminación de cobre sobre la cascarilla se produce un proceso de oxidación-reducción (o cementación), entre los iones Cu2+ en solución y el Fe 0 presente en la cascarilla, de modo que al fijarse el Cu 2+ sobre la cascarilla, el Fe 0 de ésta se oxida pasando a la solución como Fe 2+ y el Cu 2+ se reduce a Cu 0 , según la reacción:
Cu 2+ + Fe 0 —> Cu 0 + Fe 2+
|
Tabla I. Parámetros de Langmuir y Freundlich en función de la temperatura
|
||||||||
|
Ión metálico
|
T (°C)
|
Xm
(mg/g) |
b
(l/mg) |
R 2
|
a
|
1/n
|
R 2
|
XmF
(mg/g) |
| Cd 2+ | 20 | 0.11 | 0.09 | 0.991 | – | – | 0.673 | – |
| Cd 2+ | 40 | 0.37 | 0.04 | 0.986 | 0.04 | 0.42 | 0.989 | 0.30 |
| Cd 2+ | 60 | 0.73 | 0.06 | 0.987 | 0.16 | 0.26 | 0.986 | 0.73 |
| Cd 2+ | 80 | 1.20 | 0.13 | 0.994 | 0.40 | 0.20 | 0.970 | 1.23 |
| Zn 2+ | 20 | 0.22 | 0.03 | 1 | 0.02 | 0.46 | 0.969 | 0.20 |
| Zn 2+ | 40 | 0.19 | 0.02 | 0.970 | 0.01 | 0.56 | 0.961 | 0.18 |
| Zn 2+ | 60 |
0.68 |
0.03 | 0.998 | 0.04 | 0.50 | 0.974 | 0.78 |
| Zn 2+ | 80 | 2.17 | 0.02 | 0.990 | 0.19 | 0.38 | 0.998 | 2.21 |
| Pb 2+ | 20 | 2.45 | 0.06 | 0.994 | 0.41 | 0.30 | 0.975 | 2.65 |
| Pb 2+ | 40 | 2.72 | 0.15 | 0.998 | 0.50 | 0.28 | 0.887 | 2.89 |
| Pb 2+ | 60 | 2.74 | 0.75 | 1 | – | – | 0.696 | – |
| Pb 2+ | 80 | 2.60 | 2.01 | 1 | – | – | 0.501 | – |
| XmF = Adsorción máxima, obtenida de la isoterma de Freundlich. | ||||||||
Teniendo en cuenta que el contenido de Fe 0 en la cascarilla es de un 7,2 %, la cantidad de iones cobre eliminados equivale a 0,6 mg Cu (II)/mg Fe 0 (T> 60 °C).
A 60 y 80 °C, fundamentalmente, el cobre cementa para altas concentraciones iniciales del metal (1,0-8,0 g/l Cu (II), donde [Cu] eliminado/ [Fe] solución » 1) y, a 20 y 40 °C, reacciones secundarias del proceso serían las responsables de las altas relaciones, [Cu] eliminado / [Fe] solución, alcanzadas. La relación [Cu] eliminado/ [Fe] solución para concentraciones comprendidas en el rango 0,05-0,1 g/l Cu (II) es mayor de 1.
3.3. Ensayos de desorción
Para los ensayos de desorción de los metales Cd (II), Zn (II) y Pb (II) se utilizó HCl 1 M por su capacidad de complejación con estos metales. En la tabla II se muestran los resultados de los ensayos de desorción realizados. Los iones Cd 2+ y Pb 2+ se desorben completamente y el Zn 2+ , en un 83 %.
Los ensayos de desorción del Cu (II) se han llevado a cabo utilizando soluciones de HNO 3 al 2 % y 1 % v/v en agua destilada y la mezcla HNO 3– H 2SO 4 al 0,5-0,5 v-v/v en agua destilada. En la tabla III se muestran los resultados de los ensayos de desorción realizados. Se observa que al aumentar la concentración del ácido aumenta la desorción de cobre, llegando a alcanzarse un 96 %, aproximadamente, de cobre desorbido a las 5 h de reacción. Con la mezcla de ácidos, la desorción de cobre es mayor que con HNO3 al 1 % v/v.
|
Tabla II. Porcentajes de desorción de los metales Cd (II), Zn (II) y Pb (II), t = 5 h
|
|||
|
Ión metálico
|
Desorción (%)
|
||
|
Cd 2+
|
100
|
||
|
Zn 2+
|
83.3
|
||
|
Pb 2+
|
100
|
||
|
Tabla III. Porcentajes de desorción de Cu (II), t = 5 h
|
|||
|
Desorción (%)
|
Desorción (%)
|
Desorción (%)
|
|
|
HNO 3 2 % v/v
|
HNO 3 1 % v/v
|
HNO 3-H 2SO 4 0,5-0,5 % v-v/v
|
|
|
95.8
|
26.7
|
63.3
|
|
4. CONCLUSIONES
Los resultados obtenidos indican que la cascarilla es un material efectivo para eliminar iones Cd 2+, Zn 2+, Pb 2+ y Cu 2+ en solución acuosa. Esta eliminación está influida por la temperatura en el caso del Cd2+, Zn2+ y Cu2+, aumentado la eliminación con el aumento de la temperatura. La eliminación de cadmio, cinc y plomo corresponde a un proceso de adsorción superficial y la eliminación de cobre, a un proceso de cementación.
La desorción de Cd 2+, Zn 2+, Pb 2+ de cascarillas cargadas puede llevarse a cabo con HCl 1 M y la desorción de Cu2+ se puede realizar con HNO 3 al 2 % v/v, en las condiciones experimentales ensayadas.
Agradecimientos
Los autores agradecen a los Sres. A. Delgado, J.L. Báscones y M. López su asistencia técnica.
REFERENCIAS
[1] INTERNATIONAL IRON AND STEEL INSTITUTE, The Management of Steel Plant Ferruginous By-Products, Committee on Environmental Affairs and Committee on Technology, Brussels, 1994.
[2] W.C. YING, Processings of the 44th Purdue Industrial Waste Conference, Lewis Publishers, Chelsea, MI, 1989, p. 313.
[3] F.J. ALGUACIL, A.G. COEDO, T. DORADO, I. PADILLA, Rev. Metal. Madrid 38 (2002) 306-311.
[4] F.J. ALGUACIL, Rev. Metal. Madrid 38 (2002) 348-352.
[5] F.J. ALGUACIL, Rev. Metal. Madrid 39 (2003) 205-209.
[6] J. HO SUH y D. SEOG KIM, J. Chem. Technol. & Biotechnol. 75 (2000) 279-284.
[7] S. AL-ASHED y F. BANAT, Adsorpt. Sci. & Technol. 19 (2001) 117-129.
[8] G. CIMINO, A. PASSERINI y G. TOSCANO, Water Res. 34 (2000) 2.955-2.962.
[9] M.I. PANAYOTOVA, Waste Manage. 21 (2001) 671-676.
[10] P.D. JOHNSON, M.A. WATSON, J. BROWN y I.A. JETCOAT, Waste Res. 35 (2001) 965-976.
[11] F.J. ALGUACIL, Rev. Metal. Madrid 38 (2002) 205-209.
[12] F.J. ALGUACIL, M. ALONSO, Rev. Metal. Madrid 38 (2002) 263-269.
[13] O. HERREROS, G. FUENTES, R. QUIROZ, J. VIÑALS, Rev. Metal. Madrid 39 (2003) 90-98.
[14] C.A. HERRERA, J.F. MUÑOZ, J.M. CASAS, Rev. Metal. Madrid 39 (2003) 330-345.
[15] A. PELLÓN, F. BENITEZ, J. FRADES, L. GRACÍA, A. CERPA, F.J. ALGUACIL, Rev. Metal. Madrid 39 (2003) 9-16.
[16] INSTITUTO DEL HIERRO y DEL ACERO, Métodos de análisis químicos unificados, Parte III, Instituto del Hierro y del
Acero, Madrid, 1955, pp. 18-22 y 91.
[17] F.J. ALGUACIL, Tesis Doctoral, Facultad de Ciencias Químicas, Universidad Complutense de Madrid, 1984.
[18] A. DABROWSKI, Adv. Colloid Interface Sci. 93 (2001) 135- 224.
Por: M.I. Martín, F.A. López, A. López-Delgado, C. Pérez y F.J. Alguacil
Centro Nacional de Investigaciones Metalúrgicas (CENIM), Madrid
Fuente: Rev. Metal. Madrid