Comparación de diferentes soluciones de aminas para la purificación de Biogás
RESUMEN
El biogás es un valioso combustible renovable producido por la digestión anaeróbica de materia orgánica desechable. Sus principales componentes son metano (CH4), dióxido de carbono (CO2), agua (H2O) y ácido sulfhídrico (H2S). La presencia de anhídrido carbónico y ácido sulfhídrico constituye un problema ya que son perjudiciales para cualquier equipo de procesamiento de biogás y producen emisiones contaminantes. Entre las diversas tecnologías disponibles actualmente para purificar biogás, la absorción con aminas es una tecnología muy conveniente por su alta selectividad hacia el CO2 y el H2S. El presente trabajo compara la concentración de metano, anhídrido carbónico y ácido sulfhídrico en el gas endulzado y el consumo de energía en un proceso convencional de absorción-desorción para seis tipos de soluciones de aminas o mezclas de ellas.
Palabras clave: endulzamiento con aminas, dióxido de carbono, ácido sulfhídrico, gas dulce, ProMax, purificación de biogás.
INTRODUCCIÓN
La alta dependencia que existe en el país de los combustibles fósiles como fuente primaria para la generación de energía determina la insustentabilidad de la matriz energética. Por lo tanto resulta necesario diversificar esa matriz con la incorporación de fuentes de energía renovable, utilizadas de un modo sustentable. Una opción muy interesante para la sustitución de hidrocarburos por fuentes renovables de energía es el aprovechamiento del biogás. El biogás se produce a partir de la digestión anaeróbica de residuos orgánicos que pueden provenir de fuentes industriales, municipales y/o agrícolas. Se solucionan de esta manera los problemas relacionados con la contaminación de los diferentes tipos de desperdicios biológicos y a la vez se contribuye a disminuir el calentamiento global al reducir la alta dependencia con los hidrocarburos y al aprovechar el metano eliminado por dichos desperdicios. La composición aproximada del biogás se estima en 60% de metano (CH4), 35% de anhídrido carbónico (CO2), 4% de vapor de agua y estimativamente un máximo de 1% de ácido sulfhídrico (H2S).
Actualmente están siendo implementados diferentes sistemas de purificación de biogás en diversas partes del mundo.
Entre los sistemas de purificación existentes a escala de aplicación tecnológica se encuentra, por ejemplo, el proceso conocido como Binax, desarrollado por Central Plants Inc. en California, USA (Henrich, 1983). Esquema que puede perfeccionarse con un rediseño de la torre de absorción de agua (Rasi y et. al., 2008). Por otro lado, tanto la empresa Guild Associates, Inc. (Ohio, USA) como la HAASE Energietechnik AG (Alemania) ofrecen un proceso de purificación en el cual, se comprime biogás a alta presión, como primera etapa, y luego es introducido a un sistema de adsorción. Además la agencia de medio ambiente de Gran Bretaña ha producido una discusión de los distintos métodos de purificación (Environmental Agency, 2002) y de la misma forma Abatzoglou (2009), Patterson y el. al. (2011) y Ryckebosch (2011) discuten diferentes métodos para la purificación y la mejora de las técnicas existentes.
Recientemente Tippayawong y Thanompongchart (2010) están investigando la eliminación del CO2 y el H2S con soluciones acuosas de sales y aminas en una columna empacada, aunque recomienda que se continúe investigando la factibilidad y eficiencia de esta tecnología a grandes escalas.
El objetivo de este trabajo es discutir la factibilidad del proceso de endulzamiento con aminas en la purificación del biogás. Para ello se simulará una unidad convencional de absorción-desorción utilizando el simulador ProMax® con TSWEET® y PROSIM® para estudiar el comportamiento de diferentes tipos de aminas y mezcla de aminas y determinar la eficiencia de este proceso.
CONSIDERACIONES GENERALES DE LOS DIFERENTES TIPOS DE AMINAS
Es muy importante poder determinar la solución adecuada de aminas para el proceso de purificación de biogás, la cual variará en función de las condiciones de presión y temperatura y también de los niveles de purificación que se pretenda alcanzar. Las aminas han sido ampliamente estudiadas por muchos años para remover las impurezas del gas natural (principalmente CO2 y H2S) por lo que se hará una breve descripción de las ventajas y desventajas de los principales tipos de aminas utilizados en la actualidad. A continuación se resumen algunas condiciones de operación de las aminas más comunes (Polasek y Bullin, 1984; Kohl y Nielsen, 1997).
MEA (Monoetanolamina)
Las soluciones de monoetanolaminas son apreciablemente más corrosivas que las soluciones con otras aminas, especialmente si la concentración de aminas excede el 20%. Debido a estos problemas de corrosión, la carga de gas ácido se debe limitar entre 0,3 – 0,35 moles de gas ácido por moles de amina en equipos de acero al carbón. Sin embargo, siguen siendo el solvente preferido en corrientes de gas que contienen bajas concentraciones de H2S y CO2 y especialmente cuando están presentes contaminantes no menores como COS y CS2. El bajo peso molecular de las monoetanolaminas (que resulta en una alta capacidad de la solución a moderadas concentraciones), su alta alcalinidad y la relativa facilidad con que se pueden regenerar las soluciones contaminadas son ventajas que en muchos casos contrarrestan las desventajas.
Dado el calor de reacción de la MEA de aproximadamente 825 BTU/lb CO2, un gas de alimentación que contenga altas concentraciones de CO2 causará un alto consumo energético en el rehervidor o una regeneración pobre de la solución de amina. El calor de reacción de la MEA con H2S es aproximadamente 550 BTU/lb. Es importante resaltar que el calor de reacción de las aminas es función de la carga de gas ácido y de otras condiciones y generalmente varía solo entre 50 y 60 BTU/lb en cargas de gas ácido total de hasta 0,5 mol/mol. Por encima de este valor de la carga de gas ácido el calor de reacción varía considerablemente y debe ser calculado como una función de la carga.
Finalmente, la alta presión de vapor de la MEA causa pérdidas significativas por vaporización, particularmente en operaciones a baja presión.
DEA (Dietanolamina)
Las soluciones acuosas de dietanolaminas se utilizaron por muchos años en el tratamiento de gases de refinería que normalmente contiene cantidades apreciables de COS y CS2, además de H2S y CO2. Las aminas secundarias son menos reactivas con COS y CS2 que las aminas primarias y los productos de reacción son menos corrosivos que en el caso de la MEA. Las soluciones de DEA son normalmente utilizadas en concentraciones entre 25 – 35 % en peso y la carga total de gas ácido está también limitada entre 0,3 – 0,35 moles de gas ácido por moles de amina en equipos de acero al carbón. El calor de reacción para las DEA con CO2 es de 653 BTU/lb, que es aproximadamente 20% menos que para la MEA. Mientras que el calor de reacción para la DEA con H2S es aproximadamente 511 BTU/lb.
Una desventaja de las soluciones de dietanolaminas es que para recuperar la solución contaminada puede requerir una destilación al vacío. Otra desventaja es que las DEA se someten a numerosas reacciones irreversibles con el CO2, formando productos de degradación corrosivos, y por esta razón, las DEA no son una buena opción para el tratamiento de gases que contienen altas concentraciones de CO2.
DGA (Diglycolamina)
Este solvente es, en muchos aspectos, similar a las monoetanolaminas excepto por su baja presión de vapor. Esto permite que se pueda utilizar en mayores concentraciones (50 – 70%) disminuyendo su caudal de circulación y el consumo de vapor. Sin embargo, al igual que las soluciones con MEA, los problemas de corrosión limitan la carga de gas ácido a 0,35 mol de gas ácido por mol de amina. Una característica de esta amina es que tiene la preferencia de reaccionar con CO2 antes que con H2S.
Las DGA son particularmente útiles para purificar grandes volúmenes de gas a bajas presiones ya que puede operar a temperatura ambiente y puede producir gas endulzado a moderadas presiones. Una de las principales desventajas es el alto calor de reacción tanto para el CO2 (850 BTU/lb) como para el H2S (674 BTU/lb).
MDEA (Metildietanolamina)
Las aminas terciarias, especialmente las MDEA, pueden absorber selectivamente H2S bajo condiciones de operación apropiadas con bajos tiempos de contacto. Estas soluciones se utilizan, especialmente, cuando la proporción de CO2 con H2S es muy alta. Diversos estudios han comprobado que los solventes selectivos pueden producir concentraciones de H2S tan bajas como 4 ppmv en el gas tratado mientras que permite que una gran cantidad de CO2 pase a través del absorbedor sin ser absorbido.
Debido a su baja presión de vapor, la MDEA puede ser usada en concentraciones entre 20 – 50% en peso, sin pérdidas por evaporación apreciables. Además, como son poco corrosivas pueden tener cargas de gas ácido entre 0,7 – 0,8 moles de gas ácido por moles de aminas en equipos de acero al carbón. Otras ventajas de estas aminas sobre las aminas primarias y secundarias incluyen: bajos calores de reacción (alrededor de 600 BTU/lb CO2 y 522 BTU/lb H2S) y alta resistencia a la degradación térmica y química.
Mezcla de aminas
Las MDEA han aumentado su importancia como solventes no selectivos para la remoción de altas concentraciones de gas ácido, especialmente de CO2, debido a sus bajos requerimientos energéticos, su alta capacidad, excelente estabilidad y otros atributos favorables. Su principal desventaja es la baja velocidad de reacción (y por lo tanto de absorción) con CO2. La adición de una amina primaria o secundaria, tales como MEA o DEA, aumenta la velocidad de absorción sin disminuir las ventajas de la MDEA (Polasek et al., 1992). Las aminas secundarias generalmente comprenden menos del 20% del total de las soluciones de aminas en una base molar. A bajas concentraciones de MEA y DEA, la concentración total puede ser tan alta como 55%, sin necesidad de utilizar equipamientos de metal especializados. En algunos casos se utilizan activadores (tales como piperazina) que aumentan la velocidad de hidratación del CO2.
Muchos autores han intentado explicar la absorción selectiva de aminas de H2S en presencia de CO2. Algunos autores concluyen que estas preferencias se deben a diferencias en la solubilidad, la velocidad de reacción o una combinación de ambas. Sin embargo, todas las aminas muestran algún grado de selectividad basado en los efectos cinéticos (Bullin et al., 1982) por ejemplo, la velocidad de reacción del CO2 disminuye con la sustitución del grupo nitrógeno por lo que las aminas primarias reaccionan más rápido que las aminas secundarias y a su vez estas lo hacen más rápido que las aminas terciarias. La velocidad de reacción del H2S es tan rápida que el equilibrio es efectivamente alcanzado para todas las aminas (Lunsford y Bullin; 1996). Por lo tanto si el objetivo es eliminar conjuntamente ambos contaminantes, la mezcla de aminas es una buena opción.
SIMULACIÓN DEL PROCESO DE PURIFICACIÓN DE BIOGÁS EN SOLUCIONES ACUOSAS DE AMINAS
Para poder comparar la influencia de los diferentes tipos de aminas en la purificación del biogás se simuló un proceso convencional de absorción-desorción operando en idénticas condiciones con seis tipos de aminas o mezclas de ellas.
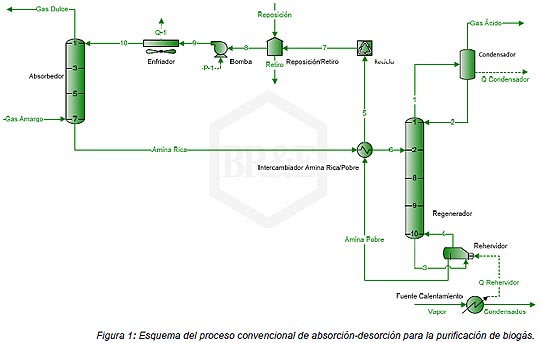
Para ello, se utilizó el simulador de procesos ProMax® con TSWEET® y PROSIM® cuya precisión está bien establecida en la industria. Este simulador incluye las principales aminas utilizadas comercialmente (MEA, DEA, DGA, MDEA, DIPA, TEA, entre otras) así como también los principales componentes presentes en el biogás (H2S, CO2, CH4, H2O, etc.). Las mezclas de aminas también pueden ser modeladas efectivamente. La presión de vapor de H2S y CO2 sobre las soluciones de aminas puede ser calculada utilizando el modelo propietario de endulzamiento con aminas que está basado en el modelo de Pitzer-Debye-Hückel con significativas modificaciones. Un modelo cinético en el absorbedor predice los efectos del tiempo de residencia, temperatura, concentración de la solución, presión y tipo de amina, en la velocidad de absorción del CO2. El programa ha demostrado ser confiable en el diseño de unidades de endulzamiento de gas natural con aminas y las capacidades de ProMax han sido descritas previamente por varios autores (Holmes y Bullin, 1983; Polasek et al., 1982, 1983). El esquema de procesos de la unidad de endulzamiento modelada con el simulador, se muestra en la Figura 1.
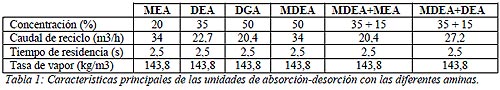
En la simulación se utilizó la máxima concentración de aminas posible para evitar la corrosión. La composición de biogás utilizada se aproximó en: 60% CH4, 35% CO2, 4% vapor de agua, 1% H2S. La corriente de ingreso de biogás crudo se fijó en 0,5 m3/s a 373 K de temperatura y 3 bar de presión, para todas las simulaciones. La temperatura de la corriente de amina al ingreso de la torre de absorción se varió entre 316 K – 344 K. En la Tabla 1 se resumen las características principales de la unidad de purificación para las diferentes aminas. El tiempo de residencia de cada plato teórico se fijó en 2,5 segundos y la tasa de vapor al rehervidor utilizada fue de 143,8 kg de vapor por m3 de amina en circulación, la cual se encuentra dentro de los valores usualmente utilizados para este proceso (entre 95,9 – 143,8 kg/m3). En este estudio se utilizó el valor límite superior del rango recomendado para obtener mayores niveles de purificación.
|
|
RESULTADOS OBTENIDOS
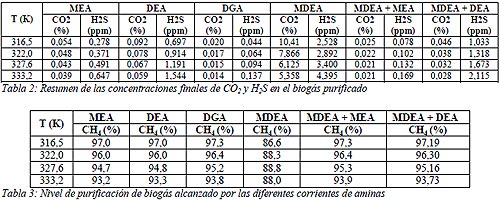
La Tabla 2 resume los resultados obtenidos de la simulación, donde se pueden apreciar las concentraciones finales de las impurezas presentes en el biogás para diferentes temperaturas de alimentación de la amina pobre al absorbedor (ver Figura 1). Dado que la absorción del CO2 está controlada cinéticamente, el incremento de la temperatura de la amina pobre ocasiona un aumento en la cantidad de CO2 absorbido por la amina (Lunsford y Bullin, 1996). Mientras que la Tabla 3 expone los niveles de purificación del metano alcanzados por el proceso de endulzamiento con aminas. Las concentraciones de metano disminuyen al aumentar la temperatura debido a que se producen mayores pérdidas de agua y amina en el gas dulce (Lunsford y Bullin, 1996). Estos resultados muestran que las aminas más eficientes para remover las impurezas son MEA, DEA y DGA siendo la MDEA menos eficiente por lo que esta última amina debe mezclarse con alguna de las anteriores para obtener mejores resultados (como bien se observa en la Tabla 2). Usar mezclas de aminas parece ser una buena opción cuando se desea remover en simultaneo el CO2 y el H2S, aunque los menores niveles de estos contaminantes se alcanzaron con la DGA.
 |
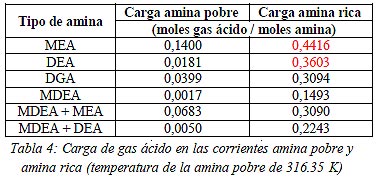
En la Tabla 4 se resumen la carga de gas ácido en las corrientes amina pobre y amina rica (ver Figura 1). Se puede observar como en la mayoría de los casos analizados se respeta la carga máxima recomendada para evitar la corrosión, excepto en el caso de la MEA y DEA donde la carga de la corriente amina rica excede dicho valor, aunque en este último caso el exceso es mínimo.
 |
Existen muchos aspectos a tener en cuenta a la hora de optimizar una unidad de endulzamiento con aminas. No solo es importante seleccionar adecuadamente la amina a utilizar sino que además se deben tener en cuenta otros factores como por ejemplo, la concentración de las aminas, el uso de mezclas de aminas y la temperatura de la solución que ingresa al absorbedor (Lunsford y Bullin, 1996). Por otra parte, si bien este estudio analizó una unidad de absorcióndesorción convencional, existen otro tipo de unidades que pueden ser implementadas para mejorar el proceso. Una discusión al respecto fue desarrollada por Shethna y Towler, (1997).
Otros de los principios básicos y críticos en el diseño del equipo de absorción-desorción, y muchas veces mal interpretado, es la capacidad de las soluciones de aminas en circulación, como bien se describe en el trabajo realizado por Jenkins y Haws (2002). Generalmente la fuerza del solvente se mide como una base porcentual másica (wt%) de la solución ya que de esta forma los resultados son más fáciles de medir e interpretar. Sin embargo, cuando se comparan las fuerzas relativas de las diferentes aminas, es necesario considerar el peso molecular de las mismas para comprender cuál es la verdadera capacidad hacia los gases ácidos. Cada mol de H2S reacciona con un mol de amina, por lo que la capacidad real de extracción de gas ácido de cada amina está relacionada con el número de moles de amina que se encuentran por unidad de volumen de circulación de la solución. Dichos autores afirman que la molaridad (mol/lt) es la medida que se debería utilizar para determinar la capacidad de las soluciones de aminas de extraer gases ácidos. Los valores de molaridad de las soluciones analizadas se expresan en la Tabla 5.
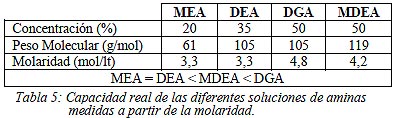 |
Adicionalmente, la fuerza básica relativa es otro aspecto a tener en cuenta para analizar la potencia de una solución de aminas, como se menciona también en el trabajo de Jenkins y Haws (2002). Cuanto mayor es la fuerza básica, mayor es la afinidad para remover gases ácidos. La contante de acidez pKa es la medida que normalmente se utiliza para medir la fuerza básica relativa de varias soluciones de tratamiento de gas. Cuanto mayor es este valor, más débil es el ácido o más fuerte es la base. Los valores de pKa de las soluciones de aminas analizadas se detallan en la Tabla 6.
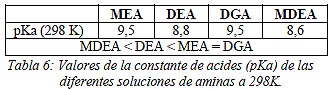 |
El calor utilizado por el rehervidor es otro parámetro que se tuvo en cuenta para comparar los diferentes sistemas de endulzamiento con aminas. Estos datos se detallan en la Tabla 7. Se puede observar que los procesos que consumen la menor cantidad de calor son lo que utilizan DGA y las mezcla de aminas MDEA+MEA, mientras que el proceso que utiliza únicamente MDEA es el que mayor cantidad de calor consume.
 |
Muchas veces se analiza el calor de reacción de las diferentes aminas como un parámetro para determinar la energía consumida por el proceso. Sin embargo, mientras el calor de reacción varía solo entre 15 – 30% en las diferentes aminas, la energía requerida para invertir el calor de reacción es muy pequeña cuando se la compara con la cantidad de calor requerido para aumentar la temperatura de la solución en el regenerador, esto se debe a la gran cantidad de agua presente en la solución. Es decir, que el tipo de amina juega un rol menor en los requerimientos energéticos del proceso. Por lo tanto para optimizar la energía utilizada es necesario optimizar la tasa de circulación, es decir, maximizar la potencia de cada unidad de volumen circulado (Jenkins y Haws, 2002).
Los datos presentados en las Tablas 5 y 6 permiten entender porque los mayores niveles de purificación se obtuvieron con la DGA y con las mezclas de aminas MDEA+MEA y porque el calor necesario en el rehervidor es menor. Estas dos soluciones parecen ser las mejores opciones para la purificación de biogás.
Los métodos de absorción fisicoquímicos (como por ejemplo la remoción con agua) se utilizan normalmente en la purificación de biogás ya que son efectivos incluso a bajos caudales. Además son métodos menos complicado, requiere poca infraestructura, son de relativamente bajo costo y las pérdidas de metano son bajas (menores al 2%) debido a la gran diferencia en la solubilidad entre el CO2 y el CH4. Otra de las ventajas del arrastre con agua es que la planta tiene la capacidad de ajustarse a los cambios de presión y temperatura y puede lograr eficiencias mayores al 97% de CH4. Algunas de las desventajas son: atascamientos por el crecimiento bacterial, formación de espumas y baja flexibilidad a las variaciones en el gas de entrada.
En lugar de agua, también se puede utilizar polietilenglycol para absorber CO2, H2S y agua, dado que tienen mayor solubilidad que el metano. Además este solvente físico tiene baja presión de vapor por lo que las pérdidas químicas son muy bajas. El proceso es muy similar al lavado con agua seguido de la regeneración. Además, este proceso tiene la ventaja de necesitar menores volúmenes de absorvedor debido a la alta solubilidad del CO2 y del H2S en polietilenglicol, resultando tanques más pequeños y menores bombeos. Por otra parte, no es necesario secar el gas purificado ya que el agua es absorbida por el polietilenglicol. Las desventajas de este proceso están asociadas a la corrosión, el gran calor necesario para la regeneración y a la reducción en la operación cuando se diluye el glicol en agua.
Por último el proceso químico de absorción con aminas puede lograr mayores eficiencias que los anteriores (>99%), los costos de operación son bajos, se puede lograr la regeneración de la amina, existen mayores cantidades de CO2 disuelto por unidad de volumen (comparado con el agua) y tiene muy bajas perdidas de metano (<0,1%). Sin embargo, también es necesario suministrar calor para la regeneración, cuenta con problemas de corrosión (como ya se mencionó anteriormente), existen precipitados de sales, posibles formaciones de espumas, descomposición y envenenamiento de aminas por la presencia de O2 y de otros químicos.
CONCLUSIONES
Existen muchos aspectos a tener en cuenta a la hora de decidir el proceso más adecuado de purificación de biogás. Sin embargo, el endulzamiento con aminas es un proceso largamente estudiado para el gas natural que parece adaptarse muy bien al caso particular del biogás. En este trabajo se simuló, utilizando ProMax®, un proceso convencional de absorción-desorción para seis tipos de soluciones aminas (MEA, DEA, DGA, MDEA) o mezclas de ellas (MDEA + MEA, MDEA + DEA), mostrando buenos resultados en los niveles de purificación alcanzados. Sin embargo, es necesario continuar investigando éste y otros procesos para poder desarrollar una unidad óptima de purificación de biogás.
REFERENCIAS
Abatzoglou, N. (2009). “A review of biogas purification processes”; Wiley InterScience (www.interscience.wiley.com); DOI: 10.1002/bbb.117; Biofuels, Bioprod. Bioref. 3:42–71
Bullin, J.A. Polasek J.C. (1982). «Selective Absorption Using Amines,» Proceedings of the 61st GPA Annual Convention, p. 86 (1982).
Environmental Agency (2002), “Guidance on Gas Treatment Technology for Landfill gas Engines” Bristol, December.
Henrich, R.A. (1983) “Advances in Biogas to Fuel Conversion”. Biocycle Magazine. pp. 28-31.
Holmes, J. W., Spears M. L. y Bullin J. A. (1984). «Sweetening LPG’s with Amines,» Chemical Engineering Progress, 80, N° 5, p. 47.
Jenkins J. L. y Haws R. (2002) “Understanding gas treating fundamentals”, Refining Gas Processing Petrochemicals, Reprinted from PTQ (Petroleum Technology Quarterly) Winter 2001-2 issue.
Kohl, A. y Nielsen, N. (1997). “Gas Purification”, 5th edición, Gulf Publishing Company, Houston, Texas.
Lunsford K. M. y Bullin, J.A. (1996). “Optimization of Amine Sweetening Units”, Bryan Research and Engineering, Inc., Technical Papers. Proceedings of the 1996 AIChE Spring National Meeting. New York, NY: American Institute of Chemical Engineers.
Patterson T., Esteves S., Dinsdale R. y Guwy A. (2011). “An evaluation of the policy and techno-economic factors affecting the potential for biogas upgrading for transport fuel use in the UK” Energy Policy 39, 1806–1816.
Polasek J. C. y Bullin J. A. (1982). «Selective Absorption Using Amines,» Proceedings of 61st Annual Gas Processors. Convention.
Polasek J. C. y Bullin J. A. (1984). «Selecting Amines for Sweetening Units,» Energy Progress, Vol. 4, (N° 3), p. 146
Polasek J. C., Bullin J. A. y Iglesias-Silva G. A. (1992). «Using Mixed Amine Solutions for Gas Sweetening», Presented at the 71st Annual Gas Processors Association Convention.
Polasek J. C., J. A. Bullin y Donnelly S. T. (1983). «How to Reduce Costs in Amine Sweetening Units, » Chemical Engineering Progress, 79, No. 3, p.63.
Rasi S., Läntelä J., Veijanen A. y Rintala J. (2008) “Landfill gas upgrading with countercurrent water wash”, Waste Management 28, 1528-1534.
Ryckebosch E., Drouillon M., Vervaeren H. (2011). “Review: Techniques for transformation of biogas to biomethane”, Biomass and Bienergy 35, 1633 – 1645.
Shethna H. K. y Towler G. P. (1997). “Design of Mixed-Solvent Processes for Chemisorption with Ultrahigh Recovery”, Ind. Eng. Chem. Res., 36, 5307-5320.
Tippayawong, N.; Thanompongchart, P. (2010). “Biogas quality upgrade by simultaneous removal of CO2 and H2S
in a packed column reactor” Energy 35, 4531 – 4535.
Por: B. Morero 1, M. C. Croquer-Martinis 2, E. Groppelli3 , E. A. Campanella 4
1 Instituto de Desarrollo Tecnológico para la Industria Química (INTEC),
Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET)
2 Bryan Research & Engineering, Inc., Bryan, Texas USA
3 Grupo de Energía No Convencional, Facultad de Ingeniería Química (FIQ),
Universidad Nacional del Litoral (UNL), Santa Fe, Argentina
4 Instituto de Desarrollo Tecnológico para la Industria Química (INTEC), Facultad de Ingeniería y Ciencias Hídricas (FICH),
Universidad Nacional del Litoral (UNL), Santa Fe, Argentina
Fuente: Avances en Energías Renovables y Medio Ambiente