Co-Digestión de la fracción orgánica de residuos sólidos domiciliarios con aserrín en reactores anaeróbicos semicontinuos
RESUMEN
El objetivo de este trabajo fue estudiar el proceso de la co-digestión anaeróbica de la fracción orgánica de residuos sólidos domiciliarios (FORSD) con aserrín y la caracterización de los efluentes generados. Los reactores fueron alimentados diariamente con la FORSD y una mezcla de la FORSD y aserrín pretratado (FORSD-AS). En el efluente se determinaron variables físico-químicas para el monitoreo del proceso. Se midió diariamente el volumen de biogás y semanalmente su calidad (CH4, CO2, N2, SH2 y H3C-SH). Los resultados en el efluente mostraron condiciones de estabilidad en ambos tratamientos, no observándose una mejora en la calidad con el co-sustrato. El rendimiento de biogás fue mayor en la FORSD, observándose que el co-sustrato no mejoro el rendimiento del biogás. Los valores de CH4 y CO2 fueron similares en ambos tratamientos, sin embargo se observó una disminución de SH2 y H3C-SH en FORSD-AS, mejorando así la calidad del efluente gaseoso.
Palabras clave: biogás, digestión anaeróbica, residuos domiciliarios, co-sustrato, efluente
INTRODUCCIÓN
Los grandes volúmenes generados de residuos sólidos domiciliarios (RSD) y su gestión inadecuada representan serios problemas en el ambiente a nivel mundial. La producción de los desechos alimenticios oscila entre 950 a 1150 toneladas/día (2009) en la Ciudad Autónoma de Buenos Aires, y son el principal componente del flujo de los RSD, representando un 40,1% del total (FIUBA y CEAMSE, 2010).
Estos desechos alimenticios pueden ser aprovechados para generar energía y disminuir así el mayor porcentaje de los residuos sólidos que se generan. La fracción orgánica de los RSD (FORSD) puede ser utilizada como sustrato por bacterias anaeróbicas, capaces de degradar estos compuestos y transformarlos en biogás, el cual está formado principalmente por CH4, CO2 y otros gases trazas (Pavlostathis y Giraldo-Gómez, 1991).
La biometanización de compuestos orgánicos resulta compleja, debido a que es una transformación bioquímica donde los microorganismos requieren ciertas condiciones ambientales óptimas para su desarrollo. Existen numerosos factores que pueden afectar la actividad de las bacterias, principalmente las metanogénicas y, en consecuencia, la producción de biogás. A tal efecto, resulta clave monitorear la calidad del efluente semi-líquido mediante determinaciones físicas y químicas como el pH, los ácidos grasos volátiles (AGV), la alcalinidad parcial (AP) y la total (AT), la demanda química de oxígeno (DQO) y los indicadores de estabilidad alfa y AGV/AT, entre otros, las cuales nos describen la evolución del proceso y su funcionamiento (Beily et al., 2010; Bres et al., 2010; Da Silva, 2007; Cruz y Plaza, 2004). Además existen ciertos parámetros operativos como la temperatura, la agitación, la velocidad de carga (VC) y el tiempo de retención que afectan fuertemente el desarrollo de la digestión anaeróbica (Lindorfer et al., 2008; Gomez et al., 2006). Una elevada VC en la etapa de arranque, puede generar una acidificación en el sistema y, en consecuencia, la detención del proceso. Es por ello que, durante esta etapa, la alimentación debe incrementarse en forma gradual para aclimatar las bacterias al nuevo sustrato y evitar la acumulación de los AGV que inhiben la actividad de las metanogénicas (Gropelli y Giampaoli, 2001).
Varios investigadores han estudiado a escala laboratorio el tratamiento de la FORSD mediante la digestión anaeróbica (Fernández et al., 2008; Foster-Carneiro et al., 2008; Zhang et al., 2007; Castillo et al., 2005; Gallert et al., 2003). Uno de los problemas encontrados al trabajar con este tipo de residuos es su baja relación C/N (entre 15:1-20:1), siendo la relación óptima para el desarrollo de las bacterias entre 20:1-30:1 (Gropelli y Giampaoli, 2001; Zaher et al., 2007).
Se ha demostrado que la co-digestión es una alternativa viable para solucionar este tipo de problema, es decir utilizar una mezcla de sustratos como alimento. El uso de un co-sustrato, mejora el rendimiento del biogás, debido al efecto sinérgico de los microorganismos y al aporte de nutrientes que se encontraban ausentes o en baja concentración en el medio (Mata Alvarez et al., 2000). Algunos trabajos han codigerido a la FORSD con lodos y aguas residuales (Zhang et al., 2008; Elango et al., 2007; Sosnowsky et al., 2003), estiércol vacuno (Callaghan et al., 1999), estiércol de tambo (Macias-Corral et al., 2008) y con residuos de mataderos (Alvarez y Liden, 2008; Cuetos et al., 2008).
Los compuestos lignolíticos poseen una alta relación C/N. Sin embargo estos compuestos son resistentes al ataque enzimático debido a su estructura compleja y la fuerte asociación que existe entre la lignina, la celulosa y la hemicelulosa.
La lignina no puede ser degradada bajo condiciones anaeróbicas. En plantas de biogás que tratan estiércol, la baja biodegradabilidad de las biofibras en el estiércol produce una pérdida de la generación de metano (CH4) y limita la eficiencia del proceso (Jin et al., 2009). Se ha demostrado que el material lignolítico pre-tratado por procesos físicos, con compuestos químicos o con material biológico tienen un efecto positivo en la biodegradabilidad, acelerando el proceso de hidrólisis y mejorando la producción de biogás (Bruni et al., 2010; Fernández et al., 2009; Taherzadeh and Karimi, 2008).
Existen trabajos que han demostrado que los compuestos lignocelulolíticos pre-tratados mejoraron la producción de biogás comparados con aquellos que no sufrieron un tratamiento previo. Un estudio evaluó los diferentes tipos de tratamientos en las biofibras del estiércol para incrementar la producción de CH4. Los resultados mostraron que el mayor rendimiento de CH4 se obtuvo en las biofibras tratadas con los compuestos alcalinos Ca(OH)2 y NaOH (Bruni et al., 2010). Un estudio con reactores anaeróbicos, alimentados con los sarmientos de la vid, mostró que este sustrato tratado con NaCl al 1% produjo una mayor rendimiento de CH4 en comparación con el mismo sustrato sin tratamiento previo (Gunaseelan, 1997).
El aserrín es un residuo que si bien tiene un costo de oportunidad para ser empleado en la generación de calor, en algunas regiones los volúmenes liberados son muy grandes y la falta de gestión apropiada genera riesgos directos al ambiente (Martina et al., 2007).
El objetivo de este trabajo fue estudiar el proceso de la co-digestión anaeróbica de la FORSD con aserrín pre-tratado y la caracterización del efluente semi-líquido generado en reactores de alimentación semicontinua.
MATERIALES Y MÉTODOS
Diseño del reactor
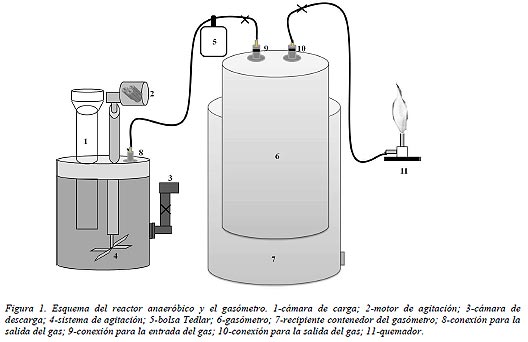
El ensayo se realizó en reactores plásticos de 20 l, siendo su volumen de trabajo de 19 l. En la figura 1 se muestra el diseño
del reactor y del gasómetro. En la parte superior se conectó una cámara de carga, sellada hidráulicamente con el líquido del
digestor para evitar fugas de gas, un motor para la agitación de la biomasa y la toma de gas, conectada a una manguera (especial para la conducción de gases) que finaliza en el gasómetro. La cámara de descarga, consistió en un caño acoplado al recipiente, elevado hasta el volumen de trabajo. Cada gasómetro consistió en una campana de plástico invertida, colocada en un reciente con agua para sellar hidráulicamente. El volumen de biogás generado es proporcional a la altura del gasómetro.
Se colocó un medidor de presión y una conexión para las bolsas Tedlar, las cuales fueron utilizadas para determinar la composición del biogás generado.
 |
Diseño experimental y condiciones de operación
La agitación se realizó en forma mecánica, programada a 20 rpm, y con una frecuencia de 2 veces por día durante 10 minutos. El diseño mecánico y de programación de la agitación fue realizado por la Universidad Tecnológica Nacional (UTN-cede Regional Haedo). Cada reactor fue inoculado con 19 l de una mezcla de estiércol vacuno y de efluente anaeróbico en una relación 1:9 (Tabla 1). Como sustrato arrancador, se agregó una mezcla de harina de maíz y salvado, un residuo previamente evaluado en un reactor de 12 m3 a flujo pistón (Bres et al., 2010). Los reactores fueron colocados en un baño termostatizado, de acero inoxidable, programado para trabajar en el rango mesofílico (35 ± 2 ºC). Se midió la producción diaria de biogás durante 11 días, período en el cual se detuvo la generación de biogás.
Luego los reactores fueron alimentados diariamente con dos sustratos diferentes: fracción orgánica de residuos sólidos domiciliarios (FORSD) y una mezcla de la FORSD y aserrín pre-tratado con NaOH (FORSD-AS), ambos diluidos al 10%.
Para el arranque, se incrementó semanalmente la VC, a fin de favorecer la adaptación de las bacterias al nuevo sustrato y evitar la acidificación del sistema. Las VC empleadas fueron de 0,7 gSV l-1 d-1 del día 12 al 18, 1,1 gSV l-1 d-1 del día 19 al 26 y 1,3 gSV l-1 d-1 del día 27 al 32. Luego se trabajó con una VC constante de 1,8 gSV.l–1.d-1 desde el día 33 hasta el final del ensayo (58 d).
El efluente desplazado fue muestreado dos veces por semana para las determinaciones físicas y químicas. El biogás acumulado en el gasómetro fue medido diariamente y se analizó la composición de biogás una vez por semana. Los resultados fueron analizados considerando las dos etapas del proceso: arranque y carga constante (VC=cte).
Para el análisis estadístico se realizó la prueba de Kruskal-Wallis para comparar las medianas entre tratamientos de cada variable analizada (p<0,05) para la etapa de VC constante. Además, se realizó un análisis de correlación a través del coeficiente R de Spearman, entre la CE y los iones Ca 2+, Mg 2+, K+, Na+.
Preparación de los sustratos
La FORSD fue recolectada del comedor de INTA y de verdulerías. Cada componente de este residuo fue pesado en forma separada antes de ser mezclado. La composición de este sustrato fue: 13,1 % de tomate, 0,7% de manzana, 1% de pan, 22,3 % de remolacha, 1,5% de cáscara de huevo, 9,1% de cítricos, 17,2% de hojas verdes, 1% de cebolla, 21,3% de papa, 2,3% de papeles, 5,3% de calabaza, 3,2 % de zanahoria, 2,9% de palta, 1,2 de brócoli y 2,1 % de restos de comida (% p/p en base al peso húmedo).
 |
El material fue mezclado y procesado con una chipeadora y una picadora hasta obtener un diámetro final de partículas entre 3 y 5 mm.
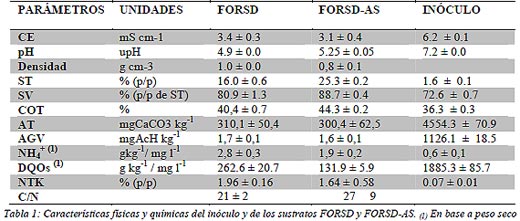
La mezcla FORSD y aserrín pre-tratado (FORSD-AS) se preparó en una relación 6:1. El tratamiento del aserrín consistió en sumergirlo en una solución de 22 gl-1 de NaOH durante 10 días, siguiendo la metodología descripta por Glennie y McCarthy (1974) y Martina et al. (2007). Las muestras FORSD y FORSD-AS ya homogenizadas fueron pesadas, empaquetas en bolsas de polietileno y freezadas a -20 ºC hasta su uso. La caracterización de los sustratos y del inóculo son mostrados en la tabla 1.
Métodos analíticos
Para la caracterización del sustrato y del inóculo se determinó: densidad, pH, conductividad eléctrica (CE), % de sólidos totales (ST), % de sólidos volátiles (SV), carbono orgánico total (COT), nitrógeno total Kjeldahl (NTK), demanda química de oxígeno soluble (DQOs), según métodos normalizados por APHA (1992) y amonio (NH4 +) y nitrato (NO3 -), según el método de microdestilación descripto por Bremner (1965). Para el análisis de de la DQO soluble en el sustrato se realizó un extracto, según metodología estandarizada por el Grupo de Tecnologías del Medio Ambiente, Departamento de Ingenieria Química y Tecnología de Alimentos de la Universidad de Cádiz, España (Álvarez Gallego, 2005). La alcalinidad total (AT, pH 4,3) fue determinada, según método propuesto por Jenkins et al. (1983) y, los ácidos grasos volátiles (AGV), por valoración por retroceso de la muestra empleada para la alcalinidad. Para el monitoreo del efluente se determinaron los parámetros pH, conductividad eléctrica (CE), sales (Ca 2+, Mg 2+, K+, Na+), DQOs, alcalinidad parcial (AP, pH 5,75), AT y AGV. A través de estos tres últimos parámetros se calcularon las relaciones entre las alcalinidades (alfa=AP/AT) y entre los AGV y la AT (AGV/AT). Estas dos relaciones son consideradas indicadores de estabilidad del proceso (Jenkins et al., 1983; Lopez et al., 2000; Beily et al., 2009; Bres et al., 2009).
El volumen de biogás generado diariamente fue medido por el método de desplazamiento de la campana invertida. Los valores fueron expresados en CNPT (T=0ºC, P=1 atm). Las concentraciones de metano (CH4), dióxido de carbono (CO2) y nitrógeno (N2) en el biogás fueron medidas según la norma ASTM D 1945 y los compuestos azufrados según la norma ASTM D 5504 (Laboratorio ALARALAB). Para los compuestos CH4, CO2 y N2 se utilizó un cromatógrafo de Gases (Hewlett Packard 6890 GC System) equipado con un detector de conductividad térmica (TCD) y un detector de ionización por llama (FID) y las columnas utilizadas fueron Tamiz Molecular 13X, Porapak N y Capilar PONA. Con los datos obtenidos se permitió calcular las propiedades físicas de la mezcla como la densidad y poder calorífico, a través de valores de tabla de componentes puros. Para los compuestos azufrados, sulfhídrico (SH2) y metilmercaptano (H3C-SH), se utilizó un equipo Sievers SCD 355L (SCD: Sulfur Chemioluminiscence Detector).
RESULTADOS Y DISCUSIÓN
Monitoreo del efluente líquido
En la figura 2, se muestran los resultados obtenidos de las alcalinidades (AP y AT), de los AGV, del pH y los indicadores del proceso alfa y AGV/AT para ambos tratamientos (FORSD y FORSD-AS) en función del tiempo. Durante la etapa de inoculación y arranque (desde el día 0 al 32) los valores de AT se mantuvieron dentro de un mismo rango, con un promedio de 4156,6 ± 189,7 mgCaCO3l-1 y de 3652,8 ± 112,0 mgCaCO3l-1 para FORSD y FORSD-AS respectivamente (Figura 2 a y b). En el inicio, se observó una caída en la AT. La escasez de sustrato en el inóculo, pudo provocar un consumo rápido de los carbonatos y bicarbonatos existentes en el medio durante las primeras alimentaciones. Luego la generación de los compuestos alcalinos por las bacterias fue aproximadamente constante como consecuencia del aporte continuo del sustrato.
Cuando se trabajó con una VC constante, los valores de AT se encontraron dentro del rango de 3000-5000 mgCaCO3l-1 en ambos tratamientos, indicando que la digestión anaeróbica se desarrolló en condiciones de estabilidad (APAT, 2005). La AT promedio fue de 4767,1 ± 330,1 mgCaCO3 l-1 para FORSD y de 3805,0 ± 181,14 mgCaCO3 l-1 para FORSD-AS, observándose un incremento del 23% para FORSD y del 7 % para FORSD-AS desde el inicio de VC constante (día 33) hasta el final del ensayo (día 58). El análisis estadístico mostró que existieron diferencias significativas (p<0,05) entre ambos tratamientos. La mayor generación de compuestos alcalinos en FORSD pudo deberse a una mayor cantidad de compuestos biodegradables en este sustrato. En la etapa de arranque, los valores promedios para la AP fueron de 2990,2 ± 114,0 mgCaCO3 l-1 y de 2629,0 ± 50,8 mgCaCO3 l-1 para FORSD y FORSD-AS respectivamente. En la etapa de VC constante los promedios fueron 3657,9 ± 476,1 mgCaCO3 l-1 para FORSD y 2930,8± 316,1 mgCaCO3 l-1 para FORSD-AS respectivamente, encontrándose diferencias significativas para este parámetro entre los tratamientos (p<0,05). La AP mostró un incremento en el día 43 en ambos tratamientos, y luego se mantuvo dentro de un mismo rango, siendo el incremento al final del ensayo del 20% para FORSD y del 7 % para FORSD-AS. Estos resultados mostraron que el sustrato FORSD proporcionó un mayor contenido de bicarbonatos que con el agregado de un co-sustrato (FORSD-AS). En cuanto a los AGV, se observó inicialmente una disminución y luego se mantuvo aproximadamente constante desde el día 19 hasta el final del ensayo en ambos tratamientos. Los valores promedios durante la etapa de VC constante fueron 251,9 ± 39,9 mgAcH l-1 y 220,6 ± 33,9 mgAcH l-1 para FORSD y FORSD-AS respectivamente, encontrándose dentro de los valores normales del proceso anaeróbico (Metcalf y Eddy, 1995). El análisis estadístico mostró que existieron diferencias significativas (p<0,05) entre tratamientos, mostrando un menor contenido de ácidos en FORSD-AS debido a las propiedades intrínsecas de este sustrato. Seong Jin et al. (2008) trabajaron con reactores a diferentes VC (5, 9 y 13 gSV.l-1.d-1) y encontraron que los AGV totales se incrementaron con el aumento de la misma (de 13 a 30 g l-1). En este trabajo, no se observó un incremento de los AGV con las VC. Probablemente, el incremento de la VC en forma leve y gradual evitó la generación de mayores cantidades de AGV, la cual podría haber generado una acumulación de éstos y conducir a una acidificación del sistema.
Los indicadores de estabilidad son mostrados en la figura 2 c y d para FORSD y FORSD-AS respectivamente. El valor de pH se mantuvo entre 7 y 7,5 para ambos tratamientos, encontrándose dentro de los valores óptimos para el desarrollo de las bacterias anaeróbicas. El valor alfa se mantuvo entre 0,6 y 0,8 durante todo el ensayo en ambos tratamientos, alcanzando el valor máximo con la VC constante Los valores obtenidos para este indicador se encontraron dentro de los valores que indican condiciones de estabilidad del proceso (entre 0,6 y 0,8).
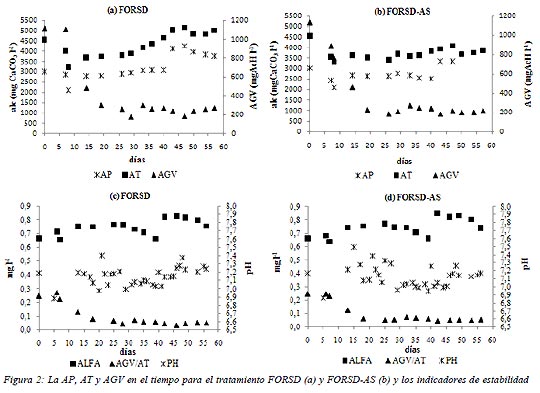 |
En cuanto a la relación AGV/AT fue menor a 0,1 durante todo el ensayo en ambos tratamientos. Estos resultados mostraron que existieron condiciones de estabilidad para una óptima actividad biológica anaeróbica. Los valores encontrados en AGV/AT concuerdan con los encontrados por Rubia et al. (2005), donde la relación AGV/AT fue cercana a 0,09, trabajando con un reactor para tratamiento de lodos residuales en condiciones mesofílicas. El análisis estadístico mostró que no hubo diferencias significativas entre tratamientos para los indicadores alfa y AGV/AT durante la etapa de VC constante.
Las curvas de la CE en el tiempo para ambos tratamientos son mostradas en la Figura 3 a.
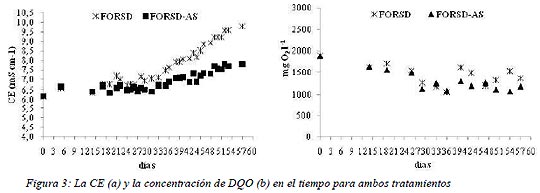 |
Los valores promedios obtenidos de la CE durante la etapa de VC constante fueron de 8,8 ± 0,8 mS cm-1 y 7,4 ± 0,4 mS cm-1 para FORDS y FORDS-AS respectivamente, encontrándose diferencias significativas entre ambos tratamientos (p<0,05). La mayor CE encontrada en la FORSD está relacionada con la mayor cantidad de bicarbonatos y carbonatos presentes en este tratamiento (Dong et al., 2009). Además, se observó un incremento en el tiempo para ambos tratamientos. La CE se incrementó un 47 % para FORSD y un 18% para FORSD-AS, desde el día 21 hasta finalizar el ensayo, siendo los valores máximos de 10,8 ± 0,1 y 8.2 ± 0,4 mS cm-1 respectivamente. Este incremento de la CE en el tiempo, también fue observado en el efluente de un reactor de 12 m3, alimentado diariamente con FORSD (Beily et al., 2010; Bres et al., 2010).
La evaluación de la presencia de Ca2+, K+ y Na+, Mg2+ en el efluente mostró una correlación positiva con la CE del 0,94 y 0,89 para los iones Na+ y K+ respectivamente (R de Spearman). En consecuencia los iones de Na+, K+, junto con la alcalinidad, fueron las principales responsables del aumento de la CE en el tiempo.
Los resultados obtenidos de la DQO soluble en el tiempo para ambos tratamientos son mostrados en la Figura 3 b. Durante la etapa de arranque los valores de DQO fueron los máximos alcanzados, siendo en promedio de 1601,9 ± 233,6 y 1539,2 ± 268,6 mg l-1 para FORSD y FORSD-AS respectivamente. La DQO soluble representa la materia orgánica soluble, la cual se genera durante las etapas de hidrólisis y acidogénica. Los compuestos solubles son los sustratos de las metanogénicas, los cuales son convertidos en CH4 y CO2 gradualmente. Los valores máximos encontrados con las menores VC pudieron deberse a que las bacterias se encontraban en el período de adaptación al sustrato, donde la velocidad de producción es mayor a la velocidad de consumo por las metanogénicas.
Durante la etapa de VC constante la DQO se mantuvo dentro de un mismo rango, mostrando que la degradación de la materia orgánica se realizó en forma equilibrada y en condiciones estables hasta finalizar el ensayo. Los valores promedios de DQO en esta etapa fueron 1342,9 ± 229,7 mg l-1 y 1186,7 ± 109,33 mg l-1 para FORSD y FORSD-AS respectivamente, no existiendo diferencias significativas entre ambos tratamientos. El agregado del co-sustrato a la FORSD, no mejoro la eficiencia del proceso de degradación de la materia orgánica.
Los porcentajes de eliminación fueron del 62 % para FORSD y del 60 % para FORSD-AS al final del ensayo. Si bien hubo una importante remoción de la materia orgánica, los valores de DQO fueron elevados al final del ensayo, según lo establece la Legislación Argentina (RES AGOSBA 336). En consecuencia, el efluente de estos reactores debe ser tratado antes de su vuelco a un cuerpo de aguas superficial o suelo. Zhang et al., 2008 estudiaron la co-digestión de biosólidos con residuos municipales en reactores en bach, y encontraron que los valores de DQO en el efluente fueron elevados (> 5000 mg l-1) al final de la digestión, estableciendo la necesidad del tratamiento antes de su descarga.
Monitoreo del efluente gaseoso
Los rendimientos de biogás y de CH4 son mostrados en la Figura 4 para ambos tratamientos. Similares curvas de biogás y CH4 fueron encontradas por otros autores (Gómez et a.l, 2006; Álvarez y Liden, 2008; Zhang et al., 2008).
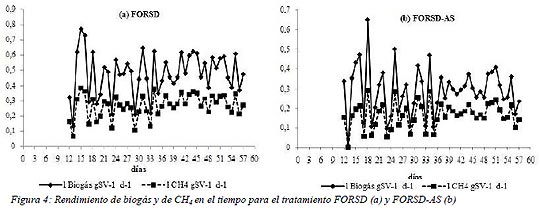 |
Se observaron fluctuaciones pronunciadas en el rendimiento de biogás y de CH4 durante la etapa de arranque (hasta el día
33). Esto podría estar asociado a la adaptación de las bacterias al sustrato y debido a las diferentes VC aplicadas. Sin embargo, hubo una performance más estable del proceso desde el día 33 al 58, cuando se trabajó con una VC constante, en ambos tratamientos. El rendimiento de biogás y de CH4 promedio durante esta etapa fue de 0,50 ± 0,11 l biogás gSV-1 y 0,29 ± 0,06 lCH4 gSV-1 para FORSD y 0,29 ± 0,09 l biogás gSV-1 y 0,17 ± 0,05 lCH4 gSV-1 para FORSD-AS, mostrando diferencias significativas entre ambos tratamientos. Inversamente a lo esperado, el co-sustrato no mejoró el rendimiento de biogás.
Si bien los compuestos celulolíticos y lignoceluloliticos pueden ser degradados por las bacterias anaeróbicas, existen varios factores como la aclimatación al sustrato y el tiempo de exposición que influyen en el proceso degradativo. Se ha demostrado que ciertos compuestos que son tóxicos o inhibitorios para las bacterias metanogénicas, pueden ser tolerados o degradados cuando hay una adaptación previa a ese sustrato (Cheng and Creamer, 2008). De todo el consorcio bacteriano, las bacterias metanogénicas poseen el más lento crecimiento y la velocidad cinética más baja, requiriendo períodos mayores para ajustarse a shocks de tóxicos y compuestos orgánicos. Sin embargo se ha demostrado que los microorganismos comienzan a aclimatarse cuando reciben un aporte continuo de compuestos tóxicos (Silva et al., 2009).
Probablemente un mayor tiempo de exposición al aserrín, establecería una microflora adaptada a este sustrato, mejorando así la actividad de las bacterias metanogénicas. Además, los compuestos celulolíticos y fenólicos liberados por el pre-tratamiento, podrían enlentecer o inhibir el proceso de metanogénesis (Puig-Grajales et al. 2001).
La cantidad total de volumen de CH4 generado fue de 404 l y 268,3 l para FORSD y FORSD-AS respectivamente, al final del proceso, obteniéndose 0,31 lCH4 gSV-1 y 0,20 lCH4 gSV-1, en relación a la cantidad total de residuo agregado.
Similares rendimientos de CH4 fueron hallados por otros autores (Alvarez y Lidén, 2008).
En la Tabla 2 se muestra la composición del biogás promedio en la etapa de VC constante. El % de CH4 y CO2 fueron similares en ambos tratamientos, no encontrándose diferencias significativas entre los mismos. Sin embargo, hubo una menor concentración de SH2 y H3C-SH en FORSD-AS, observándose una mejor calidad del biogás en este tratamiento. El menor porcentaje de sulfuros en FORSD-AS (95.8% menos) pudo deberse a las características propias del co-sustrato, en el cual la presencia de algún compuesto pudo afectar a la actividad de las bacterias sulfato reductoras (BSR), responsables de la generación del SH2. Los compuestos celulolíticos pueden inhibir o enlentecer la producción de sulfuro, comparado con otros sustratos, ya sea sólo o con mezcla (Waybrant et al. 1998; Sheoran et al. 2010). Además, la adaptación de las BSR a estos compuestos orgánicos complejos puede ser lenta, requiriendo un mayor tiempo para ser degradados. Las mayores proporciones de corteza de coníferas y/o de aserrín han sido asociadas con una lenta velocidad de reducción de sulfato en ensayos de corto plazo. Sin embargo otros trabajos han demostrado que una mezcla de sustratos con alto contenido de aserrín dan la mejor eficiencia en estudios a largo plazo (Sheoran et al. 2010).
 |
En cuanto al H3C-SH, los valores obtenidos en FORSD, se encuentran por debajo del límite permisible de exposición en el aire (20 mg m-3, para 8 hs diarias y 40 hs semanales), según lo establece la Administración de Salud y Seguridad Ocupacional (OSHA). Este gas proviene de la degradación biológica de proteínas y aminoácidos como la metionina y cisteína, que tienen en común la presencia de azufre. En consecuencia, la degradación anaeróbica de la FORSD aporta una baja concentración del H3C-SH en el biogás.
Los valores de H3C-SH en FORSD-AS no fueron detectables. Una de las causas de la inhibición de este compuesto, podría ser la presencia de compuestos fenólicos. La presencia de fenoles puede inhibir las enzimas bacterianas, actuando además sobre la pared celular de las bacterias anaeróbicas responsables de la producción del H3C-SH (Pascual La Rocca, et al.2005). El Poder Calorífico (PC) hallado en el biogás en ambos tratamientos, coincidió con los valores de PC mencionados por Gropelli y Giampaolli (2001). El análisis estadístico mostró que no existieron diferencias significativas (p<0,05) entre ambos tratamientos, coincidiendo este resultado con los valores similares de % de CH4.
CONCLUSIONES
El incremento gradual de la VC favoreció las condiciones de estabilidad durante la etapa de arranque, sin la necesidad de agregar sustancias químicas para mantener el pH óptimo.
Las medias de las AP y AT y AGV durante la etapa de VC constante fueron mayores en el tratamiento FORSD, debido a un mayor contenido de estos compuestos en el sustrato. Sin embargo, en ambos tratamientos, los valores obtenidos para estos parámetros se encontraron en los rangos normales durante todo el proceso anaeróbico.
Los indicadores pH, alfa y AGV/AT se mantuvieron dentro de los valores estables del proceso en ambos tratamientos. El agregado de un co-sustrato no mostró diferencia en estos parámetros analizados, con respecto al residuo sin co-digerir.
El incremento de la CE en el tiempo, fue asociado con el incremento de la alcalinidad y de los iones K+ y Na+, los cuales no llegan a ser consumidos por las bacterias anaeróbicas y son acumulados por el aporte continuo de estos compuestos en el alimento. El co-sustrato no aportó un mayor contenido de estos compuestos, mostrando una CE menor que el tratamiento FORSD.
La DQO en el residuo con el aserrín no mostró diferencias con respecto a la FORSD únicamente, indicando que el cosustrato no mejoró la eficiencia de la degradación de la materia orgánica.
El monitoreo del efluente líquido mediante estos parámetros físicos y químicos, indicó que el proceso se desarrolló en condiciones estables durante todo el ensayo. Sin embargo, se evidenció la necesidad de establecer algún tipo de tratamiento del efluente antes de su descarga.
En cuanto a la generación de biogás, el co-sustrato no mejoró el rendimiento de biogás y CH4, probablemente debido a las características intrínsecas del mismo. Los % de CH4 y de CO2 fueron similares en ambos tratamientos. Sin embargo, la presencia del aserrín en la FORSD resultó ser un inhibidor del SH2, compuesto corrosivo, y del H3C-SH, compuesto tóxico en altas concentraciones.
Este co-sustrato no mostró una importante mejora en la calidad del efluente, sin embargo mejoró la calidad del biogás, evitando la formación de ciertos compuestos trazas que son indeseables para la aplicación del biogás como fuente de energía.
La aclimatación al sustrato, el tiempo de exposición y la presencia de ciertos compuestos tóxicos podrían interfirir en la producción de biogás y los compuestos azufrados. Sin embargo se requieren otros estudios para demostrar algunas de las hipótesis aquí planteadas
AGRADECIMIENTOS: Se agradece a los Sres. Jose Luis Ávila y Sergio Costa del Laboratorio ALARA Lab S.A. por las determinaciones analíticas de la composición del gas y por los aportes de sus conocimientos en esta temática; a los Sres Hugo Garbuglia, Miguel y colaboradores de la Universidad Tecnológica Nacional (UTN) por la mecanización y programación del sistema de agitación de estos reactores.
Este ensayo fue financiado por el proyecto AEGA 1622 de INTA. Se agradece a Luis Diaz por su participación activa en la realización de técnicas analíticas y a los Sres Cristian Audisio, Marcos Miskow y Eduardo Espinosa por su colaboración en la recolección del sustrato y las mediciones operativas del ensayo.
REFERENCIAS BIBLIOGRÁFICAS
Alvarez, Gallego C.J. (2005). Ensayo de diferentes procedimientos para el arranque de un proceso de codigestión anaerobia seca de FORSU y lodos de depuradora en rango termofílico. Tesis Doctoral. Servicio de Publicaciones de la Universida de Cádiz, España.
Alvarez R. y Liden G. (2008). Semi-continuous co-digestion of solid slaughterhouse waste, manure, and fruit and vegetable waste. Renewable Energy 33, 726-734
APAT. Agenzia per la protezione dell´ambiente e per i servizi tecnic. (2005). Digestione anaeróbica della frazione organica dei rifiuti solidi. Aspetti fondamentali, progettuali, gestionali, di impatto ambientale ed integrazione con la depurazione della acque reflue, 152 pp.
APHA. (1992). Métodos Normalizados para el Análisis de Aguas Potables y Residuales. 17th edición. Diaz de Santos.
Madrid, España.
Beily M.E., Bres P., Rizzo P., Giampaoli O. y Crespo D. (2010). Monitoreo de reactor anaeróbico semi-continuo para el tratamiento de residuos de cereales. Parte I. Avances en Energías Renovables y Medio Ambiente 14, 37-42.
Bremner J.M. (1965). Inorganic forms of nitrogen. En Methods of soil analysis. Part 2. Agronomy, Black, C.A., De Wite E., Ensminger L.E. y Clark F.E.(editores). Cap 9, pp 1179-1237, American Society of Agronomy, Inc., Madison,.
Bres P., Beily M.E., Rizzo P., Giampaoli O. y Crespo D. (2010). Monitoreo de reactor anaeróbico semi-continuo para el tratamiento de residuos de cereales. Parte II. Avances en Energías Renovables y Medio Ambiente 14, 29-34.
Bruni E., Jensen A.P. y Angelidaki I. (2010). Comparative study of mechanical, hydrothermal, chemical and enzymatic treatments of digested biofibers to improve biogas production. Bioresource Technology 101, 8713–8717.
Callaghan F.J., Wase D.A.J., Thayanithy K. and Forster C.F. (1999). Co-digestion of waste organic solids: batch studies.
Bioresource Technology 67, 117-122.
Castillo E.F., Cristancho D.E. y Arellano V. (2005). Study of the operational conditions for anaerobic digestión of urban solid waste. Waste Management 26, 546-556.
Chen Y., Cheng J.J. y Creamer K.S.(2008). Inhibition of anaerobic digestión process: a review. Bioresource Technology 99, 4044-4064.
Cruz M. y Plaza G. (2004). Digestión Anaeróbica semiseca de la fracción orgánica de los residuos municipales (FOM). Avances de Energías Renovables y Medio Ambiente, 8, 1, 71-76.
Cuetos M.J., Gomez X., Otero M. y Morán A. (2008). Anaerobic digestion of solid slaughterhouse waste (SHW) at laboratory scale: Influence of co-digestion with the organic fraction of municipal solid waste (OFMSW). Biochemical Engineering Journal 40, 99-106.
Da Silva V. (2007). Monitoramento de parámetros físicos, químicos y biológicos em um reator anaerobio hibrido (RAH) em escala piloto, tratando agua residuaria do café producido por vía úmida. Tesis de maestría. Universidad Federal Lavras, Brasil, 170 pp.
De la Rubia M.A., Perez M., Romero L.I y Sales D. (2006). Effect of solids retention time (SRT) on pilot scale anaerobic thermophilic sludge digestion. Process Biochemistry 41, 79–86.
Dong J., Zhao Y.S, Hong M. y Zhang W.H (2009). Influence of alkalinity on the stabilization of municipal solid waste in anaerobic simulated bioreactor. Journal of Hazardous Materials 163, 717-722.
Elango D., Pulikesi M., Baskaralingam P., Ramamurthi y Sivanesan S. (2007). Production of biogas from municipal solid waste with domestic sewage. Journal of Hazardous Materiales 141, 301-304.
Facultad de Ingenieria Sanitaria (FIUBA) y CEAMSE. (2010). Estudio de la calidad de los residuos sólidos urbanos 2009.
Resumen Ejecutivo, 81 pp.
Fernández T.V., Klaasse Bos G.J., Zeeman G., Sanders J.P.M. y Van Lier J.B. (2009). Effects of thermo-chemical pretreatment on anaerobic biodegradability and hydrolysis of lignocellulosic biomass. Bioresource Technology 100, 2575- 2579.
Fernández J., Perez M. y Romero L.I. (2008). Effect of substrate concentration on dry mesophilic anaerobic digestión of organic fraction of municipal solid waste (OFMSW). Bioresource Technology 99, 6075-6080.
Forster-Carneiro T., Perez. M. y Romero L.I. (2008). Anaerobic digestion of municipal solid wastes: Dry thermophilic performance. Science Direct. Bioresource Technology 99, 8180-8184.
Gallert C.; Henning A. y Winter J. (2003). Scale-up of anaerobic digestion of the biowaste fraction from domestic wastes.
Water research 37, 1433:1441.
Glennie D.W. y McCarthy J.L. (1974). Química de la Lignina. En Ciencia y tecnología sobre pulpa y papel, Libby E.C.
(editor). Tomo I. Pulpa. 3º edición.Cap 5 pp 113-141. Compañía Editorial Continental S.A, D.F, México.
Gomez X, Cuetos M.J., Cara J., Moran A. y García A.I. (2006). Anaerobic co-digestion of primary sludge and the fruit and vegetable fraction of the municipal solid waste. Condition for mixing and evaluation of the organic loading rate.
Renewable Energy 31, 2017-2024.
Gropelli E.S. y Giampaoli O.A. (2001). El camino de la biodigestión. Ambiente y tecnología socialmente apropiada. Centro de Publicaciones, Secretaria de Extensión, Universidad Nacional del Litoral. Santa Fe, Argentina, 191 pp.
Gunaseelan V.N. (1997). Anaerobic digestion of biomass for methane production: Review. Biomass and bioenergy 13, 83-
1149.
Jin Y., Hu Z. y Wen Z. (2009). Enhancing anaerobic digestibility and phosphorus recovery of dairy manure through microwave-based thermochemical pretreatment. Water research 43, 3493-3502.
Jenkins S. R, Morgan J. M. y Sawyer C. L. (1983). Measuring anaerobic slugde digestion and growth by a simple alcalimetric titration. Journal WPCF 55, 5, 448-453.
Lindorfer H., Waltenberger R., Köllner K., Braun R. y Kirchmayr R. (2008). New data on temperature optimum and temperature changes in energy crop digesters. Bioresource Technology 99, 7011-7019.
Lopez J., Morgan J. y Noyola A. (2000). Arranque de reactores anaerobios industriales: dos casos de estudio. En Memorias de XII Congreso de la Federación Mexicana de Ingeniería Sanitaria y Ciencias Ambientales (FEMISCA).
Macias-Corral M., Samani Z., Hanson A., Smith G., Funk P., Yu H. y Longworth J. (2008). Anaerobic digestion of municipal solid waste and agricultural waste and the effect of co-digestion with dairy cow manure. Bioresource Technology 99, 8288–8293.
Martina P., Yank L., Corace J., Bucki Wasserman B., Aeberhard R. y Ventín A. (2007). Estudio de la producción de biogás en función de la cantidad de residuos de madera en un biodigestor del tipo de carga única o batch. Avances de Energías Renovables y Medio Ambiente 9, 23-27.
Mata-Alvarez J., Macé S. y LLabres P. (2000). Anaerobic digestión of organic solid waste. An overview of research achievement and perspectives. Bioresource Technology 74, 3-16.
Metcalf y Eddy. (1995). Procesos biológicos unitarios. En: Ingeniería de aguas residuales. Tratamiento, vertido y reutilización. Tercera Edición., cap 8 pp 409-506. Mac Graw Hill, España Pascual-La Rocca A., Savoini M. y Santos A. (2005). Halitosis y colutorios orales: Revisión de la literatura. RCOE [online]. 10,4, 417-425.
Pavlostathis S.G. y Giraldo-Gomez E. (1991). Kinetics of Anerobic Treatment: A Critical Review. Critical Reviews in Environmental Control 21, 5, 6, 411-490.
Puig-Grajales L., Olguín-Lorca P y Razo_Flores E. (2001). IX Congreso Nacional de Biotecnología y Bioenergía. XIII Congreso Nacional de Ingenieria Bioquimica. II Congreso Internacional de Ingenieria Bioquímica. 10 a 14 de 0 a 14 de septiembre, 2001. Veracruz, México.
Seong J.L., Byoung J.K, Chang-Moon J., Jin_dal-rae C., Yeong H.A y Ho N.C. (2008). Anaerobic organic acid production of
food waste in once a day feeding and drawing-off bioreactor. Bioresource Technology 99, 7866 -7874.
Sheoran A., Sheoran V.y Choudhary R. (2010). Bioremediation of acid-rock drainage by sulphate reducing prokaryotes: A review. Minerals Engineering 23, 1073-1100.
Silva F., Nadais H., Prates A., Arroja L. y Capela I. (2009). Molasses as an external carbon source for anaerobic treatment of sulphite evaporator condénsate. Bioresource Technology 100, 1943–1950
Sosnowsky P., Wieczorek A. y Ledkowicz S. (2003). Anaerobic co-digestion of sewage sludge and organic fraction of municipal solid waste. Advances in Environmental Research 7, 609-616.
Taherzadeh M.J. y Karimi K. (2008). Pretreatment of lignocellulosic wastes to improve ethanol and biogas production: a review. Int. J. Mol. Sci. 9, 1621-1651.
Waybrant K., Blowes D., Ptacek C. (1998). Selection of reactive mixture for use in permeable reactive walls for treatment of mine drainage. Enviromental Science Technology 323, 1972-1979.
Zaher U., Cheong D., Wu B. y Chen S. (2007). Producing energy and fertilizer from organic municipal solid waste. Departament of Biological Systems Engineering. Washington State University. 89 pp.
Zhang P., Zeng G., Zhang G., Li Y., Zhang B. y Fan M. (2008). Anaerobic co-digestion of biosolids and organic fraction of municipal solid waste by sequencing batch process. Fuel processing Technology, 89, 485-489.
Zhang R., El-Mashad H.M., Hartman K. y Wang F. (2007). Characterization of food waste as feedstock for anaerobic digestion. Bioresource Technology 98, 929-935.
Por: Patricia Bres 1, M. Eugenia Beily1, Juan O’Farrel2, Diana Crespo1
1- Instituto Nacional de Tecnología Agropecuaria (INTA)-Instituto de Microbiología y Zoología Agrícola (IMYZA)
2- Universidad Católica Argentina. Facultad de Ciencias Ambientales
INTA. Castelar, Buenos Aires, Argentina
Fuente: Avances en Energías Renovables y Medio Ambiente