El carbón activado en procesos de descontaminación
- Creado por admin
- El 14 octubre, 2004
- 0
|
CARBÓN ACTIVADO
|
El carbón activado es un material de carbón que se prepara en la industria para que tenga una elevada superficie interna y así poder adsorber (retener sobre su superficie) una gran cantidad de compuestos muy diversos, tanto en fase gaseosa como en disolución.
Son dos las características fundamentales en las que se basan las aplicaciones del carbón activado: elevada capacidad y baja selectividad de retención.
La elevada capacidad de eliminación de sustancias se debe a la alta superficie interna que posee, si bien porosidad y distribución de tamaño de poros juegan un papel importante.
En general, los microporos (tamaño inferior a 2nm) le confieren la elevada superficie y capacidad de retención, mientras que los mesoporos (tamaño comprendido entre 2-50nm) y macroporos (tamaño>50nm) son necesarios para retener moléculas de gran tamaño, como pueden ser colorantes o coloides, y para favorecer el acceso y la rápida difusión de las moléculas a la superficie interna del sólido[1].
Por otra parte, el carbón activado tiene escasa especificidad ante un proceso de retención, es un adsorbente “universal”.
No obstante, por su naturaleza apolar y por el tipo de fuerzas implicadas en el proceso de adsorción, retendrá preferentemente moléculas apolares y de alto volumen molecular (hidrocarburos, fenoles, colorantes..), mientras que sustancias como el nitrógeno, oxígeno y agua prácticamente no se retienen por el carbón a temperatura ambiente. De ahí que más de 190.000 Tm/año (de las 375.000 producidas) se destinen a la eliminación de contaminantes procedentes de sectores muy variados, tanto en fase gas (sulfuro de hidrógeno, dióxido de azufre, óxidos de nitrógeno, vapores de gasolinas…) como líquida (aguas potables, industriales y residuales, tintorerías…).
Las propiedades adsorbentes de un carbón activado no dependen únicamente de la superficie y porosidad.
En particular, las sustancias polares se retienen débilmente sobre la superficie (apolar) del carbón.
En estos casos, la fijación al carbono de “heteroátomos”, principalmente oxígeno e hidrógeno, formando estructuras o grupos funcionales tipo ácido carboxílico, lactonas, carbonilo, etc, eleva la afinidad de las sustancias polares por la superficie del adsorbente , pudiendo imprimir un carácter ácido-base al carbón.
Finalmente, cuando la sustancia a eliminar tiene una polaridad apreciable, bajo volumen molecular y está muy diluída en aire la retención a temperatura ambiente por el carbón sólo es efectiva si se impregna con reactivos específicos o se aprovechan las propiedades catalíticas del carbón. De esta manera, tras la adsorción se producen unas reacciones químicas que transforman los productos tóxicos en inertes que se desorben o quedan retenidos en la porosidad del carbón.
|
INFLUENCIA DE LA POROSIDAD EN LA ADSORCIÓN EN FASES GAS Y LIQUIDA
|
Una forma simple de seleccionar un carbón activado para su uso en procesos de eliminación de gases apolares (p.e. hidrocarburos) o de sustancias disueltas (p.e. fenoles) es cuantificando su superficie. En general, una mayor superficie conlleva mayor capacidad de retención de contaminantes, y la forma de aumentarla es prolongando el nivel o grado de activación (cuantificado a través del porcentaje de carbono perdido durante el proceso o porcentaje de quemado).
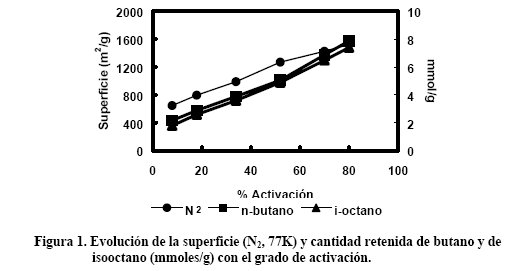
En la Figura 1 se muestra la evolución de la superficie con el grado de activación[2].
También se incluye la capacidad de retención de n-butano e iso-octano, dos hidrocarburos con dimensiones moleculares mínimas diferentes (0.43 y 0.59 nm respectivamente).
Se puede observar que la superficie es una buena referencia para estimar las posibilidades de retención del carbón, ya que las tendencias encontradas son similares.
No obstante, a bajos grados de activación la capacidad de retención de n-butano y de iso-octano es baja, aun cuando la superficie es próxima a 700m 2 /g.
Esto se debe a que la mayor parte de la superficie en este carbón es generada por una microporosidad tan estrecha que no es accesible a estas moléculas (microporos de menos de 0.4nm).
Puesto que mayores porcentajes de activación conllevan un aumento de la superficie y simultáneamente un ensanchamiento de la microporosidad, la alta capacidad de eliminación de hidrocarburos se asegura en estos casos cuando la superficie es alta.
Sin embargo, un elevado grado de activación conduce a un descenso de la densidad y la resistencia mecánica del carbón.
Además, en microporos de gran tamaño desciende la intensidad de la retención por el hidrocarburo, perdiendo eficacia en procesos de descontaminación del aire.
Hay por tanto un valor óptimo de superficie-microporosidad-grado de activación adecuado a cada proceso de aplicación.
Un comportamiento similar al descrito ocurre cuando se aplican estos carbones en procesos de eliminación de sustancias disueltas en agua, como son los fenoles y colorantes.
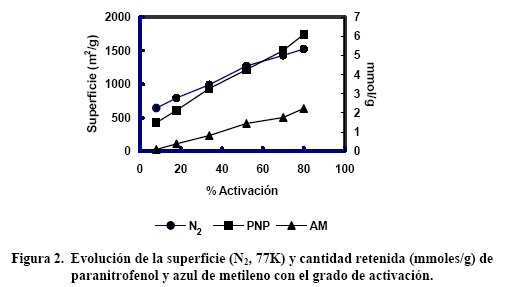
En la Figura 2 se representan las cantidades retenidas de paranitrofenol y azul de metileno. Como referencia se incluye la superficie del carbón.
Se puede observar de nuevo que cuando el grado de activación es bajo la microporosidad es tan estrecha que la superficie no está totalmente disponible para la retención del paranitrofenol, por tener un tamaño molecular mayor que el de una fracción de los microporos.
Esto no ocurre a medios-altos grados de activación, ya que los microporos se han ensanchado.
El efecto es todavía mas notable en la retención de azul de metileno, cuyas dimensiones moleculares son mucho mayores que las del paranitrofenol: la ausencia de microporos de mayor tamaño y de mesoporos hace que las cantidades retenidas de azul de metileno (con dimensiones moleculares de al menos 0.84 nm) sean prácticamente despreciables hasta que no se alcanza el 30% de activación.
Las dificultades de acceso de las moléculas de gran tamaño junto con la lentitud con la que transcurre el proceso de adsorción hacen que en la decoloración se utilice carbón muy activado, en polvo, operando de manera discontinua, mientras que para eliminar fenoles se prefiera un lecho de carbón granular microporoso, por el que pasa el efluente continuamente.
Por la presencia común de fenol y fenoles (nitrofenoles, clorofenoles…) en aguas potables, el estudio de la influencia del pH en el proceso de retención sobre carbones activados es particularmente relevante.
Los resultados obtenidos [3, 4] indican que a pH básico (predomina en el agua la especie aniónica fenolato), la capacidad de retención del carbón es alrededor de la mitad de la que tiene cuando el pH es ligeramente ácido (predomina la especie neutra fenol).
En cambio, afecta poco la capacidad de retención de colorantes. Por tanto, parece que la influencia del pH en la retención de sustancias orgánicas iónicas es tanto menor cuanto mayor sea el volumen de la parte “apolar” de la molécula.
|
INFLUENCIA DE LA NATURALEZA QUIMICA EN LA ADSORCIÓN EN FASES GAS Y LÍQUIDA
|
Las propiedades adsorbentes de un carbón activo no dependen únicamente de la porosidad.
Puesto que la superficie del carbón es no polar, la capacidad de retención de moléculas polares en fase gas es limitada. Para incrementarla, es necesario introducir grupos superficiales que favorezcan las interacciones específicas con la sustancia a retener.
Por ejemplo con reactivos oxidantes se aumenta el contenido de oxígeno, con amoniaco el contenido en nitrógeno, con sulfuro de carbono el azufre, etc.
La influencia de los grupos superficiales de oxígeno en la adsorción de moléculas con diferente grado de polaridad como nitrógeno, dióxido de azufre, metanol y agua se ha estudiado preparando un carbón activo (M0) el cual se ha oxidado con una disolución de ácido nítrico en condiciones muy suaves (carbón M15N) de forma que sólo se modifique el contenido de oxígeno pero no la porosidad [5].
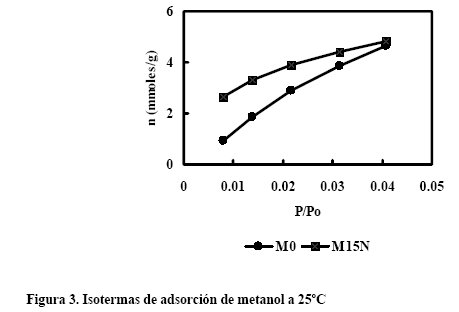
De la comparación de las isotermas de adsorción de nitrógeno a 77K, dióxido de azufre, metanol y agua a 25ºC del carbón activado sin oxidar y oxidado, se ha deducido que la presencia de grupos superficiales no modifica el proceso de adsorcion de una molécula apolar como el nitrógeno, pero sí en el caso del dióxido de azufre, metanol y agua, especialmente en la zona de bajas presiones relativas.
Como ejemplo, en la Figura 3 se muestra que cuando el carbón no está oxidado, la cantidad adsorbida de metanol es más baja que cuando está oxidado, lo que indica que en el proceso de adsorción intervienen, ademas de las interacciones no específicas entre el metanol y la superficie del carbón, otras específicas con los grupos superficiales de oxígeno.
Por tanto, si se desea adsorber sustancias con cierta polaridad que se encuentren diluídos en aire, la oxidación del carbón supondría una mejora en la eficacia de retención
La situación es más compleja en procesos de adsorción en disolución ya que se establece una competencia entre el soluto y el disolvente por la superficie y, como acabamos de describir, la afinidad del agua por los grupos superficiales de oxígeno es alta.
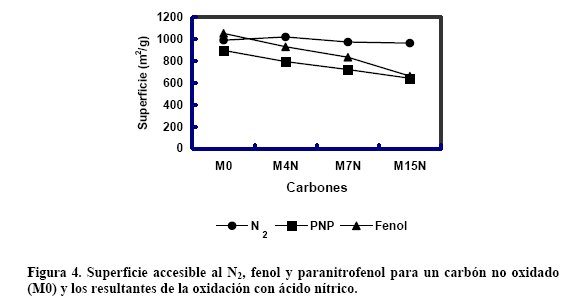
En el caso concreto de la retención de fenoles en agua se comprueba que un aumento del grado de oxidación del carbón conduce a un descenso de la superficie del carbón ocupada por el fenol.
Así, en la Figura 4 se muestra que la superficie del carbón activado no cambia de manera apreciable con el grado de oxidación (carbón sin oxidar y oxidado con ácido nítrico 4, 7 y 15M). En cambio, la superficie ocupada por el fenol, o por el paranitrofenol desciende hasta el 40% para el carbón más oxidado.
Se ha comprobado que la presencia de estructuras tipo ácido carboxílico y lactonas son las principales responsables del descenso, y se debe a la preferencia de las moléculas de agua respecto al soluto por estos grupos hidrofílicos, ocupándose así una parte importante de la superficie del carbón.
La presencia de grupos superficiales de oxígeno, ácidos y básicos, en carbones activados, junto con el pH, afectan a la capacidad de adsorción frente a compuestos inorgánicos, específicamente iones metálicos de mercurio, cromo y plomo.
En la mayoría de los casos, el metal se encuentra en las aguas residuales en un estado de oxidación si bien en algunos casos, como el cromo, está presente en varios, Cr(III) y Cr(VI).
Cuando el carbón activado se oxida profundamente, a pesar de que desciende la superficie accesible porque queda bloqueada por los grupos superficiales de oxígeno introducidos, aumenta la capacidad de retención tanto de Cr(III) como de Cr(VI).
El aumento de la capacidad de retención deCr(III) se atribuye a una atracción electrostática entre los cationes y la superficie de carbón cargada negativamente.
El aumento de la capacidad de retención de Cr(VI) se debe a que se reduce en la superficie del carbón, especialmente a bajo pH, posiblemente por la presencia de los grupos quinona o hidroquinona en la superficie del carbón.
|
CARBONES IMPREGNADOS PARA APLICACIONES ESPECIALES
|
La capacidad de retención de un carbón activado frente a contaminantes muy diluídos en aire y que además tengan volúmenes moleculares bajos es muy escasa.
Este sería el caso desustancias como el sulfuro de hidrógeno, amoniaco, los cuales se encuentran como mucho a concentraciones de algunas ppb, o compuestos con extremado grado de toxicidad como el cloruro de cianógeno, ácido cianhídrico, etc.
Preparar un filtro de carbón activo para eliminar completamente este tipo de gases supone alterar profundamente la funcionalidad del carbón, y para ello es necesario aprovechar las propiedades catalíticas del carbón ó depositar reactivos sobre su superficie.
De esta forma, el carbón actuaría como adsorbente y además, como soporte poroso para que se produzcan reacciones del gas tóxico con los agentes químicos, inmovilizándolo o dando productos inocuos que se desorben.
Una aplicación específica es la eliminación de olores en plantas depuradoras de aguas residuales.
Los olores son causados por los gases liberados durante el proceso de descomposición de la materia orgánica, y se debe fundamentalmente a la presencia de sulfuro de hidrógeno, mercaptanos, amoniaco, aminas, etc. Aun cuando todos ellos están presentes a muy bajas concentraciones, su bajo umbral de detección requiere su eliminación completa, y para ello hay que considerar la oxidación con aire.
El carbón activado proporciona una superficie catalítica para la oxidación y además se puede impregnar con catalizadores de oxidación como óxidos metálicos y metales nobles.
Así, el sulfuro de hidrógeno podría oxidarse a azufre, los mercaptanos a disulfuros, y cuando esta oxidación tiene lugar en la superficie del carbón el mayor volumen molecular de los productos obtenidos significa un aumento en la capacidad de retención.
La eliminación de compuestos con extremada toxicidad como el cloruro de cianógeno y de ácido cianhídrico requiere la impregnación del carbón activado con una alta proporción (hasta el 10%) de sales de Cu(II) y Cr(VI).
Lógicamente la deposición de sales metálicas en la superficie del carbón provoca un descenso importante del volumen de microporos que se manifiesta en un descenso en el tiempo de agotamiento de la columna hacia la cloropicrina, sustancia que se retiene en el carbón mediante adsorción física.
En cambio, la capacidad de retención del cloruro de cianógeno y el ácido cianhídrico por el carbón sin impregnar es muy escasa, aumentando extraordinariamente cuando se impregna[6].
Los resultados obtenidos permiten asociar una mayor retención de ácido cianhídrico con un mayor contenido de Cu(II) y una mayor retención de cloruro de cianógeno con un mayor contenido de Cr(VI), si bien se ha comprobado que es imprescindible la presencia de cobre para la completa destrucción del último.
F. Rodríguez Reinoso y M. Molina Sabio
Departamento de Química Inorgánica. Universidad de Alicante. España.
E-mail: [email protected]
|
REFERENCIAS
|
1- Bansal, R.C., Donnet, J.B. and Stoeckli, F. Active Carbon . Marcel Dekker, New York (1998).
2-Garrido, J., Linares-Solano, A., Martín-Martínez, J.M., Molina-Sabio, M., Rodríguez-Reinoso, F. and Torregrosa, R. J. Chem. Soc., Faraday Trans. 83, 1081 (1987).
3. Caturla, F., A., Martín-Martínez, J.M., Molina-Sabio, M., Rodríguez-Reinoso, F. and Torregrosa, J. Colloid Interface Sci . 124, 528 (1988).
4. Mattson, J.B. and Mark, H.B. Activated Carbon Marcel Dekker, New York (1971).
5. Rodríguez-Reinoso, F., Molina-Sabio, M. and Muñecas, M.A. J. Phys. Chem. 96 , 2707 (1992).
6. Molina-Sabio, M., Pérez, V. and Rodríguez-Reinoso, F. Carbon 32, 1259 (1994). 168


0 comentarios on El carbón activado en procesos de descontaminación