Reducción Selectiva de NOx con Hidrocarburos
Autor: Juan O. Petunchi
Instituto de Investigaciones en Catálisis y Petroquímica – INCAPE – (FIQ,UNL-CONICET) Santiago del Estero 2829 – 3000 – Santa Fe – República Argentina
Tel.: 54-342-4536861.Fax: 54-42-571162. e-mail: [email protected]
INTRODUCCION
La emisión de óxidos de nitrógeno a la atmósfera produce una variedad de problemas en la salud de la población como así también efectos ambientales negativos sobre el planeta. La exposición directa a tales óxidos en concentraciones superiores a 3 ppm aumenta las posibilidades de enfermedades pulmonares en niños y agrava los problemas de enfermos cardíacos. Además de su toxicidad, reacciona con los hidrocarburos sin quemar para formar ozono, causante principal del smog fotoquímico, el que origina entre otros problemas de salud, irritación de la vista, tos, dolores de cabeza, problemas respiratorios. Además causa daño en la forestación y afecta seriamente al crecimiento de ciertas variedades de cultivos y frutales; junto con los óxidos de azufre son los principales responsables de la lluvia ácida.
Anualmente más de 30 millones de toneladas de NOx son venteados a la atmósfera, siendo generados principalmente en los procesos de combustión en fuentes móviles (automóviles, camiones, transporte público) y fuentes fijas (centrales de potencia, hornos incineradores). Hay también una contribución de otras industrias químicas (producción de ácido nítrico, urea, etc.).
Este trabajo se centrará en el análisis de una de las alternativas para la eliminación de NOx cual es la reducción selectiva con hidrocarburos. Se hará una referencia a otras tecnologías catalíticas y no catalíticas.
ASPECTOS FUNDAMENTALES
Los óxidos de nitrógeno son formados en los procesos de combustión por dos vías: la oxidación del nitrógeno del aire a alta temperatura o por la oxidación de compuestos de nitrógeno contenido en los combustibles. En la industria química son productos secundarios de las reacciones principales.
La contribución de las dos formas de generación de NOx en los procesos de combustión depende del tipo de quemador, del contenido de nitrógeno del combustible y de las condiciones de operación. Es aceptado que la formación de NOx en combustibles sin nitrógeno ocurre por dos mecanismos. El de Zeldovich o formación térmica que se verifica en condiciones de alimentación pobre (relación combustible/aire menor que la estequiométrica) y el mecanismo Prompt o de formación rápida. En el primer esquema de reacción la formación de NOx es fuertemente dependiente de la temperatura y sólo se verifica a temperaturas de alrededor de 1500°C o mayores, duplicándose la producción a partir de esta temperatura por cada incremento de 40°C en la temperatura de llama.
El NOx generado a partir de los compuestos nitrogenados contenidos en los combustibles se denomina "Fuel NOx". El mecanismo para su formación es en cierta forma independiente de la forma en que se encuentra el nitrógeno en el combustible y es más sensible a la estequiometría que a los tratamientos térmicos de la alimentación. Por esta razón estrategias de recirculación de la alimentación o inyección de agua no reducen la emisión de óxidos de nitrógeno.
Consideraciones Termodinámicas
A pesar de que cinéticamente la formación de NO se da a altas temperaturas, desde el punto de vista termodinámico las reacciones de descomposición de NO o de reducción del mismo con diferentes reductores están muy favorecidas en un amplio rango de temperaturas. Para ejemplificar lo antes expuesto se pueden considerar las siguientes reacciones:
![]()
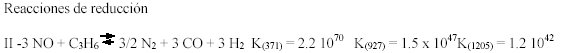
Los valores de las constantes de equilibrio K (entre paréntesis temperaturas a que fueron calculados) señalan claramente que a pesar de la exotermicidad de todas las reacciones, no hay limitaciones termodinámicas para la transformación de NO aún a temperaturas de 1200°C.
Consecuentemente, la dificultad para que tales reacciones se verifiquen es puramente cinética.
TECNOLOGIAS DISPONIBLES
Como se mencionó precedentemente para disminuir la emisión de óxidos de nitrógeno se puede aportar soluciones en dos grandes líneas que pueden ser en algunos casos complementarias: a) Prevención en la generación del contaminante, b) Eliminación del contaminante ya generado por el proceso. En ambas formas existen tecnologías disponibles pero que no alcanzan a satisfacer totalmente las necesidades de las distintas fuentes generadoras del contaminante.
– Prevención de la generación. Evitar la formación del contaminante es la opción que parecería más simple. Sin embargo no siempre es técnicamente posible. Mientras que en fuentes fijas se han propuesto diferentes alternativas, en fuentes móviles el problema resulta más complicado.
Importantes progresos en la disminución de NOx se han dado en base a mejoras en los procesos de combustión tales como: combustión en lecho fluidizado, mejora en el diseño de quemadores, recirculación de combustibles, entre otras (1). Algunas de estas soluciones pueden traer problemas secundarios como un aumento de la emisión de N2O . Otra alternativa de gran potencialidad es la combustión catalítica.
– Eliminación de NOx generado
Fuentes fijas. Existen una serie de alternativas tecnológicas comerciales para eliminar óxidos de nitrógeno entre las que se pueden destacar las basadas en procesos de adsorción, térmicos y catalíticos (2). Los procesos térmicos requieren un exceso de metano y altas temperaturas de operación, mientras que los procesos selectivos no catalíticos que se basan en la inyección de NH3 o urea en la salida del horno tienen los inconvenientes de una baja eficiencia, 25 a 50% de reducción; Este es además función de la temperatura del gas, la eficacia del mezclado del reactivo y la concentración de reductor entre otros parámetros y el estrecho rango de temperatura (alrededor de 950°C) para obtener el óptimo de rendimiento.
La reducción catalítica selectiva (RCS) con amoníaco surge como la mejor tecnología disponible en la actualidad para la disminución de los niveles de NOx en efluentes gaseosos de fuentes fijas (3).
A pesar de ser la RCS la tecnología que aporta soluciones concretas para el cumplimiento de las legislaciones existentes, (reducción de NO a aproximadamente 5 ppm) presenta algunas desventajas no resueltas: Altos costos de capital y operativos, dificultades de operación con combustibles que contienen azufre, movimiento y almacenaje de grandes volúmenes de NH3, lo que origina potenciales riesgos ecológicos de gran magnitud. Tales tecnologías son de imposible aplicación a fuentes móviles.
Fuentes móviles. En este caso para satisfacer las demandas de las normas regulatorias, la única tecnología existente es la catalítica. Desde 1980 en EE.UU y posteriormente en Europa y Japón se utilizan los denominados catalizadores de tres vías basados en Pt/Pd-Rh cerio soportados sobre alúmina estabilizada lo que forman una capa de 0,17 a 0,20 mm sobre un soporte monolítico tipo panal de abeja de cordierita. Esta tecnología no puede ser aplicada a los motores diesel ni tampoco permitirían operar los motores Ciclo Otto en las zonas pobres (relación combustible/aire < estequiométrico).
REDUCCIÓN CATALÍTICA SELECTIVA CON HIDROCARBUROS
En 1990 Held et al. e Iwamoto et al. encontraron que Cu intercambiado en zeolita tipo ZSM5 resultaba activo y selectivo para la RSC con hidrocarburos. Desde entonces múltiples sistemas han aparecido como potenciales catalizadores para tal reacción, provenientes del sector industrial y académico, habiendo dado lugar a un sinnúmero de trabajos académicos (4) y patentes (5). (Tabla 1).

– Catalizadores en base a zeolitas intercambiadas. Diferentes estructuras zeolíticas, fundamentalmente ZSM5, Mordenita, Ferrierita y en menor medida, zeolitas â y KL intercambiadas con distintos cationes y aún en su forma protónica, resultaron activas para la reducción selectiva de NOx.
Diferentes hidrocarburos han sido empleados como gases reductores entre los que se pueden mencionar: CH4, C2H6, C2H4, C3H3, C3H6, nC4H10, nC5H12, 3,3 dimetil pentano, 2,3,4, trimetil pentano, nC16H34. La actividad y selectividad para la reducción de NOx resultaron función del tipo de zeolita, del tipo de catión intercambiado y de las condiciones de reacción.
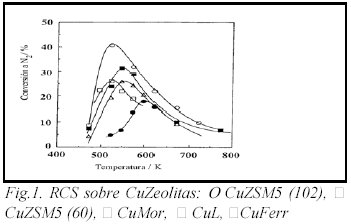
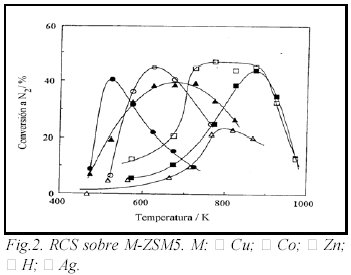
A manera de ejemplo en las Figs. 1 y 2 se muestran los resultados obtenidos cuando se empleó como agente reductor C2H4 (250 ppm) con un 2% de oxígeno en la alimentación y 1000 ppm de NO. Para un mismo catión la actividad es función de la matriz zeolítica. La CuZSM5 convierte un 42% de NO a N2 mientras que la CuY sólo un 5% (Fig. 1). Cuando se comparan los distintos tipos de cationes para un mismo tipo de zeolita e iguales condiciones de reacción que las previamente descriptas, se observa que Ag, Co, Zn y Cu presentan similar conversión de NO a N2 pero las temperaturas para obtener tales valores difieren desde 250°C para el caso de CuZSM5 hasta 600°C para el Zn (Fig. 2).
El nivel de intercambio también es un factor que determina la actividad de las metal zeolitas. En efecto, en el caso del Cu la conversión de NO a N2 pasa por un máximo para niveles de intercambio entre 80 y 100% y luego decrece suavemente. Esto difiere de lo que fue previamente descripto en la reacción de descomposición de NO. Sin embargo, para el caso de FeZSM5, Hall y colaboradores encontraron que para un nivel de intercambio de 183% la conversión de NO a N2 fue del 100% mientras que para un 22% de intercambio, sólo se alcanzó el 40% de conversión.
De lo expuesto surge que una diversidad de factores condicionan la eficacia de las zeolitas como catalizadores para la reducción selectiva de NOx. Posibles explicaciones del efecto de la estructura zeolítica incluyen: modificación de la acidez, estructura de poros, propiedades redox de los cationes intercambiados, las que son afectadas por la configuración geométrica y la coordinación de los mismos según la matriz zeolítica.
Es importante destacar el comportamiento catalítico de zeolitas intercambiadas con metales nobles (Pt, Rh, Pd) con referencia a su potencial resistencia al vapor de agua contenido en la alimentación. Kharas e Iwamoto encontraron que Pt intercambiado en ZSM5 resultaba la más activa para convertir NO en N2 a bajas temperaturas, aproximadamente 200°C, usando etileno como gas reductor. A mayores temperaturas, predomina la reacción de combustión. La aparición de N2O como producto de reacción es un inconveniente en este tipo de catalizadores.
Otro sistema de interés fue el encontrado por Misono y colaboradores. Sus resultados muestran que la estructura de la zeolita es de fundamental importancia en la conversión de NO a N2 en el sistema NO + C3H6 + O2. El orden de actividad encontrado fue: Ce-ZSM5 > Ce- Mordenita >> Ce-Y-Zeolita > Ce/SiO2.
La posibilidad de usar metano como gas reductor ha resultado muy atractiva en virtud de su bajo costo y la disponibilidad del mismo en las centrales de potencia. Li y Armor fueron quienes encontraron que Co intercambiado en ZSM5 era activo en la reducción selectiva de NOx.
Ga e In en Mordenita y ZSM5 también resultaron activos y selectivos para tal reacción a igual que Pd y Rh en los mismos soportes. Sistemas bimetálicos que combinan las características de metales nobles con metales de transición han sido encontrados recientemente que resultan muy efectivos para convertir NOx en N2 aun con hasta un 10% de agua en la alimentación. CoPtMordenita, CoPtFerrierita, CoPdZSM5, PtInZSM5, IrInZSM5, RhInZSM5 entre otros, han sido probados con éxito como catalizadores para reducir NOx con CH4. Un detallado análisis de estos sistemas son presentados en otra contribución de este documento.
– Desactivación de los catalizadores zeolíticos en condiciones reales de operación. Los sistemas catalíticos para el control de la contaminación ambiental están sometidos a severas condiciones de operación que pueden causar acelerados procesos de desactivación de los mismos. Causas concurrentes de naturaleza química, térmica y mecánica actúan desfavoreciendo la actividad y selectividad. En este marco, se hará una breve reseña de esta problemática.
En los procesos de combustión además de los óxidos de nitrógeno, carbono e hidrocarburos sin combustionar, se encuentran presentes H2O en proporciones de hasta el 10% y SOx en proporciones variables según el tipo de combustible (aproximadamente 50 ppm es el límite máximo). El efecto de estas sustancias como venenos depende del tipo de catión intercambiado, del tipo de zeolita, y de la naturaleza del hidrocarburo usado como reductor.
– Metasilicatos con estructura zeolítica. Los materiales estudiados fueron: cationes metálicos no reducibles pero que generaban una fuerte acidez, (Ga), catationes metálicos parcialmente reducibles (Fe, Mn, Cr) y cationes fácilmente reducibles (Cu). Utilizando cetano para simular una corriente de escape de motores diesel Inui y colaboradores encontraron que la Fesilicalite era el material más activo y estable. Comparables estudios fueron realizados por Kikuchi y colaboradores pero usando propileno como gas reductor encontrando también que H-Fe-Silicalite (Si/Fe = 50) era el catalizador más efectivo.
– Oxidos metálicos simples y mixtos. Hamada ha recopilado estudios a nivel de laboratorio de una serie de óxidos simples y óxidos mixtos. Oxidos metálicos con alta actividad para la oxidación tales como Co3O4 y Fe2O3 no cataliza la reducción de NOx, solamente Al2O3 y Ga2O3 mostraron ser selectivos cuando se usó propano como gas reductor. En el caso de óxidos binarios Al2O3/ZrO2 y ZrO2/TiO2 se obtiene 50% y 68% de conversión de NO a N2 para una relación de alimentación C3H8/NO = 1,3 y 10% de oxígeno. Los óxidos mixtos no mostraron una actividad importante para la reducción selectiva de NO siendo LaAlO3 y La0.8Sr0.2AlO3 con 20 y 21% de conversión de NO a 500 y 600°C , respectivamente, las más activas.
– Metales Nobles soportados. En líneas generales los catalizadores basados en metales nobles soportados son activos a menores temperaturas que los basados en metales básicos intercambiados en zeolitas. Pt/Al2O3 resultó más activo que Pd y Rh sobre el mismo soporte. La temperatura para la máxima conversión de NO a N2 fue de 250°C para el primero y de 300°C para los dos últimos. El Pt/Al2O3 resultó no sólo el más activo sino también el más estable en presencia de vapor de agua y SO2. Una de las limitaciones más serias para el uso comercial de estos catalizadores es el estrecho rango de temperatura en el cual tales sistemas resultan activos y selectivos (200-250°C) como así también la producción de N2O.
NUEVAS ALTERNATIVAS
– Adición Intermedia de Reductor (IAR). Este método fue propuesto por Iwamoto et al. Y consiste en la adición de un gas reductor (C2H4) en la corriente de NO + O2 luego de que la misma pase por un catalizador de oxidación de NO a NO2 y previo al ingreso a un segundo lecho catalítico de reducción de NOx a N2.
– Catalizadores de 4 vías. Recientemente Farrauto y colaboradores (Engelhard Corporation) han anunciado el uso de un sistema catalítico denominado de 4 vías que combina un catalizador de oxidación diesel con un catalizador de reducción selectiva denominado HTC-1, basado en Pt/ãAl2O3. Este conjunto permite una razonable conversión de NOx a N2 a bajas relaciones C/Nox y con una adecuada reducción de hidrocarburos sin combustionar, CO y particulados.
– Sistemas Híbridos. Esta alternativa se basa en la capacidad de ciertos sistemas (trap) para entrampar (absorber) NOx cuando el motor opera en condiciones pobres de alimentación y lo libere cuando opere en condiciones estequiométricas o ricas en combustible. Estos sistemas en conjunción con un catalizador de tres vías permitirían la operación de un motor parcialmente en condiciones pobres con un ahorro de combustible entre 5 y 10%.
CONCLUSIONES Y PERSPECTIVAS
Las tecnologías existentes basadas en NH3 como gas reductor son de muy difícil implementación en fuentes móviles y aún a pesar de que permitan resolver el problema en fuentes fijas tienen desventajas que ya han sido enumeradas.
El descubrimiento de la reducción selectiva de NOx con hidrocarburos sobre diferentes zeolitas ha abierto un gran interés en estos sistemas. Lamentablemente, con alimentaciones conteniendo H2O y SO2, éstas experimentan una considerable pérdida de actividad.
Recientemente, han sido descubiertos nuevos sistemas tales como FeZSM5 que resultó altamente estable en presencia de vapor de agua y SO2, o los basados en la incorporación de un segundo catión, PdHZSM5 o IrInHZSM5, que mejoran notablemente la actividad en presencia de vapor de agua. También resultan promisorias las zeolitas bimetálicas que combinan un metal noble como Pt con Co y/o In. Catalizadores basados en metales nobles surgen como alternativas de interés para superar los problemas de estabilidad y envenenamiento que experimentan las metal zeolitas. Sin embargo, presentan otras dificultades tales como la formación de N2O, la oxidación de SO2 a SO3 y la estrecha región de temperatura en que son efectivos. Importantes esfuerzos se continúan haciendo, algunos de los cuales fueron previamente comentados, en la búsqueda de nuevos materiales y tecnologías conducentes a lograr un sistema que pueda operaren condiciones reales de operación (10-14% de H2O, 25 a 50 ppm de SO2, GHSV = 100.000 h-1) con una vida útil que el caso de las fuentes móviles se traducirían en alrededor de 160.000 Km.
Referencias
1 – H. Shelton. Environmental Engineering World, 27, Noviembre 1996 and J.F. Straitz III and V. Mendoza, Environmental Engineering World 4, Noviembre 1994.
2 – H. Bosch and F. Janssen, Catal. Today, 2, 369 (1988). 3 – S.M. Cho, Chemical Engineering Progress, 39, Enero 1994.
4 – M.D. Amiridis, T. Zhang, R. Farrauto, Appl. Catal., 10, 203 (1996).
5 – T. Tabata, M. Kokitsu, O. Okada, Catal. Today, 147 (1994).