Bioadsorción de Cadmio (II) en Solución Acuosa por Biomasas Fúngicas
Resumen
Se determinó la bioadsorción de Cadmio (II) en solución por la biomasa celular de quince hongos, por el método colorimétrico de la ditizona. La biomasa de Mucor rouxii IM-80 fue más eficiente en la remoción de Cadmio (II) en solución (8.2 mg/g) seguida de M. rouxii mutante (7.1 mg/g), A. flavus I (5.9 mg/g) y Helminthosporium sp (5.4 mg/g). Para la biomasa de M. rouxii-IM-80, la mayor bioadsorción fue a pH= 5.0-6.0, a 28oC durante 40 horas con 1.0 mg/200 mL de concentración inicial de Cadmio (II) y 80 mg/200 mL de biomasa celular. Se concluye que algunas biomasas fúngicas remueven eficientemente Cadmio (II) en solución y pueden utilizarse para descontaminar nichos acuáticos contaminados con este metal.
Palabras clave: Bioadsorción, Cadmio (II), biomasa, hongos, aguas residuales
INTRODUCCIÓN
La contaminación del agua, aire y suelo por metales pesados es uno de los problemas ambientales más severos, además de ser muy difícil de resolver. Las fuentes más comunes de contaminación por dichos metales son: los procesos de petróleo, las plantas generadoras de energía y los procesos metalúrgicos. De éstos, el Cadmio es un metal pesado que alcanza el medio ambiente entre otras razones por acción antrópica, ya que es utilizado en galvanoplastia, como protector contra la corrosión, estabilizador de plásticos, etc. Su eliminación del medio ambiente es prioritaria debido a su elevada toxicidad (US-EPA, 1979), ya que es carcinogénico, embriotóxico, teratogénico y mutagénico, puede causar hiperglicemia, reducir el sistema inmunológico y anemia, debido a que interfiere con el metabolismo del hierro (Sanders, 1986).
Para su recuperación, se han utilizado métodos basados en biomasas de bacterias, hongos, levaduras y algas, las cuales tienen dife-rente composición química, con porcentajes de captación de los iones metálicos relativamente altos, por medio de procesos pasivos como bioadsorción, que es dependiente del grado de afinidad entre las especies metálicas o sus formas iónicas y los sitios de unión en la estructura molecular de la pared celular, es relativamente rápido, y se puede recuperar el metal y reutilizar el bioadsorbente. El modo activo de acumulación de metales por células vivas es la bioacumulación, la cual depende de la actividad metabólica de la célula. La aplicación de la bioadsorción en la purificación de aguas residuales presenta un gran potencial, pues las biomasas fúngicas son naturales, se pueden obtener fácilmente en grandes cantidades, son económicas, reutilizables, emplear dos o más de manera simultánea y remover selectivamente diferentes iones metálicos de soluciones acuosas, los cuales pueden ser fácilmente liberados y recuperados (Cañizares, 2000; Kratochvil y Volesky, 1998; (Kapoor y Viraraghavan, 1995; Sag, 2001).
También se han utilizado otras biomasas para remover el Cd (II) en solución como: Carbón activado (Leyva-Ramos et. al., 2005) mazorca de maíz y corteza de Pinus pinaster (Vázquez et.al., 2005). Por lo anterior, este trabajo se propuso estudiar la bioadsorción de Cd (II) en solución por 15 biomasas fúngicas.
METODOLOGÍA
Bioadsorbentes
Se utilizaron 15 biomasas fúngicas, los hongos Aspergillus flavus I-V y Aspergillus fumigatus I-II resistentes a plomo aislados de una mina de Zimapan, Hgo., México (temp. media anual de 18.30oC y 1780 m sobre el nivel del mar); Helminthospo rium sp, Cladosporium sp, Mucor sp-1 y Mucor sp-2, resistentes a zinc, plomo y cobre aisladas del aire de una zona cercana a una planta procesadora de Zinc en San Luís Potosí, S.L.P., México (temp. media anual de 18.67oC y 1860 m sobre el nivel del mar), M. rouxii mutante resistente a cobre y plomo, obtenida por mutagénesis con Etilmetanosulfonato, M. rouxii IM-80 (silvestre); las levaduras Candida albicans y Cryptococcus neoformans resistentes a cromo (VI) y aisladas de una tenería de la ciudad de León, Gto., México (temp. media anual de 18.86oC y 1786 m sobre el nivel del mar).
Obtención de la biomasa celular
El crecimiento de los hongos se llevó a cabo inoculando 1 x 106 células/mL en caldo tioglicolato (8 g/L), a 28oC con agitación constante (100 rpm). 4 días después de la incubación, se obtuvo la biomasa por filtración en papel Whatman No. 2. Posteriormente se centrífugó (3000 rpm, 5 min), se lavó 3 veces con agua tridesionizada, se secó (80oC, 2 h) en estufa bacteriológica, se molió en mortero y se pesaron 80 mg en matraces Erlenmeyer de 250 mL, y se esterilizaron a 15 libras/30 min (Acosta et. al., 2004).
Soluciones de Cadmio (II)
Se trabajó con 200 mL de una solución de1.0 mg/200mL de concentración de Cd (II) obtenida disolviendo 0.2272 g de CdCl2 en 1 L de agua tridesionizada. Se ajustó el pH de la dilución a analizar según sea el caso con NaOH y/o H2SO4 1 M, antes de adicionarla a las biomasas celulares.
Estudios de bioadsorción
80 mg de biomasa celular se mezclaron con 200 mL de una solución de 1.0 mg/200mL de concentración del metal (pH= 5.0 +/-0.2 y 28oC) y se incubaron con agitación constante (100 rpm). A diferentes tiempos se tomaron alícuotas de 10 mL cada una, se centrifugaron a 3000 rpm (5 min), y al sobrenadante respectivo se le determinó la concentración de Cd (II). Para el efecto del pH, se varió el pH inicial de la solución, con NaOH 1N y/o H2SO4 1N, según el caso, a valores iniciales de 1.0 a 9.0. Para la temperatura, se varió ésta a 28, 37 y 42oC, mientras que para la concentración inicial de metal, se utilizaron cantidades iniciales crecientes en un rango de 0.5 a 2.5 mg/200mL. Los experimentos se realizaron por duplicado en matraces Erlenmeyer de 250 mL, previamente lavados con HNO3 1:10 (v/v) y enjuagados con agua tridesionizada estéril.
Determinación de la concentración de Cd (II)
Se utilizó el método colorimétrico de la ditizona, en el cual los iones Cd (II) reaccionan con la ditizona formando un complejo de color rosarojo, que puede ser extraído con cloroformo, determinando la concentración de Cd (II) a las soluciones problema (10 mL), y leyendo la absorbancia de las muestras a una longitud de onda de 518 nm (Greenberg et. al., 1992), obteniendo la concentración de Cd (II) de una curva de calibración preparada a partir de una solución estándar del metal, tratada de la misma manera que la muestra, teniendo en cuenta que la concentración mínima detectable es de 0.5 mg/15 mL de solución de ditizona.
RESULTADOS Y DISCUSIÓN
Cinética de bioadsorción de Cd (II)
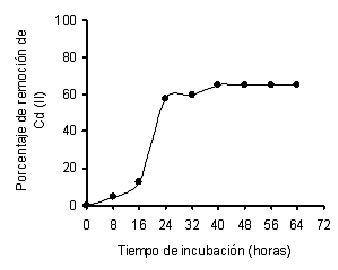
En relación con el tiempo de incubación sobre la bioadsorción de Cd (II), por la biomasa de la cepa IM-80 de M. rouxii se encontró que la mayor bioadsorción ocurre entre 24 y 40 h, ver figura 1. Los resultados anteriores, revelan que durante las primeras 14 h no hay una bioadsorción significativa, y a las 24 h va mejorando, y después de 40 h, los porcentajes de sustracción del metal no variaron. La literatura reporta tiempos menores de captación cuando se trabajó con las biomasas de Rhizopus arrhizus (Tobin et. al., 1984), M. rouxii (Yan y Viraraghavan, 2003) y Penicillium purpurogenum (Say et. al., 2003). La bioadsorción de los metales por los componentes de la pared celular se basa en dos mecanismos: su captura por grupos funcionales como carboxilatos, fosfatos, amino y fosfodiester, y los mecanismos de captación resultantes de las interacciones fisicoquímicas de los fenómenos de adsorción, pero, el primer proceso parece tener una función muy importante (Kapoor y Viraraghavan, 1995; Kratochvil y Volesky, 1998).
Efecto del pH sobre la bioadsorción de Cd (II)
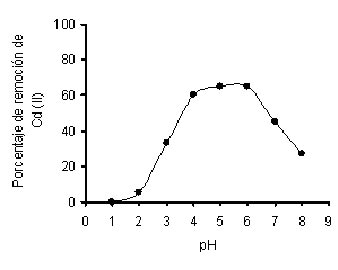
En la figura 2 se muestra la influencia del pH de equilibrio sobre la eficiencia de remoción. La mayor actividad se evidenció a pH 5.0-6.0 + 0.2, para M. rouxii IM-80. Los contrastes observados en la remoción del metal a diferentes pHs, pueden deberse a la participación de grupos carboxilato (pK= 3-5) y fosfato, que presentan una carga negativa por encima de pH 3.0, por lo que el incremento en la eliminación de Cd (II) que se observa entre pH 2.0 y 4.0, se puede atribuir al cambio en el estado iónico de estos grupos funcionales.
Esto implica que la adsorción depende en parte de la protonación o desprotonación de los polímeros que forman parte de la pared celular. A pHs menores que el pK, estos grupos se encuentran protonados, restringiendo la entrada de los iones Cd, sin embargo a pHs entre 4.0 y 6.0, los grupos responsables de la retención del metal se encuentran cargados negativamente facilitando el enlace de los iones Cd (II) positivos. A pHs mayores de 6.0 se observa una disminución en la captación, lo cual concuerda con la mayoría de los reportes, y tal vez se deba a una menor exposición de los grupos fosfato, pues a pHs mayores, los carboxilatos, óxidos e hidróxidos son más estables (Volesky y Holan, 1995).
Algunos investigadores han encontrado el pH óptimo para la remoción de Cd (II) por las biomasas de P. purpurogenum (Say et. al., 2003), P. digitatum (Galum et. al., 1987), R. arrhizus (Fourest y Roux, 1992) y de M. rouxii tratada con NaOH (Yan y Viraraghavan, 2003) en un rango de 5.0 a 6.0.
Efecto de la temperatura sobre la bioadsorción de Cd (II)
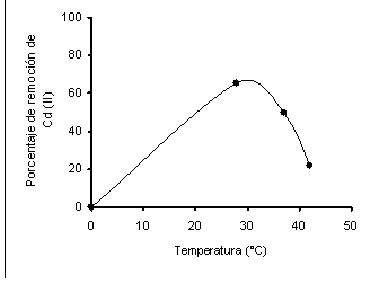
La más alta remoción se observó a 28oC, (Fig. 3). De otra parte, la literatura (Galum et. al., 1987; Veglio y Beolchini1997), sostiene que la bioadsorción se incrementa a medida que se aumenta la temperatura, en este trabajo sucedió a 28oC; resultados que no son coincidentes con los de Say et. al., (2003), Galum et. al., (1987) y Puranik y Paknikar (1999), quienes observaron que a 20 y 25oC ocurre la adsorción del Cd (II) con las biomasas de P. purpurogenum, P. digitatum y Citrobacter MCM B-181 (bacteria tipo de laboratorio).
|
Fig. 1 Efecto del tiempo de incubación sobre la bioadsorción de Cd (II) por la cepa IM-80 de M. rouxii. 1.0 mg/200mL, 80 mg de biomasa, 28°C con agitación constante (100 rpm).
Fig. 2 Efecto del pH sobre la bioadsorción de Cd (II) por la cepa IM-80 de M. rouxii. 1.0 mg/200mL, 80 mg de biomasa, 28°C, 40 horas de incubación con agitación constante (100 rpm). |
Efecto de la concentración inicial de Cd (II) sobre la bioadsorción
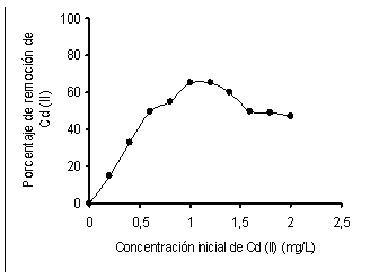
A una concentración de 1.0 mg/200mL, la biomasa de M. rouxii IM-80, mostró las mejores respuestas de remoción del metal, tal como lo deja ver la figura 4. Algunos autores (Kapoor y Viraraghavan, 1995; Say et.al., 2003; Tobin et. al., 1984) sostienen que la cantidad de metal eliminado por las biomasas de diferentes microorganismos, tales como R. arrhizus, P. purpurogenum aumenta en proporción directa con el incremento de la concentración del ión metálico en solución. De nuevo se encuentran discrepancias con los resultados de esta investigación, por cuanto la biomasa utilizada en el estudio mostró la mayor capacidad de bioadsorción a una concentración de 1.0 mg/L.
|
Fig. 3 Efecto de la temperatura de incubación sobre la bioadsorción de Cd (II) por la cepa IM-80 de M. rouxii . 1.0 mg/200mL, 80 mg de biomasa, 40 horas de incubación con agitación constante (100 rpm).
Fig. 4 Efecto de la concentración sobre la bioadsorción de Cd (II) en solución por la cepa IM-80 de M. rouxii . 28°C, 40 horas de incubación con agitación constante (100 rpm). |
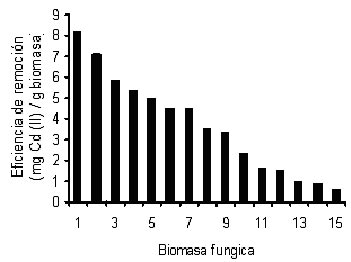
Se analizaron en las mismas condiciones, otras 14 biomasas fúngicas, siendo las más eficientes en la remoción de Cd (II) la de la cepa silvestre de M. rouxii IM-80, M . rouxii mutante y A. flavus-I, con 8.2, 7.1 y 5.9 mg de Cd (II)/mg de biomasa, respectivamente, seguidas de Helmintosporium sp (5.4), C. neoformans (5.0) y A. fumigatus II (4.5), mientras que las demás biomasas analizadas fueron menos eficientes en la remoción, a las 40 h de incubación a 100 rpm, pH de 5.0-6.0 y 28oC. Ver figura 5.
|
Fig. 5 Eficiencia de remoción de Cd (II) en solución por las biomasas fúngicas. 1.- M. rouxii IM-80, 2.- M. rouxii mutante, 3.- A. flavus I, 4.- Helmintosporium sp, 5.- C. neoformans, 6.- A. fumigatus II, 7.- C. albicans, 8.- A. flavus IV, 9.- A. flavus V, 10.- A. flavus III, 11.- A. flavus II, 12.- A. fumigatus I, 13.- Mucor sp I, 14.- Mucor sp II, 15.- Cladosporium sp |
Importa mencionar que la cantidad de Cd (II) removido por cada gramo de biomasa, resulta mayor a los valores reportados por Massaccesi et. al. (2002) con hongos aislados de sedimentos contaminados en La Plata (Argentina), Fourest y Roux (1992) para R. arrhizus y por Galum et. al. (1987) con P. digitatum. Sin embargo, son semejantes a los de Yan y Viraraghavan, (2003) y los de Norris y Kelly (1977) para la biomasa de M. rouxii tratada con NaOH y la levadura Saccharomyces cerevisiae, respectivamente, pero son menores a los encontrados para P. chrysogenum, R. arrhizus, y P. purpurogenum (Holan y Volesky, 1995; Tobin et. al. 1984, Say, et. al. (2003).
Se desconocen las razones que expresan las diferencias de bioadsorción de Cd (II) de las biomasas estudiadas en este trabajo, pues la remoción del metal depende de diversos factores, como la composición química de la pared celular de las biomasas, pH, temperatura, materia orgánica, textura de la biomasa y la presencia de otros iones (Volesky y Holan, 1995; Cañizares, 2000; Kapoor y Viraraghavan, 1995; Sag, 2001). Las eficiencias de remoción encontradas, indican una posible aplicación de algunas de estas biomasas como bioadsorbentes naturales en sitios contaminados por Cadmio.
CONCLUSIONES
Los resultados obtenidos muestran que algunas de las biomasas fúngicas analizadas remueven eficientemente Cd (II) en solución. A las concentraciones estudiadas, la cepa silvestre de M. rouxii, M. rouxii mutante, A. flavus-I, Helminthosporium sp, C. neoformans y A. fumigatus II pueden utilizarse solas o mezcladas, para tratar de eliminar el Cd (II) presente en aguas residuales industriales.
AGRADECIMIENTOS
Convenio C06-FAI-03-7.10 de la UASLP
REFERENCIAS
- Acosta, I., X. Rodríguez, C. Gutiérrez y M.G. Moctezuma-Zarate, Biosorption of Chromium (VI) from aqueous solutions onto fungal biomass, Bioinorganic Chemistry Applications: 2 (1,2) 1-7 (2004).
- Cañizares-Villanueva, R.O., Biosorción de metales pesados mediante el uso de biomasa microbiana, Revista Latinoamericana de Microbiología: 42, 131-143 (2000).
- Fourest, E. y J.C. Roux, Heavy metals biosorption by fungal mycelial by-products: mechanism and influence of pH, Applied Microbiology Biotechnology: 37, 399-403 (1992).
- Galum, M., et. al., Removal of metals ions from aqueous solutions by Penicillium bio-mass: Kinetic an uptake parameters, Water, Air, Soil Pollution: 33 (3,4) 359-371 (1987).
- Greenberg, A.E., L.S. Clesceri y A.D. Eaton, Standard methods for the examination of water and wastewater, 18a edición. American Public Health Association, Washington, D.C. 3.107 (1992).
- Kapoor, A. y T. Viraraghavan, Fungal biosorption an alternative treatment option for heavy metal bearing wastewaters: a review, Bioresource Technology: 53, 195-206 (1995).
- Kratochvil, D. y B. Volesky, Advances in the biosorption of heavy metals, TIBTECH: 16, 291- 300 (1998).
- Leyva-Ramos, R., P.E. Díaz-Flores, A. Aragón-Piña, J. Mendoza-Barrón y R.M. Guerrero-Coronado, Adsorption of Cadmium(II) from an aqueous solution onto activated carbon cloth, Separation Science and technology: 40, 2079-2094 (2005).
- Leyva-Ramos, R., L.A. Bernal-Jacome e I. Acosta-Rodriguez, Adsorption of Cadmium(II) from aqueous solution on natural and oxidized corncob, Separation and Purification Technology: 45: 41-49 (2005).
- Massaccesi, G., C. Romero, M. Cazau y A. Bucsinszky, Cadmium removal capacities of filamentous soil fungi isolated from industrially polluted sediments, in La Plata (Argentina), World Journal of Microbiology and Biotechnology: 18, 817-820 (2002).
- Norris, P.R. y D.P. Kelly, Accumulation of cadmium and cobalt by Saccharomyces cerevisiae, Journal of General Microbiology: 99 317-324 (1977).
- Puranik, P.R. y K.M. Paknikar, Biosorption of lead, cadmium and zinc by Citrobacter strain MCM B-181: Characterization studies, Biotechnology Progress: 15, 228-237 (1999).
- Sag, Y., Biosorption of heavy metals by fungal biomass and modeling of fungal biopsorption: a review, Separation and Purification Methods 30, 1-48 (2001).
- Sanders, C.L., Toxicological aspects of energy production, New York: MacMillan Publishing Company. USA, 158-162 (1986).
Say, R., Y. Nalan y D. Adil, Biosorption of Cadmium, Lead, Mercury and Arsenic ions by the fungus Penicillium purpurogenum, Separation Science and Technology: 38(9) 2039-2053 (2003). - Tobin, J.M., D.G. Cooper y R.J. Neufeld, Uptake of metal ions by Rhizopus arrhizus biomass, Applied and Environmental Microbiology: 47(4), 821-824 (1984).
- US Environmental Protection Agency, Water related environmental fate of 129 pollulants. EPA-44074-79-029, Wash., D.C. (1979).
- Vázquez, G., J. González-Álvarez, S. Freire y G. Antorrena, Desarrollo de un adsorbente basado en taninos de corteza de Pinus pinaster, Información Tecnológica, La Serena: 16, 47-51 (2005).
- Veglio, F. y F. Beolchini, Removal of metals by biosorption: a review, Hydrometallurgy: 44, 301-316 (1997).
- Volesky, B. y Z.R. Holan, Biosorption of heavy metals, Biotechnology Progress: 11, 235-250 (1995).
- Yan, G. y T. Viraraghavan, Heavy-metal removal aqueous by fungus Mucor rouxii, Water Research: 37, 4486-4496 (2003).
Por: Ismael Acosta, María de Guadalupe Moctezuma -Zárate, Juan F. Cárdenas y Conrado Gutiérrez
Universidad Autónoma de San Luis Potosí, Centro de Investigación y de Estudios de Posgrado,
Facultad de Ciencias Químicas, México (e-mail: [email protected])
Fuente: Inf. tecnol., 2007, vol.18, no.1, p.09-14. ISSN 0718-0764