Emisión de gases en un sistema ganadero intensivo
RESUMEN
Los problemas ambientales que enfrentan los sistemas intensivos de engorde de bovinos se relacionan con el metabolismo animal y la degradación de estiércol, siendo el propósito de este trabajo estudiar el origen de emisiones de compuestos causantes del olor y gases de efecto invernadero (GEI) además de algunos factores que controlan su producción. Para ello, se realizó una incubación in vitro, bajo diferentes condiciones de aireación (aerobiosis y anaerobiosis) del suelo proveniente de un sistema de engorde a corral y se monitoreó, cada 48 h durante un periodo de 216 h, la generación de gases metano (CH4), monóxido de carbono (CO), dióxido de carbono (CO2) y oxígeno (O2). También se efectuaron mediciones a campo en distintas áreas de dicho sistema (corrales con y sin animales, trampa de sólidos, laguna aeróbica y anaeróbica) de los gases CH4, CO, CO2 y oxígeno (O2), con equipos portátiles adaptados a las condiciones propias del sistema productivo intensivo (Reike Keiki RH -515 y Eagle 2). Para controlar la producción del olor característico de un engorde a corral se evaluó un producto comercial enzimático que midió la concentración de sulfuro de hidrógeno (SH2), compuestos orgánicos volátiles (COV), amoníaco (NH3), CH4 y CO2 con medidores portátiles. Los resultados de producción de gases fueron similares en laboratorio y campo, ya que en ambas situaciones se observó digestión -anaeróbica y aeróbica, dependiendo de las condiciones prevalentes en el momento, mostrando la coexistencia de ambos metabolismos en el sistema. Ello sugiere la posibilidad de controlar las emisiones dependiendo del vector ambiental preponderante. Los niveles máximos encontrados fueron de 0,109% LEL (límite inferior de explosividad) de CH4, 22,27 ppm de CO y 8,23% de CO2 para las condiciones in vitro en anaerobiosis, y 0,468% LEL de CH4, 0,43% de CO2, 7,21 ppm de NH3, 4,67 ppm de SH2 y 14,54 ppm de COV para las condiciones naturales. El tratamiento con el producto comercial enzimático sólo produjo modificaciones significativas en NH3 y COV, que disminuyeron, a diferencia de SH2 que aumentó. Se concluye que un buen manejo de la reducción de emisiones de gases y de control de efluentes potencialmente contaminantes debe prever más de una práctica alternativa que se adapte a las variables condiciones climáticas locales y a la heterogeneidad del sistema intensivo de producción de carne.
Palabras clave: Sistemas ganaderos intensivos, emisiones gaseosas, medición in vitro, medición in situ.
INTRODUCCIÓN
En la actualidad el clima de la Tierra experimenta cambios que afectan tanto la composición de la atmósfera como el balance de la radiación solar, jugando un rol importante en las actividades ganaderas. Tanto los sistemas de producción extensivos como intensivos han afectado el medio ambiente significativamente, modificando los hábitats naturales. La ganadería intensiva, además de bienes y subproductos, genera efluentes que cuando son de naturaleza gaseosa, se denominan emisiones: olores, gases con efecto invernadero (GEI), etcétera. El aire, al igual que los otros vectores ambientales como el agua y el suelo, tiene una capacidad de asimilación dada, superada la cual se está en presencia del fenómeno de contaminación (Gómez Orea, 1998).
En los corrales de engorde, el manejo del estiércol y la producción de olores desagradables constituyen un problema de relevancia y de gran complejidad. En los olores, constituidos por una mezcla de gases volátiles y material particulado, se han identificado entre 80 y 200 sustancias (O’Neill y Phillips, 1992) que se adhieren y transportan por las partículas de polvo durante los procesos de dispersión atmosférica (Bottcher, 2001). Los olores pueden percibirse a varios kilómetros de distancia, debido a la presencia de amoniaco (NH3), compuestos sulfurados, aminas, ácidos grasos volátiles (AGV), indoles, fenoles, mercaptanos, alcoholes y carbonilos que reaccionan entre sí mediante interacciones de sinergia y antagonismo. En este sentido, la percepción fisiológica del conjunto no es el resultado de la suma sensorial de los compuestos individuales, sino un producto final aleatorio.
Dentro de los GEI se encuentra el dióxido de carbono (CO2), de mayor contribución relativa (65%) al calentamiento global, seguido por el metano (CH4) cuya concentración atmosférica ha aumentado más de 140% en los últimos dos siglos (IPCC, 1996). Ambos gases, junto a los óxidos de nitrógeno (N2O, NO2 y NO), son generados principalmente por la ganadería. Sus precursores dependen del manejo del estiércol, a excepción del CO2 que se relaciona directamente con el nivel de tecnificación ganadera (SAyDS, 2007). De acuerdo al reciente informe de la FAO, “Hacer frente al cambio climático a través de la ganadería: una evaluación global de las emisiones y las oportunidades de mitigación” (Gerber et al., 2013), las emisiones globales de GEI asociadas a las cadenas productivas de la ganadería ascienden a 7,1 gigatoneladas (Gt) de CO2 equivalente (CO2eq) por año, lo que representa el 14,5% de todas las emisiones de GEI de origen humano. Las principales fuentes de emisión de gases son: la producción y procesamiento de alimentos (45% del total), la digestión de los vacunos (39%), y la descomposición del estiércol (10%). El resto se debe al procesado y transporte de productos de origen animal.
El suelo de los sistemas intensivos es un sustrato ideal para el desarrollo de microrganismos (Miller y Varel, 2003), debido a que acumulan gran cantidad de enzimas como, por ejemplo, las ureasas que catalizan la conversión de urea de la orina a amonio y, finalmente, a NH3 que se libera a la atmósfera. La emisión de NH3 se relaciona con el olor y, al igual que el sulfuro de hidrógeno (H2S), son responsables del olor a huevo podrido, y con un límite de detección bajo, entre 0,0085 y 1 ppm (Lomans et al., 2002). En condiciones de acidez, los iones sulfuro (S◦2) se asocian con protones para formar H2S, un producto final común en sistemas biológicos anaeróbicos que tienen compuestos orgánicos azufrados o proteínas con azufre. Power et al. (2001), encontraron una correlación directa entre los AGV, los compuestos aromáticos y los olores. El contenido de estiércol y las condiciones ambientales tales como temperatura y humedad afectan la actividad microbiana pudiendo incidir en la producción de gases, olor y polvo (Miller y Varel, 2003). En estos sistemas de engorde a corral, al permanecer gran cantidad de animales en sectores reducidos durante periodos prolongados, la alta concentración de excretas por unidad de superficie aumenta el riesgo de contaminación puntual de los recursos naturales (Atkinson y Watson, 1996; Gil et al., 2006). Se incrementa asimismo la presencia de residuos de drogas veterinarias denominados micro contaminantes emergentes de alta persistencia (Teuber, 2001; Boxall et al. 2004). Se han identificado alrededor de 200 compuestos, muchos de ellos sulfurosos y nitrogenados provenientes del metabolismo de las proteínas.
Además se identificaron compuestos fenólicos, AGV, alcoholes, cetonas y aldehídos (ACFA y AAFRD, 2002) a partir de los cuales se generan compuestos orgánicos volátiles (COV) que agrupan a una gran cantidad de sustancias químicas que luego se convierten, fácilmente, en vapores o gases. Se conoce que los AGV y COV presentan correlación directamente proporcional con la producción de olor (Zahn et al., 2001) y, junto con los GEI, generan disturbios en el medio por la formación de ozono troposférico.
Actualmente, son numerosos los avances en los estudios sobre el impacto ambiental de los sistemas de producción agrícolas. A pesar de ello, aún no han sido claramente determinados y poco se conoce sobre el origen de los compuestos causantes del olor y los factores que controlan su producción.
Conscientes que para una gestión ambiental apropiada es necesario identificar las áreas de riesgo para controlar o reducir sus efectos, se plantearon los siguientes objetivos:
1.determinar las concentraciones in vitro (laboratorio) de los gases: oxígeno (O2), CH4, monóxido de carbono (CO) y CO2 con dos niveles de concentración de oxígeno (O2) (condiciones de aerobiosis y anaerobiosis) en una mezcla de estiércol y suelo, símil a la del suelo de un sistema intensivo de producción ganadera.
2.determinar las concentraciones in situ (a campo) de CH4, CO, CO2 (gases contaminantes) y O2 en 5 áreas relevantes del sistema de producción ganadero.
3.evaluar la efectividad de un complejo poli-enzimático comercial en la reducción de la concentración de cinco gases contaminantes (CH4, CO2, COV, H2S y NH3), caracterizados por incidir en la generación de olores desagradables.
MATERIALES Y MÉTODOS
La experiencia se efectuó en un establecimiento de engorde intensivo de bovinos situado en latitud 33.70º Sur, longitud 65.50º Oeste, próximo a la ciudad de Villa Mercedes (provincia de San Luis), durante los meses de octubrenoviembre, antes de que las lluvias estivales modificasen las áreas a evaluar. Se registraron los siguientes factores climáticos: temperatura media diurna del aire, velocidad media del viento y humedad relativa. La dieta de los animales (novillos en terminación), expresada en base a materia seca (MS), contenía grano de maíz (Zea mays) 56%, Gluten Feed de maíz húmedo 36%, cáscara de maní (Arachis hypogaea) 4,5% y suplemento vitamínico mineral 3,5% del total.
Al no existir un protocolo estándar, se decidió medir cada muestra de aire por triplicado considerando el valor promedio.
Se empleó un equipo detector de gases portátil (Reike Keiki RH -515) para determinar las concentraciones de O2, CO2, CH4 y CO. Este detector combina sensores infrarrojo (NDIR), galvánico y de células electroquímicas, con rangos de medición entre 0 y 100% LEL (límite inferior de explosividad), o de 0 a 100% volumen (vol.) para CH4; de 0 a 25% vol. para O2; de 0 a 1000 ppm para CO y de 0 a 20% vol. para CO2. Para la determinación de otros compuestos precursores de sustancias odoríferas se recurrió a un equipo Eagle 2, que utiliza sensores fotoionizables (PID) para aplicaciones con alta sensibilidad e infrarrojos, identificando NH3 con un rango de 0 a 75 ppm, H2S hasta una concentración de 100 ppm, y COV con un rango de 0 a 2000 ppm. En el procedimiento de medición el volumen de aire ingresa a la sonda conectada a una bomba de aspiración y, transcurridos 15 segundos para su estabilización, se lee la concentración en la pantalla del equipo.
Determinaciones in vitro
El protocolo en el laboratorio consistió en la medición de la concentración de los gases O2, CH4, CO y CO2 contrastando dos niveles de concentración de O2. De la superficie de los corrales fueron extraídas muestras, constituidas por tierra, heces y orina de los animales (estiércol). Se colocó el material, 250 g de mezcla de suelo más estiércol, en un Erlenmeyer de 250 mL (12 unidades), conformando dos tratamientos: T0 ambiente aeróbico= 6 Erlenmeyer cerrados con algodón que permitía el intercambio de aire y T1 ambiente anaeróbico= 6 Erlenmeyer cerrados con tapones de goma de cierre hermético. Se incubaron las muestras en estufa de cultivo (37 ºC) por un periodo de nueve días y se midió la concentración de gases cada 48 h. Quitados los tapones, se introdujo una sonda conectada a una bomba de aspiración y ésta al equipo que determina la concentración del volumen de aire que ingresa. El procedimiento se realizó en habitación cerrada para no afectar las condiciones de cada unidad experimental.
Determinaciones in situ
El protocolo consistió en la medición de la concentración de los gases CH4, CO, CO2 y O2 en cinco áreas relevantes del establecimiento: a- corrales con animales (20m2/animal); b- corrales sin animales; c- trampa de sólidos o pileta de sedimentación; d- laguna anaeróbica de sedimentación y evaporación; e- laguna aeróbica de almacenamiento o facultativa (figura 1). Se utilizó una cámara estanca de 2 litros de capacidad en cada corral y se ubicó a nivel del piso para evitar la corriente de aire interna, posicionándose en cuatro sitios al azar, tanto en corrales con animales como sin ellos. En las áreas de trampa de sólidos y lagunas se utilizó una cámara estanca de 1 litro de capacidad de material liviano que flota en la superficie y se conecta al equipo medidor con una manguera de goma de 2 m. Las mediciones se repitieron al mismo momento (12:00 am) por tres días consecutivos.
Para el tercer objetivo, se aplicó a la trampa de sólidos un complejo poli-enzimático comercial Rolls TZ-1000 (http://www.rolls.com.ar/) destinado a eliminar los olores pútridos y la materia orgánica, dosificándose 150 ml/m3 en función de la superficie a tratar, según instrucciones del marbete.
Previo al agregado del producto comercial, se realizó un monitoreo por tres días consecutivos de los gases CH4, NH3, H2S, CO2 y COV en laguna aeróbica de sedimentación y anaeróbica de almacenamiento, determinando valores de referencia para comparar el efecto del producto con los datos obtenidos siete días después.
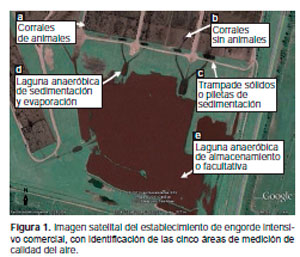 |
Análisis estadístico
Los resultados se analizaron con el paquete estadístico SPSS (Statistical Package for the Social Sciences). A los datos obtenidos en laboratorio se les realizó el análisis de varianza de un factor, tomando como unidad experimental cada Erlenmeyer. Los modelos incluyeron tipo de fermentación, tiempo transcurrido y la interacción entre ambos.
Las diferencias entre las medias de los cuadrados se testearon con el test de Tukey, aceptando como diferencia significativa p<0,05. Para poder evaluar el efecto de los distintos lugares de muestreo in situ (corrales, trampas y laguna) sobre la concentración de gases, se planteó un análisis de la varianza realizando la prueba no paramétrica de Kruskal-Wallis. En el caso de la evaluación enzimática, como alternativa de manejo, se realizó la Prueba “T” para observaciones apareadas, lo que permitió evaluar si existieron modificaciones en el patrón de gases de fermentación por efecto del tratamiento.
RESULTADOS
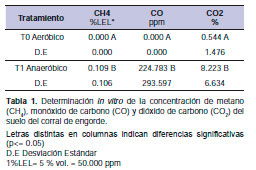
Los valores medios obtenidos sobre las concentraciones de CH4, CO y CO2 en condiciones aeróbicas y anaeróbicas generadas a partir de las 96 h en el interior de los Erlenmeyer (primer objetivo) se presentan en la tabla 1. Se observa una clara diferencia significativa (p<0,05) en la concentración media de cada gas producido con y sin O2.
En presencia de O2, no se detectó CH4 ni CO, mientras que bajo condiciones anaeróbicas incrementó a 0,109% LEL para CH4 y la concentración de CO hasta 224,78 ppm. A su vez, la concentración de CO2 incrementó casi 15 veces en condiciones anaeróbicas. Se observó una correlación positiva (r=0,731, p=0,00048) entre la concentración de CH4 y CO2.
 |
En la figura 2, se observa la tendencia en la producción de gases in vitro en función del tiempo para ambos tratamientos.
Las curvas obtenidas en condiciones anaeróbicas presentaron diferencias significativas para CO (p=0,0189), CH4 (p=0,0004), CO2 (p<0,0001) y O2 (p<0,0001), y describen una sigmoidea. Para el tratamiento aeróbico el comportamiento fue constante con una leve tendencia negativa para CO2, no detectándose CO y CH4 en el periodo de evaluación.
Durante el periodo de medición a campo, las condiciones de humedad relativa (45%), temperatura del aire (20 ºC) y velocidad media del viento (9,3 km/h) permanecieron estables. Los valores medios de las emisiones de gases, cuantificadas por tres días consecutivos en las cinco diferentes áreas (segundo objetivo), muestran evidencias estadísticas de que no presentaron una distribución normal y homogeneidad de la varianza según la prueba de Shapiro-Wilk y de Levene, respectivamente, ambos p<0,05. Por lo tanto, se usó la prueba no paramétrica de Kruskal-Wallis (Kruskal-Wallis, 1952), y se encontraron diferencias significativas (p<0,0001) en la concentración de CH4 y CO2 entre las cinco áreas de medición como se observa en la tabla 2. Con respecto al CH4, en los corrales con y sin animales el nivel de % LEL fue de 0,000, mientras que el valor más alto se registró en la trampa de sólidos (0,468% LEL) al igual que la concentración de CO2 (0,232%). No se generó CO en ninguna área y la concentración de O2 fue constante en todas las áreas (20,95%).
Profundizando el análisis en cada zona, se observa diferencia significativa en la concentración de CO2 (p= 0,007) dentro de los corrales sin animales (concentración media 80% inferior).
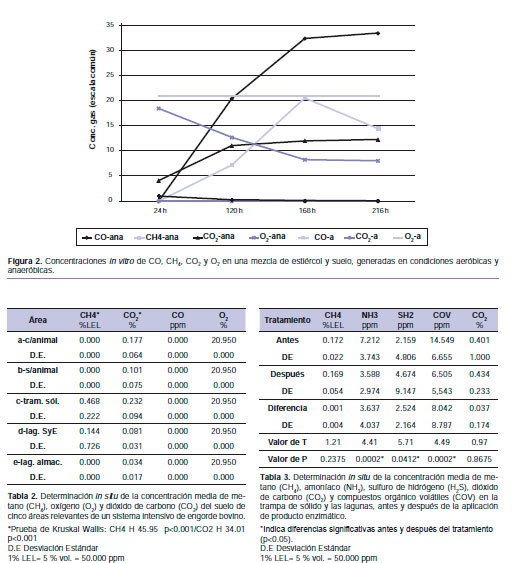 |
Por último, en la tabla 3 se presentan los resultados de las observaciones apareadas del tratamiento poli-enzimático a las trampas de sólido y lagunas, determinando las concentraciones medias de los gases CH4, NH3, H2S, CO2 y COV, antes y después de la aplicación del producto.
Sólo se detectaron diferencias significativas (p<0,05) debido a la aplicación del producto en la concentración de NH3, H2S y COV. De estos gases, el NH3 y los COV decrecieron luego de la aplicación del producto, mientras que el H2S aumentó su concentración.
DISCUSIÓN Y CONCLUSIONES
La creciente importancia del efecto contaminante sobre el ambiente de los sistemas de engorde a corral, junto al progresivo aumento de estas instalaciones en la provincia de San Luis, han incentivado a la investigación en la búsqueda de una mejor gestión ambiental. En la explotación en estudio, los olores de mayor potencial contaminante proceden tanto de las fuentes fijas (corrales, lagunas, trampas) como temporales (liberado desde el estiércol), y son las condiciones meteorológicas las que tienen, en gran medida, incidencia en su formación como así también en su emisión. En estos sistemas, las raciones suministradas a los animales son ricas en almidón y exceden el contenido de proteínas que éstos necesitan. El remanente no asimilado por el animal retorna al suelo en heces y orina, lo que produce un efecto sobre la flora microbiana estableciendo un metabolismo aeróbico y/o anaeróbico, que dependerá de la acumulación, pérdida o persistencia del estiércol como así también de las propiedades del suelo y condiciones climáticas predominantes. El nitrógeno presente en las excretas tiene grandes posibilidades de perderse hacia la atmósfera como NH3, según la temperatura, contenido de humedad, pH del suelo, entre otros factores de acuerdo al trabajo de Keeney y Hatfield (2001). El fósforo que es excretado puede moverse por escurrimiento superficial hacia los cuerpos de agua, con riesgo de eutrofización de las aguas superficiales, como confirma Nelson (1999) en sus estudios. De este modo, la dieta constituye un factor que afecta indirectamente a la contaminación del ambiente en estos sistemas intensivos. La metodología diseñada de la cámara de medición in situ genera una atmósfera constante que, sumado a la estabilidad climática en el periodo del ensayo a campo, contribuyó a minimizar el efecto de la dilución de la concentración de los gases de interés con el aire, y a alcanzar resultados repetitivos en la generalidad de los mismos.
Del resultado en laboratorio se observó un similar comportamientoen cuanto a concentración de gases para ambos tratamientos en las primeras 24 h, coincidiendo con lo hallado por Miller (2003). Este investigador afirmó que es suficiente tan sólo el 1% de O2 para dar lugar a fermentaciones aeróbicas, concentración superada en el sistema anaeróbico al comienzo del ensayo. Esta concentración tendió a disminuir, diferenciándose del tratamiento aeróbico que se mantuvo constante (20,9%). Las poblaciones de organismos existentes en el material incubado en el sistema cerrado van agotando el O2 disponible debido a su respiración. Esto conduce al cambio, mayoritariamente, de una respiración aeróbica a una fermentación anaeróbica, efecto que se observa en el patrón de los gases al transcurrir los días del estudio y se observa un comportamiento equivalente entre el CO y el CO2, a su vez, inversamente proporcionales al O2. Las concentraciones del CO y CO2 aumentaron al final del periodo de incubación y la de O2 disminuyó. La curva sigmoidea de producción de CO2 del tratamiento cerrado se estabilizó a las 120 h, por lo que se infiere que se ha alcanzado el máximo potencial de masa microbiana activa (fase estacionaria), comportamiento inverso al del O2, que se encuentra en la menor concentración.
En el tratamiento aeróbico el CO2 mostró una tendencia lineal decreciente y de bajo volumen. En el caso del CH4 bajo condiciones anaeróbicas, éste llegó a su máxima concentración a las168 h, disminuyendo al transcurrir los días, lo que indicaría la estabilización del medio a causa de la autolimitación de la fermentación al convertir el almidón en ácido láctico. A su vez, esto generaría una disminución del pH, afectando la población de bacterias metanogénicas y, por consiguiente, la disminución de la concentración de CH4. Un comportamiento semejante podría generarse en el ambiente superficial del corral donde las heces frescas y efluentes líquidos, proporcionan un inoculo para bacterias metanogénicas, estimulan el consumo de O2 y conducen mayoritariamente a una digestión aeróbica que con el tiempo se transforma en fermentación anaeróbica. La carga bacteriana de organismos facultativos en las heces y condiciones adecuadas para el cambio de metabolismo, permitiría el rápido desarrollo de las nuevas poblaciones microbianas, generando como productos intermedios y/o finales de su metabolismo, desprendimiento de gases, algunos de olores desagradables y otros tóxicos, lo que da lugar a problemas sanitarios y de contaminación en el exterior. En primer caso, a través de bacterias patógenas (LeJeune y Wetzel, 2007) o por nitratos, reduciendo la capacidad de transporte de oxígeno en la sangre, enfermedad conocida como metahemoglobinemia y, en segundo caso, a través de los GEI como sugiere Thomassen (2008) en el estudio comparativo de sistemas lecheros. En el tratamiento aeróbico del laboratorio no se producirían CO y CH4, manteniéndose la concentración de O2 del medio ambiente, situación que podría suceder en la superficie de los corrales, pudiendo modificarse en función de la humedad del suelo y el ambiente, la actividad microbiana, la temperatura y prácticas de manejo. En trampa de sólidos se generaron los niveles más altos de CH4, posiblemente, como consecuencia de una mayor concentración de CO2 lo que creó condiciones anaeróbicas que favorecieron la metanogénesis. Este proceso de construcción de material celular desde H2 y CO2 produce CH4, como único proceso generador de energía de las bacterias metanogénicas, las cuales se desarrollan perfectamente en hábitats extremos, por lo que es una fuente natural de gas que normalmente es descartado en lugar de ser reciclado.
Existen en el mercado diferentes productos comerciales para minimizar el efecto de algún vector ambiental como el que se empleó en el último ensayo. Se busca disminuir el olor en el aire con la aplicación de un producto enzimático, debido a que Zahn y otros (2001), encontraron que correlaciona estos compuestos con la disminución de los olores desagradables para el hombre. En este estudio se obtuvieron resultados negativos ya que la concentración de SH2 (gas característico de olores desagradables) aumentó después de aplicado el producto y no sucedió lo mismo para los gases de NH3 y COV que disminuyeron. Esto indicaría que el producto aplicado modifica las reacciones biológicas de los desechos del sistema acelerando la degradación y disminuyendo las exhalaciones de algunos gases contaminantes, pero no del responsable principal de olores desagradables, como citan numerosos trabajos previos en la temática (Hobbs et al., 1995; MacIntyre et al., 1995; Zahn et al., 1997), actuando el producto comercial como bioremediador enzimático y no como desodorizante.
Basados en los datos obtenidos en el trabajo, se concluye que la emisión de gases bajo condiciones aerobias es menos perjudicial que cuando tiene lugar en ausencia de O2, pero de mayor proporción respecto de la superficie total del predio. Sin embargo, la situación aeróbica puede transformarse a anaeróbica al transcurrir el tiempo, o por algún factor externo (precipitaciones), siendo inevitable que ambas condiciones se produzcan en simultáneo. Por este motivo, sería necesario disminuir las fuentes de producción de fermentación anaeróbica a través de las buenas prácticas de manejo, controlando los sustratos en el estiércol a través de una justa y balanceada ración, como así también favoreciendo la población de bacterias lácticas de manera controlada a través del monitoreo de pH para no aumentar la emisión de SH2. Por esta razón, el conocimiento de las relaciones suelo-alimento-planta y la vulnerabilidad entre estas interacciones, conllevaría a la elección de estrategias de menor impacto ambiental en búsqueda de la sustentabilidad de los agroecositemas. No obstante, es necesario realizar más investigación, especialmente si se considera que los sistemas de engorde a corral son muy complejos y heterogéneos.
BIBLIOGRAFÍA
ACFA – Alberta Cattle Feeders’ Association & AAFRD – ALBERTA. Agriculture; Food and Rural Development. 2002. Beneficial Management Practices – Environmental Manual for Feedlot Producers in Alberta. 45-88. (www1.agric.gov.ab.ca/$department/ deptdocs.nsf/all/epw5837, verificado 2/agos/2013).
ATKINSON, D.; WATSON, C. 1996. The environmental impact of intensive systems of animal production in the lowlands. Animal Science 63:353-361.
BOTTCHER, R. 2001. An environmental nuisance: Odor concentrated and transported by dust. Chemical Senses 26. 327-331.
BOXAL, A.; FOGG, L.; BLACKWELL, P.; KAY, P.; PEMBERTON, E. 2004. Veterinary medicines in the environment. Reviews of Environmental Contamination and Toxicology.. 180:1-91.
GERBER, P.J.; STEINFELD, H.; HENDERSON, B.; MOTTET, A.; OPIO, C.; DIJKMAN, J.; FALCUCCI, A.; TEMPIO, G. 2013. Tackling climate change through livestock: A global assessment of emissions and mitigation opportunities. Food and Agriculture Organization of the United Nations (FAO), Rome.
GIL, S.B.; ORLANDO, A.A.; HERRERO, M.A. 2006. Indicadores de riesgo ambiental en sistemas agropecuarios con engorde a corral. Revista Argentina de Producción Animal 26 (1): 330-332.
GÓMEZ OREA, D. 1998. Evaluación de impacto ambiental. El caso de la producción animal. AAPA, 22.º Congreso Argentino de Producción Animal: 1-10. Google Earth. (www.google.com/intl/es/earth/index.html, verificado 28/febrero/2009).
HOBBS, P.J.; MISSELBROOK, T.H.; PAIN, B.F. 1995. Assessment of odours from livestock wastes by a photoionization detector, an electronic nose, olfactometry and gas chromatography– mass spectrometry. Journal of Agricultural Engineering Research 60:137–144.
INTERGOVERNMENTAL PANEL ON CLIMATE CHANGE (IPCC). 1996. Revised Guidelines for National Greenhouse Gas Inventories. (www.ipccnggip.iges.or.jp/public/gl/invs1.htm, verificado 2/agos/2013).
KEENEY, D.; HATFIELD, J. 2001. The nitrogen cycle, historical perspective and current, and future potential concerns. Elservier Science. The Netherlands: 3-6.
LEJEUNE, J.T.; WETZEL, A.N. 2007. Preharvest control of Escherichia coli O157 in cattle. Journal Animal Science 85: E73-E80.
LOMANS, B.P.; POL, A.; CAMP, H.J. 2002. Microbial cycling of volatile organic sulfur compounds in anoxic environments. Water Science and Technology 45(10):55-60.
MACINTYRE, S.; WANNINKHOF, R.; CHANTON, J. 1995. Trace gas exchange across the air–water interface in freshwater and coastal marine environments. p. 52–97.
MILLER, D.; VAREL, V. 2003. Swine manure composition affects the biochemical origins, composition, and accumulation of odorous compounds. Journal Animal Science 81:2131–2138.
NELSON, C.J. 1999. Managing nutrients across regions of the United States. Journal Animal Science. 77: 90-100.
O’NEILL, D.; PHILLIPS, V. 1992. A review of the control of odour nuisance from livestock buildings: Part 3. Properties of the odorous substances which have been identified in livestock wastes or in the air around them. Journal Agricultural Engineering 53:23–50.
POWER, V.; MAGUIRE, D.; CANTRELL, B.; STAFFORD, T.;
ROONE, B.; LYNOTT, D. 2001. Odour impacts and odour emission control measures for intensive agriculture. Final report. Environmental Protection Agency, R&D Report Series No. 14:1-145.
SAYDS-SECRETARÍA DE AMBIENTE Y DESARROLLO SUSTENTABLE (SAyDS). 2007. 2a Comunicación Nacional de la República Argentina a la Convención Marco de las Naciones Unidas sobre Cambio Climático. 201.
TEUBER, M. 2001. Veterinary use an antibiotic resistance. Current Opinion in Microbiology 4: 493-499.
THOMASSEN, M.A.; VAN CALKER, K.J.; SMITS, M.C.; LEPEMA, G.; BOER, J.M. 2008. Life cycle assessment of conventional and organic milk production in the Netherlands. Agricultural Systems 96(1-3): 95-107.
WALLIS, A.; KRUSKAL, W. 1952. Use of ranks in one-criterion variance analysis. Journal of the American Statistical Association 47 (260): 583–621.
ZHAN, J.A.; DI SPIRITO, A.A.; DO, Y.S.; BROOKS, B.E.; COOPER, E.E.; HATFIELD, J.L. 2001. Correlation of human olfactory responses to airborne concentrations of malodorous volatile organic compounds emitted from swine effluent. Journal Environmental Quality 30:624–634.
ZAHN, J.A.; HATFIELD, Y.S.; DO, A.A.; DISPIRITO, D.A.; LAIRD, D.A.; PFEIFFER, R.L. 1997. Characterization of volatile organic emissions and wastes from a swine production facility. Journal Environmental Quality 26:1687–1696.
Por: GUZMÁN, M.L.; VENECIANO, J.H.; SAGER, R.L
Fuente: Revista de Investigaciones Agropecuarias