Viabilidad de un Proceso para la Eliminación conjunta de H2S Y NH3 contenido en Efluentes Gaseosos. Parte 8
 |
Martín Ramírez Muñoz TESIS DOCTORAL |
La presente Tesis ha sido co-dirigida por los Doctores D. Domingo Cantero Moreno, Catedrático de Ingeniería Química y D. José Manuel Gómez Montes de Oca, Profesor Titular de Ingeniería Química de la Universidad de Cádiz, y cumple los requisitos exigidos por la legislación vigente.
Fdo.: Dr. D. Domingo Cantero Moreno Fdo.: Dr. D. José Manuel Gómez Montes de Oca
Fdo.: Dr. D. José María Quiroga Alonso
Director del Dpto. de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente
Universidad de Cádiz
4. RESULTADOS Y DISCUSIÓN
4.1.ELIMINACIÓN DE ÁCIDO SULFHÍDRICO EN AIRE MEDIANTE Thiobacillus thioparus INMOVILIZADO EN UN BIOFILTRO DE ESCURRIMIENTO EMPAQUETADO CON ESPUMA DE POLIURETANO
4.1.1. Cinética de crecimiento
En el proceso de oxidación de tiosulfato se forma azufre elemental y sulfato, estados de oxidación 0 y 6, respectivamente. A simple vista, podría parecer que la bacteria tiene la capacidad de realizar tanto oxidaciones como reducciones, si suponemos un estado de oxidación de +2 para cada átomo de azufre presente en el tiosulfato. En realidad, lo que ocurren son dos oxidaciones puesto que el estado de oxidación de los dos átomos de azufre presentes en el tiosulfato (-S-SO3 -) son -2 y +5, respectivamente (Vairavamurthy et al., 1993); permitiendo fácilmente la formación de azufre elemental por la oxidación del primer átomo de azufre y la formación de sulfato por oxidación de grupo sulfonato. Esta ruta metabólica ha sido comprobada marcando, con átomos pesados, el átomo con estado de oxidación -2 (-35S- 32SO3 -), encontrándose que la acumulación de 35S se produce en el azufre elemental (Peck and Fisher 1962).
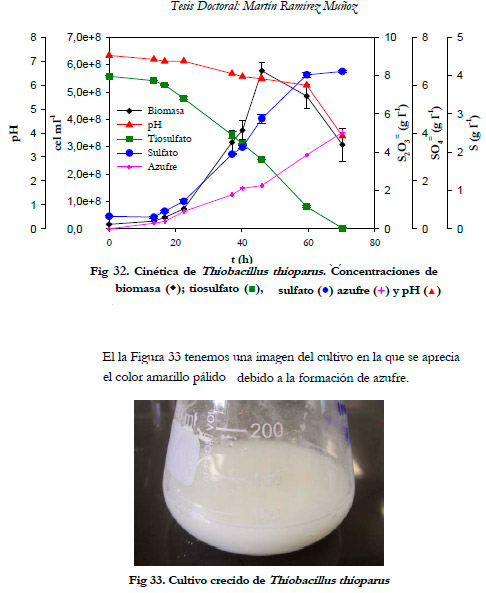
En la Figura 32, se ha representado la variación del pH, biomasa total, concentración de tiosulfato y de sulfato respecto al tiempo. La concentración de azufre se ha calculado realizando un balance de materia al sistema.
La biomasa inicial fue de 1,6·107 cel ml-1, alcanzándose un máximo de crecimiento de 5,7·108 cel ml-1 a las 46 horas. A las 70 horas se produce el agotamiento de la fuente de sustrato (tiosulfato) con una disminución de pH desde 7,2 hasta 3,8. La concentración de sulfato no superó los 7,0 g l-1. Se puede apreciar que a partir de una concentración de sulfato por encima de 4,0 g l-1 se produce una mayor cantidad de azufre elemental.
 |
Para calcular las velocidades de consumo de tiosulfato y producción de sulfato, se ha supuesto una variación lineal de la concentración en la fase exponencial de crecimiento; obteniéndose una velocidad de consumo de tiosulfato de 0,140 g l-1 h-1 y una velocidad de producción de sulfato de 0,128 g l-1h-1. Los coeficientes de regresión lineal (r2) fueron de 0,986 y 0,994, respectivamente.
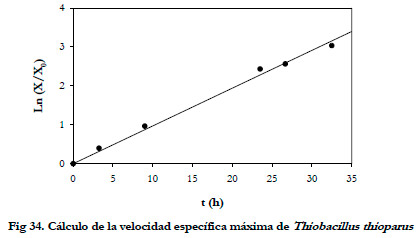
La velocidad específica de crecimiento se puede obtener representando el logaritmo neperiano del cociente de la concentración de biomasa en cada instante y la concentración de biomasa inicial frente al tiempo (Figura 34). De esta forma, se obtuvo una velocidad específica máxima de crecimiento (μ) de 0,0971 h-1, con un coeficiente de regresión lineal (r2) de 0,993.
 |
4.1.2. Desarrollo y adaptación de biopelículas
4.1.2.1. Inmovilización en matraces
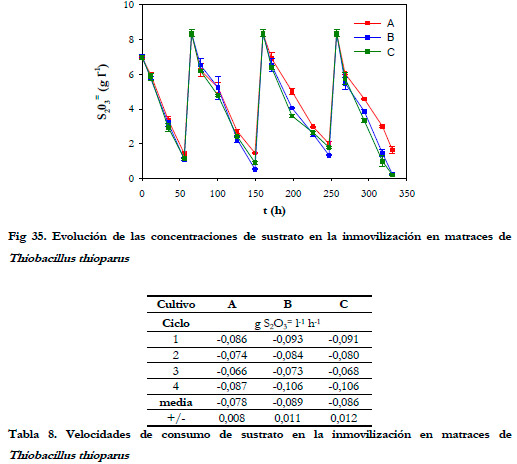
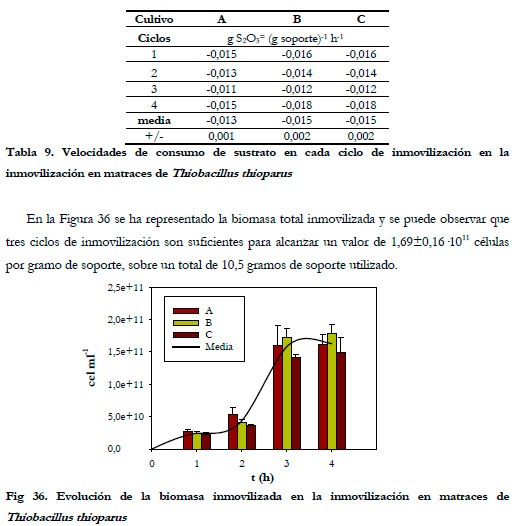
Se llevaron a cabo 4 ciclos de inmovilización, sobre tres cultivos en paralelo, con una duración total de 335 horas. La cantidad de biomasa inmovilizada alcanzada fue de 1,69±0,16·1011 células por gramo de espuma de poliuretano. La duración de cada ciclo fue de 64,5; 93,6; 96,5 y 77,0 horas, respectivamente. En la Figura 35 se representa la evolución del sustrato para cada cultivo.
Los tres cultivos evolucionaron de igual forma, lo que nos permite comprobar la reproducibilidad de la técnica utilizada. Si realizamos el cálculo de las velocidades de consumo de sustrato para los 3 cultivos (Tabla 8), podemos ver que se obtienen prácticamente los mismos valores de estas velocidades.
 |
Si referimos las velocidades de consumo de sustrato al peso total de soporte (Tabla 9), comprobamos que la velocidad de consumo se mantiene prácticamente constante, a pesar de que la biomasa se incremente notablemente. Este hecho podría relacionarse con un aumento de la resistencia a la transferencia de oxígeno y/o de sustrato en las biopelículas, que limite la velocidad de consumo. La mayor cantidad de biomasa se encuentra inmovilizada en el soporte, y tanto el sustrato como el oxígeno han de difundir hacia la biopelícula. La concentración de oxígeno al trabajar con el soporte sumergido en un medio acuoso será muypequeña dada la baja solubilidad de oxigeno, por lo que la hipótesis de la limitación por oxigeno sea probablemente la más acertada.
 |
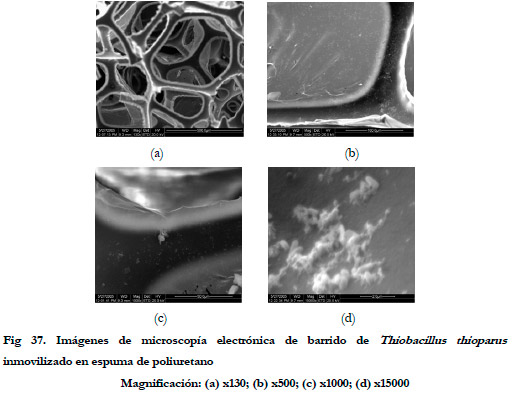 |
En las imágenes de microscopía electrónica puede observarse como las bacterias inmovilizadas se distribuyen uniformemente sobre la superficie del soporte. No existen antecedentes del uso de la espuma de poliuretano para la inmovilización de Thiobacillus thioparus como tal, sino como parte de un consorcio microbiano presente en los lodos activos. A pesar de ello, este tipo de bacterias si se han inmovilizado en otro tipo de soportes para su uso en experiencias de biofiltración de TRS.
Recientemente, se ha realizado un estudio de inmovilización de esta bacteria sobre un soporte polimérico con partículas magnéticas (MPB), para la degradación en aguas residuales de sulfuro mediante un reactor de lecho fluidizado, obteniéndose una cantidad de biomasa inmovilizada de 9,3·109 células por gramo de soporte (Qiu et al., 2006). Es de destacar, que la cantidad de biomasa inmovilizada en la espuma es 17 veces mayor que en las partículas MPB.
Tanji et al. (1989) trabajaron con un BTF inmovilizando Thiobacillus thioparus TK-m en anillos de propileno y llegaron a concentraciones de 11,7 g células (peso seco) l-1 en la parte inferior del biofiltro. Cho et al. (1992b) trabajaron con un biofiltro utilizando turba como soporte e inocularon Th. Thioparus DW44. Al cabo de 120 días de operación obtuvieron una cantidad de 9,50·107 CFU (g turba seca)-1 en la parte inferior. De igual forma, Park et al. (1993) trabajando con un biofiltro alcanzaron una concentración máxima final de 2,3·108 CFU (g turba seca)-1 de Thiobacillus thioparus TK-m. Finalmente, Oyarzún et al. (2003) inocularon un biofiltro relleno con turba con Thiobacillus thioparus alcanzado valores de 2,7·108 células (g turba seca)-1.
Por último, este soporte de espuma de poliuretano se ha utilizado para inmovilizar bacterias similares como Acidithiobacillus ferrooxidans, llegando a concentraciones entre 8,0·1010 y 1,2·1012 células por gramo de soporte (Mesa et al., 2002), lo que indica que los valores alcanzados en este estudio están dentro del orden de magnitud para bacterias con cierto grado de similitud.
4.1.2.2. Inmovilización in situ
Se llevaron a cabo 11 ciclos de inmovilización con una duración total de 310 horas. El primer ciclo fue el más largo, con una duración total de 71,50 horas. La duración del resto de ciclos fue muy similar con un tiempo medio de 20 horas.
En todos los ciclos, una vez agotado el sustrato del medio de recirculación, se procedió a retirar dos unidades de espuma de poliuretano del centro del biofiltro para la determinación de la cantidad de biomasa inmovilizada, comprobándose que la inmovilización no fue tan homogénea como en los experimentos de inmovilización en matraces. En la Figura 38 tenemos una fotografía del sistema empleado para la inmovilización.
 |
En la Figura 39 aparece la cantidad de biomasa inmovilizada obtenida para cada muestra. Como se puede apreciar en la Figura, la variación en la cantidad de biomasa inmovilizada desde los primeros ciclos presenta grandes diferencias. Esto es debido a deficiencias en la distribución del medio de recirculación sobre el soporte. Al tomar muestras a una misma altura podía observarse, a simple vista, que la cantidad de biomasa inmovilizada era muy diferente de una muestra a otra, ya que, dependiendo de su posición en la sección, el área expuesta al medio de recirculación era distinta.
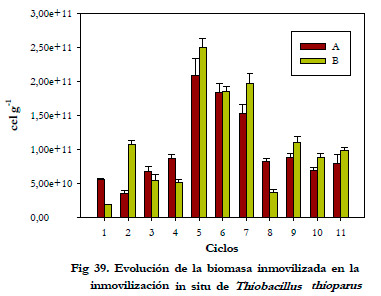 |
Por otra parte fue imposible evitar, dada las dimensiones del biofiltro, los efectos de la pared ya que una gran parte del medio de recirculación fluye pegado a ella, siendo por tanto muy diferente, una unidad de espuma situada justo en la pared del biofiltro que otra situada en el centro de la sección de éste.
Para intentar minimizar la formación de caminos preferenciales se procedió, una vez finalizado el cuarto ciclo, a inundar la columna durante una hora previamente a la reposición del medio, de esta forma se mejoró la homogenización del sistema, así como, acelerar el proceso de inmovilización. Esta inundación también se realizó en los ciclos posteriores.
En las imágenes de la Figura 40 se puede observar como la biopelícula empieza a crecer por las aristas del cubo de espuma de poliuretano en el cuarto ciclo, llegando en los últimos ciclos a cubrir la totalidad de la superficie; lo que provoca que el soporte adquiera una apariencia mucho más rígida por la formación de precipitados de azufre.

La cantidad de biomasa inmovilizada obtenida como promedio en los cuatro últimos ciclos fue de 8,19±1,29·1010 células por gramo de soporte, justamente la mitad de la inmovilización conseguida en matraces.
Mediante esta técnica de inmovilización la velocidad de consumo de sustrato no se mantuvo constante, como ocurrió en la técnica de inmovilización en matraces. El aumento de la velocidad de consumo conforme se aumenta el número de ciclos, nos permite corroborar la hipótesis realizada anteriormente sobre limitación de la transferencia de materia del oxígeno, dado que mediante la inmovilización in situ la transferencia de oxigeno desde la fase gas a la biopelícula es mucho más efectiva que en un cubo de espuma sumergido en medio, dada la baja solubilidad del oxigeno en agua.
Si calculamos las velocidades de consumo de sustrato en cada ciclo, referidas a la cantidad de soporte del lecho, se obtiene una velocidad de consumo promedio de 0,038 (g S2O3 =) (g soporte)-1 h-1, valor éste 2,7 veces superior a la velocidad de consumo alcanzada mediante la técnica de inmovilización en matraces.
En la Figura 41 está representada la velocidad de consumo para cada ciclo de inmovilización.
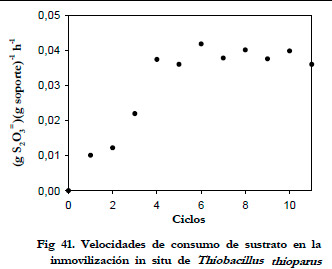
A pesar de tener en este caso la mitad de biomasa inmovilizada, la velocidad de consumo es mucho mayor, por tanto ha de suponerse que el número de bacterias viables también es mucho mayor. La siembra en placa mostró una cantidad de 1,10·1010 CFU por gramo de soporte.
Por todo ello, la velocidad de consumo de sustrato se muestra como un excelente indicador de cuándo se alcanza el máximo de bacterias inmovilizadas. En nuestros experimentos 5º ciclos hubiesen sido suficientes para pasar a la siguiente etapa de adaptación de la biopelícula, lo que supone un tiempo de inmovilización de 7 días, que podría incluso ser menor de haber realizado la inundación de la columna previa a la descarga desde el primer ciclo.
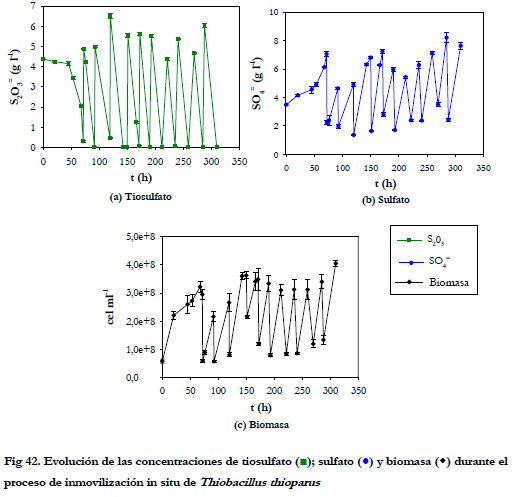
En la Figura 42, tenemos representado la evolución de las concentraciones de tiosulfato, sulfato y biomasa en suspensión frente al tiempo durante el experimento de inmovilización.
Como se puede apreciar, al finalizar cada ciclo la concentración de sustrato es prácticamente nula y la cantidad de biomasa libre se mantuvo prácticamente constante en todos los ciclos.
4.1.2.3. Adaptación de la biopelícula
En la fase de adaptación de la biopelícula, se sustituye la fuente de sustrato del medio de recirculación por el ácido sulfhídrico que lleva la corriente de aire con un caudal de 120 l h-1 y que se corresponde a un tiempo de residencia de 30 segundos. En la Figura 43, aparecen dos fotografías del sistema de generación de la corriente de aire contaminado. A la izquierda la generación de H2S y NH3 mediante reacción química y desabsorción respectivamente y a la derecha a partir de gases licuados.

El pH del medio de recirculación fue controlado entre 6,5 y 6,6, siendo el caudal de recirculación del resto nutrientes de 308 ml min-1.
La carga de alimentación inicial fue de 15,4 gS m-3h-1 durante las primeras 182 horas, llegándose a alcanzar un 82,5% de eliminación (Figura 44). La concentración de sulfato fue aumentando progresivamente hasta 5,9 g l-1. Una vez alcanzados estos valores, con objeto de reducir la velocidad de producción de sulfato y lograr una mejor adaptación de la cepa, se fijó la carga en 11,5 gS m-3h-1. Al realizar el cambio de la carga de alimentación se obtuvo un aumento del porcentaje de eliminación hasta un 98,5%, pero al cabo de 72 horas el porcentaje de eliminación de H2S disminuyó hasta el 75%, manteniéndose constante la concentración de sulfato en 8 g l-1. A las 350 horas se produce un aumento de la concentración de sulfato hasta 10,7 g l-1, que provocó una nueva disminución del porcentaje de eliminación hasta un 52%.
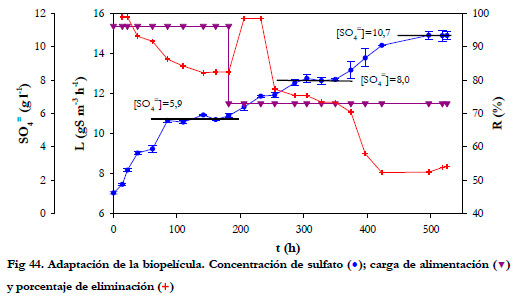
Como se puede ver la capacidad de eliminación del biofiltro esta íntimamente relacionada con la concentración de sulfato, ya que para un valor constante de la carga de alimentación se produce un aumento de la concentración de sulfato hasta un valor que permanece invariable.
En el gráfico de la Figura 44 se pueden apreciar 3 valores constantes de la concentración de sulfato de 5,9; 8,0 y 10,7 g l-1. Se observa que cuando la concentración de sulfato es constante, la eliminación de ácido sulfhídrico no cesa, en estos casos se produce la oxidación total hasta azufre elemental, como producto intermedio de la oxidación (Buisman et al., 1990).
Transcurrido cierto tiempo, la cepa se adapta a la concentración de sulfato del medio y comienza a oxidar nuevamente el H2S hasta sulfato. Conviene resaltar que a pesar de que la cepa logre oxidar el H2S a sulfato, incluso a altas concentraciones, se produce una disminución del porcentaje de eliminación del biofiltro; por ello conviene controlar la concentración de sulfato, reponiendo el medio de recirculación cuando ésta sea muy alta.
En cuanto a la concentración de biomasa en suspensión, se alcanzaron concentraciones de 2,6·109 células por mililitro a las 180 horas; y a partir de este momento, la cantidad de biomasa en suspensión baja en dos ocasiones hasta los 2,1·109 y 1,5·109 células por mililitro a las 305 y 423 horas, respectivamente (Figura 45).
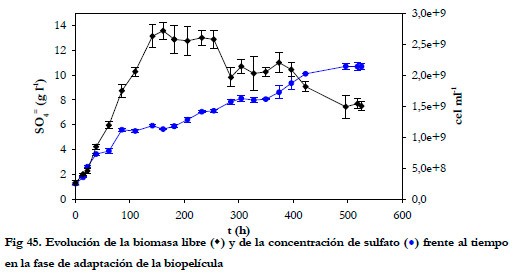
Estas tres mesetas donde la biomasa se mantiene constante coinciden con las mesetas de la concentración de sulfato. Este hecho nos sugiere la siguiente explicación para la inmovilización bacteriana: Inicialmente, las bacterias crecen en el medio en suspensión y progresivamente se van adsorbiendo sobre el soporte. Cuando la concentración de sulfato aumenta se inhibe el crecimiento en suspensión, estableciéndose un equilibrio entre las bacterias que se adhieren y las que se desprenden, fenómeno éste que provoca una estabilización de la concentración de biomasa en el medio de recirculación. Una vez que las bacterias se adaptan a la nueva concentración de sulfato, fundamentalmente las adheridas al soporte por el efecto protector que tiene la biopelícula, comienza otra fase de producción de sulfato que termina volviendo a inhibir el crecimiento bacteriano en suspensión. Este fenómeno provoca las sucesivas disminuciones de la biomasa libre en suspensión.
Tras 525 horas se sustituyó el medio por medio fresco y se comienza el estudio del efecto de las principales variables de operación.
4.1.3. Estudio del efecto de las principales variables de operación sobre la eficacia del proceso en la degradación de H2S. Determinación de las capacidades y eficacias de eliminación
4.1.3.1. Estudio del efecto del caudal de recirculación de nutrientes
Se estudiaron tres caudales de recirculación de nutrientes de 308, 182 y 64 ml min-1, que se corresponden a velocidades superficiales del líquido de 5,94; 3,50 y 1,24 m h-1, respectivamente. El tiempo de residencia del gas fue de 30 segundos, la carga de alimentación fue de 11,50 gS m-3h-1 y el pH entre 6,5 y 6,6.
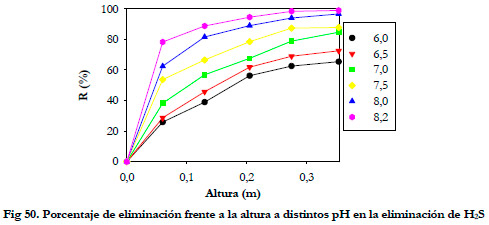
Se realizaron medidas de la concentración de H2S a lo largo del lecho del biofiltro. El biofiltro dispone a lo largo del lecho de 5 puntos de toma de muestras gaseosas a alturas de 0,060; 0,130; 0,205; 0,275 y 0,354 m.
En la Figura 46 se ha representado el porcentaje de eliminación con respecto a la altura del lecho para cada velocidad superficial del líquido y en la Figura 47 los porcentajes de eliminación alcanzados a la salida del biofiltro para cada velocidad superficial.
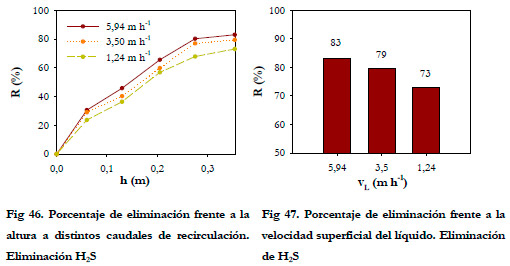
En las Figuras puede apreciarse el efecto del caudal de recirculación sobre el proceso de eliminación. Al pasar de una velocidad superficial del líquido de 5,94 a 1,24 m h-1, se produce una disminución del porcentaje de eliminación del 10%. Esta disminución se reduce al 4 % al pasar de 5,94 a 3,50 m h-1. Por tanto, no cabe esperar un aumento mucho mayor de la eliminación a mayores caudales.
Gabriel and Deshusses (2003) trabajaron con un biofiltro de escurrimiento para eliminar H2S, empleando como soporte espuma de poliuretano y una velocidad superficial de medio de recirculación de 1,7 m h-1. En estudios posteriores, ensayaron velocidades superficiales del medio de recirculación hasta 7,99 m h-1, utilizando como soporte mezcla de cubos de espuma de poliuretano y otro soporte comercial denominado TriPack (Gabriel et al., 2004).
En la bibliografía no aparecen estudios relativos al efecto del caudal en biofiltros de escurrimiento con espuma de poliuretano, aunque sí con otros soportes. En este sentido, Jin et al. (2005a) estudiaron el efecto del caudal de recirculación en un BTF relleno de anillos de propileno en un rango de 0,627 a 2,746 m h-1, siendo mayores los porcentajes de eliminación para los caudales pequeños. En nuestro caso, la superficie específica de la espuma de poliuretano es del orden de dos veces la de los anillos de propileno, 600 y 350 m2 m-3 respectivamente. Es evidente que con esta superficie específica y los caudales de recirculación ensayados, la formación de la película de líquido no juega un papel tan importante y es de suponer que, en nuestro caso el aumento de caudal mejora el contacto de las fases involucradas, facilitando el acceso de nutrientes al microorganismo.
A caudales muy altos del medio de recirculación podría disminuir el porcentaje de eliminación por un aumento de capa líquida, que llegado al límite máximo podría incluso inundar la columna.
4.1.3.2. Estudio del efecto inhibitorio de la concentración de sulfato
El efecto inhibitorio de la concentración de sulfato ha sido ya comprobado en la fase de aclimatación y adaptación de la biopelícula, sin embargo, se estimó oportuno realizar un estudio más profundo de este efecto, para poder llegar a establecer cuál es la concentración de sulfato que no se debe superar en el medio de recirculación en ningún momento, y evitar así, una drástica disminución del porcentaje de eliminación del biofiltro.
Se realizó un experimento trabajando con un tiempo de residencia del gas de 30 segundos, un caudal de recirculación de nutrientes de 308 ml min-1, una carga de alimentación de 11,5 gS m-3h-1 y un pH entre 6,5 y 6,6.
Se realizaron medidas de la concentración de H2S a distintas alturas de la columna, a medida que iba aumentando la concentración de sulfato desde 3,0 hasta 10,7 g l-1 (Figura 48).
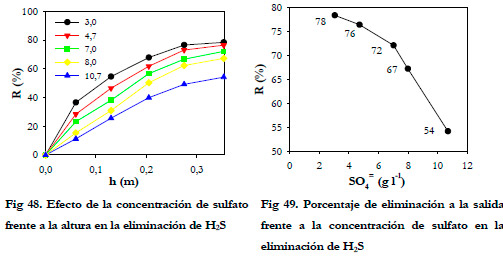
Para cada altura de lecho ensayada, se observó que el porcentaje de eliminación es mucho menor conforme aumenta la concentración de sulfato, disminuyendo a la salida del 78 al 54 % para concentraciones de sulfato de 3,0 hasta 10,7, respectivamente. (Figura 49).
A partir de 5 g l-1 se produce una drástica disminución en la eliminación; es por ello, que se recomienda mantener la concentración de sulfato siempre por debajo de los 5 g l-1. Esta recomendación es tarea fácil a valores de carga bajos, dado que la velocidad de generación de sulfato será lenta, pero es algo difícil cuando se trabaja a valores de carga superiores ya que la velocidad de generación de sulfato será muy alta.
Para controlar la concentración de sulfato se repuso el 100% del medio de recirculación. Esta técnica ha sido empleada por diversos autores. Así, en los trabajos de investigación realizados con biofiltros de escurrimiento y con distintos microorganismos a distintos pH para la eliminación de H2S, se puede observar que Tanji et al. (1989) realizaron reposiciones cuando la concentración de sulfato del medio de recirculación superaba los 5 g l-1; Koe and Yang (2000) mantuvieron, realizando reposiciones de medio fresco, una concentración de sulfato entre 2 y 5 g l-1; Jin et al. (2005a) trabajando a pH bajos, evitaron concentraciones mayores de 1,9 g l-1 y Ruokojärvi et al. (2001) y Sercu et al. (2005b), establecieron un límite más alto de 15 g l-1.
El hecho de utilizar como soporte la espuma de poliuretano representa también una ventaja con respecto al efecto inhibitorio del sulfato, ya que al tener una alta porosidad se facilita el lavado de sulfato generado, evitando así su acumulación. Shinabe et al. (2000) realizaron un estudio con varios soportes cerámicos encontrando que los soportes
macroporosos (1 mm), a pesar de tener una menor superficie específica, daban mayores capacidades de eliminación que otros microporosos de mayor superficie, y la explicación se encuentra en que éstos últimos dificultaban el lavado del sulfato generado.
4.1.3.3. Estudio del efecto del pH
El pH del medio de recirculación tiene una gran influencia en el proceso de oxidación del H2S, no sólo porque afecta a la concentración de H2S en el medio líquido, sino porque al tratarse de una degradación biológica, cada microorganismo tiene un óptimo de pH al cual se da la máxima velocidad de consumo de sustrato y por tanto de degradación.
Para la especie Thiobacillus thioparus, el pH óptimo de crecimiento en cultivo sumergido se sitúa entorno a 6,6-7,2, pero en el caso de las biopelículas, hay que tener en cuenta que el microorganismo puede estar expuesto a un pH ligeramente distinto al que se mide en el medio líquido. Además, como se ha comentado anteriormente, al pasar el H2S de la fase gas a la fase líquida, en función del pH, el ácido sulfhídrico se encontrará como H2S, HS- o S=, y los valores
de las constantes son 7,02 para el pKa1 y 11,96 para el pKa2:
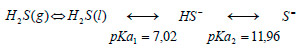
Por tanto, si estamos con un pH por debajo de 7,02 la especie mayoritaria será el H2S, entre 7,02 y 11,96 será el HS- y, por encima de 11,96, se encontrará mayoritariamente el S=.
Para estudiar el efecto del pH, se fue aumentado el valor de éste en el medio de recirculación desde 6,0 hasta 8,2. El tiempo de residencia del gas fue de 30 segundos y la carga de alimentación de 11,5 gS m-3h-1, manteniendo la concentración de sulfato por debajo de los 5 g l-1. En la Figura 50, se representa el porcentaje de eliminación para cada valor de pH del medio de recirculación en función de la altura del lecho. Como se puede apreciar la eliminación aumenta considerablemente al incrementarse el pH, incluso por encima del óptimo de crecimiento de la bacteria en cultivo sumergido.
Al eliminar el H2S de la corriente gaseosa, la eliminación se puede producir bien por absorción y/o reacción química, o por oxidación biológica por el microorganismo. Para diferenciar entre ambas eliminaciones se ha definido el término de “porcentaje de eliminación biológica (Rb)”, cuyo valor se obtiene mediante un balance de materia al sistema (ver anexo
6.1.5). De esta forma, cuando la concentración del compuesto aumenta en el medio de recirculación, el porcentaje de eliminación biológica será menor que el porcentaje de eliminación que se calcula considerando las concentraciones de entrada y salida del biofiltro. Y cuando la concentración del compuesto disminuye en el medio de recirculación, el porcentaje de eliminación biológica será mayor que el porcentaje de eliminación, pudiendo incluso ser mayor del 100% en algunos casos.
Si se representa el porcentaje de eliminación y el porcentaje de eliminación biológica con respecto al pH obtenemos el siguiente gráfico (Figura 51):
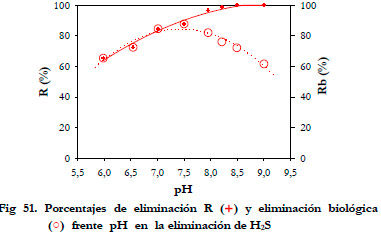
En esta Figura con cruces rojas (+) están representados los valores del porcentaje de eliminación considerando la concentración de entrada y salida de H2S. Los dos últimos experimentos a pH de 8,5 y 9,0 fueron realizados a posteriori. Si se quiere conocer la contribución exclusiva de la eliminación biológica, hay que tener en cuenta que el H2S no se esté acumulando en medio líquido de recirculación, puesto que no se trataría de una eliminación biológica sino de una eliminación por absorción. Esto es precisamente lo que ocurre para pH por encima 8,0, dado los valores de los pKa, para pH por encima de 7,02 esta favorecida la especie HS- en disolución. El ácido sulfhídrico se absorbe en el medio líquido produciéndose su acumulación en el medio, pero no se degrada biológicamente.
Para el pH de 9,0 la eliminación aparente es del 100%, pero realmente el microorganismo está degradando solo el 61,6%, quedando el porcentaje restante absorbido en el medio líquido. Se ha representado en azul la eliminación por degradación biológica (Rb), siendo el óptimo de degradación para valores de pH entre 7,0 y 7,5.