Viabilidad de un Proceso para la Eliminación conjunta de H2S Y NH3 contenido en Efluentes Gaseosos. Parte 6
 |
Martín Ramírez Muñoz TESIS DOCTORAL |
La presente Tesis ha sido co-dirigida por los Doctores D. Domingo Cantero Moreno, Catedrático de Ingeniería Química y D. José Manuel Gómez Montes de Oca, Profesor Titular de Ingeniería Química de la Universidad de Cádiz, y cumple los requisitos exigidos por la legislación vigente.
Fdo.: Dr. D. Domingo Cantero Moreno Fdo.: Dr. D. José Manuel Gómez Montes de Oca
Fdo.: Dr. D. José María Quiroga Alonso
Director del Dpto. de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente
Universidad de Cádiz
3. MATERIAL Y MÉTODOS
3.1. ELIMINACIÓN DE ÁCIDO SULFHÍDRICO EN AIRE MEDIANTE Thiobacillus thioparus INMOVILIZADO EN UN BIOFILTRO DE ESCURRIMIENTO EMPAQUETADO CON ESPUMA DE POLIURETANO
3.1.1. Microorganismo
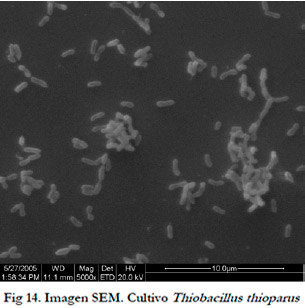
Para llevar a cabo la oxidación biológica del ácido sulfhídrico se empleó la cepa Thiobacillus thioparus (ATCC 23645). Thiobacilus thioparus pertenece al reino Eurobacterium y a la familia Thiobacillaceae. Morfológicamente es una bacteria en forma de barra fina acortada con un tamaño entre 0,5 y 1,0-3,0 μm (Figura 14). Posee un flagelo polar que le da motilidad y a veces se disponen en pares y/o cadenas cortas.
 |
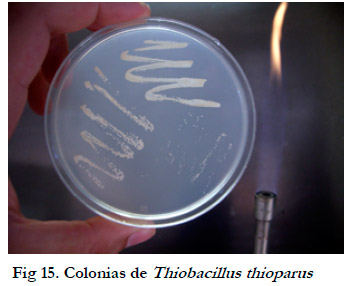
Las colonias en medio agar-tiosulfato son pequeñas (menos de 0,5 mm de diámetro), de forma circular, con elevación convexa y amarillas debido a la precipitación de azufre, siendo opacas en el centro al cabo de una larga incubación (Figura 15).
 |
Es una bacteria estrictamente aerobia y autótrofa. Obtiene la energía de la oxidación de tiosulfato a sulfato, aunque también oxida o reduce parcialmente otros compuestos de azufre, incluyendo el ácido sulfhídrico (H2S), metil mercaptano (CH3SH; MM), dimetil sulfuro ((CH3)2S; DMS), dimetil disulfuro ((CH3)2S2; DMDS), disulfuro de carbono (CS2) y azufre elemental. Su hábitat es el fango, suelo, canales de agua y otras fuentes de agua dulce, encontrándose extensamente distribuida.
El óptimo de temperatura es de 28ºC y el óptimo de pH es entre 6,6-7,2, aunque ocurre crecimiento entre pH 4,5-7,8 (Brenner et al., 2006).
3.1.2. Medio de cultivo
La composición del medio de crecimiento empleado para el crecimiento de la cepa fue el recomendado por la ATCC (Medio ATCC 290: S6 medium for Thiobacillus). La composición en gramos por litro es: 1,2 g de Na2HPO4, 1,4 g de KH2PO4, 0,1 g de MgSO4·7H2O, 0,1 g de (NH4)2SO4, 0,03 g de CaCl2, 0,02 g de FeCl3, 0,02 g de MnSO4 y 10,0 g de Na2S2O3.
Se disolvieron todos los compuestos menos el FeCl3, que se esterilizó por filtración, añadiéndose al medio esterilizado en autoclave (121 ºC, 20 min). El pH final del medio se ajustó a 7,0 mediante la adición de NaOH, conservándose en oscuridad a 4ºC.
3.1.3. Procedimiento de propagación y conservación
La cepa se conservó en tubos inclinados con medio sólido (composición del medio sólido igual al medio ATCC 290 con un 1,5% p/v de agar-agar). A los 4-5 días de incubación, una vez se observen las colonias, se pasa a conservar los tubos a 4ºC, realizando traspasos de las cepas a otros tubuos inclinados cada seis meses.
Para la conservación de la cepa en medio líquido es necesario realizar un traspaso líquidolíquido semanalmente. Se utilizaron erlenmeyers de 250 ml con 100 ml de medio ATCC 290 inoculado al 5% y mantenido en agitador incubador (Gerhardt Thermoshake THO5/THL5) a 30ºC y 150 rpm.
Para escalar la cepa desde los tubos inclinados, se inoculó con asa de siembra 10 ml de medio ATCC 290 incubando a 30ºC durante 48 horas; al cabo de este tiempo se utilizó como inóculo de 90 ml de medio fresco, incubando el cultivo en incubador agitador a 150 rpm y 30ºC.
Se puede apreciar crecimiento a simple vista por la formación de azufre elemental, que vuelve el cultivo color amarillo pálido. Al dejarlo en reposo se aprecia el azufre sólido en el fondo.
3.1.4. Cinética de crecimiento
Se realizó la inoculación de 95 ml de medio ATCC 290 con 5 ml procedentes de un cultivo de 10 ml sembrado a partir de un tubo inclinado e incubado 48h a 30ºC. Se incubó en agitador incubador a 30ºC y 150 rpm. Los parámetros medidos para el estudio de la cinética de crecimiento fueron: biomasa total, concentración de sustrato (tiosulfato), concentración de producto (sulfato) y pH. Para obtener el azufre elemental se realizó un balance de materia al sistema.
3.1.5. Características del soporte
El material utilizado como soporte para la bacteria fue espuma de poliuretano. La espuma de poliuretano empleada tiene una densidad 20 kg/m3 y una porosidad del 96%. Se utilizaron cubos de 1 cm3 obtenidos a partir de una plancha de espuma de 1 cm de espesor (Figura 16).
La superficie específica de la espuma de poliuretano es de 600 m2m-3 (Devinny et al., 1999).
 |
3.1.6. Desarrollo y adaptación de biopelículas
Para crear la biopelícula de Thiobacillus thioparus se van a utilizar dos técnicas, la primera de ellas se realizará en matraces mediante la inmersión del soporte en un cultivo sumergido (inmovilización en matraces), y la segunda se realizará en la misma columna que se va a utilizar como biofiltro de escurrimiento (inmovilización in situ). La técnica de inmovilización en matraces nos permitirá conocer la capacidad máxima de adhesión al soporte, para poder comparar con la técnica in situ, la cual es mucho más fácil de emplear a la hora de un escalamiento.
3.1.6.1. Inmovilización en matraces
Para colonizar la espuma de poliuretano se realizó la inmersión del soporte en un cultivo con Thiobacillus thioparus (ATCC 23645). Se emplearon tres matraces erlenmeyers de un litro, conteniendo cada uno: 500 ml de medio ATCC 290, 100 ml de inóculo y 3,5 g de unidades de soporte de 1 cm3. El inóculo fue obtenido de un cultivo en fase exponencial crecido según la técnica de conservación mediante traspasos líquido-líquido.
Los matraces fueron incubados en un incubador agitador a 150 rpm y 30ºC. El parámetro seguido durante la inmovilización fue la concentración de sustrato; una vez que la concentración de sustrato disminuyó hasta un valor próximo a 1 g l-1, se reemplazó el medio líquido por medio nuevo (600 ml), realizando previamente el recuento de la biomasa total inmovilizada en el soporte. En el segundo y sucesivos ciclos, se utilizó como inóculo la propia biomasa inmovilizada en el soporte. Se realizaron varios ciclos consecutivos hasta que la cantidad de biomasa inmovilizada en el soporte fue constante.
3.1.6.2. Inmovilización in situ
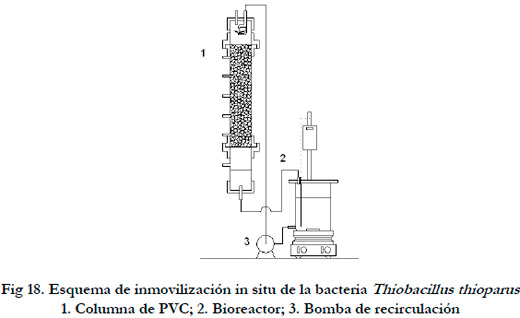
Para formar la biopelícula se utilizó la misma columna que se va a emplear como biofiltro de escurrimiento. Se trata de una columna de PVC transparente de 63 mm de diámetro externo, 1,5 mm de espesor y una altura útil de 320 mm. En ambos extremos se dispusieron dos bridas roscadas de PVC, en la brida inferior se colocó un disco de silicona (espesor 3 mm y perforaciones de 3 mm de diámetro) para soportar el soporte. En la parte superior se coloco un sistema de distribución del líquido que permitió una adecuada distribución de éste (Figura 17) para tener una buena dispersión del medio líquido.
 |
Para el relleno se emplearon un total de 10 g de espuma de poliuretano de 1 cm3 teniendo un volumen inicial empaquetado de 1 litro. La columna fue alimentada por cabeza con un cultivo de Thiobacillus thioparus crecido utilizando Medio ATCC 290 en un bioreactor de 1 litro con control de temperatura a 30ºC (Heildoph EKT 3001) y agitado a 200 rpm (Agitador Selecta Agimatic-N). El caudal de recirculación fue suministrado por una bomba EHEIM 1046 con un valor fijo de 308 ml min-1 que corresponde a una velocidad superficial de 5,94 m h-1.
Mediante la percolación del lecho empaquetado con el soporte, se realizó la adhesión de las bacterias al soporte con la consiguiente formación de la biopelícula. Dada la baja velocidad especifica de crecimiento, para evitar que se produzca el lavado de la población, se recirculó la corriente de salida del biofiltro al bioreactor. Antes de llegar al agotamiento del sustrato principal, se repuso el medio del bioreactor con medio fresco, dejando en el primer ciclo un 10% como inóculo y retirando la totalidad del medio en los siguientes. De esta forma se garantizó la presencia de bacterias para la formación de la biopelícula. En la Figura 18 se presenta un esquema del sistema empleado.
 |
Se realizaron medidas diarias del pH, concentración de tiosulfato, concentración de sulfato y biomasa en suspensión. La biomasa total inmovilizada fue medida al final de cada ciclo de reposición de medio mediante la extracción de unidades de soporte de la columna. Se realizaron ciclos consecutivos hasta alcanzar una cantidad de biomasa total constante en el soporte.
Una vez conseguida la máxima inmovilización de biomasa, la siguiente fase fue la adaptación de la biopelícula al ácido sulfhídrico. Para adaptar la biopelícula, se cambió el medio de recirculación por un medio formulado de forma idéntica al ATCC 290, pero sin la fuente de sustrato (tiosulfato), iniciando al mismo tiempo la alimentación de H2S en aire. El caudal de aire empleado fue de 120 l h-1 y la concentración de H2S de entrada de 100 ppmv.Para la generación de la corriente de aire con H2S se utilizó el sistema descrito en el apartado 3.1.7.1 de esta Memoria.
3.1.7. Sistema experimental de eliminación de ácido sulfhídrico
El sistema experimental utilizado para la eliminación del ácido sulfhídrico se encuentra representado en la Figura 19. En este sistema, se pueden distinguir claramente tres zonas:
- Generación de la corriente de entrada.
- Biofiltro de escurrimiento.
- Equipos de control y medición.
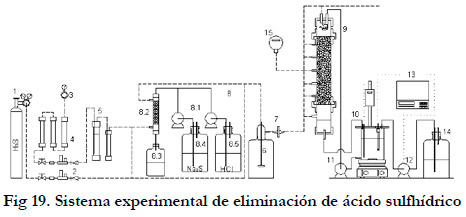 |
1. Botella gas licuado (H2S/aire sintético); 2. Controladores flujo másico; 3. Mano-reductor de aire; 4. Prefiltros de aire; 5. Humidificador y trampa de agua; 6. Depósito de expansión; 7. Filtro de aire; 8. Sistema de generación por reacción química; 8.1 Bombas peristálticas; 8.2. Columna PVC rellena de bolas de vidrio; 8.3. Depósito de recogida de los productos de reacción; 8.4. Depósito Na2S; 8.5. Depósito de HCl; 9. Biofiltro de escurrimiento; 10. Bioreactor; 11. Bomba de recirculación de nutrientes; 12. Bomba de adición de base; 13. Biocontroller; 14. Depósito de NaHCO3; 15. Sensor H2S.
3.1.7.1. Generación de la corriente de entrada
Para generar la corriente de entrada se dispone de dos metodologías. La primera de ellas, consiste en la utilización de una botella de gases licuados para bajas concentraciones o aquellos casos en los que se necesita una concentración exacta y constante del compuesto. La segunda consiste en la generación a partir de la reacción química entre el HCl y el Na2S, sistema que se utilizó para altas concentraciones o cuando no era necesario tener una concentración exactamente conocida a la entrada.
Para el primer sistema se utilizó una botella de 50 litros a 150 bar de composición: 0,5% H2S, 21% O2 y resto N2 (suministrador Air-Liquide). Esta corriente concentrada (5000 ppmv) se diluye con aire para obtener la concentración y el caudal deseado.
El aire procede de un compresor industrial (línea de gases centralizados de la UCA). Para acondicionar el aire de entrada al sistema se realizó una prefiltración con los siguientes filtros (Φ=32 mm, altura relleno=30 mm):
- Sílica gel: Eliminar posibles restos de humedad.
- Carbón activo: Eliminar posibles restos de aceite.
- Lana de vidrio: Eliminar partículas en suspensión de filtros anteriores.
Los caudales de cada corriente son controlados por controladores de flujo másico (Bronkhorst F-201C):
- Rango de caudal controlador flujo de Aire industrial: 0 a 5 lN/min.
- Rango de caudal controlador Aire sintético/H2S: 0 a 30 lN/h.
Previamente a la mezcla de ambas corrientes, se realizó la humidificación de la corriente de aire en un humidificador (Φ=63 mm, altura de agua= 40 mm). Se utilizó un difusor de aire para aumentar la transferencia y se dispuso una trampa de agua a la salida del humidificador.
Una vez mezcladas ambas corrientes para lograr una mejor homogenización a la entrada, se pasó la corriente resultante a un depósito de expansión de 2,5 l. Por último, se utilizó un filtro de 0,45 μm para esterilizar la corriente de entrada al biofiltro (Millipore Filter SLG05010).
El sistema anteriormente descrito lo podemos ver en la Figura 20.
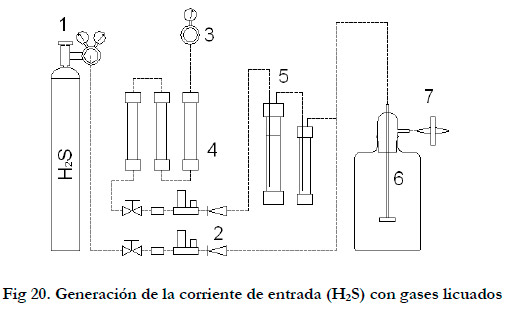 |
1. Botella gas licuado (H2S/aire sintético); 2. Controladores flujo másico; 3. Mano-reductor de aire; 4. Prefiltros de aire; 5. Humidificador y trampa de agua; 6. Depósito de expansión; 7. Filtro de aire.
Para la generación por el segundo sistema, se sustituyó la botella de gas licuado por una columna de PVC transparente de 63 mm de diámetro, empacada de esferas de vidrio de 5 mm de diámetro hasta una altura de 25 mm (Figura 21). Por cabeza de columna se gotearon dos soluciones; una de HCl y otra de Na2S pasando el aire en contracorriente. En el lecho se produce la siguiente reacción:
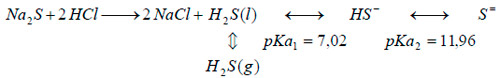 |
El ácido sulfhídrico formado es arrastrado por la corriente de aire. Se prepararon las soluciones de forma que el HCl estuviese en exceso para favorecer la formación de H2S gaseoso. El producto de reacción (disolución ácida salina) fue recogido en un depósito situado debajo de la columna.
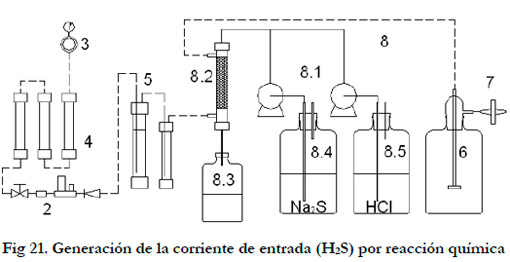 |
2. Controlador flujo másico; 3. Mano-reductor aire; 4. Prefiltros de aire; 5. Humidificador y trampa de agua; 6. Depósito de expansión; 7. Filtro de aire; 8. Sistema de generación por reacción química; 8.1 Bombas peristálticas; 8.2. Columna PVC rellena de bolas de vidrio; 8.3. Depósito recogida de los productos de reacción; 8.4. Depósito Na2S; 8.5. Depósito de HCl.
3.1.7.2. Biofiltro de escurrimiento
Como se ha descrito en el apartado de inmovilización, el biofiltro de escurrimiento es la misma columna en la que se realiza la etapa de inmovilización y adaptación de la biopelícula.
3.1.7.3. Equipos de control y medición
Para el control del pH, así como del caudal de las bombas, se empleó un controlador (BioController ADI 1030 de Applikon). Dadas las características del medio, se utilizó un electrodo con diafragma esmerilado (CRISON 5221) recomendado para muestras difíciles y con presencia de sulfuros.
La temperatura de trabajo se mantuvo constante a 30ºC mediante el calentamiento del medio de recirculación. Dado el alto caudal de recirculación del medio líquido se logró mantener la temperatura dentro del lecho del biofiltro.
Para medir la concentración de ácido sulfhídrico se utilizó un sensor específico de la marca Crowcon (Modelo GASFLAG, TXGARD-IS).
3.1.8. Estudio de la influencia de las principales variables de operación sobre la eficacia del proceso en la degradación de H2S. Determinación de las capacidades y eficacias de eliminación
Concretamente, se estudio el efecto del caudal de recirculación de nutrientes, los efectos inhibitorios de la concentración de sulfato, el efecto del pH, de la carga de alimentación y del tiempo de residencia sobre la capacidad de degradación del biofiltro.
3.1.8.1. Estudio del efecto del caudal de recirculación de nutrientes
Para estudiar el efecto del caudal de recirculación sobre la eficacia de eliminación, se ensayaron tres caudales de 308, 182 y 64 ml min-1, respectivamente, que se corresponden con valores de la velocidad superficial del líquido de 5,94; 3,50 y 1,24 m h-1. El ensayo se realizó a un tiempo de residencia del gas de 30 segundos, una carga de alimentación de 11,50 gS m-3h-1 y un pH de 6,5.
Las medidas de la concentración de H2S se realizaron a distintas alturas de la columna; 0,060, 0,130, 0,205, 0,275 y 0,354 m.
3.1.8.2. Estudio del efecto inhibitorio de la concentración de sulfato
Para estudiar el efecto inhibitorio de la concentración de sulfato en el medio de recirculación, se estudió la disminución de la eficacia de eliminación en un rango de concentraciones desde 3 hasta 10 g l-1 de sulfato. Los experimentos se realizaron con un tiempo de residencia del gas de 30 segundos, un caudal de recirculación de 308 ml min-1, una carga de alimentación de 11,50 gS m-3h-1 y un pH de 6,5.
3.1.8.3. Estudio del efecto del pH
Para estudiar el efecto del pH sobre la eficacia de eliminación se fue cambiando el pH del medio de recirculación abarcando un rango desde 6,2 hasta 8,2. Los experimentos se realizaron con un tiempo de residencia del gas de 30 segundos, un caudal de recirculación de 308 ml min-1, una carga de alimentación de 11,5 gS m-3h-1 y una concentración de sulfato por debajo de 5 g l-1.
3.1.8.4.Estudio del efecto de la carga de alimentación
El estudio de la carga de alimentación se realizó en un rango desde cero hasta 55 gS m-3h-1. Para minimizar los efectos derivados de la transferencia de materia, se trabajó con un tiempo de residencia de 150 segundos para poder determinar el máximo de degradación biológica. La concentración de sulfato se mantuvo por debajo de 5 g l-1, el pH entre 7,1 y 7,2 y el caudal de recirculación fue de 308 ml min-1.
3.1.8.5. Estudio del efecto del tiempo de residencia
El estudio del efecto del tiempo de residencia se llevó a cabo para dos valores de carga de alimentación de 11,50 y 2,90 gS m-3h-1 y distintos valores del tiempo de residencia del gas de 150, 120, 90, 60, 30, 20 y 11 segundos. El caudal de recirculación fue de 308 ml min-1 y el pH se mantuvo en un rango entre 7,1 y 7,2.
3.1.8.6.Estudio del efecto de la pérdida de carga
El estudio del efecto de la pérdida de carga se llevo a cabo con tiempos de residencia del gas de 150, 120, 90, 60, 30, 20 y 11 segundos con el soporte sin colonizar, y una vez establecida la biopelícula con un caudal de recirculación del medio líquido de 308 ml min-1.
3.2. ELIMINACIÓN DE AMONIACO EN AIRE MEDIANTE Nitrosomonas europaea INMOVILIZADA EN UN BIOFILTRO DE ESCURRIMIENTO EMPAQUETADO CON ESPUMA DE POLIURETANO
3.2.1. Microorganismo
Para llevar a cabo la oxidación biológica del amoniaco se empleó la cepa Nitrosomonas europaea (ATCC 19718). Nitrosomonas europaea pertenece al reino Eurobacterium y a la familia Nitrobacteraceae. La familia Nitrobacteraceae está compuesta de las bacterias oxidantes de amonio a nitrito fijando dióxido de carbono de la atmósfera como fuente de carbono (Prosser 1989; Stein and Arp 1998a). Todas las bacterias de este grupo son gram-negativas y quimiolitoautotrófica. Nitrosomonas europaea es una bacteria que se aísla frecuentemente, pero no se trata de la bacteria amonio oxidante mas frecuente en el medio ambiente. Hay evidencias que la especie Nitrosolobus es la especie amonio oxidante mas abundante en suelos, Nitrospira en los suelos ácidos y Nitrosococcus en el medio marino (Prosser 1989). En la mayoría de los estudios realizados con bacterias amonio oxidantes se han utilizando bacterias de tipo Nitrosomonas europaea, esto se debe posiblemente a que crece mas rápidamente que otras bacterias de la misma familia.
En su metabolismo interfieren dos tipos de enzimas. La amonio monoxigenasa (AMO) que cataliza la oxidación de amonio (NH3) a hidroxilamina (NH2OH) y la oxidoreductasa que oxida a hidroxilamina a nitrito (NO2 -). Hasta hace poco tiempo se pensaba que su crecimiento no era posible en presencia única de hidroxilamina, sin embargo De Bruijn et al. (1995) han logrado oxidar hidroxilamina en condiciones anaerobias, siendo el nitrito el aceptor de electrones.
Morfológicamente la familia Nitrobacteraceae puede ser muy variada, siendo la bacteria Nitrosomonas europaea de forma redondeada con un tamaño entre 0,8-0,9 hasta 1,0-2,0 mm (Figura 22). Posee de uno a dos flagelos, que le dan movilidad, de un tamaño de 3 a 4 veces su longitud.
 |
Puede sobrevivir en un pH entre 6,0 y 9,0, siendo el óptimo entre 7,5-8,0. La temperatura óptima de crecimiento está en el rango de 25 a 30ºC. Se trata de una bacteria fotosensible por lo que ha de crecer en oscuridad.
En la naturaleza se encuentra en lugares como el suelo, aguas residuales, agua fresca y en las paredes de los edificios, especialmente en áreas muy contaminadas con altos niveles de compuestos nitrogenados.
3.2.2. Medio de cultivo
La composición del medio de crecimiento empleado para el crecimiento de la cepa fue el recomendado por la ATCC (Medio ATCC #2265). Para la preparación del medio se necesitan 3 soluciones:
Solución 1: 4,95 g de (NH4)2SO4 (para 50 mM NH4 +), 0,2 g de KH2PO4, 0,27 g de MgSO4·7H2O, 0,04 g de CaCl2, 0,5 ml de FeSO4 (30 mM en 50 mM EDTA a pH 7,0), 0,2 mg de CuSO4·5H2O en 1,2 litros de agua destilada.
Solución 2: 8,2 g de KH2PO4, 0,7 de NaH2PO4 en 0,3 litros de agua destilada (pH 8,0 con NaOH 10N).
Solución 3 (buffer): 0,6 g de Na2CO3 en 12 ml de agua destilada.
Las 3 soluciones son esterilizadas en autoclave a 121ºC durante 20 minutos y mezcladas una vez enfriadas a temperatura ambiente.
3.2.3. Procedimiento de propagación y conservación de la cepa
A partir del cultivo stock de la ATCC (1ml) se realizó la propagación mediante el procedimiento recomendado por esta organización, hasta tener un volumen final en una primera etapa de 10 ml. Este cultivo se utilizó para inocular 90 ml de medio ATCC #2265 en un erlenmeyer de 250 ml, realizando la incubación durante un periodo de 7 días a 30ºC, 150 rpm y en un agitador incubador. Una vez crecido, se centrifugó a 15000 rpm y 4ºC durante 15 minutos. El pellet obtenido fue resuspendido en 5 ml de medio ATCC #2265 y dispensado en 5 recipientes eppendorf de 1,5 ml, para su posterior conservación a -80ºC.
Para la conservación de la cepa en medio líquido es necesario realizar un traspaso líquidolíquido semanalmente. Se utilizaron erlenmeyers de 250 ml con 100 ml de medio ATCC #2265 inoculado al 10% y mantenido en agitador incubador (Gerhardt Thermoshake THO5/THL5) a 30ºC, 150 rpm y en oscuridad.
Para escalar la cepa desde los eppendorf se siguió el mismo procedimiento que el recomendado por la ATCC.
3.2.4. Cinética de crecimiento
Se realizó la inoculación de 100 ml de medio ATCC #2265 con 2 ml de inóculo. Para preparar el inóculo se realizó la centrifugación (4ºC, 15000 rpm y 15 min) de un cultivo de 100 ml resuspendiendo el pellet en 5 ml de medio.
El cultivo se incubó en agitador incubador a 30ºC, 150 rpm y en oscuridad. Los parámetros medidos para el estudio de la cinética de crecimiento fueron: biomasa total, concentración de sustrato (amoniaco), concentración de producto (nitrito) y pH.
3.2.5. Características del soporte
El soporte utilizado fue el mismo que el empleado para la inmovilización de Thiobacillus thioparus.
3.2.6. Desarrollo y adaptación de biopelículas
Para crear la biopelícula de Nitrosomonas europaea se emplearon las mismas técnicas que las utilizadas para crear la biopelícula de Thiobacillus thioparus.
3.2.6.1. Inmovilización en matraces
Para colonizar la espuma de poliuretano se realizó la inmersión del soporte en un cultivo con Nitrosomonas europaea (ATCC 19718). Se emplearon 2 matraces erlenmeyers de un litro conteniendo cada uno: 500 ml de medio ATCC #2265, 100 ml de inóculo y 3,5 g de unidades de soporte de 1 cm3. El inóculo fue obtenido de un cultivo en fase exponencial crecido según la técnica de conservación mediante traspasos líquido-líquido.
Ambos matraces fueron incubados en un incubador agitador a 150 rpm, 30ºC y en oscuridad. El pH, concentración de amoniaco (sustrato) y concentración de nitrito (producto) fueron medidos diariamente. Antes de que el pH bajase de 6,0, se procedió a reemplazar el medio líquido por medio nuevo (600 ml), realizando previamente el recuento de las biomasa total inmovilizada en el soporte. En el segundo y sucesivos ciclos, se utilizó como inóculo la propia biomasa inmovilizada en el soporte. Se realizaron varios ciclos consecutivos hasta que la cantidad de biomasa inmovilizada en el soporte fue constante.
3.2.6.2. Inmovilización in situ
Para formar la biopelícula se empleó el mismo procedimiento que el empleado para la inmovilización de Thiobacillus thioparus. La columna utilizada fue idéntica, con la misma cantidad de soporte pero en ausencia de luz. La columna fue alimentada por cabeza con un cultivo de Nitrosomonas europaea crecido utilizando Medio ATCC #2265 en un bioreactor de 1 litro con control de temperatura a 30ºC (Heildoph EKT 3001), agitado a 200 rpm (Agitador Selecta Agimatic-N) y en oscuridad. El caudal de recirculación fue suministrado por dos bombas EHEIM 1046 conectadas en serie, siendo el caudal alimentado de 445 ml min-1 que se corresponde a una velocidad superficial de 8,57 m h-1. En la Figura 23 se presenta un esquema del sistema empleado.
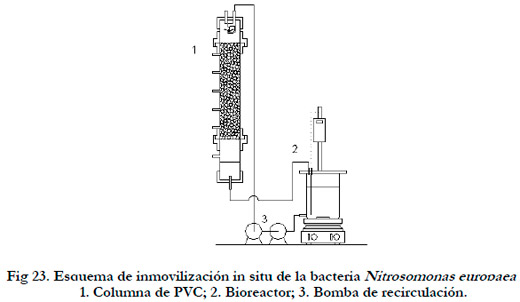 |
Se realizaron medidas diarias del pH, concentración de amoniaco, concentración de nitrito y biomasa en suspensión. La biomasa total inmovilizada fue medida al final de cada ciclo de reposición de medio, mediante la extracción de unidades de soporte de la columna a distintas alturas. Se realizaron ciclos consecutivos hasta alcanzar una cantidad de biomasa total inmovilizada constante en el soporte.
Una vez conseguida la máxima inmovilización de biomasa la siguiente fase fue laadaptación de la biopelícula al amoniaco. Para adaptar la biopelícula, se cambió el medio de recirculación por un medio formulado de forma idéntica al ATCC #2265, pero sin la fuente de sustrato (amoniaco), iniciando al mismo tiempo la alimentación de NH3 en aire. El caudal de aire empleado fue de 120 l h-1 y la concentración de NH3 de 50 ppmv.
Para la generación de la corriente de aire con NH3 se utilizó el sistema descrito en el apartado 3.2.7.1.
3.2.7. Sistema experimental de eliminación de amoniaco
El sistema experimental fue muy similar al sistema de eliminación de ácido sulfhídrico, donde igualmente se pueden diferenciar tres partes (Figura 24):
- Generación de la corriente de entrada.
- Biofiltro de escurrimiento.
- Equipos de control y medición.
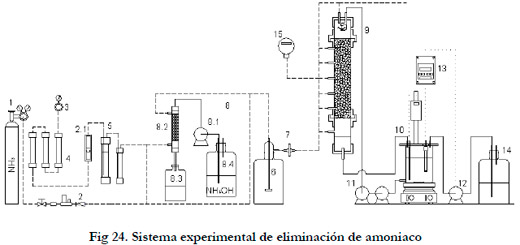 |
1. Botella gas licuado (NH3/aire sintético); 2. Controlador flujo másico; 2.1 Rotámetro 3. Mano-reductor de aire; 4. Prefiltros de aire; 5. Humidificador y trampa de agua; 6. Depósito de expansión; 7. Filtro de aire; 8. Sistema de generación por reacción química; 8.1 Bomba peristáltica; 8.2. Columna PVC rellena de bolas de vidrio; 8.3. Depósito de recogida; 8.4. Depósito de NH4OH; 9. Biofiltro de escurrimiento; 10. Bioreactor; 11. Bombas de recirculación de nutrientes; 12. Bomba de adición de base; 13. Controlador de pH; 14. Depósito de NaHCO3; 15. Sensor NH3.
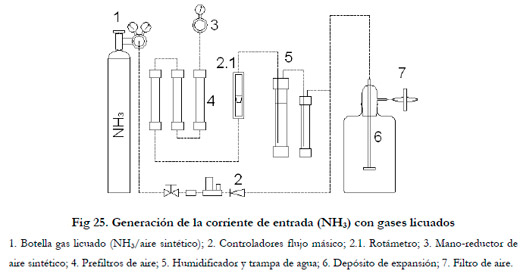
3.2.7.1. Generación de la corriente de entrada
Para generar la corriente de entrada se dispone de dos metodologías. La primera de ellas consiste en la utilización de una botella de gases licuados para bajas concentraciones y el segundo sistema a partir de la desorción física de NH3, de una solución de NH4OH para altas concentraciones.
Mediante la primera de las metodologías se utilizó una botella de 50 litros a 150 bar, de composición: 0,1% NH3, 21% O2 y resto N2, (suministrador Air-Liquide). Esta corriente concentrada (1000 ppmv) se diluye con aire para obtener la concentración y el caudal deseado.
El aire, al igual que el sistema de prefiltración, es el mismo que el utilizado en la eliminación de H2S.
El caudal de la corriente de aire se regula por medio de un rotámetro (Brooks instrument BV:
rango: 0 a 150 lN h-1), y el caudal de la corriente NH3/aire sintético de la botella de gas licuado se regula por medio un un controlador de flujo másico (Bronkhorst F-201C: rango de 0 a 30 lN h-1).
Previamente a la mezcla de ambas corrientes se realiza la humidificación de la corriente de aire en un humidificador (Φ=63 mm, altura de agua= 40 mm). Se utilizó un difusor de aire para aumentar la transferencia y se dispuso una trampa de agua a la salida del humidificador.
Una vez mezcladas ambas corrientes, la corriente resultante pasa a un depósito de expansión de 2,5 l. Por último, se utilizó un filtro de 0,45 μm para esterilizar la corriente de entrada al biofiltro (Millipore Filter SLG05010).
El sistema anteriormente descrito lo podemos ver en la Figura 25.
 |
Para la generación por la segunda metodología, se sustituyó la botella de gas licuado por una columna de PVC transparente de 63 mm de diámetro, empacada de esferas de vidrio de 5 mm de diámetro hasta una altura de 25 mm (Figura 26). Por cabeza de columna se hizo gotear una solución de NH4OH pasando el aire en contracorriente. En el lecho se produce la desabsorción física (pKa 9,259 a 25ºC):
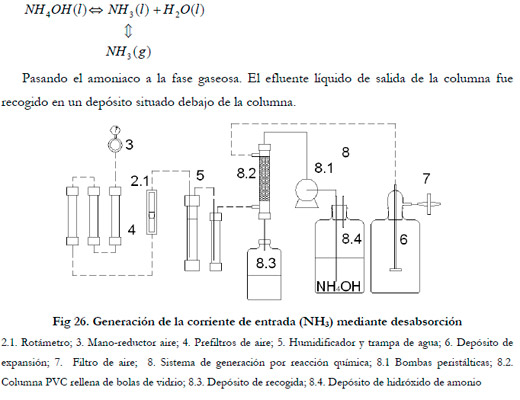 |
3.2.7.2. Biofiltro de escurrimiento
Como se ha descrito en el apartado de inmovilización, el biofiltro de escurrimiento es la misma columna en la que se realiza la etapa de inmovilización y adaptación de la biopelícula.
3.2.7.3. Equipos de control y medición
Para el control del pH, se utilizó el controlador de pH (CRISON PH28). Dadas las características del medio se utilizó un electrodo con diafragma esmerilado (CRISON 5221) recomendado para muestras difíciles y con presencia de sulfuros.
El mismo controlador (BioController ADI 1030 de Applikon) fue empleado para regular el caudal de la bomba que suministra la disolución de NH4OH para la generación de NH3.
La temperatura de trabajo se mantuvo constante a 30ºC mediante el calentamiento del medio de recirculación a esta temperatura.
Para medir la concentración de ácido sulfhídrico se utilizó un sensor específico de la marca Crowcon (Modelo GASFLAG, TXGARD-IS).
3.2.8. Estudio de la influencia de las principales variables de operación sobre la eficacia de degradación de NH3. Determinación de las capacidades y eficacias de eliminación
En este apartado, se estudió el efecto del caudal de recirculación de nutrientes, el efecto de la concentración de nitrito, del pH, de la carga de alimentación y del tiempo de residencia sobre la capacidad de degradación del biofiltro.
3.2.8.1. Estudio del efecto del caudal de recirculación de nutrientes
Para estudiar el efecto del caudal de recirculación sobre la eficacia de eliminación se emplearon tres caudales de 445, 237 y 83 ml min-1, que se corresponden a velocidades superficiales del líquido de 8,57; 4,55 y 1,59 m h-1, respectivamente. El ensayo se realizó a un tiempo de residencia del gas de 30 segundos, una carga de alimentación de 6,38 gN m-3h-1 y un pH entre 7,5 y 7,6.
3.2.8.2. Estudio del efecto de la concentración de nitrito
Para estudiar el efecto de la concentración de nitrito en el medio, se observó la evolución de la eficacia de eliminación al aumentar la concentración de nitrito en el medio de recirculación. Los experimentos se realizaron con un tiempo de residencia del gas de 30 segundos, un caudal de recirculación de 445 ml min-1, una carga de alimentación de 6,76 gN m- 3h-1 y un pH entre 7,5 y 7,6.
3.2.8.3. Estudio del efecto del pH
Para estudiar el efecto del pH sobre la eficacia de eliminación se fue cambiando el pH del medio de recirculación abarcando un rango desde 6,5 hasta 8,1. Los experimentos se realizaron con un tiempo de residencia del gas de 30 segundos, un caudal de recirculación de 445 ml min-1, una carga de alimentación de 6,76 gS m-3h-1 y una concentración de nitrito por debajo de 150 mM.
3.2.8.4. Estudio del efecto de la carga de alimentación
El estudio de la carga de alimentación se realizó en un rango desde cero hasta 21,7 gN m¯3h¯1. Para minimizar los fenómenos de limitación por la transferencia de materia, se trabajó con un tiempo de residencia de 150 segundos para poder determinar el máximo de degradación biológica. La concentración de nitrito se mantuvo por debajo de 150 mM, el pH se mantuvo entre 7,5 y 7,6 y el caudal de recirculación de nutrientes fue de 445 ml min-1.
3.2.8.5. Estudio del efecto del tiempo de residencia
El estudio del efecto del tiempo de residencia se llevó a cabo con una carga de alimentación de 8,0 gN m-3h-1, para tiempos de residencia del gas de 150, 100, 50, 25, 20, 11 y 5 segundos. El caudal de recirculación fue de 445 ml min-1 y el pH se mantuvo en un rango entre 7,5 y 7,6.
3.2.8.6.Estudio del efecto de la pérdida de carga
El estudio del efecto de la pérdida de carga se llevo a cabo con tiempos de residencia del gas de 150, 100, 50, 25, 20, 11 y 5 segundos con el soporte sin colonizar, y una vez establecida la biopelícula con un caudal de recirculación del medio líquido de 345 ml min-1.