Viabilidad de un Proceso para la Eliminación conjunta de H2S Y NH3 contenido en Efluentes Gaseosos. Parte 5
 |
Martín Ramírez Muñoz TESIS DOCTORAL |
La presente Tesis ha sido co-dirigida por los Doctores D. Domingo Cantero Moreno, Catedrático de Ingeniería Química y D. José Manuel Gómez Montes de Oca, Profesor Titular de Ingeniería Química de la Universidad de Cádiz, y cumple los requisitos exigidos por la legislación vigente.
Fdo.: Dr. D. Domingo Cantero Moreno Fdo.: Dr. D. José Manuel Gómez Montes de Oca
Fdo.: Dr. D. José María Quiroga Alonso
Director del Dpto. de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente
Universidad de Cádiz
2.9.ELIMINACIÓN CONJUNTA DE H2S Y NH3
El estudio de la eliminación conjunta de H2S y NH3 tiene una gran importancia, puesto que ambos compuestos son emitidos conjuntamente por muchas industrias. Normalmente, altas concentraciones de H2S y bajas de NH3 son emitidas por el procesado del caucho, industria del cuero y plantas de tratamiento de aguas residuales (Chung et al., 2004c), mientras que altas concentraciones de NH3 y bajas de H2S son emitidas por plantas de producción de compost, industria del pescado, granjas de cría e incinedoras de animales (Chung et al., 1996c; Devinny et al., 1999; Sheridan et al., 2002b; Chung et al., 2005).
Muchos de estos trabajos han eliminado el amoniaco de forma indirecta, mediante la reacción química que se produce entre éste y el sulfato, sustrato principal de la oxidación biológica del ácido sulfhídrico, formándose sulfato amónico (Tanji et al., 1989; Cho et al., 1992c; Park et al., 1993; Kim et al., 2003; Lee et al., 2005). Las concentraciones de amoniaco estudiadas son muy bajas, no encontrándose efectos inhibitorios en la eliminación de los compuestos azufrados por la presencia de amoniaco; son Lee et al. (2005) los que trabajan en un rango de concentraciones de amoniaco mucho mayor desde 50 hasta 500 ppmv. En este último trabajo los autores adaptan una cepa de Acidithiobacillus thioooxidans, aislada de un lodo activo, a altas concentraciones de sulfato amónico encontrando que hasta una concentración de 60 g l-1 de sulfato amónico no resulta letal para el crecimiento y oxidación biológica de azufre. En cuanto a la eliminación de H2S, la capacidad de eliminación crítica disminuye desde 810 gS m-3h-1 hasta 400 gS m-3h-1 por la presencia de amoniaco, siendo la capacidad máxima de eliminación de éste de 190 gN m-3h-1.
La mayoría de los trabajos realizados de eliminación conjunta de estos dos compuestos emplean cultivos mixtos con bacterias azufre y amonio oxidantes.
Chung et al. (2000) inmovilizan Thiobacillus thioparus CH11 y Nitrosomonas europaea ATCC 19718 en esferas de alginato de calcio utilizando un biofiltro de escurrimiento. Trabajan con concentraciones de 60 a 120 ppmv para cada uno de los componentes. Encuentran que altas concentraciones de H2S pueden inhibir la eliminación de NH3, mientras que altas concentraciones de NH3 no afectan a la eliminación de H2S. Atribuyen que la alta eliminación de H2S, a pesar de tener una alta concentración de NH3, se pueda deber a la neutralización del NH3 con el sulfato procedente de la oxidación del H2S, de forma que se previene la acidificación; por el contrario cuando aumentan la concentración de H2S, con respecto a la concentración de amoniaco se produce una disminución de la eliminación de éste. Atribuyen la disminución de la eliminación de NH3 a dos efectos: inhibición por la disminución del pH (hasta 6,5) y/o inhibición por la alta concentración de H2S. Las capacidades máximas críticas para no superar concentraciones de salida de 0,1 y 1 ppmv de H2S y NH3 respectivamente, fueron de 3,8 gS m-3h-1 y 5,6 gN m-3h-1 con un tiempo de residencia del gas de 72 segundos. La concentración máxima de nitrito alcanzada en el medio de recirculación fue de 386 mg l-1 (28,3 mM N(NO2 -)), y la cantidad máxima de NH4 +/NH3 residual en el reactor fue sólo del 5%.
Chung et al. (2001) inmovilizan dos bacterias heterótrofas, Arthrobacter oxydans CH8 para la eliminación de amoniaco y Pseudomonas putida CH11 para el ácido sulfhídrico. Realizan una inmovilización por atrapamiento en esferas de alginato de calcio. El rango de concentraciones va desde 60 a 120 ppmv para ambos compuestos. Obtienen porcentajes de eliminación mayores del 95% para el amoniaco y por encima del 90% para el sulfhídrico. Al trabajar con altas concentraciones de H2S observan una inhibición por sustrato de la eliminación de H2S (ocurre un aumento de la concentración de sulfuro en medio líquido hasta 0,16 mg l-1). Al aumentar la concentración de NH3 se produce una ligera acidificación del biofiltro que provoca una disminución de la eliminación de H2S. Las concentraciones de nitrito en el medio líquido son muy pequeñas, de 0,069 mg l-1 (1,5·10-3 mM N(NO2 -)). Al aumentar la concentración de H2S con respecto a la de amoniaco observan que, a 60 ppmv, se favorece el metabolismo de NH3 con respecto a la ausencia de H2S, sin embargo para 120 ppmv la eliminación disminuye, siendo el valor de la constante de saturación mayor y, por tanto, la afinidad por el amoniaco menor.
Park et al. (2001) trabajan con un biofiltro de escurrimiento empaquetado con cerámica porosa fabricada a partir de cenizas, diatomita y escorias de altos hornos. Como inóculo emplearon un lodo activo, que necesitó un tiempo de aclimatación de un mes para alcanzar una eliminación del 95%. Tratan un efluente real de una planta de compostaje con concentraciones de NH3 en el rango de 8-90 ppmv y de H2S de 3,3-5,5 ppmv. Consiguen una eliminación mayor del 95%, con tiempos de residencia de 7,2 segundos. Las capacidades máximas de eliminación que alcanzaron fueron de 1,13 Kg NH3 m-3d-1 (38,8 gN m-3h-1) y 0,165 kg H2S m-3d-1 (6,5 gS m-3h-1). Kim et al. (2002a) emplean dos biofiltros empaquetados uno con astillas de madera y otro con carbón activo granular. Alcanzan porcentajes de eliminación del 99% y 92% para el H2S y NH3 respectivamente. Emplean como inóculo Thiobacillus thioparus (ATCC 23645) para la eliminación de H2S y un lodo activo como cultivo mixto de bacterias nitrificantes para el NH3.
El rango de concentraciones es desde 35 a 200 ppmv y desde 30 a 450 ppmv para el amoniaco y ácido sulfhídrico respectivamente, con tiempo de residencia de 20 a 60 segundos.
Encuentran que altas concentraciones de H2S por encima de 200 ppmv inhibe la eliminación de NH3, que disminuye hasta el 28% en el biofiltro con astillas de madera; en el biofiltro con carbón activo la disminución es menor (75%), debido posiblemente a la capacidad del carbón activo de absorber picos de concentración. El efecto de esta disminución es reversible en ambos biofiltros al disminuir la concentración de H2S. Al disminuir el pH por la formación de H2SO4 y HNO2 disminuye la eliminación, acumulándose el amoniaco como sulfato amónico.
Alcanzan capacidades de eliminación máximas de 8,0 mgN l-1h-1 y 75 mgS l-1h-1 en el biofiltro con astillas de madera y de 6,0 mgN l-1h-1 y 45 mgS l-1h-1 en el biofiltro con carbón activo granular.
Lee et al. (2002) trabajan con un biofiltro empleando como soporte cerámica y como inóculo excrementos de Lumbricus terrestris. Obtienen porcentajes de eliminación del 100% para concentraciones de hasta 600 ppmv (EC=148 gN m-3h-1) y tiempo de residencia de 10,9 segundos. Al alimentar conjuntamente H2S observan efectos de inhibición para cargas de alimentación sobre 60 gS m-3h-1. Los valores máximos de eliminación (99%) los obtienen para cargas de alimentación de amoniaco de 139 gN m-3h-1 y concentraciones de entrada de H2S por debajo de 100 ppmv. Para concentraciones de H2S de 220 ppmv y 460 ppmv la capacidad máxima de eliminación de amoniaco (R=99%) disminuye hasta 76 y 30 gN m-3h-1 respectivamente. Las concentraciones de nitrito y nitrato en el drenaje líquido fueron de 3,5±0,7 y 5,5±1,4 g l-1(76,1 y 88,7 mM respectivamente).
Malhautier et al. (2003b) trabajan con dos biofiltros utilizando como soporte un lodo granulado. Como inóculo utilizan un lodo activo y aclimatan un biofiltro (BGSn) a la eliminación de H2S y el otro (BGNn) a la eliminación de NH3. El rango de concentraciones va desde 50 hasta 200 ppmv para ambos compuestos. Las cargas de alimentación son de 26,66 gSm-3h-1 y 2,91 gN m-3h-1 para el BGSn y de 6,66 gS m-3h-1 y 11,66 gN m-3h-1 para el BGNs.
Obtienen porcentajes de eliminación para H2S del 100% en el BGSn y del 80% en el BGNn y para el NH3 son del 100% en el BGNs y del 80% en el BGSn. Al igual que los investigadores anteriores encuentran un efecto negativo sobre la población nitrificante al trabajar con altas concentraciones de H2S. La eliminación de H2S tampoco se ve afectada por las concentraciones de amoniaco. El número de bacterias nitrificantes en el BGNs (103-104 bacterias g-1) es 10 veces superior a la población en el BGSn, produciéndose en el BGNs una acumulación de nitrito del 19%.
Jones et al. (2004) trabajan con dos biofiltros, uno comercial (Bio-Matrix®, soporte patentado por BioReaction Industries, LLC.) y otro con una mezcla de astillas de madera y compost (“natural”). El soporte comercial es descrito como unos cilindros de ⅝ de pulgada de diámetro relleno de un material orgánico. Trabajan con concentraciones de H2S de 20 a 100 ppmv. En el biofiltro con el soporte comercial obtienen que cada sección contribuye a la eliminación, puesto que la concentración disminuye significativamente a lo largo del lecho, siendo los porcentajes de eliminación desde el 36% en el puerto de muestra más cerca de la base hasta el 92-96% para el rango de concentraciones. Con el soporte natural la mayor parte de la eliminación fue alcanzada en la primera sección, siendo para 100 ppmv la eliminación en el puerto de muestras más inferior del 68% y a la salida del 90%. Con respecto al efecto de la adición de amoniaco, encuentran que la adición de 80 ppmv de NH3 no tiene un efecto apreciable sobre la eficiencia de eliminación de H2S. Los porcentajes de eliminación de NH3 son del 94% y 99% para los biofiltros con soporte comercial y natural respectivamente (concentración de entrada de H2S de 100 ppmv).
Chung et al. (2004a) inmovilizan dos bacterias heterótrofas, Arthrobacter oxydans CH8 para la eliminación de amoniaco y Pseudomonas putida CH11 para el ácido sulfhídrico. Realizan una inmovilización por adhesión en carbón activo granular; en un estudio anterior emplearon alginato de calcio con estas mismas bacterias (2004b). El porcentaje de eliminación medio fue del 98% para concentraciones de H2S de 0,083 a 0,167 mg l-1 (61-122 ppmv) y 0,004 a 0,021 mg l-1 (6-31 pmmv) para el amoniaco. Encuentran que la eliminación de H2S no se ve afectada por la concentración de NH3, no observando tampoco acidificación del biofiltro. La máxima capacidad de eliminación alcanzada y la carga crítica fueron de 18,9 y 7,7 gH2S m-3h-1, siendo Pseudomonas putida CH11 la especie dominante (población mayor del 90%).
Chung et al. (2004b) publican otro artículo este mismo año empleando el mismo sistema. En este caso estudian la variación de la fuente de carbono empleando melazas (0,21 g de glucosa por gramo de melaza) y glucosa. El rango de concentraciones de NH3 y H2S es de 10 a 120 ppmv, con tiempos de residencia de 180 a 30 segundos. Encuentran que la melaza proviene una mayor eficiencia de la especie Arthrobacter oxydans CH8, no variando la eficiencia para la Pseudomonas putida CH11. Como productos metabólicos de la oxidación de amoniaco el mayoritario fue el nitrógeno orgánico (84,4%) seguido del amoniaco (15,55% de NH4 +/NH3) acumulado en el soporte, mientras que el producto mayoritario fue el azufre elemental (90,85%) seguido del sulfato (9,09%). Mantienen fácilmente el pH en torno 6-8, puesto que el amoniaco que se acumula se neutraliza con el sulfato y, al ser el azufre el compuesto mayoritario, se evita la acidificación. El porcentaje de eliminación fue del 99,5% y del 99,2% para el H2S y NH3 respectivamente, a 60 ppmv de cada compuesto con un EBRT de 45,25 segundos.
Chen et al. (2004a) trabajan con un biofiltro empaquetado con compost. Las cargas de alimentación fueron de 5,88 gS m-3h-1 y 7,89 gN m-3h-1, alcanzando porcentajes de eliminación de H2S mayores del 99% y sobre el 80% de amoniaco. Los productos de la oxidación del amoniaco son nitrito y nitrato y del ácido sulfhídrico fue sulfato. Sin embargo la mayor parte de la eliminación de amoniaco se debe a una absorción sobre el soporte y la fracción acuosa
del soporte. Encuentran que la mayor eliminación se alcanza en la primera sección de la columna y que la presencia de amoniaco no afecta a la eliminación de H2S.
Chung et al. (2005) continúan trabajando con las mismas bacterias y el mismo soporte y equipo (Arthrobacter oxydans CH8 y Pseudomonas putida CH11); en este caso califican el sistema como un biofiltro de escurrimiento, sin embargo la recirculación de medio sigue siendo intermitente, con el mismo caudal de recirculación que en el estudio anterior. En este caso trabajan con altas concentraciones de NH3 en presencia de H2S, no encontrando efecto inhibitorio en la eliminación de NH3 (80-120 ppmv) por la presencia de H2S 6,25 gS m-3h-1 (98% de eliminación de NH3 y 100% de H2S), dado que no se produce acidificación significativa del medio. El pH del medio de recirculación lo mantienen entre 6,5 y 8,0 durante 140 días sin necesidad de controlarlo. Consiguen porcentajes de eliminación mayores del 96% cuando la carga de H2S es de 6,25 gS m-3h-1. El tiempo de residencia para obtener una eliminación de amoniaco mayor del 95% fue de 65 segundos y la carga crítica de NH3 fue de 4,2 gN m-3h-1 y la carga máxima de 16,2 gN m-3h-1. La población amonio oxidante fue mayoritaria entre el 87,9% y 94,2%.
Park et al. (2006) estudian la eliminación conjunta de tres compuestos, amoniaco, ácido sulfhídrico y tolueno para investigar los efectos de inhibición en mezclas ternarias. Emplean como inóculo varias cepas; para la eliminación de H2S Thiobacillus thioparus (ATCC 23645, KCTC 2753), para la eliminación de tolueno Pseudomonas aeruginosa (ATCC 15692, KCTC 1637) y Pseudomonas putida (ATCC 23973, KCTC 1643) y para la eliminación de amoniaco aíslan bacterias nitrificantes de un lodo activo (presumiblemente Nitrosomonas y Nitrobacter).
Como soporte emplean un soporte comercial “zeocarbon” y trozos de corcho, cada uno en un biofiltro. Según los resultados obtenidos los autores no encuentran evidencias de inhibición.
Los tiempos de residencia del gas son de 40, 60 y 120 segundos. El rango de concentraciones en el biofiltro con “zeocarbon” fue de 37 a 168 ppmv, 30 a 160 ppmv y de 41 a 57 ppmv para el H2S, NH3 y tolueno respectivamente. En biofiltro con corcho el rango fue de 31 a 168 ppmv, 51 a 190 ppmv y de 3 a 134 ppmv para el H2S, NH3 y tolueno respectivamente. El porcentaje de eliminación del H2S fue del 100% y las capacidades máximas de eliminación de 23±12 y 11±6 gNH3 m-3h-1 y 8±0,5 y 4±0,3 g tolueno m-3h-1 para el biofiltro con “zeocarbon” y corcho respectivamente.
Chung et al. (2007) realizan una biofiltración en dos etapas para evitar los fenómenos de inhibición, observados en estudios anteriores, en la eliminación de NH3 por la presencia de H2S, para ello emplean dos biofiltros empaquetados con carbón activo granular, siendo el primero de ellos inoculado con Thiobacillus thioparus y el segundo con Nitrosomonas europaea, ambas bacterias aisladas de aguas residuales de pocilgas. De esta forma logran eliminar en el primer biofiltro el H2S, de forma que se evita la inhibición de éste en la oxidación biológicapor las bacterias amonio oxidantes en el segundo biofiltro. Logran alcanzar un 98% de eliminación de H2S y un 100% de NH3 durante un periodo de operación de 210 días con tiempos de residencia de 23 a 180 segundos. El sistema de dos biofiltros en serie soporta incluso concentraciones de entrada de H2S de hasta 300 ppmv sin disminución de la eliminación de NH3. La capacidad máxima de degradación de NH3 fue de 2,35 gN d-1 kg-1 (47 gN m-3h-1). La concentración máxima de sulfato en el medio líquido fue de 4,3 g l-1 y 0,31 g l-1 de nitrito (6,74 mM). Del análisis de los productos metabólicos obtienen que el 68% de azufre total fue oxidado a azufre elemental y el 82,4% a nitrito. Al disminuir el tiempo de residencia disminuye la eliminación, logran una eliminación completa para tiempos de residencia de 36 y 45 segundos para el NH3 y el H2S respectivamente, disminuyendo la eliminación hasta el 75% para 25 segundos.
2.10. MODELOS MATEMÁTICOS
Hasta hace poco tiempo los procesos biológicos han sido estudiados con un modelo de caja negra, dada la complejidad de los procesos involucrados en estos sistemas. El modelado matemático del proceso de biofiltración empezó en la década de los años ochenta y, desde entonces, han sido muchos los modelos matemáticos postulados por diferentes autores (Ottengraf and Van den Oever 1983; Devinny et al., 1991; Hodge et al., 1991; Shareefdeen et al., 1993; Deshusses et al., 1995a; Deshusses et al., 1995b).
2.10.1. Modelo de Ottengraf
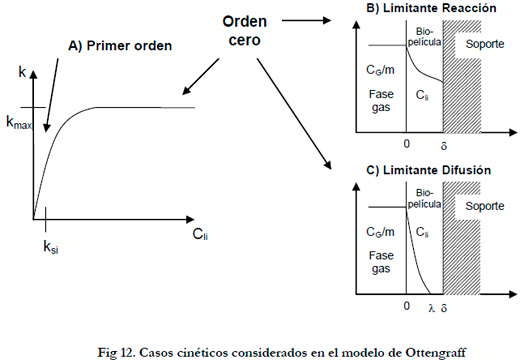
El modelo fue publicado en el año 1983, (Ottengraf and Van den Oever 1983), pero se desarrolla unos años más tarde (Ottengraf 1986). Se basa en la teoría de la doble película descrita por Lewis and Whitman (1924), y parte de un modelo de crecimiento microbiano tipo Monod. A partir de una serie de simplificaciones se reduce a un conjunto de expresiones cinéticas de primer y segundo orden con soluciones analíticas. Las suposiciones del modelo fueron:
En la biopelícula el transporte de nutrientes es por difusión y puede ser descrita por un coeficiente de difusión efectiva, Deff.
- El espesor de la biopelícula δ es pequeño comparado con el diámetro de las partículas.
- La microcinética de consumo de sustrato en la biopelícula es descrita por la ecuación de Monod según la ecuación:
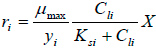 |
Donde: ri es la velocidad de consumo del componente i por la biomasa; μmax es la velocidad específica máxima de crecimiento; yi el coeficiente de rendimiento; Cli es la concentración del componente i en la fase líquida; Ksi la constante de Monod del componente i y X la concentración de biomasa activa.
- El flujo de la fase gas a través del biofiltro sigue el modelo ideal de flujo en pistón.
- La resistencia de la película gaseosa es despreciable.
Para altas concentraciones del sustrato la velocidad de degradación tiende a ser independiente de su concentración (Cli>>Ksi) dando lugar a cinéticas de orden cero, pudiéndose diferenciar dos casos según sea la etapa limitante, la reacción química o la difusión del componente. Para bajas concentraciones del sustrato o baja solubilidad de éste en agua la velocidad de reacción es proporcional a su concentración, teniendo una cinética de primer orden (Figura 12).
El resultado de aplicar el modelo en función de la cinética de primer orden, de orden cero con limitación por reacción y de orden cero con limitación por difusión, da respectivamente las siguientes ecuaciones:
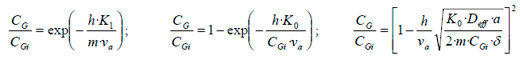 |
Donde: CG la concentración del gas; CGi la concentración a la entrada; h la altura del biofiltro; K0 la constante cinética de orden cero; K1 la constante cinética de primer orden; m el coeficiente de partición gas-líquido; va la velocidad superficial del gas; Deff el coeficiente de difusión efectiva y δ el espesor de la biopelícula.
 |
2.10.2. Modelo de Devinny y Hodge
Devinny y Hodge desarrollaron un modelo haciendo suposiciones simples, con el objeto de acentuar los efectos derivados de realizar cambios en la concentración de entrada (Devinny et al., 1991; Hodge and Devinny 1995; Hodge and Devinny 1997).
El modelo describe el proceso biológico y los fenómenos básicos de transporte: el aire pasa a través del biofiltro y el contaminante se ve afectado por advección, dispersión, adsorción, absorción y degradación biológica. El modelo trata el medio poroso como un sistema con dos fases: la fase gas y la fase líquido/sólido. Se considera el líquido y los sólidos como una sola fase, para despreciar fenómenos como la difusión en estas dos fases y los procesos de adsorción en la interfase sólido/líquido. El modelo también describe la evolución del CO2 generado por la biomasa, prediciendo los perfiles de concentración. Las simplificaciones son las siguientes:
- No hay fenómenos de turbulencia.
- La composición del relleno del biofiltro es homogénea (porosidad, contenido en agua, espesor biopelícula …).
- Distribución y densidad de biomasa homogénea.
- Adsorción irreversible.
- Advección y difusión en la biopelícula son despreciables.
- Cinética de primer orden para la velocidad de consumo del sustrato por los microorganismos.
- La producción de CO2 sigue la siguiente estequiometría:
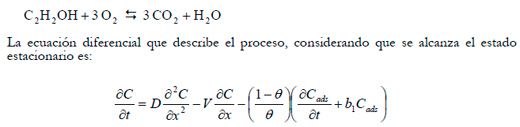 |
Siendo C la concentración en la fase gas a lo largo de la altura “x” del biofiltro; D el coeficiente de dispersión en la fase gas; V la velocidad axial intersticial del gas; θ la porosidad del material; Cads la concentración en la fase líquido/sólido y t el tiempo. Para resolver esta ecuación se han de utilizar métodos numéricos, pero si se asume que la dispersión longitudinal es despreciable y el sistema alcanza el estado estacionario, entonces se llega a la siguiente ecuación:
 |
Donde C es la concentración a lo largo de la altura “x” del biofiltro; C0 es la concentración a la entrada, b1 es la constante de primer orden de la degradación biológica, V la velocidad superficial del aire y Km es el cociente de partición entre la masa de contaminante en la fase sólido/líquido y en la fase gas.
Así pues, la concentración en el biofiltro disminuye exponencialmente, con una velocidad constante proporcional a la velocidad de degradación y al coeficiente de partición y es inversamente proporcional a la velocidad de flujo de aire. El biofiltro trabaja mejor si la biodegradación es rápida y si el contaminante pasa bien a la fase líquido/sólido. Muchos
estudios indican que la biodegradabilidad y la solubilidad son dos de los factores más importantes para tener éxito en la eliminación de un compuesto mediante el uso de un biofiltro.
2.10.3. Modelo de Shareefdeen et al.
Shareefdeen publicó y validó otro modelo matemático (Shareefdeen et al., 1993), estudiando la degradación de metanol en un biofiltro mediante un consorcio de bacterias inmovilizadas en una mezcla de turba con partículas de perlita. Este modelo es similar al propuesto por Ottengraff, pero con diferencias en las expresiones microcinéticas. Se pasó de considerar un solo compuesto en las ecuaciones cinéticas (sustrato) a tener en cuenta también el oxigeno como reactivo necesario en la degradación aerobia. Las suposiciones del modelo son:
- El metanol y el oxigeno son los únicos sustratos que afectan a la velocidad de reacción, considerándose difusión y reacción de ambos compuestos en la biopelícula. La velocidad específica de crecimiento es descrita por un modelo interactivo, teniendo una dependencia en la concentración de metanol de tipo Andrews (o Haldane, generalización de Monod) y una dependencia de oxigeno de tipo Monod.
- La biopelícula se forma en la superficie exterior de las partículas y el espesor δ∗ es pequeño comparado con el tamaño de la partícula (se puede aplicar geometría plana). Al menos uno de los sustratos es agotado antes de alcanzar la interfase soporte biopelícula (ocurre a un espesor δ de la biopelícula). No hay ninguna capa límite en la interfase aire/biopelícula, y las concentraciones de cada componente en la interfase se obtienen por los coeficientes de distribución como proponen Ottengraf and Van den Oeve (1983). En la fase gas no hay variación de la concentración en dirección radial a la columna (flujo en pistón).
- La espuma de poliuretano utilizada como soporte de material de relleno (turba/perlita) no contribuye al proceso de biofiltración.
- La densidad de la biopelícula es constante a lo largo de la columna.
- Después de la etapa inicial del proceso, la acumulación de biomasa es insignificante u ocurre muy lentamente, por lo que se puede asumir estado estacionario o, más específicamente, pseudo-estacionario.
Bajo estas consideraciones se realizan los correspondientes balances de materia, llegando a una solución que requiere la integración por métodos numéricos para su resolución, evitando la elección entre primer orden u orden cero.
Este modelo permite calcular la profundidad a la cual penetran ambos compuestos y ver cual se agota primero, definiendo así el espesor activo de la biopelícula en función de la profundidad de penetración del reactivo limitante.
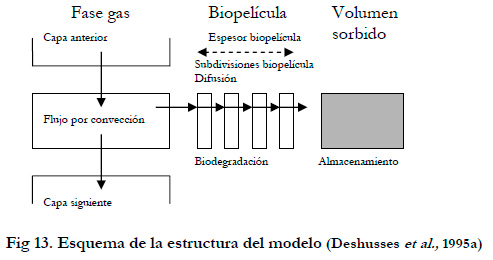
2.10.4. Modelo de Deshusses et al.
Deshusses (Deshusses et al., 1995a; Deshusses et al., 1995b) considera el biofiltro formado por un número finito de subdivisiones o capas. Cada subdivisión se divide en tres secciones (Figura 13): la fase gas, la biopelícula que rodea el material y el agua retenida dentro del soporte (volumen sorbido). La biopelícula es dividida en 4 subdivisiones y cada subdivisión se considera con mezcla ideal.
Asume una gran cantidad de simplificaciones similares a las de Ottengraff, siendo las más significativas:
- La concentración es homogénea en cada subdivisión ya que se supone en cada una de ellas mezcla ideal.
- El volumen sorbido es asumido igual al agua contenida en el material de soporte menos el volumen de la biopelícula, y ninguna reacción biológica tiene lugar en este volumen.
- No hay limitación por oxigeno.
- En la biopelícula se asume que no se da crecimiento de la biomasa, por lo que se mantienen constantes los parámetros cinéticos. Se utiliza una cinética tipo Monod con competición entre sustratos.
 |
Para validar el modelo realizó un estudio de la degradación simultánea de Metil etil cetona (MEK) y Metil isobutil cetona (MIBK) en un biofiltro con compost/poliestireno. Para cada subdivisión realizó un balance de materia que resuelve por diferencias finitas, necesitando para llegar a simular de 5 a 10 horas de operación entre 3000 y 5000 iteraciones.
2.10.5. Modelos QSARs
Las siglas QSARs provienen de la abreviatura de “Quantitative structure activity relationships”, que vendría a ser “Modelo cuantitativo estructura-actividad”. Estos modelos buscan describir la actividad de determinados compuestos químicos basándose en su estructura química. Los modelos QSAR son muy diferentes a los modelos conceptuales y en muchos casos más limitados, porque los datos usados son sólo los descritos por los compuestos utilizados y no pueden describir todos los aspectos de la biofiltración. Lo que si pueden describir es la capacidad de eliminación de un compuesto para unas condiciones dadas. Un ejemplo de aplicación de este modelo fue realizado por Aizpuru et al. (2002) para la eliminación de VOCs en un biofiltro, obteniendo un coeficiente de ajuste de 0,96.
2.10.6. Otros modelos
Otros muchos modelos han sido aplicados a los biofiltros. Algunos autores incluyen nuevas consideraciones, siendo las más significativas:
Cherry and Thompson (1997) incluyen en el modelo los requerimientos energéticos de la bacteria para mantenimiento. El modelo intenta explicar los fenómenos de ausencia de crecimiento que se producen a veces en los biofiltros, al cabo de tiempos largos de operación.
Al cesar el crecimiento se produce una disminución de la eliminación, puesto que el consumo de energía de mantenimiento es mucho menor en comparación con el de crecimiento. Alonso et al. (1999) distinguen entre biomasa activa y no activa. Describe un modelo matemático aplicado a la degradación de VOCs (dietil eter) en un biofiltro de escurrimiento, considerando tres fases: gas, líquido/biopelícula y biomasa no uniforme.
Amanullah et al. (1999) describen un modelo que tienen en cuenta los fenómenos de transporte, los procesos físico-químicos y biológicos que tiene lugar durante la biofiltración (convección, dispersión, adsorción, absorción, difusión, reacción y características de la biopelícula.). El objetivo de los autores es ver que nivel de complejidad del modelo se requiere para lograr una correcta estimación de su funcionamiento.
Baquerizo et al. (2005) desarrollan y validan un modelo matemático en la eliminación de amoniaco. El modelo incluye los efectos inhibitorios del amoniaco libre y del ácido nitroso libre.