Viabilidad de un Proceso para la Eliminación conjunta de H2S Y NH3 contenido en Efluentes Gaseosos. Parte 4
 |
Martín Ramírez Muñoz TESIS DOCTORAL |
La presente Tesis ha sido co-dirigida por los Doctores D. Domingo Cantero Moreno, Catedrático de Ingeniería Química y D. José Manuel Gómez Montes de Oca, Profesor Titular de Ingeniería Química de la Universidad de Cádiz, y cumple los requisitos exigidos por la legislación vigente.
Fdo.: Dr. D. Domingo Cantero Moreno Fdo.: Dr. D. José Manuel Gómez Montes de Oca
Fdo.: Dr. D. José María Quiroga Alonso
Director del Dpto. de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente
Universidad de Cádiz
2.5.ELIMINACIÓN DE H2S MEDIANTE PROCESOS COMBINADOS
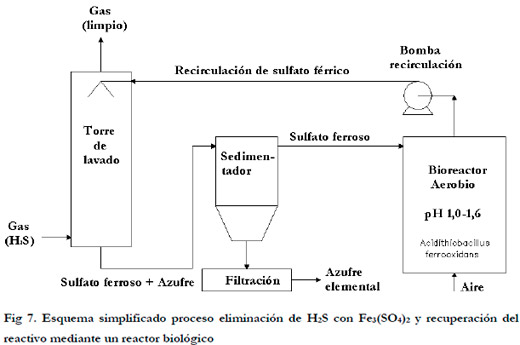
2.5.1. Eliminación de H2S por absorción en Fe3(SO4)2 y recuperación del reactivo mediante un reactor biológico
Este proceso se aplica fundamentalmente para la desulfuración del biogás (Jensen and Webb 1995b; Pagella et al., 1996). El proceso básico consiste en poner en contacto, en una torre de lavado (absorbedor), una disolución de sulfato férrico, en contracorriente, con el biogás que contiene H2S. La disolución absorbe el ácido sulfhídrico del gas y lo oxida a azufre elemental, reduciéndose el sulfato férrico a ferroso, de acuerdo con la siguiente ecuación química global:
|
|
En una segunda etapa (biológica) se realiza la oxidación del sulfato ferroso a férrico por Acidithiobacillus ferrooxidans según la siguiente ecuación:
|
|
La disolución oxidada que resulta en esta etapa biológica, puede utilizarse nuevamente en la etapa de absorción, minimizando, por tanto, el consumo del oxidante, consiguiendo que sea económicamente viable el sistema. En la Figura 7 se representa esquemáticamente el proceso.
Numerosas configuraciones de reactores y estudios para mejorar la velocidad de oxidación de sulfato ferroso a sulfato férrico han sido investigados (Jensen and Webb 1995a; Mesa et al., 2002). Un excelente review que describe los modelos utilizados ha sido publicado por Nemati et al. (1998).
 |
2.5.2. Proceso Shell-Paques THIOPAQTM de desulfurización
Consiste en un proceso también combinado físico-químico y biológico. Igualmente consta de dos etapas; en una primera etapa se realiza una absorción del H2S en una torre de lavado con una solución alcalina, seguida de una oxidación biológica del H2S absorbido hasta azufre elemental.
 |
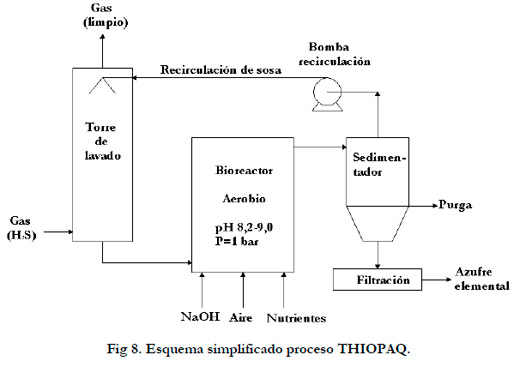 |
El producto final es el azufre elemental, siendo tan sólo menos del 5% oxidado hasta sulfato, la solución alcalina no es totalmente regenerada en el reactor biológico, por lo que es necesaria la adición de sosa para mantener el pH sobre 8,2. Según la información que facilita la empresa que ha desarrollado la tecnología se trata de bacterias del género Thiobacillus (Cline et al., 2003). Recientemente Sorokin et al. (2007) han aislado de un bioreactor THIOPAQ en Eerbeek (Países Bajos) una nueva bacteria anaerobia (Desulfurispirillum alkaliphilum), que utiliza azufre como aceptor de electrones y acetato como fuente de carbono, describen que el reactor trabaja en condiciones limitantes de oxigeno y condiciones alcalinas.
2.6. AMONIACO
El amoniaco (NH3) es un gas incoloro, tóxico, reactivo y corrosivo con un olor picante desagradable (Busca and Pistarino 2003).
2.6.1. Propiedades
En el siguiente listado se detallan algunas de las propiedades físico-químicas más importantes (Cheremisinoff 1999; Perry et al., 2001; Carson and Mumford 2002; ICSC 2003b).
– Nº CAS: 7664-41-7
– Fórmula: NH3
– Peso molecular: 17,03
– Punto de ebullición: -33,4ºC
– Punto de fusión: -77,7ºC
– Presión de vapor a 20ºC: 8,6 bar
– Coeficiente de Henry a 25ºC (mol·m-3)aire/(mol·m-3)agua): 0,00089
– Solubilidad en agua (g/100ml): 89,5 g (0ºC); 52,9 g (20ºC)
– Densidad relativa del gas (aire=1): 0,6
– Densidad relativa del líquido (agua=1): 0,7
– Temperatura de autoignición: 651ºC
– Límites de explosividad (% en volumen en el aire): 15 – 28
– Constante de disociación a 25ºC: pKa=9,259
– Factor de conversión: 1 ppmv=0,70 mg/m3 (25ºC)
En un estudio reciente sobre los límites de detección e irritación del amoniaco, se ha fijado el límite de detección en 2,6 ppmv y el límite de irritación en 31,7 y 60,9 ppmv mediante un método estático y dinámico respectivamente (Smeets et al., 2007).
Los valores límites de exposición ambiental según la ACGIH para el NH3 son de 25 ppmv (17 mg m-3) para el TLV-TWA y de 35 ppmv (24 mg m-3) para el TLV-STEL (ICSC 2003b).
En España, según el INSHT, el valor del VLA-ED de 20 ppmv (14 mg m-3) y el VLA-EC de 50 ppmv (36 mg m-3).
2.6.2. Fuentes
Una considerable cantidad de NH3 es liberado por procesos industriales como las refinerías de petróleo, industrias metalúrgicas, industrias de alimentos y textiles, plantas de tratamiento de residuos y plantas de compostaje (Busca and Pistarino 2003). En explotaciones ganaderas de Taiwán las emisiones de amoniaco son del rango de 10 a 60 ppmv (Chung et al., 1996c), mientras que en plantas de compostaje de residuos se han medido concentraciones de hasta 270 mg m-3 (332 ppmv a 30ºC) (Smet et al., 2000) y en plantas de compostaje de lodo de hasta 700 mg m-3 (1023 ppmv a 30ºC) (Haug 1993).
Las emisiones antropogénicas de amoniaco son de 43 millones de toneladas de nitrógeno por año, que equivalen aproximadamente al 55% del total (NH3+NOX+N2O). Del total de éstas tres especies, la mayor fuente con diferencia es la agricultura (50%), seguida de las fuentes móviles y estacionarias de combustión de las fuentes fósiles (20% cada una), y por último, la quema de biomasa (10%) (Krupa 2003).
En España en el año 2003, las emisiones atmosféricas de amoniaco por todas las actividades económicas fueron de 392089 toneladas (INE 2007).
El amoniaco como contaminante en el aire tiene un papel importante en la lluvia ácida y la eutrofización. Por tanto, el control de las emisiones de amoniaco es esencial para la protección del medio ambiente y la salud pública (Krupa 2003).
2.6.3. Usos
El amoníaco es el segundo producto químico sintético. Más del 90 % del consumo mundial es fabricado a partir del nitrógeno y el hidrógeno por un proceso catalítico desarrollado por Fritz Haber y Carl Bosch, que usa un catalizador promovido de hierro:
|
|
En 1997 el 85% de la producción mundial de amoniaco fue empleada para la fabricación de fertilizantes (urea y nitrato de amonio fundamentalmente). El empleo industrial de amoniaco está alrededor del 15%. Un uso importante del nitrógeno contenido en el amoniaco, en parte después de la conversión al ácido nítrico, es la producción de plásticos y fibras, como poliamidas, resinas urea-formaldehído-fenol, poliuretanos y poliacrilonitrilo. Otro uso es la fabricación de explosivos, hidracina, aminas, amidas, nitrilos y otros compuestos orgánicos nitrogenados, que sirven como intermedios para tintes y productos farmacéuticos.
Los productos inorgánicos principales son el ácido nítrico, el nitrato de sodio, el cianuro de sodio, el cloruro de amonio, y el bicarbonato de amonio. La producción de urea consumió aproximadamente el 40 % del amoniaco producido en 1995 (Wiley-VCH 2002).
2.6.4. Efectos sobre la salud
Las exposiciones a amoniaco causan principalmente irritación en las mucosas, obteniendo como resultado una sensación de quemazón en los ojos, nariz y garganta; esta sensación se pude producir a concentraciones muy bajas, desde 50 hasta 100 ppmv (Busca and pistrano, 2003). A concentraciones de 400 ppmv la irritación es inmediata, sobre 1500 ppmv produce tos y a 2500 ppmv es una amenaza para la vida (Helmers et al., 1971; Ferguson et al., 1977).
2.7.ELIMINACIÓN DE NH3 MEDIANTE PROCESOS FÍSICO-QUÍMICOS
2.7.1. Incineración térmica
La oxidación de amoniaco a NO y N2O está muy favorecida termodinámicamente y se trata de reacciones muy exotérmicas, aunque la oxidación paralela de NH3 a N2 es incluso más exotérmica y favorable termodinámicamente. También las reacciones del NH3 con el NO formado dan N2, siendo reacciones también favorecidas termodinámicamente (Tabla 6).
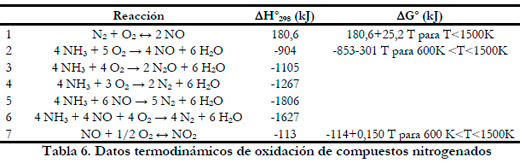 |
La oxidación térmica de amoniaco depende obviamente de la temperatura, el tiempo de residencia y la composición del gas. La oxidación comienza sobre los 1100K, cerca de las condiciones estequiométricas, generándose una gran cantidad de NO y aumentando la temperatura.
Uno de los inconvenientes principales de esta tecnología es el contenido de óxidos de nitrógeno en el gas tratado, debido a que las altas temperaturas de reacción hacen que reaccionen el oxígeno y nitrógeno del aire, formándose óxidos de nitrógeno. La oxidación del nitrógeno del aire para dar NO es una reacción muy endotérmica y desfavorable termodinámicamente, pero se produce si se alcanzan altas temperaturas (a 1800K se puede llegar a generar 4000 ppm de NO). El NO es un compuesto inodoro, por lo que se podría usar la incineración térmica para la eliminación de olores, pero se trata de un compuesto altamente tóxico, por lo que su emisión está regulada (Busca and Pistarino 2003). Igualmente se puede producir N2O. La emisión de N2O no está todavía regulada, pero se trata de un gas de efecto invernadero como el CO2.
2.7.2. Combustión catalítica
La combustión catalítica es una alternativa a la incineración térmica para tratar efluentes altamente concentrados, permitiendo una recuperación de energía. El uso de catalizadores permite que las emisiones de óxidos de nitrógeno sean muy bajas, al igual que el consumo de combustible. Las principales desventajas son el complicado diseño del reactor y los costes del catalizador (metales nobles de corta vida útil). De hecho, la combustión catalítica sufre de inhibición del catalizador cuando el gas contiene compuestos de azufre (Busca and Pistarino 2003).
Uno de los precursores del ácido nítrico es el NO, que se genera mediante un oxidación catalítica del amoniaco con un catalizador de platino. Con respecto al tratamiento de gases (Burch and Southward 2001), lograron una combustión limpia de óxidos de nitrógeno en la combustión de biogás, empleando catalizadores de Rh/Al2O3 o Ir/Al2O3 bajo condiciones limitantes de oxigeno.
2.7.3. Oxidación catalítica selectiva de NH3 a nitrógeno
Se le conoce con las siglas SCO (Selective Catalytic Oxidation); permite la disminución de la concentración de amoniaco de gases que contienen oxígeno, sin la necesidad de introducir otros reactivos en la mezcla de gases y sin la generación de otros contaminantes (Busca and Pistarino 2003).
La reacción [4] de la Tabla 6 tiene una mayor velocidad a bajas temperaturas. Debido a la estabilidad termodinámica del N2 con respecto al NO y N2O, es obvio que las reacciones [3] y [2] deben ser paralelas en lugar de sucesivas con respecto a la reacción [4]. Mediante un catalizador de Cu-Y/zeolita se han logrado conversiones del 100% y un 98% de selectividad a 573 K (Gang et al., 1999).
2.7.4. Condensación
El amoniaco puede ser recuperado por condensación, dado el bajo punto de ebullición (240K y 1 atm). Esta técnica es actualmente razonable de emplear cuando en el gas tenemos una concentración muy alta de amoniaco, bajo presión significativa y cuando enfriar es relativamente fácil al disponer de fluidos criogénicos. Éste es el caso de la síntesis del gas amoniaco.
2.7.5. Absorción
El amoniaco es muy soluble en agua pura, e incluso más en soluciones ácidas. Soluciones de fosfato de amonio son utilizadas para recuperar el amoniaco desde gases que contienen CO2 y H2S; este proceso se denomina Phosam-W. Así, la absorción en agua o soluciones de agua, puede realizarse en torres de absorción. La regeneración es también posible mediante un “stripping” a alta temperatura o un sobrecalentamiento. El principal inconveniente de este tipo de proceso es que el amoniaco no es destruido, por lo que se necesita de un tratamiento posterior si la concentración es tal que su reutilización no es posible.
La absorción con agua es particularmente efectiva para tratar, además de amoniaco, compuestos como aminas, cetonas, acetatos, etc. (Regina 2006).
2.7.6. Adsorción
Los materiales más utilizados en la adsorción de amoniaco son las zeolitas (materiales como Linde 4A, 5A o 10X. Zeolitas de origen natural como clinoptilolita han sido empleadas para absorber amoniaco procedente del hogar de una caldera (Kelleher et al., 2002). Otro material empleado es el carbón activo que puede ser empleado en los ciclos de refrigeración (Critoph 2002). Los sistemas de absorción-regeneración permiten recuperar el contaminante cuando la concentración es lo suficientemente alta, siendo posible la reutilización del soporte.
2.8.ELIMINACIÓN DE NH3 MEDIANTE BIOFILTRACIÓN
2.8.1. Microorganismos
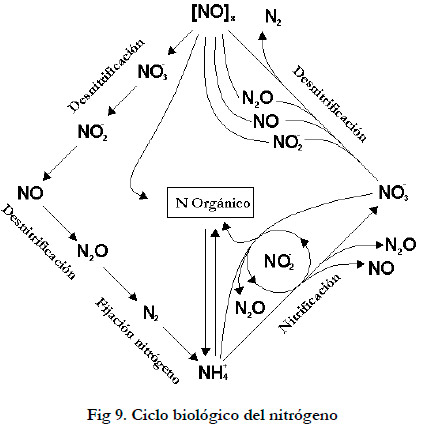
La eliminación de amoniaco se lleva a cabo a partir de una parte del ciclo biológico del nitrógeno (Figura 9), la nitrificación (Madjid 2005).
 |
En un primer paso los microorganismos (ej., Nitrosomonas sp.) transforman el amoniaco en nitrito, estas bacterias son autótrofas (emplean como fuente de carbono el CO2 atmosférico).
El nitrito producido es oxidado a nitrato en un segundo paso (ej., Nitrobacter sp.). Los pasos de la oxidación pueden describirse mediante las dos ecuaciones siguientes (Stepanov and Korpela 1997):
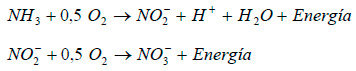 |
Durante el proceso de oxidación de amoniaco se pueden producir trazas de NO y N2O.
También se podría producir nitrógeno bajo ciertas condiciones de operación (Stepanov and Korpela 1997), así Nitrosomonas europaea puede generar nitrógeno en condiciones limitantes de oxigeno (Poth 1986; Shrestha et al., 2002). En la oxidación de amoniaco por Nitrosomonas europaea intervienen dos enzimas, la amonio monooxigenasa (AMO) y la hidroxilamina oxidoreductasa (HAO), siendo el amoniaco libre (NH3) el sustrato, ya que esta especie no puede oxidar el ión amonio (Suzuki et al., 1974). La primera enzima (AMO) oxida el amoniaco a hidroxilamina (NH2OH) y consume oxigeno molecular y dos electrones. En el segundo paso metabólico la enzima HAO oxida la hidroxilamina a nitrito, liberando cuatro electrones. Dos de estos electrones son consumidos por la AMO en el primer paso metabólico y los otros dos son empleados para la síntesis de ATP o para fijar el CO2 mediante una reducción (Wood 1986). En la Figura 10 se ha representado esquemáticamente los pasos metabólicos.
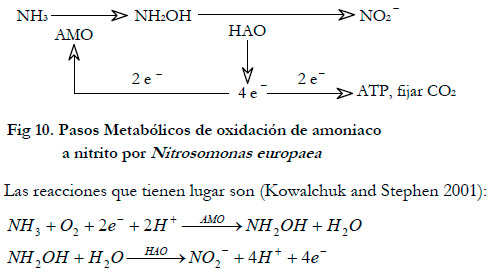 |
En la desnitrificación por Nitrosomonas europaea intervienen 3 enzimas (Figura 11): Nitrito reductasa, Nitrito oxidoreductasa y Nitroso oxido reductasa (Shrestha et al., 2002).
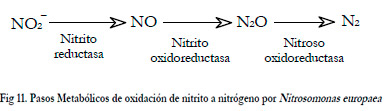 |
La degradación de amonio también puede ser realizada por bacterias nitrificantes heterótrofas, como Alcaligenes, Pseudomonas y Arthrobacter sp. Los microorganismos autótrofos tienen un papel muy importante en la eliminación de NH3, sin embargo, en algunas condiciones como en ambientes ácidos, condiciones limitantes de oxigeno o con altas concentraciones de amoniaco, la nitrificación heterótrofa es predominante, especialmente en ambientes ácidos (Chung and Huang 1998).
El producto final de la oxidación es frecuentemente nitrito, no llegándose a la oxidación hasta nitrato, aunque los microorganismos heterótrofos pueden utilizar el nitrito como fuente de energía. Las velocidades de nitrificación de los heterótrofos son varios ordenes de magnitud menor (103-104) que la de los autótrofos, pero la concentración de heterótrofos es 104-105 veces mayor que la de los autótrofos, por tanto se puede ver compensada la capacidad de eliminación (Prosser 1989). La mayor concentración de heterótrofos va acompañada de una mayor biodiversidad en comparación de los autótrofos. Estudios de biodiversidad de población en comunidades degradadoras de amonio, indican una disminución de la biodiversidad de la población durante periodos largos de operación en sistemas de eliminación de amoniaco (Sakano and Kerkhof 1998).
En biofiltración son muy pocos los estudios realizados con cultivos puros, siendo la inmensa mayoría de biofiltros inoculados con lodos activos (Hartikainen et al., 1996; Yani et al., 1998b; Yani et al., 1998a; Liang et al., 2000; Hirai et al., 2001b; Gracian et al., 2002; Kim et al., 2002b; Sheridan et al., 2002a; Sheridan et al., 2002b; Chen et al., 2004b; Chen et al., 2005; Shahmansouri et al., 2005; Taghipour et al., 2006; Chou and Wang 2007). La no utilización de cultivos puros implica la necesidad de un periodo de aclimatación, que puede ser del orden de semanas e incluso de meses. Así Liang et al. (2000) necesitaron un periodo de 2 semanas de aclimatación, Gracian et al. (2002) de 3 a 4 semanas y Shahmansouri et al. (2005) hasta 3 meses.
Con respecto al empleo de cultivos puros, Chung et al. (1997b) emplean un biofiltro inoculado con un microorganismo heterótrofo, aislado de granjas animales donde las concentraciones de amoniaco son muy altas. Identifica la bacteria como Arthorobacter oxydans CH8, y realiza una inmovilización por atrapamiento en esferas de alginato de calcio. Chung and Huang (1998) trabajan con la misma cepa utilizada en el desarrollo de esta Tesis Doctoral (Nitrosomonas europaea ATCC 19718), realizando también una inmovilización por atrapamiento en esferas de alginato de calcio. Realizan un estudio para ver como afecta la contaminación de microorganismos heterótrofos suministrando glucosa a uno de los biofiltros; obtienen que la presencia de bacterias heterótrofas producen una disminución del porcentaje de eliminación del 84,2% al 73,5%.
Un microorganismo novedoso, no empleado hasta el momento para la eliminación de amoniaco, fue la bacteria marina: Vibrio alginolyticus (Kim et al., 2000; Kim and Shoda 2002). Se trata de una bacteria aislada de un medio halófilo, que trabajan con una concentración de NaCl del 3% (p/v), por lo que a pesar de no trabajar en condiciones estériles, logran evitar que la contaminación afecte al rendimiento del biofiltro; realizan la inmovilización sobre obsidiana sinterizada (fluyolita). Kanagawa et al. (2004) aíslan una cepa nitrificante de un suelo, sin embargo no identifican el microorganismo. Kim et al. (2007b) recientemente aíslan un cultivo mixto nitrificante, mediante el enriquecimiento en un medio específico para la obtención de este tipo de bacterias, pero tampoco llegan a identificar las especies presentes.
2.8.2. Soportes utilizados en la eliminación de NH3
En la Tabla 7 se recogen las distintas configuraciones de biofiltros empleadas para la eliminación de amoniaco, así como, los inóculos empleados y los resultados más relevantes obtenidos en cuanto a rango de concentraciones de entrada de amoniaco, tiempos de residencias, porcentajes de eliminación obtenidos y capacidades de eliminación alcanzadas en los trabajos que se han revisado.
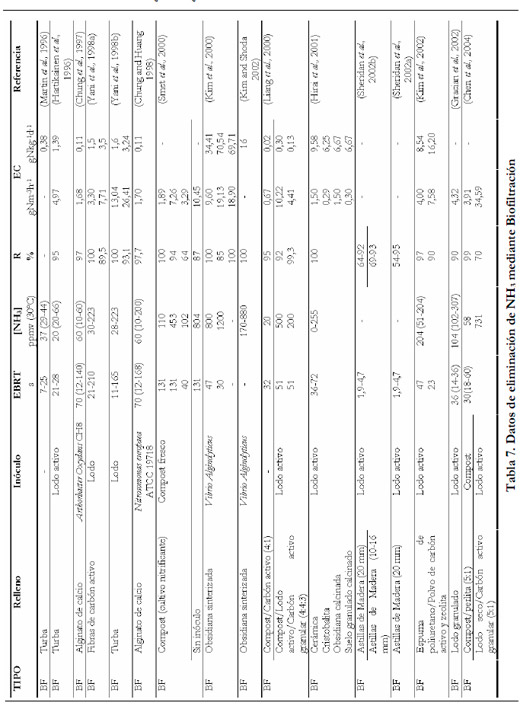 |
 |
Todos los valores de esta Tabla han sido convertidos a las mismas unidades para poder comparar, así mismo algunos de estos datos no son suministrados directamente por los autores, por lo que se han calculado en función de los datos suministrados en cada estudio.
Como se puede observar, la gran mayoría de las configuraciones son biofiltros, siendo sólo cuatro los trabajos encontrados en los que se emplea un biofiltro de escurrimiento (Kanagawa et al., 2004; Melse and Mol 2004; Sakuma et al., 2004; Chou and Wang 2007). Entre los biofiltros predomina el uso del compost y la turba, a veces mezclados con compuestos inorgánicos como el carbón activo y perlita (Chen et al., 2005), e incluso plástico (Taghipour et al., 2006). Los materiales naturales tienen la desventaja de que su descomposición puede causar fenómenos de taponamiento y cambio en el tamaño de partícula, con el consiguiente aumento de la pérdida de carga (Kim et al., 2002b).
2.8.3. Resultados obtenidos en la eliminación de NH3
En la mayoría de los estudios realizados se emplean como inóculo lodos activos y se favorece la proliferación de bacterias, tanto amonio oxidantes como nitrito oxidantes, por lo que se pretende alcanzar una oxidación total hasta nitrato, pero la formación final de nitrito o nitrato va a estar influencia por las concentraciones de amoniaco (Focht and Verstraete 1977), de los productos de la oxidación (Hunik et al., 1992; Smet et al., 2000) y del pH. La inhibición
para la especie Nitrosomonas europaea y Nitrobacter agilis ocurre para concentraciones muy altas de amoniaco, mientras que para el nitrito la inhibición es mucho mayor a pH bajos, por el aumento de la concentración de ácido nitroso (Smet et al., 2000). A pH altos esta inhibición no debiera de ocurrir pero el aumento de la presión osmótica, debido a concentraciones altas de iones, inhibe principalmente la especie Nitrosomonas europea (Hunik et al., 1992).
El valor máximo de la capacidad de eliminación fue obtenida mediante un biofiltro de escurrimiento por Kanagawa et al. (2004), 59,88 gN m-3h-1 con un porcentaje de eliminación del 99,8%. Igualmente el tiempo de residencia más bajo (1,0 y 1,4 segundos) también fue empleado en un biofiltro de escurrimiento por Melse and Mol (2004), obteniendo una capacidad máxima de eliminación de 33,83 gN m-3h-1, con un porcentaje de eliminación del 90%.