Viabilidad de un Proceso para la Eliminación conjunta de H2S Y NH3 contenido en Efluentes Gaseosos. Parte 3
 |
Martín Ramírez Muñoz TESIS DOCTORAL |
La presente Tesis ha sido co-dirigida por los Doctores D. Domingo Cantero Moreno, Catedrático de Ingeniería Química y D. José Manuel Gómez Montes de Oca, Profesor Titular de Ingeniería Química de la Universidad de Cádiz, y cumple los requisitos exigidos por la legislación vigente.
Fdo.: Dr. D. Domingo Cantero Moreno Fdo.: Dr. D. José Manuel Gómez Montes de Oca
Fdo.: Dr. D. José María Quiroga Alonso
Director del Dpto. de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente
Universidad de Cádiz
2.4. ELIMINACIÓN DE H2S MEDIANTE BIOFILTRACIÓN
La biofiltración no es la única tecnología empleada para la eliminación de H2S. Muchos tipos de reactores con distintos tipos de microorganismos han sido estudiados como procesos alternativos para tratar efluentes contaminados con H2S. Jensen and Webb (1995b) y Syed et al. (2006) han publicado unos excelentes reviews en los que recogen distintos métodos biológicos, entre los que se pueden encontrar reactores agitados discontinuos, realimentados o continuos, reactores con los microorganismos en suspensión o inmovilizados, incluso reactores de fototubos.
A continuación nos vamos a centrar en la eliminación de H2S mediante biofiltración.
2.4.1. Microorganismos
El azufre existe en 9 estados de oxidación desde 6 hasta -2; sin embargo solo 3 estados de oxidación son abundantes en la naturaleza: -2 en forma de anión hidrosulfito (HS-), 0 en forma de azufre elemental (S) y 6 en forma de sulfato (SO4 =), estando en los océanos la mayor reserva de azufre en forma de sulfato inorgánico (Brüser et al., 2000).
El azufre va cambiando de estado de oxidación en la naturaleza, debido a transformaciones tanto por procesos químicos, geológicos y biológicos. El ciclo biológico del azufre esta representado en la Figura 5 (Brüser et al., 2000; Lomans et al., 2002).
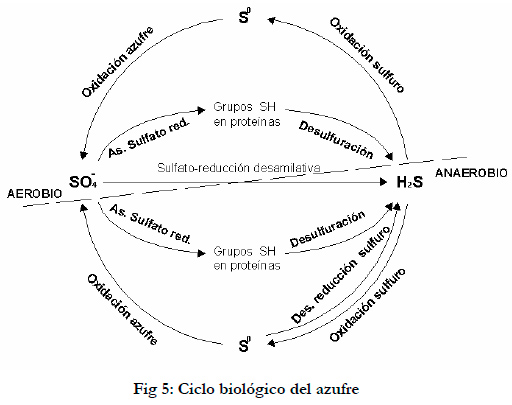 |
La oxidación biológica del sulfuro de hidrógeno a sulfato es una de las reacciones principales del ciclo global del azufre. Los compuestos de azufre inorgánicos reducidos son oxidados exclusivamente por procariotas, siendo el sulfato el producto principal de la oxidación (Friedrich et al., 2001). Las bacterias procariotas azufre oxidantes son filogenéticamente muy diversas, estando en el dominio Arquea restringida a los miembros del orden Sulfolobales (hypertermófilas) (Stetter et al., 1990).
Existen bacterias procariotas azufre oxidantes tanto en condiciones alcalinas, neutras como ácidas. Las bacterias aerobias azufre oxidantes pertenecen a géneros como Acidianus, Acidithiobacillus, Aquaspirilum, Aquifex, Bacillus, Beggiota, Methylobacterium, Paracoccus, Pseudomonas, Starkeya, Sulfolobus, Thermithiobacillus, Thiobacillus y Xanthobacter, siendo muchas de ellas termófilas. Las bacterias anaerobias azufre oxidantes son comúnmente neutrófilas y mesófilas, de géneros como Allochromatium, Chlorobium, Rhodobacter, Rhodopseudomonas, Rhodovulum y Thiocapsa (Friedrich et al., 2001). Choloribium limicola (bacteria fotoautótrofa anaerobia) es capaz de oxidar H2S a azufre elemental con presencia de CO2, luz y un medio con nutrientes inorgánicos (Syed et al., 2003).
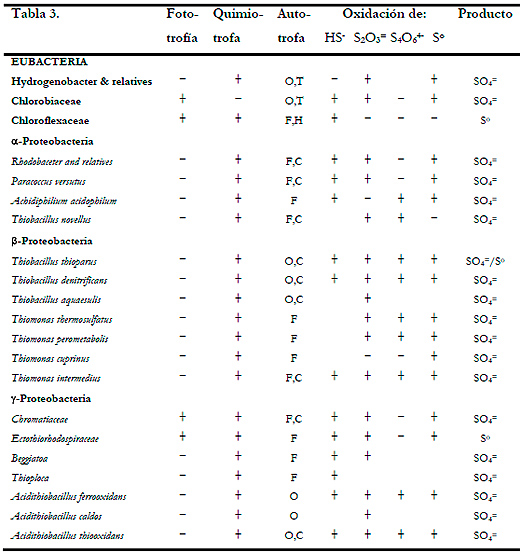
Brüser et al. (2000) realizan una comparación de las bacterias que son capaces de crecer litotróficamente en presencia de compuestos reducidos de azufre (Tabla 3).
 |
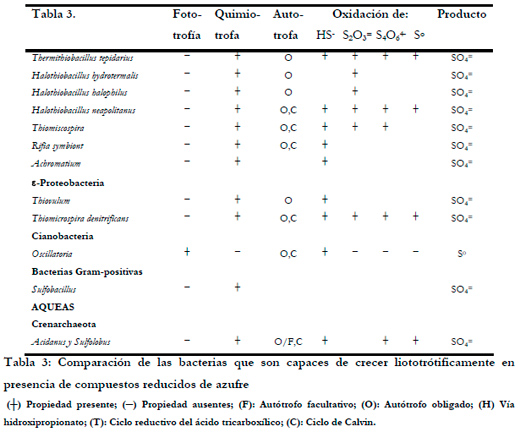 |
Los microorganismos más utilizados para la oxidación de H2S en sistema de biofiltración de gases son las bacterias del género Acidithiobacillus y Thiobacillus. Dentro de estos tipos encontramos bacterias acidófilas como Acidithiobacillus thiooxidans (Shinabe et al., 1995; Cho et al., 2000; Wu et al., 2001; Sercu et al., 2005b; Lee et al., 2006), y neutrófilas como Thiobacillus novellus (Chung et al., 1998), Thiobacillus thioparus (Tanji et al., 1989; Cho et al., 1991b; Cho et al., 1992b; Park et al., 1993; Chung et al., 1996b; Chung et al., 2000; Cox and Deshusses 2002; Oyarzun et al., 2003) o Thiobacillus denitrificans (Ma et al., 2006a; Ma et al., 2006b)
Bacterias heterótrofas como Xantomonas sp. (Cho et al., 1992b), Pseudomonas putida CH11 y Arthrobacter oxidanas CH8 (Chung et al., 1996b; Chung et al., 2001; Chung et al., 2004a) también han sido utilizadas en biofiltros para la oxidación de H2S. Otras bacterias que han demostrado una buena capacidad en la eliminación de TRS son del género Hyphomicrobium (Zhang et al., 1991; Cho et al., 1992b; Hirai et al., 2001a; Sercu et al., 2005b).
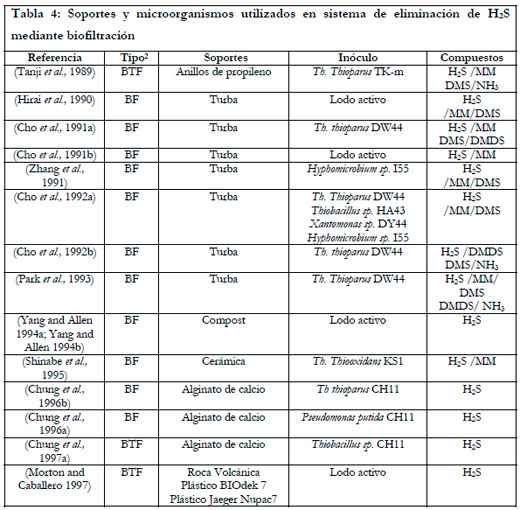
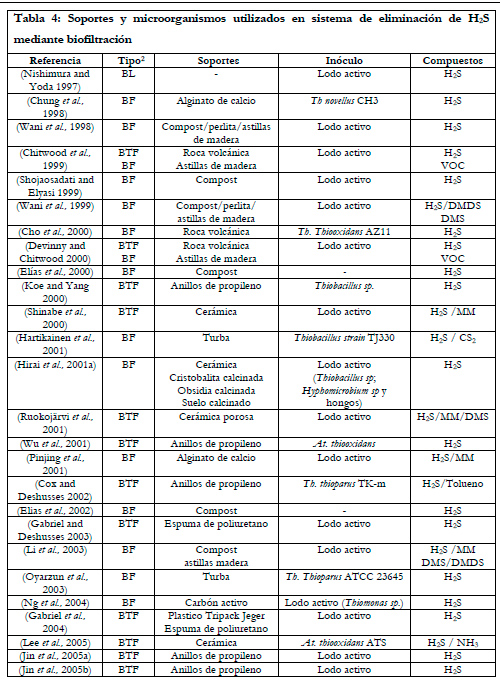
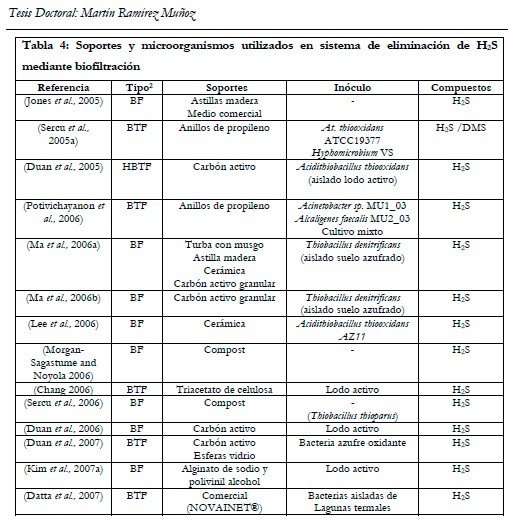
En la Tabla 4 se muestra un resumen, ordenado cronológicamente, de los tipos de microorganismos y soportes utilizados en biofiltración para la eliminación de ácido sulfhídrico.
 |
 |
 |
En el tratamiento de un efluente gaseoso, la selección del tipo de microorganismo es un factor muy importante, y aunque una gran cantidad de biofiltros han sido inoculados con lodos activos, presentan el inconveniente de su largo período de aclimatación para comenzar a trabajar adecuadamente (Ottengraf and Van den Oever 1983). Park et al. (2001) trabajaron con un biofiltro de escurrimiento relleno de una cerámica porosa inoculada con un lodo activo y necesitaron un período de aclimatación de 28 días; asimismo, otro biofiltro de escurrimiento relleno con anillos de propileno e inoculado con un lodo activo requirió un periodo de 22 días de aclimatación (Cox and Deshusses 2002). Una solución para reducir estos tiempos es la inoculación con especies puras, ya que disminuye o anula la fase de aclimatación obteniéndose unas altas capacidades de eliminación (Devinny et al., 1999).
2.4.2. Soportes utilizados en la eliminación de H2S
En los biofiltros (BF) el soporte más utilizado es el compost y la turba, aunque algunos autores añaden otros materiales como perlita y/o astillas de madera para intentar evitar los fenómenos de compactación del lecho (Wani et al., 1999; Li et al., 2003; Jones et al., 2004). El carbón activo como soporte ha demostrado tener un buen comportamiento, realizándose en los últimos años muchos estudios (Ng et al., 2004; Duan et al., 2005; Duan et al., 2006; Ma et al., 2006a; Ma et al., 2006b; Duan et al., 2007); el uso de este tipo de soporte permite la combinación de la eliminación por absorción física y por degradación biológica, de forma que se pueden conseguir buenos resultados en aquellos efluentes en los que se presenten picos de concentración, ya que se elimina por absorción física siendo luego degradado por el microorganismo.
La utilización de biolavadores es muy escasa, ya que dada la baja solubilidad en agua del H2S no es recomendable su utilización; sin embargo, algunos investigadores han llegado a eliminar más del 99% del H2S procedente de un digestor anaerobio con una concentración de entrada de 2000 ppmv y un caudal de 40 m3h-1 (Nishimura and Yoda 1997), aunque frente a este elevado porcentaje de eliminación se encuentra una baja capacidad de eliminación (0,185 gS m-3 h-1), ya que utiliza un tanque de 550 m3.
En los biofiltros de escurrimiento los soportes mas utilizados son los anillos de propileno, cerámicas y rocas volcánicas (Tabla 4), aunque también hay estudios realizados con espuma de poliuretano.
Loy y Flauger (1996) degradaron estireno en un biofiltro relleno de espuma de poliuretano, logrando eliminar el 100% con cargas por debajo de 25 g m-3 h-1. Moe e Irvine (2000) utilizaron espuma de poliuretano en un biofiltro inoculado con un lodo activo para eliminar tolueno, trabajando con tiempos de residencia de 1 a 4 minutos y concentraciones entre 50 y 200 ppmv, obteniendo eliminaciones mayores del 99%. Hori et al. (2001) aislaron Acitenobacter genospecies de un lodo activo y las inmovilizaron en espuma de poliuretano, llegando a una capacidad de eliminación de tolueno de 6,5 g kg-1 min-1 en un BTF. Kim et al. (2002b) utilizaron cubos de espumas mezclados con polvo de carbón activo y zeolita e inoculados con lodo activo para eliminar amoniaco en un biofiltro, obteniendo eficiencias del 90% a concentraciones de 150 ppmv y con tiempos de residencia de 23 segundos, alcanzando una cantidad de biomasa inmovilizada de 1,58·109 cell (g soporte)-1. Gabriel et al. (2003; 2004) utilizaron espuma de poliuretano para eliminar ácido sulfhídrico en un BTF trabajando con tiempos de residencia menores de 3 segundos. Partieron de un inóculo procedente de un lodo activo y llegaron a una capacidad máxima de eliminación de 40,37 gS m-3h-1 (65% de eficacia) y de 29,18 gS m-3h-1 (94% de eficacia). Igualmente ha sido empleada para construir un biofiltro de escurrimiento diferencial para la validación de un Modelo y ver cuáles son los límites en la degradación de H2S, al poder trabajar con tiempos de residencia muy bajos menores de 0,01 segundos (Kim and Deshusses 2003; Kim and Deshusses 2005). La espuma de poliuretano ha mostrado ser un soporte con unas grandes ventajas para este tipo de sistemas, ya que tiene una elevada superficie especifica (600 m2m-3) y una alta porosidad (>95%), lo que proporciona una baja perdida de carga, además de su bajo coste y sus buenas propiedades mecánicas (Devinny
et al., 1999).
2.4.3. Resultados obtenidos en la eliminación de H2S
En las experiencias realizadas, además de estudiar la capacidad de eliminación de H2S, muchos autores han estudiado el efecto que tienen otros compuestos, que normalmente acompañan a éste en los efluentes industriales, sobre la capacidad de eliminación. La mayoría de estos compuestos son MM, DMS, DMDS, CS2, NH3…ya sea en trazas o en cantidades mucho mayores.
Si la corriente además de H2S contiene NH3, se puede lograr la eliminación de este compuesto mediante la biooxidación a nitrito y/o nitrato por bacterias oxidantes de amonio presentes en los lodos activos (Park et al., 2001; Malhautier et al., 2003a), o inoculadas de cultivos aislados como Arthrobacter oxydans (Chung et al., 2001; Chung et al., 2004b) o de cepas de colección como Nitrosomonas europaea ATCC 49718 (Chung et al., 2000). Este campo de trabajo será profundizado en el apartado 2.8 de la presente Tesis.
Otra forma de eliminar este compuesto es mediante reacción química con el sulfato procedente de la biooxidación de los TRS, formándose sulfato amónico (Tanji et al., 1989; Cho et al., 1992b; Park et al., 1993; Kim et al., 2003; Lee et al., 2005).
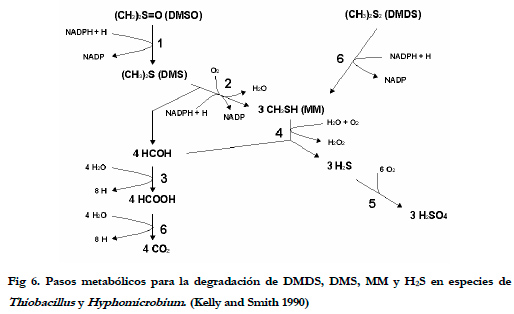
Otros compuestos que normalmente se encuentran junto con el H2S, son los compuestos órgano sulfurados (MM, DMS y DMDS, principalmente). Los compuestos órgano sulfurados se degradan en primer lugar hasta H2S, y luego son oxidados a sulfato (Smet et al., 1998), siendo este último paso la etapa productora de energía en la biodegradación (Figura 6).
 |
En la bibliografía aparecen numerosas citas en las que se enuncia el hecho de que la velocidad de degradación del H2S es siempre mayor que la del resto de los TRS. Así, por ejemplo, para el caso de Thiobacillus thioparus DW44 el orden de degradación es:
H2S>MM≥DMDS>DMS (Cho et al., 1991a), igualmente para Hyphomicrobium sp I55 se da una mayor velocidad de degradación del H2S que del resto de los TRS (Zhang et al., 1991). Para evitar estos inconvenientes algunos autores han propuesto realizar una biofiltración en dos etapas, eliminando en el primer biofiltro el H2S y en un segundo el resto de TRS (Chitwood et al., 1999; Devinny and Chitwood 2000; Pinjing et al., 2001; Ruokojärvi et al.,
2001; Li et al., 2003; Sercu et al., 2005a). Los resultados obtenidos demuestran que es una buena técnica para lograr eliminar compuestos órgano sulfurados y VOCs cuando se hayan en presencia de H2S.
El sulfato y el azufre son los productos principales de la biooxidación del ácido sulfhídrico. El azufre elemental genera un gran problema, ya que al acumularse en el biofiltro aumenta la pérdida de carga, también puede llegar a obturar conducciones, generar problemas en el sistema de bombeo etc.; por tanto, es preferible la oxidación total hasta sulfato; aunque éste también genera problemas en el biofiltro ya que es un producto inhibitorio que puede hacer disminuir mucho la eficacia del proceso (Yang and Allen 1994a).
Eliminar el azufre del soporte es muy complicado, pero se ha demostrado que cuando se disminuye la concentración de H2S el microorganismo puede oxidar el azufre a sulfato, disminuyendo así su concentración en el soporte. Según Buisman et al. (1990) en el proceso de oxidación del H2S, en una primera etapa, el H2S pierde dos electrones y se forma azufre sobre la membrana de la bacteria; en una segunda etapa este azufre es oxidado a sulfito y después a sulfato, según las reacciones que se detallan a continuación:
 |
El tiosulfato a su vez puede ser oxidado por distintas vías (Kelly et al., 1997). Kelly (2003) recoge en este trabajo los distintos pasos metabólicos desde los primeros estudios de los años sesenta hasta la actualidad.
Por tanto, el azufre es un producto intermedio en la oxidación del H2S a sulfato. En la bibliografía, podemos encontrar varios ejemplos que demuestran que el azufre es un compuesto intermedio en la oxidación del H2S, y cuando se da una baja concentración de H2S el microorganismo empieza a oxidar el azufre a sulfato (Cho et al., 1991a; Zhang et al., 1991; Duan et al., 2005; Jin et al., 2005b).
En cuanto al sulfato, la mayoría de los autores para disminuir su concentración en los BTF realizan una reposición del medio de recirculación, ya sea de forma continua o en discontinuo, reemplazando una cierta proporción del medio una vez alcanzada una concentración de sulfato. La reposición del medio también es necesaria para asegurar el aporte de micronutrientes esenciales en el metabolismo de la biomasa.
Así, Tanji et al. (1989) cuando la concentración de sulfato del medio de recirculación superó los 5 g l-1, realizaron la reposición de ¾ partes del medio por medio fresco para evitar fenómenos de inhibición. Koe and Yang (2000) mantuvieron una concentración de sulfato entre 2 y 5 g l-1 para evitar la inhibición; y Jin et al. (2005a) encontraron que una concentración mayor de 1,9 g l-1 producía efectos inhibitorios a pH bajos. Ruokojärvi et al. (2001) y Sercu et al. (2005b), establecieron un límite más alto de 15 g l-1 En los BF se produce una acumulación del sulfato en el soporte, por lo que se hace necesario un lavado del soporte. Yang and Allen (1994a) encuentran que una concentración de sulfato mayor de 25 mgS g-1 de compost inhibe la eliminación de H2S. Jones et al. (2005) realizaron un estudio de la inhibición del sulfato en un BF añadiendo sulfato al soporte en concentraciones de 40, 65 y 100 mgS g-1 de soporte. Añadiendo 100 mgS g-1 de sulfato no encontraron una disminución de la eficacia de eliminación a pH en el rango 6,8-8,5, sólo se daba el efecto inhibitorio del sulfato a pH bajos. La eficacia disminuyó del 82,3% a pH 8 al 26% a pH 2. Estos autores postularon que la transferencia de masa del sulfato de la fase líquida a la biopelícula no parece inhibir la eliminación de H2S, debiéndose la disminución de la eficacia a altas cargas de H2S o a la precipitación de azufre; igualmente sugirieron que se podrían soportar mayores concentraciones de sulfato con una biopelícula más gruesa y robusta, desarrollada sobre un soporte con un tamaño de partícula mayor que evitase la acumulación de especies sulfuradas.
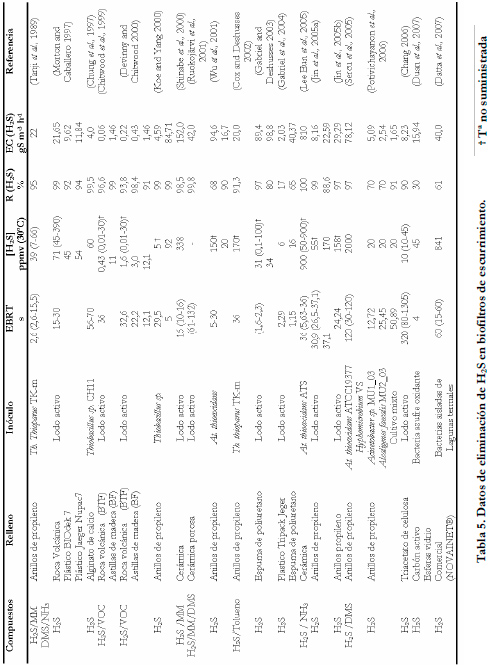
En la Tabla 5 se muestran los resultados obtenidos en la eliminación de H2S utilizando biofiltros de escurrimiento. Todos los valores de ésta Tabla han sido convertidos a las mismas unidades para poder comparar; así mismo, algunos de estos datos no son suministrados directamente por los autores, por lo que se han calculado en función de los datos suministrados en cada estudio.
El rango de tiempo de residencia del gas (EBRT) es muy variable, y siempre interesa trabajar con el menor tiempo de residencia posible, para tener un biofiltro lo más pequeño disminuyendo los costes. El menor EBRT de trabajo es el obtenido por Gabriel et al. (2003; 2004), que trabajaron en un rango de 1,15 a 2,3 segundos, igual al tiempo de residencia de los scrubbers químicos.
El rango de concentraciones también es variable, aunque normalmente son menores de 200 ppmv. Hay autores que trabajan con efluentes de plantas de tratamiento de aguas, compostaje, etc (Morton and Caballero 1997; Chitwood et al., 1999; Devinny and Chitwood 2000; Koe and Yang 2000; Park et al., 2001; Wu et al., 2001; Gabriel and Deshusses 2003; Gabriel et al., 2004) y otros investigadores lo generan artificialmente por reacción química entre HCl y Na2S, diluyendo el H2S generado con aire, o trabajan con botellas de gases licuados.
La capacidad máxima de eliminación alcanzada en un BTF es de 810 gS m-3h-1 por Lee et al. (2005) que trabajaron con un biofiltro inoculado con Thiobacillus thiooxidans inmovilizado sobre un soporte cerámico, aunque en la mayoría de los trabajos las capacidades máximas de eliminación son mucho menores.
Un trabajo muy interesante es el realizado recientemente por Datta et al. (2007). Realizan un estudio de eliminación de H2S a altas temperaturas de 40, 50, 60 y 70ºC, obteniendo muy buenos resultados. Con la comunidad bacteriana aislada se podrían tratar efluentes de la industria del papel en la que los efluentes gaseosos están a unas temperaturas sobre 40ºC.
 |