Viabilidad de un Proceso para la Eliminación conjunta de H2S Y NH3 contenido en Efluentes Gaseosos. Parte 2
 |
Martín Ramírez Muñoz TESIS DOCTORAL |
La presente Tesis ha sido co-dirigida por los Doctores D. Domingo Cantero Moreno, Catedrático de Ingeniería Química y D. José Manuel Gómez Montes de Oca, Profesor Titular de Ingeniería Química de la Universidad de Cádiz, y cumple los requisitos exigidos por la legislación vigente.
Fdo.: Dr. D. Domingo Cantero Moreno Fdo.: Dr. D. José Manuel Gómez Montes de Oca
Fdo.: Dr. D. José María Quiroga Alonso
Director del Dpto. de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente
Universidad de Cádiz
2.2. SULFURO DE HIDRÓGENO
2.2.1. Propiedades
El sulfuro de hidrógeno (H2S) es un gas incoloro y muy tóxico con olor característico a huevos podridos. Se le conoce, entre otros nombres, como: ácido hidrosulfúrico, gas de alcantarilla y ácido sulfhídrico.
En el siguiente listado se detallan algunas de las propiedades físico-químicas más importantes (Smet et al., 1998; Carson and Mumford 2002; EPA 2003; ICSC 2003a).
- Nº CAS: 7783-06-04
- Fórmula: H2S
- Peso molecular: 34,08
- Punto de ebullición: -60,7ºC
- Punto de fusión: -85ºC
- Presión de vapor a 20ºC: 18,8 bar
- Coeficiente de Henry a 25ºC (mol·m-3)aire/(mol·m-3)agua): 0,41
- Solubilidad en agua (g/100ml): 437 ml (0ºC), 186 ml (40ºC)
- Densidad relativa de vapor (aire=1): 1,19
- Punto de inflamación: gas inflamable
- Temperatura de autoignición: 260ºC
- Limites de explosividad (% en volumen en el aire): 4,3 – 45,5
- Constantes de disociación: pKa1=7,02 (genera anión hidrosulfito HS-); pKa2=11,96 (genera el anión disulfuro S=)
- Factor de conversión: 1 ppmv=1,39 mg m3 (25ºC)
El umbral de detección varía según los autores, entre 0,0085 y 1 ppmv (De Zwart and Kuenen 1992; Lomans et al., 2002), entre 0,0005 y 0,01 ppmv (Ruth 1986) o entre 0,01 y 0,3 ppmv (Guidotti 1994). Como se puede comprobar el límite de detección es excesivamente bajo y varía, dado que la sensibilidad a la hora de detectar un olor depende de muchos factores, tanto del individuo (sensibilidad, subjetividad, costumbre, etc.) como ambiental (humedad, temperatura, etc.) (Wark et al., 2004). Según la Nota Técnica de Prevención 320 del INSHT el umbral olfativo del H2S es 0,0081 ppmv, siendo irritante a partir de 10,04 ppmv y dejándose de oler a partir de 100-150 ppmv.
Los valores límites de exposición ambiental, según la ACGIH, para el H2S son de 10 ppmv (13,9 mg m-3) para el TLV-TWA y de 15 ppmv (20,85 mg m-3) para el TLV-STEL (ICSC 2003a). En España es el INSHT el encargado de publicar los valores de referencia para los agentes químicos que carezcan de valores límites reglamentarios según el RD 374/2001, de 6 de abril sobre la protección de la salud y seguridad de los trabajadores contra los riesgos relacionados con los agentes químicos durante el trabajo, siendo para el caso del H2S el valor del VLA-ED de 10 ppmv (14 mg m-3) y el VLA-EC de 15 ppmv (21 mg m-3).
2.2.2. Fuentes
El ácido sulfhídrico se encuentra de forma natural en los gases de los volcanes, manantiales de azufre, emanaciones de grietas submarinas, pantanos, petróleo crudo, gas natural y como producto de la degradación biológica de la materia orgánica. Las fuentes industriales engloban a una gran cantidad de industrias: refinerías, plantas de gas natural, plantas petroquímicas, hornos de coque, industria alimentaria, industria del papel, curtidurías, etc; pero destacan las plantas depuradoras de aguas residuales como las más significativas en la generación de olores debido a su gran número y cercanía a las poblaciones (Smet et al., 1998; Syed et al., 2006).
Toda planta de tratamiento de aguas residuales es susceptible de generar olores, aunque son las que realizan un tratamiento anaerobio las que generan mayores problemas. En un ambiente anaerobio, las bacterias sulfatoreductoras producen ácido sulfhídrico como consecuencia de su metabolismo de degradación de los sulfatos presentes en el agua residual.
Conjuntamente con el H2S se ha identificado la presencia de compuestos órgano sulfurados como MeSH, Me2S, Me2S2 y COS en las emisiones (Dechant et al., 1999).
Para reducir la emisión de olores de las plantas de tratamiento de aguas residuales, los tanques que contienen los lodos o las aguas residuales se cubren y se ventilan mediante un sistema de extracción para eliminar los compuestos responsables del mal olor. En el año 2000 se realizó un estudio en los Países Bajos para ver que tipo de tratamiento se utilizaba, y se detectó que el 78% de las plantas utilizaban sistemas de tratamiento biológico, el 11% biolavadores químicos, el 2% procesos de adsorción con carbón activo y el 9% introducía los gases en el tanque de aireación de la propia planta. En las nuevas instalaciones que se encuentran en construcción y puesta en marcha no es usual encontrar el uso de biolavadores químicos, produciéndose un desplazamiento hacia el uso de biofiltros de escurrimiento con soportes sintéticos (Van Groenestijn and Kraakman 2005). Este hecho ha provocado que se haya desarrollado un gran trabajo de investigación en este campo de aplicación medioambiental.
Así, Chitwood et al. (1999) han trabajado con un biofiltro de escurrimiento en una planta de tratamiento de aguas residuales, siendo la concentración de H2S de 5 ppmv y con una concentración de VOC entre 0,1 y 1 ppmv. Por otro lado, Wu et al. (2001) estudiaron un biofiltro de escurrimiento a nivel de planta piloto en una EDAR, teniendo la corriente de aire a tratar una concentración máxima de H2S de 20 ppmv y de VOCs de 70 a 120 g l-1; y Morton and Caballero (1997) hicieron lo mismo llegando a tratar concentraciones máximas de H2S de 380 ppmv. Por su parte, Shinabe et al. (1995) estudiaron la eliminación de H2S y MM generados en una EDAR con Thiobacillus thiooxidans, siendo la concentración máxima de H2S de 17 ppmv.
Como se puede observar, todas estas aplicaciones trataron concentraciones relativamente bajas de H2S, pero las concentraciones de este compuesto son mucho mayores en el biogás procedente de la digestión anaerobia. En el biogás la concentración de H2S varía entre 300 y 6000 ppmv (Nishimura and Yoda 1997; Schieder et al., 2003). La producción de metano a partir de biomasa se puede llevar a cabo vía térmica o biológica. Mediante la vía térmica la conversión es rápida y completa, pero se requiere un bajo contenido en agua, puesto que si contiene mucha agua se requieren grandes cantidades de energía para la vaporización antes de la gasificación. Es por esto, que son más utilizados los procesos biológicos empleando bacterias metanogénicas.
El desarrollo de la biofiltración ha sido tan rápido en los últimos años que pueden existir en Europa unas 7500 plantas de tratamiento de gases, de las cuales aproximadamente la mitad se encuentran en plantas de tratamiento de aguas residuales y plantas de compostaje (Van Groenestijn and Kraakman 2005).
En cuanto a los procesos químicos es la industria de la celulosa una de las principales industrias generadoras de H2S, gozando del rechazo popular. Los digestores anaerobios de las plantas de tratamiento de agua residuales de la industria del papel pueden llegar incluso hasta 30000 ppmv (Schieder et al., 2003). A nivel mundial el principal proceso de producción de celulosa es el “proceso Kraft”. En este proceso las astillas de madera son cocidas en una solución alcalina, basada en Na2S y NaOH, para extraer la lignina. Los principales componentes de las emisiones son H2S, MeSH, Me2S y Me2S2 (Karnofski 1975), siendo el H2S uno de los agentes más nocivos.
Otra industria química importante que genera H2S es la industria del refino del petróleo. El H2S se encuentra naturalmente en la mayoría de los crudos y se forma también durante el procesado, debido a la descomposición de compuestos de azufre inestables. Los principales focos de emisión son: la destilación atmosférica, el craqueo (térmico o catalítico) y el hidrotratamiento.
Los procesos a alta temperatura, tales como las plantas de tratamiento de grasas animales, también son un importante foco de emisión. Mediante estas plantas se obtienen productos como colas, alimentos para peces y sebo. Los principales compuestos que se emiten son H2S, MeSH, etanotiol y NH3 (Lecomte et al., 1995). Otros procesos que emiten H2S a alta temperatura son las plantas de incineración de lodos (Smet and Van Langenhove 1998).
2.2.3. Usos
El H2S se utiliza industrialmente en la manufactura de azufre elemental, agua pesada, industria metalúrgica, como reactivo analítico y en agricultura como desinfectante (Svendsen 2001).
2.2.4. Efectos sobre la salud
Existen tres rutas de asimilación del H2S por el cuerpo humano: oxidación, metilación y reacciones con metaloproteínas. El principal camino de asimilación es el de oxidación, ya que al pH fisiológico (7,4) aproximadamente el 69% del H2S se encuentra ionizado (HS-). Como producto principal del metabolismo se obtiene el sulfato, aunque también se ha aislado tiosulfato de tejidos expuestos al H2S (EPA 2003). La principal ruta de eliminación del cuerpo es mediante la orina; trabajadores voluntarios expuestos a concentraciones de 8, 18 y 3 ppmv durante 30-45 minutos dieron positivo en tiosulfato al analizar muestras de orina (Kangas and Savolainen 1987).
En la Tabla 2 se exponen los efectos que provocan las exposiciones a H2S en ser humano (Krüger 2001).
 |
2.3. ELIMINACIÓN DE H2S MEDIANTE PROCESOS FÍSICOQUÍMICOS
2.3.1. Procesos de eliminación no húmedos
2.3.1.1. Proceso Claus (oxidación directa)
Se basa en la oxidación catalítica del H2S a azufre elemental. Se trata de uno de los procesos más populares empleados a escala industrial para la eliminación de H2S con recuperación de azufre elemental. En una primera etapa el H2S es parcialmente oxidado a SO2 con aire, y en una segunda etapa, la mezcla H2S/SO2 es oxidada a azufre elemental y agua, empleando bauxita como catalizador. La eficacia de conversión de H2S a azufre elemental es del 90-95% (Kohl and Nielsen 1997).
2.3.1.2. Óxidos de hierro y cinc
Se basan en la reacción del óxido de un metal con el H2S para formar el sulfuro del correspondiente metal. Los óxidos son típicamente no regenerables aunque algunos se pueden regenerar parcialmente, pero siempre irán perdiendo actividad en cada ciclo de generación hasta que sea indispensable su sustitución. Para la regeneración se realiza una oxidación para producir azufre elemental y el óxido del metal regenerado. Los metales más empleados para este tipo de proceso son hierro y cinc.
Se pueden dividir en dos grupos: oxidación a azufre y oxidación a óxidos de azufre. Para el tratamiento de biogás se puede producir mediante esta técnica SO2, por lo que no se recomienda este tipo de proceso.
Los procesos que emplean óxido férrico son conocidos como “iron sponge”. Según la ecuación de la reacción química, 1 kg de Fe2O3 puede eliminar estequiométricamente 0,64 kg de H2S.
 |
Se emplean temperaturas sobre 200ºC a 400ºC, siendo la formación de sulfuro de cinc irreversible. Normalmente se emplean formas cilíndricas extruídas del metal de 3-4 mm de diámetro y 8-10 mm de longitud en un lecho fijo o fluidizado (Kohl and Nielsen 1997).
2.3.1.3. Sólidos alcalinos
También se pueden emplear sustancias sólidas alcalinas como hidróxido de sodio o cal apagada, normalmente se emplean disueltas en agua para utilizarlas en scrubbers, pero también se pueden utilizar de forma sólida granular. Las reacciones predominantes son:
|
|
2.3.1.4.Adsorbentes
Tanto las zeolitas naturales como las sintéticas poseen un tamaño de poro extremadamente uniforme, siendo empleadas para la deshidratación o purificación de efluentes gaseosos. Las sustancias polares como agua, ácido sulfhídrico, dióxido de azufre, amoniaco, sulfuro de carbono y mercaptanos son adsorbidos muy fuertemente, pudiendo ser eliminados de sustancias no polares, como por ejemplo el metano.
El carbón activo granulado (CAG) es fundamentalmente empleado para la eliminación de COV´s. La utilización para la eliminación de H2S ha sido limitada para la eliminación de pequeñas cantidades de H2S, fundamentalmente en sistemas de desodorización. Para aumentar la eficacia el CAG se ha impregnado con sustancias alcalinas u óxidos (Kohl and Nielsen 1997).
2.3.2. Procesos de eliminación húmedos
2.3.2.1. Oxidación en fase líquida
Oxidación con hipoclorito
 |
En este proceso es necesario añadir una base para el control del pH. A pH 9 la absorción de CO2 es pequeña y no ocurre precipitación de CaCO3 o MgCO3. La utilización de hipoclorito permite eliminar además de H2S compuestos orgánicos sulfurados; en el caso de eliminación de compuestos orgánicos sulfurados tiene un mayor poder oxidante el HClO comparado con el OCl-, siendo por tanto necesario trabajar a un pH mas bajo (Hentz et al., 1990; Muirhead et al., 1993).
Si la corriente a tratar contiene amoniaco o aminas, estos compuestos son oxidados a cloroaminas, compuestos aún más tóxicos y malolientes, por lo que es necesario tratar la corriente para eliminar los compuestos nitrogenados antes de tratar con hipoclorito (Smet et al., 1998).
Lavadores con óxidos de hierro y cinc
Estos tipos de procesos han sido los transitorios entre los procesos por vía seca y las tecnologías modernas de procesos redox en fase líquida. El proceso consiste en una reacción con una solución alcalina, seguida de la formación de sulfuro de hierro por reacción con el óxido férrico, según las ecuaciones siguientes:
 |
Proceso con Quinona y Vanadio
El proceso emplea quinonas con sales de vanadio; es conocido como proceso Strefford. En una primera etapa se reduce la quinona formándose azufre elemental, y en una segunda etapa mediante una oxidación se logra regenerar el reactivo.
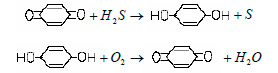 |
Soluciones de hierro con un agente quelatante
Se basa en una reacción redox empleando iones de hierro unidos a un agente quelatante similar al AEDT (Mansfield et al., 1992). Uno de los procesos más implantados en el mercado es conocido como LO-CAT® (US filter/Merichem); se aplica a la eliminación de H2S del biogás y consigue eliminaciones mayores del 99%, la solución catalítica no es tóxica y opera a temperatura ambiente (Kohl and Nielsen 1997). Las reacciones fundamentales son:
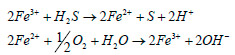 |
Soluciones con nitrito
Soluciones de nitrito han sido empleadas para la eliminación de H2S en columnas de borboteo. La ecuación general es:
|
|
En presencia de CO2 el NaOH es neutralizado produciendo carbonato de sodio y bicarbonato. El proceso produce amoniaco y óxidos de nitrógeno (NOx), los cuales pueden ser igual de problemáticos que el H2S. Sulfa-Check® (NL Industries, Inc) y Hond HS-100® (Hondo Chemical, Inc) comercializan dos medios basados en nitrito para la eliminación de H2S.
Se utiliza una columna de borboteo en la cual las condiciones óptimas de trabajo son:
– Temperatura óptima de 23,8 a 43,3ºC.
– Velocidad máxima superficial de gas por debajo de 0,048 m s-1.
– Se necesita 0,21 litros de disolución por metro cúbico de gas a tratar y por ppmv de H2S.
Soluciones de permanganato
Se puede llevar a cabo la oxidación con permanganato potásico, pero los costes son demasiado elevados, y los óxidos de permanganato deben ser adecuadamente tratados para su eliminación (Cadena and Peters 1988). Los compuestos que se forman dependen del pH.
Para pH menores de 7,5:
 |
Para pH entre 8 y 11 predomina la primera reacción, mientras que la segunda reacción es predominante a pH mucho mayores. La principal desventaja de este tipo de proceso es la precipitación de carbonatos de calcio (CaCO3) y magnesio (MgCO3), fundamentalmente cuando el pH es mayor de 10 con los consiguientes problemas de obturación (Smet et al., 1998).
Lavado cáustico
Soluciones de hidróxido de sodio son muy efectivas para eliminar CO2 y H2S, pero no se puede regenerar el reactivo. El H2S se adsorbe mucho más rápido que el CO2, por lo que se puede conseguir una selectividad parcial con tiempos de contacto bajos y a bajas temperaturas.
Un ejemplo de efluente donde tenemos presentes ambos compuestos es en el biogás.
|
|
Las soluciones alcalinas presentan una alta eficiencia, sin embargo se han de mantener altos valores de pH para evitar la liberación de H2S (Regina 2006).
Procesos con otras sales alcalinas
El proceso Seaboard (ICF Kaiser) emplea una solución de carbonato de sodio. La ecuación general es:
2.3.2.3.Procesos con alcanolaminas
Este tipo de proceso permite tratar selectivamente la eliminación de H2S o la eliminación conjunta de H2S y CO2 con altas eficacias de eliminación.
El tratamiento con alcanolaminas es el método más comúnmente empleado para eliminar el ácido sulfhídrico de efluentes gaseosos, sobre todo en gases de refinería, y como método para purificar el gas natural (Jensen and Webb 1995b; Kohl and Nielsen 1997). Las alcanolaminas poseen un grupo hidroxilo en un extremo y un grupo amino en el otro. El grupo hidroxilo disminuye la presión de vapor e incrementa la solubilidad en agua, mientras que el grupo amino proporciona la alcalinidad requerida para la absorción de los gases ácidos.
La adsorción se dirige típicamente a altas presiones con recuperación de calor. También se emplean soluciones de glycol, para mejorar la absorción física de los gases ácidos. Algunos ejemplos de alcanolaminas empleadas en los lavadores son las siguientes: monoetanolamina (MEA), dietanolamina (DEA), diglicolamina (DGA), diisopropanolamida
(DIPA) y metildietanolamina (MDEA).
2.3.3. Solventes físicos
Cuando los gases ácidos no son rentables de tratar con procesos como el anterior, se suelen emplear solventes físicos, donde los gases ácidos simplemente se absorben en el líquido y se desorben reduciendo la presión.
2.3.3.1.Agua
La absorción de gases ácidos en agua genera soluciones corrosivas que deben ser tratadas. La solubilidad del H2S en agua vendrá dada por la constante de Henry.
2.3.3.2.Otros solventes físicos
Solventes como metanol, carbonato de propileno, éteres de polietileno, glicol, etc.
2.3.4. Procesos con membranas
Generalmente no se emplean membranas para el tratamiento selectivo de H2S del biogás, pero esta siendo un proceso atractivo para aumentar la calidad de biogás.