Viabilidad de un Proceso para la Eliminación conjunta de H2S Y NH3 contenido en Efluentes Gaseosos. Parte 10
 |
Martín Ramírez Muñoz TESIS DOCTORAL |
La presente Tesis ha sido co-dirigida por los Doctores D. Domingo Cantero Moreno, Catedrático de Ingeniería Química y D. José Manuel Gómez Montes de Oca, Profesor Titular de Ingeniería Química de la Universidad de Cádiz, y cumple los requisitos exigidos por la legislación vigente.
Fdo.: Dr. D. Domingo Cantero Moreno Fdo.: Dr. D. José Manuel Gómez Montes de Oca
Fdo.: Dr. D. José María Quiroga Alonso
Director del Dpto. de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente
Universidad de Cádiz
4.1.3.5. Estudio del efecto del tiempo de residencia
Una vez estudiado en el apartado anterior los valores máximos de eliminación para cada carga de alimentación, es importante conocer como afecta el tiempo de residencia del gas.
Para estudiar el efecto del tiempo de residencia se seleccionaron dos valores de carga de alimentación de 2,89 y 11,50 gS m-3 h-1, para cada valor de carga de alimentación se fue disminuyendo simultáneamente el tiempo de residencia del gas y la concentración de entrada, de forma que la carga fuese constante. Otra posibilidad de diseño experimental hubiese sido fijar una concentración de entrada constante e ir disminuyendo el tiempo de residencia, de forma que la carga fuese aumentando. Desde el punto de vista del diseño, a escalas mayores la primera opción es más interesante, dado que permite calcular la cantidad del compuesto de interés a eliminar por volumen empaquetado del biofiltro y por unidad de tiempo que estamos alimentando al sistema. Es posible, a modo de ejemplo, tener dos gases a tratar con concentraciones de 23 y 372 ppmv de H2S y lograr alimentar a un biofiltro la misma carga de 11,5 gS m-3h-1, variando el tiempo de residencia del gas de 11 segundos para el primero a 150 segundos para el segundo.
Se emplearon tiempos de residencia de 150, 120, 90, 60, 30, 20 y 11 segundos. El caudal de recirculación fue de 308 ml min-1 y el pH se mantuvo dentro del óptimo de trabajo entre 7,1 y 7,2. Para poder hacer un modelado cinético, se realizaron medidas de la concentración de ácido sulfhídrico a lo largo de la columna en los 5 puntos de toma de muestras, a alturas de 0,060; 0,130; 0,205; 0,275 y 0,354 metros.
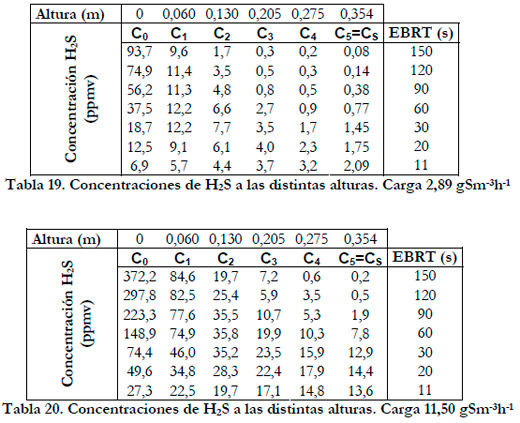
Con estos valores de carga de alimentación y en el rango de tiempo de residencia se tratan concentraciones de H2S de entrada desde 6,9 hasta 93,7 ppmv para la carga de 2,89 gS m-3h-1 y desde 27,3 hasta 372,2 ppmv para la carga de 11,50 gS m-3h-1, rango lo suficientemente amplio que abarca el rango de concentraciones estudiado por la mayoría de los investigadores. En las Tablas 19 y 20, se han representado los valores de las concentraciones medidos a las distintas alturas del biofiltro para las cargas de 2,89 y 11,50 gS m-3h-1 respectivamente.
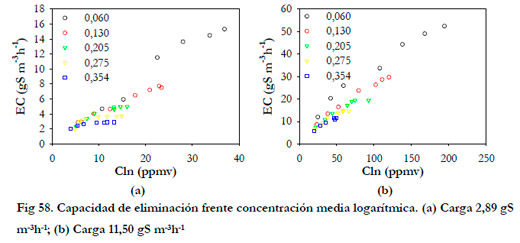
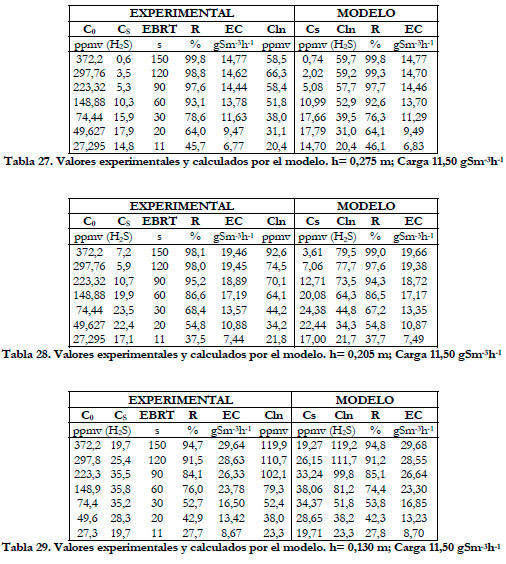
Si se representa la capacidad de eliminación frente a la concentración media logarítmica a las distintas alturas de la columna (Figura 58), se obtienen curvas que se ajustan a la ecuación del modelo suponiendo una cinética tipo Monod, obteniendo para cada altura un valor de Vmax y de la constante de saturación Km.
|
|
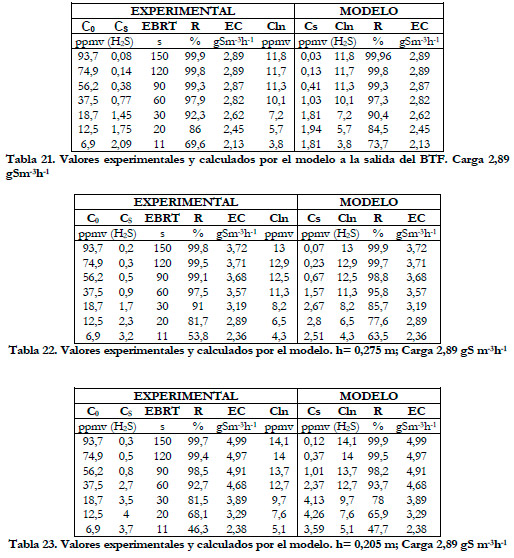
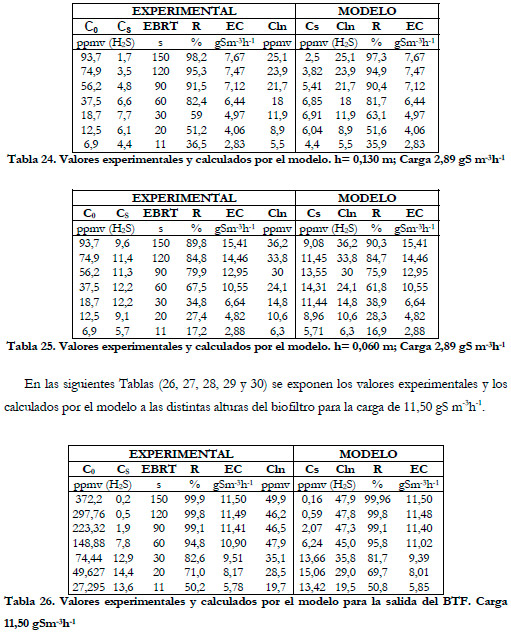
En las siguientes Tablas (21, 22, 23, 24 y 25) se exponen los valores experimentales y lo calculados por el modelo a las distintas alturas del biofiltro para la carga de 2,89 gS m-3h-1.
 |
 |
 |
 |
Obtenemos, al igual que en el estudio anterior, una disminución de los valores de las constantes cinéticas conforme aumenta la altura del lecho. En la Figura 59, se han representado los valores experimentales de la capacidad de eliminación frente a la concentración media logarítmica experimentales y calculados por el modelo.
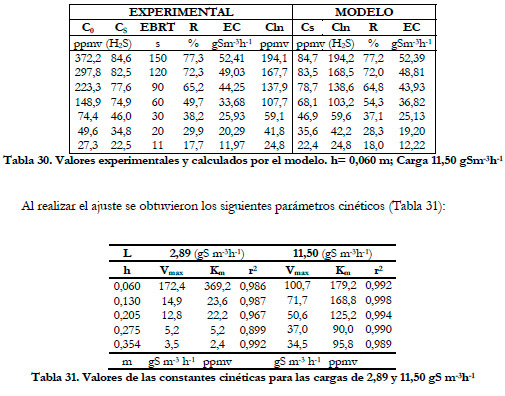
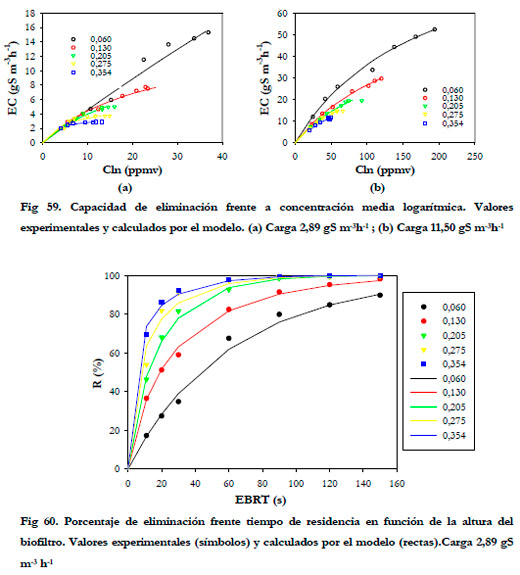
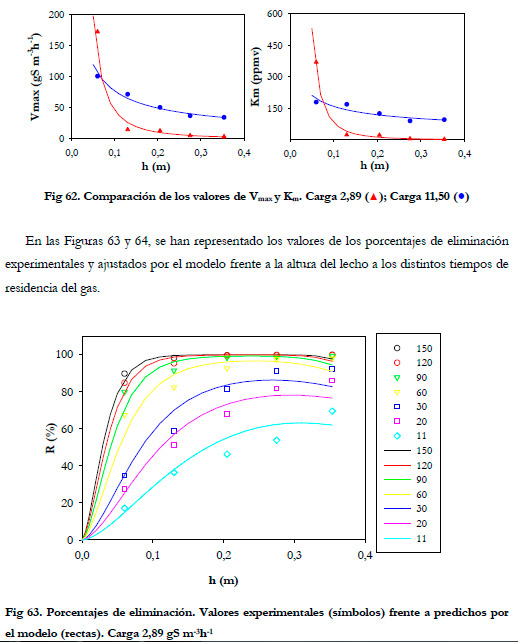
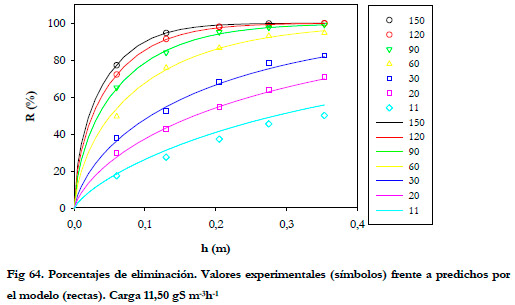
El efecto del tiempo de residencia sobre la carga se aprecia mejor si se representan los porcentajes de eliminación frente al tiempo de residencia en función de la altura del biofiltro. (Figuras 60 y 61).
 |
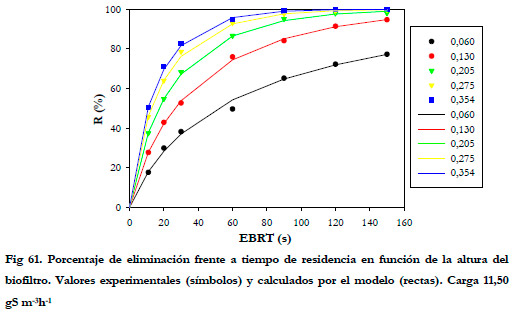 |
En las Figuras anteriores se observa que la mayor parte de la eliminación se produce en la primera sección del biofiltro, siendo ésta mayor conforme se aumenta el tiempo de residencia del gas. Para tiempos de residencia altos la diferencia entre los porcentajes de eliminación a las distintas alturas no son muy acusadas, lo que sugiere que la reducción del porcentaje de eliminación al disminuir el tiempo de residencia del gas no es debida a un tiempo insuficiente de reacción entre el sustrato y la biomasa, sino que se debe a un problema de difusión del ácido sulfhídrico desde la fase gas a la fase líquida tal y como reportan Yang and Allen (1994a). Algunos estudios previos indican que las bacterias del género Thiobacillus son capaces de metabolizar H2S en solo 1-2 s (Sublette and Sylvester 1987); por tanto, la biomasa presente en el biofiltro tiene una capacidad de degradación independientemente del flujo de gas que se suministre. Esta capacidad de degradación máxima se obtuvo en el experimento anterior, realizando el estudio de la eliminación de H2S con un EBRT de 150 segundos. Por tanto, puede afirmarse que el descenso que se produce al disminuir el tiempo de residencia, se debe a un problema de difusión del sustrato desde la fase gas a la fase líquida, siendo más acusada para los tiempos de residencia más bajos. Por tanto, cabría esperarse una menor diferencia entre los valores de eliminación cuando se mejore la transferencia gas-líquido.
En la Tabla 32, se exponen las ecuaciones obtenidas para el cálculo de las constantes cinéticas en función de la altura del lecho, utilizando para ello un modelo de ajuste multiplicativo.
 |
Empleando las ecuaciones de la Tabla 32 podemos obtener los valores de las constantes cinéticas a cada altura de la columna y, conocidos éstos, a partir de la ecuación del modelo propuesto, pueden realizarse iteraciones que permitan predecir la concentración a cualquier altura de columna para la carga de trabajo empleada. Los valores obtenidos como consecuencia de la linealización de las constantes cinéticas en función de la altura de biofiltro fueron: 3
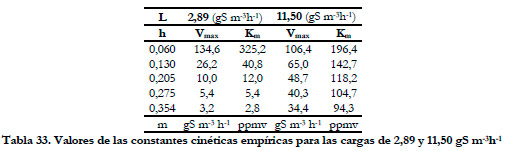 |
Así pues, en la Figura 62, se han representado los valores de los porcentajes de eliminación experimentales y ajustados por el modelo, frente a la altura del lecho a distintos tiempos de residencia del gas.
 |
 |
Las curvas del modelo dan, salvo para la carga de 2,89 gS m-3h-1, un buen ajuste. Habría que considerar que a esta carga de trabajo, la más baja de las ensayadas, los errores en la medida de concentraciones pequeñas pueden impedir comprobar la bondad del modelo propuesto.
Al mismo tiempo, hay que reseñar que el biofiltro empleado tiene algunas deficiencias desde el punto de vista del diseño hidrodinámico, que dificultan la transferencia de materia, y que, por tanto, impiden la obtención de valores más altos de eliminación. Algunas de estas deficiencias, fácilmente mejorables en un prototipo a escala de planta piloto, son: – Sistema de aspersión del medio de recirculación: el sistema de aspersión del medio de recirculación es poco eficiente, lo que sumado al pequeño diámetro de la columna, provoca que gran parte del medio de recirculación circule pegado a la pared del biofiltro. Este hecho supone una disminución de la eficacia en la transferencia de materia.
– Distribución poco uniforme del soporte en el biofiltro debido a la compactación del mismo. Este hecho puede provocar, junto con la formación en el medio de azufre elemental, un aumento de la pérdida de la carga.
Mediante la corrección de estas deficiencias se podría lograr mejorar la transferencia de materia y minimizar la caída de la eliminación, que se produce al disminuir el tiempo de residencia del gas para los distintos valores de la carga de entrada en el sistema
4.1.3.6.Estudio del efecto de la pérdida de carga
La pérdida de carga de la corriente gaseosa que atraviesa el lecho es uno de los parámetros que más afecta al coste de operación; así Leson et al. (1995), reportan que un incremento de la pérdida de presión desde 4 a 25 cm de agua supone un incremento de la energía necesaria desde 7 a 27 kW en sólo 6 meses.
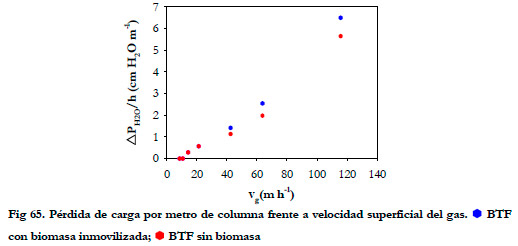
El tiempo de residencia del gas más bajo fue de 11 segundos, para el cual se obtuvo una perdida de carga de 2,3 cm de agua (6,5 cm de agua por metro de altura). En la Figura 65 se ha representado la pérdida de carga por metro de altura de columna frente a la velocidad superficial del gas, correspondiente a los tiempos de residencia de 150, 120, 90, 60, 30, 20 y 11 segundos.
 |
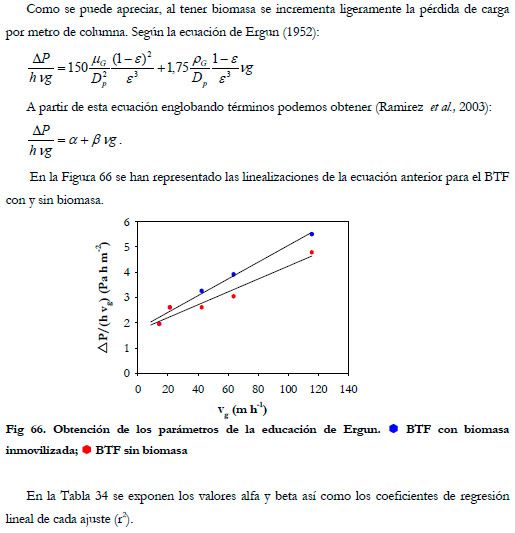 |
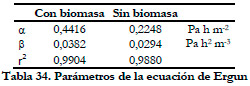 |
A la vista de los resultados podemos comprobar que la presencia de biomasa y azufre (derivado de la oxidación biológica del H2S) en el soporte no incrementa mucho la pérdida de carga de la columna, en comparación con el soporte sin colonizar. Esto supone una gran ventaja a la hora de los costes de operación e instalación en caso de un escalamiento industrial. De ambos valores (alfa y beta) el que tiene una mayor influencia en el aumento de la pérdida de carga es el valor beta al tratarse de la pendiente de la recta. Ramírez et al. (2003) estudian cinco tipos de soportes en un biofiltro, determinando los valores alfa y beta para cada material; los valores beta que obtuvieron fueron de 0,128; 4,934; 4,167; 2,271; 1,642 Pa h m-2 para cáscaras de cacahuete, bagazo de caña de azúcar, rastrojo de maíz, cáscara de arroz, y cáscara de coco respectivamente. Para la espuma de poliuretano el valor beta obtenido en nuestro estudio es muy inferior a los anteriores.
4.2.ELIMINACIÓN DE AMONIACO EN AIRE MEDIANTE Nitrosomonas europaea INMOVILIZADA EN UN BIOFILTRO DE ESCURRIMIENTO EMPAQUETADO CON ESPUMA DE POLIURETANO
4.2.1. Cinética de crecimiento
La bacteria Nitrosomonas europaea oxida el amoniaco a nitrito y en la naturaleza convive conjuntamente con la especie Nitrobacter sp., que realiza la oxidación de nitrito hasta nitrato, aunque se ha comprobado que la especie Nitrosomonas europaea es capaz de oxidar hasta nitrógeno en condiciones limitantes de oxígeno (Poth 1986; Shrestha et al., 2001). Como paso previo al estudio de la inmovilización, se realizó un experimento con el objetivo de determinar
la cinética de crecimiento del cultivo en medio ATTC#2265. En la Figura 67, se ha representado la variación del pH, de la concentración de amoniaco, de nitrito y biomasa total frente al tiempo de cultivo.
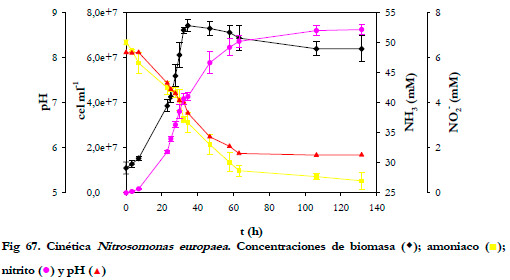 |
La concentración de biomasa inicial fue de 1,1·107 cel ml-1, alcanzándose un máximo de la población celular de 7,4·106 cel ml-1 a las 34 horas; momento a partir del cual la biomasa empieza a decrecer lentamente. El pH inicial del cultivo es de 8,0, y una vez alcanzada la fase exponencial de crecimiento, el pH decrece linealmente hasta un valor constante de 5,8 a las 63 horas. A partir de este momento, disminuye notablemente el metabolismo de la bacteria, manteniéndose constantes las concentraciones de amoniaco y nitrito. La concentración de amoniaco disminuyó desde 50 mM hasta 27 mM y la concentración de nitrito llegó hasta 7,22 mM.
Para calcular las velocidades de consumo de amoniaco y de producción de nitrito se ha supuesto una variación lineal de la concentración en la fase exponencial de crecimiento, obteniéndose una velocidad de consumo de amoniaco de 0,3477 mmol l-1 h-1 y de producción de nitrito de 0,1446 mmol l-1 h-1. Los coeficientes de regresión (r2) fueron de 0,982 y 0,961, respectivamente.
La velocidad específica máxima de crecimiento se puede obtener representando el logaritmo neperiano del cociente de la concentración de biomasa en cada instante y la concentración de biomasa inicial frente al tiempo (Figura 68).
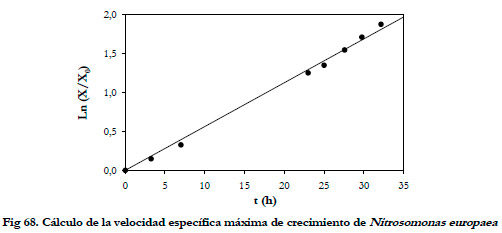 |
De esta forma, se obtuvo una velocidad específica de crecimiento (μ) de 0,0564 h-1 con un coeficiente de regresión lineal (r2) de 0,9958. El valor obtenido se encuentra dentro del rango obtenido por Prosser (1989) para cultivos continuos de Nitrosomonas europaea (0,039-0,064 h-1).
En cultivos discontinuos, Vadivelu et al. (2006) obtuvieron una velocidad especifica máxima de 0,043±0,007h-1 a pH 7 y 30ºC.
4.2.2. Desarrollo y adaptación de biopelículas
4.2.2.1. Inmovilización en matraces
Se llevaron a cabo 5 ciclos de inmovilización, con una duración total de 346 horas, para alcanzar una cantidad de biomasa inmovilizada de 3,97±0,70·109 células por gramo de espuma de poliuretano. La duración de cada ciclo fue de 54,8; 47,3; 45,2; 50,0 y 46,7 horas respectivamente, y el último ciclo se prolongó, una vez realizado el recuento de biomasa, hasta una duración total de 110 horas. En cada ciclo se reemplazó el medio del cultivo por medio nuevo antes de que el pH bajase de 6,0, puesto que a ese pH la bacteria disminuye su actividad metabólica y crecimiento (Hunik et al., 1992). Mediante la realización de ciclos consecutivos de retirada y reposición de medio se pretende inmovilizar la mayor cantidad de bacterias sobre el soporte. Esta técnica ha sido empleada anteriormente por Mesa et al. (2002) para la inmovilización de Thiobacillus ferrooxidans sobre este mismo soporte.
Este experimento de inmovilización se realizó por duplicado y se pudo comprobar que los dos cultivos evolucionaron de igual forma, lo que nos permite comprobar la reproducibilidad de la técnica utilizada. En las Figuras 69 y 70 tenemos representadas la evolución de la concentración de amoniaco, concentración de nitrito y pH para los cultivos A y B respectivamente.
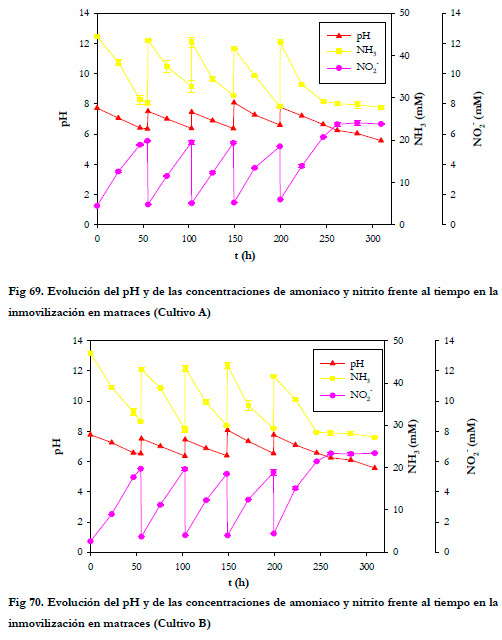 |
Fig 70. Evolución del pH y de las concentraciones de amoniaco y nitrito frente al tiempo en la inmovilización en matraces (Cultivo B)
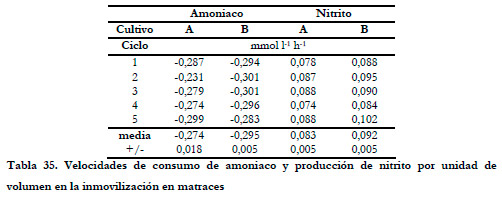
La velocidad de consumo de sustrato fue prácticamente constante e independiente de la cantidad de biomasa inmovilizada en el soporte, alcanzando valores medios de 0,274±0,018 y 0,295±0,005 (mmol NH3) h-1 l-1 para los cultivos A y B respectivamente. Al igual que para el cultivo de Thiobacillus thioparus, no se produce un aumento de la velocidad de consumo de sustrato al aumentar la cantidad de biomasa inmovilizada. Este fenómeno, contrario de mayor cantidad de biomasa y mantenimiento de la velocidad de consumo de sustrato, puede deberse a un problema de transferencia de oxigeno que límite la velocidad de consumo de sustrato, siendo el oxigeno el reactivo controlante de la oxidación biológica. La velocidad de producción de nitrito también se mantuvo constante con valores medios de 0,083±0,005 y 0,092±0,005 (mmol NO2 -) h-1 l-1 para los cultivos A y B respectivamente.
En la Tabla 35, se representan los valores de las velocidades de consumo de sustrato y producción de producto en cada ciclo, al igual que el valor medio.
 |
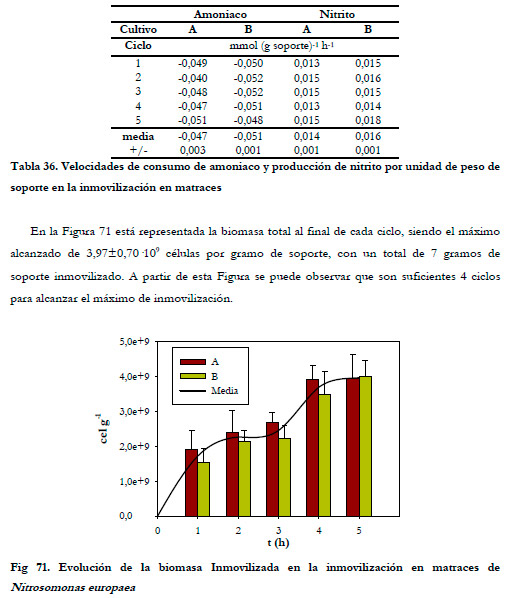
Si referimos las velocidades de consumo y producción con respecto a la cantidad de soporte (Tabla 36), obtenemos una velocidad de consumo de sustrato de 0,047±0,003 y 0,051±0,001 mmol (g soporte)-1 h-1 y de generación de nitrito de 0,014±0,001 y 0,016±0,001 mmol (g soporte)-1 h-1 para los cultivos A y B respectivamente.
 |
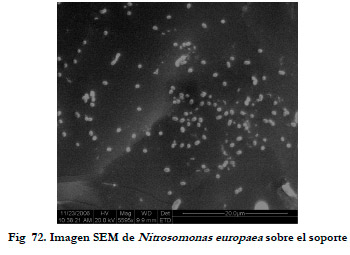
La Figura 72 muestra una imagen de microscopía electrónica de barrido en la que se pueden observar las bacterias inmovilizadas distribuidas uniformemente sobre la superficie del soporte.
 |
4.2.2.2.Inmovilización in situ
Se llevaron a cabo 10 ciclos de inmovilización con una duración total de 310 horas. El primer ciclo fue el más largo con una duración total de 78,0 horas, siendo el resto de ciclos más cortos, con una duración media de 23,7 horas. En la Figura 73 aparece una fotografía del sistema empleado para la inmovilización.
Las muestras fueron tomadas, por duplicado, en el punto medio del biofiltro y en este caso la inmovilización no fue tan homogénea como en el experimento anterior, debido a la propia dinámica de la inmovilización. El soporte presentó una gran variación en el número de bacterias inmovilizadas, como puede observarse en la Figura 74. Por tanto, como consecuencia de esta heterogeneidad en la inmovilización, al finalizar el 4º ciclo, una vez tomadas las muestras, se decidió inundar la columna durante una hora antes de llevar a cabo la sustitución del medio. El objetivo de esta inundación no era otro que tratar de conseguir la homogenización del sistema, así como, acelerar el proceso de inmovilización. Esta operación se repitió en los ciclos siguientes.
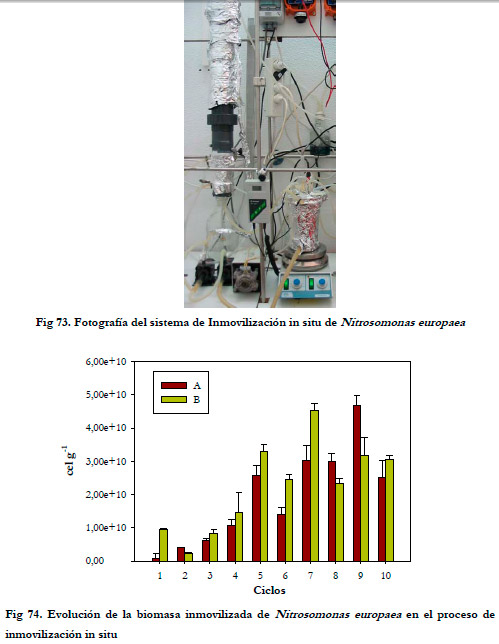 |
La cantidad media de biomasa inmovilizada en los cuatro últimos ciclos fue de 3,29±0,52·1010 células por gramo de soporte, siendo 8,3 veces mayor que la cantidad inmovilizada en matraces.
En las siguientes fotografías (Figura 75) se puede observar como la biopelícula empieza a crecer por las aristas del cubo de espuma de poliuretano en el cuarto ciclo, llegando en los últimos ciclos a cubrir la totalidad de la superficie, adquiriendo el soporte una tonalidad más oscura.
La velocidad de consumo de sustrato observada durante los ciclos de inmovilización no fue constante, hecho éste que corrobora la hipótesis que realizamos en el apartado anterior, sobre la posibilidad de que el aumento de la resistencia a la transferencia de oxigeno provoque una estabilización de la velocidad de consumo, al aumentar la cantidad de biomasa inmovilizada.
 |
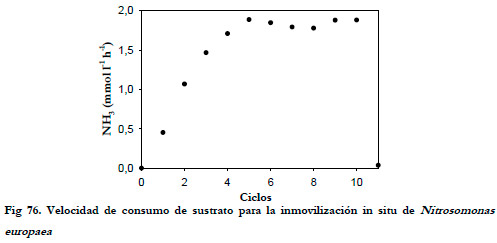
La velocidad media de consumo de amoniaco entre el 5º y 11º ciclo fue de 1,844±0,038 (mmol NH3) l-1 h-1, valor éste que supone 6,5 veces más la velocidad obtenida en el experimento de inmovilización en matraces. Si se refiere la velocidad de consumo a la cantidad de soporte empleada (10 g), se obtiene una velocidad de consumo promedio en los últimos ciclos de 0,240±0,005 (mmol NH3) (g soporte)-1 h-1, que supone 4,9 veces más que la velocidad obtenida para la inmovilización en matraces. En la Figura 76 esta representada la velocidad de consumo en cada ciclo de inmovilización.
 |
Por tanto, mediante esta técnica se consigue una mayor inmovilización y capacidad de consumo de sustrato que en la inmovilización en matraces. Con el objetivo de conocer la cantidad de biomasa viable que se encuentra inmovilizada en la espuma, se realizó una siembra en placa en medio ATCC#2265 con un 2% p/v de agar-agar, obteniéndose una cantidad de 1,22·109 CFU por gramo de soporte.
Si se considera la velocidad de consumo de sustrato como indicador del máximo grado de inmovilización de las bacterias, se puede afirmar que, en este caso, después de 5 ciclos se podría haber pasado a la siguiente etapa, lo que supone un tiempo de inmovilización de 7 a 8 días. Este tiempo podría haberse reducido si la operación de inundación, previa a la descarga, se hubiese realizado desde el primer ciclo.
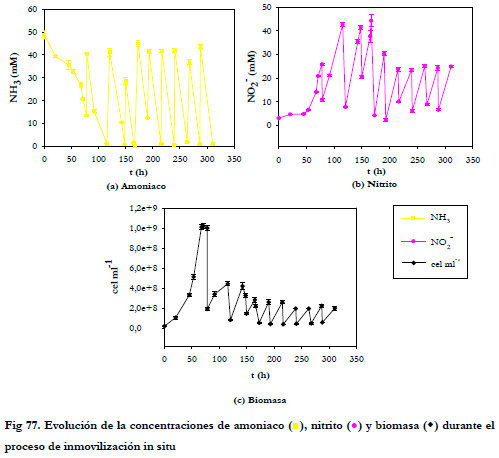
La Figura 77 muestra la evolución de las concentraciones de amoniaco, nitrito y biomasa en suspensión frente al tiempo durante el experimento de inmovilización. Como puede apreciarse, al finalizar cada ciclo la concentración de sustrato es prácticamente nula en la mayoría de los ciclos y la cantidad de biomasa libre disminuye progresivamente como consecuencia de la adhesión de las bacterias al soporte.
 |
La mayoría de los soportes empleados en eliminación de amoniaco mediante biofiltración son soportes orgánicos, destacando el uso de turba o compost (Hartikainen et al., 1996; Martin et al., 1996; Yani et al., 1998b; Smet et al., 2000; Pagans et al., 2005), aunque se han empleado soportes inorgánicos como fibras de carbón activo (Yani et al., 1998a), obsidiana sinterizada (Kim et al., 2000; Kim and Shoda 2002), espuma de poliuretano mezclada con polvo de carbón activo y zeolita (Kim et al., 2002b), cerámica (Kanagawa et al., 2004), tubos de plástico (Melse and Mol 2004) y coque (Chou and Wang 2007). En cuanto a los microorganismos empleados, la mayoría de los estudios utilizan lodos activos de depuradora como inóculo, siendo muy pocos los estudios que utilizan cultivos puros, a pesar de estar demostrado la disminución o supresión de la fase de aclimatación mediante el empleo de éstos (Ottengraf and Van den Oever 1983).
No existen antecedentes del uso de la espuma de poliuretano para la inmovilización específica de Nitrosomonas europaea. Sin embargo, Kim et al. (2002b) han empleado espuma de poliuretano cubierta con una mezcla de polvo de carbón activo y zeolita natural para inmovilizar poblaciones amonio oxidantes provenientes de un lodo. La cantidad de bacterias inmovilizadas al cabo de 53 días de operación fue de 1,58·109 células (g soporte)-1, cantidad inferior a la obtenida por la técnica de inmovilización en matraces (3,97±0,70·109 células por gramo de soporte) y por inmovilización in situ (3,29±0,52·1010 células por gramo de soporte).
Se ha realizado inmovilización de Nitrosomonas europaea por atrapamiento en materiales como alginato de calcio (van Ginkel et al., 1983) y k-carragenato (Wijffels and Tramper 1989; Wijfels et al., 1994). El alginato de calcio presenta una serie de desventajas, fundamentalmente de inestabilidad ante la presencia de compuestos quelatantes como iones fosfatos, citrato, lactato y glucanato, los cuales forman complejos con el calcio desestabilizando el gel (Smidsrod and Skjak-Braek 1990). Los carragenatos tienen propiedades similares a los alginatos, y de los tres tipos de carragenatos (lambda, kappa e iota), el tipo kappa es el más apropiado para la inmovilización de células (Van de Velde et al., 2002). El k-carragenato gelifica por la presencia de cationes covalentes como K+, Rb+, Cs+ y NH4 +, formando en comparación con el alginato cálcico un gel menos elástico.
En biofiltración, la utilización de esta bacteria en cultivos puros (Nitrosomonas europaea ATCC 19718) para la eliminación de amoniaco ha sido estudiada por Chung and Huang (1998) realizando una inmovilización en esferas de alginato de calcio, partiendo de una concentración de 105 CFU (g seco)-1. Igualmente, ha sido utilizada por estos mismos autores co-inmovilizada con Thiobacillus thioparus CH11 en esferas de alginato calcio a la misma concentración (Chung et al., 2000) y sobre carbón activo (Chung et al, 2007).