Usos de la tierra y distribución de la materia orgánica particulada béntica en ríos de montaña (Patagonia, Argentina)
RESUMEN.
A nivel mundial existe una gran preocupación acerca de cómo los distintos usos de la tierra afectan la integridad ecológica de los recursos acuáticos. En este trabajo evaluamos en qué medida el uso de la tierra afecta la distribución de diferentes fracciones de materia orgánica particulada béntica (MOPB), y la producción primaria de ríos de montaña. Estudiamos 18 ríos patagónicos rodeados por ambientes sometidos a diferentes usos (pasturas, plantaciones de pinos exóticos, urbanos, preurbanos, bosque de ñire explotado y sin disturbar). En distintos hábitats de cada río (rápidos y pozones), se examinaron distintas fracciones de la MOPB y se evaluó la cantidad de clorofila ‘a’. En términos de biomasa total, la materia orgánica particulada gruesa (MOPG) fue mayor en los sitios forestados, tanto con especies nativas como con pino respecto de los sitios de pasturas. Dentro de los componentes de la MOPG, la biomasa de madera y material fragmentado fue mayor en los sitios de bosque de ñire con y sin intervención, y la biomasa de hojas fue mayor en el bosque de ñire explotado. Los valores de clorofila perifítica no variaron de manera consistente con el uso de la tierra. La biomasa de briófitas fue significativamente mayor en el bosque de ñire; en cambio, la biomasa de macrófitas fue sensiblemente mayor en el uso urbano. En la escala de hábitat, los rápidos presentaron mayor biomasa de hojarasca entera y briófitas que los pozones, lo que indicaría que las prácticas de uso del suelo modifican tanto la entrada de detrito alóctono como la producción autotrófica. La reintroducción de especies arbóreas y la retención de parches de bosque nativo en los corredores ribereños podrían mitigar la escasez de MOPG en los ríos de áreas bajo pastoreo. La correcta disposición del material de descarte luego de las cortas y la sectorización de los accesos del ganado a los cursos de agua favorecerían las condiciones de las riberas y el hábitat dentro de los ríos.
Palabras clave: Hojarasca; Detrito; Algas; Clorofila ‘a’; Vegetación ribereña; Ríos patagónicos.
INTRODUCCIÓN
Los cambios en el uso de la tierra de cuencas hidrográficas han ocasionado modificaciones profundas de los ecosistemas acuáticos. Las distintas prácticas han afectado las características ambientales, la integridad ecológica y la biodiversidad de los cursos de agua en vastas áreas del planeta (Allan 2004) debido a las interacciones múltiples entre los ríos y el paisaje circundante (Ward 1989). En los sistemas hídricos, el nexo esencial entre el ecosistema terrestre y el acuático es la vegetación ribereña (Abelho & Graça 1998). Los corredores ribereños actúan como zonas de amortiguación y evitan la erosión de las riberas, mitigan el ingreso de contaminantes, regulan la temperatura y disminuyen la entrada de luz, que repercute en la productividad primaria (Newbold et al. 1980; Scarsbrook & Halliday 1999; Miserendino 2005). La combinación de una disponibilidad determinada de nutrientes con temperaturas adecuadas y luz solar puede promover el desarrollo de macrófitas en ambientes sometidos al pastoreo o en tramos posturbanos (Quinn & Linkater 1993; Collier et al. 2000; Morley & James 2002). La alteración de los corredores ribereños puede modificar la cantidad y la calidad de la materia orgánica que ingresa al sistema, y esto, a su vez, puede tener consecuencias sobre los niveles tróficos superiores (Cillero et al. 1999; Scarsbrook et al. 2001; Osborne & Kovacic 1993).
El detrito alóctono es el recurso de mayor energía en los ríos y arroyos de las áreas boscosas dado que muchos invertebrados acuáticos ingieren este tipo de detrito (Danger & Robson 2004; Mollá et al. 2006). La retención de la hojarasca es un factor determinante de la abundancia de desmenuzadores, y la protección y la estabilización de las riberas pueden aumentar la proporción de áreas someras marginales con un impacto positivo sobre la retención de la hojarasca (Flory & Milner 1999). Este y otros estudios ponen en evidencia la función de la vegetación ribereña en el mantenimiento de la heterogeneidad espacial en la escala de hábitat. Por otro lado, la heterogeneidad física, incluyendo el tipo de sustrato y la velocidad de la corriente, son variables que tienen una influencia marcada en la retención y la distribución de la materia orgánica (Hauer & Resh 1996; Braillie & Davies 2002).
En un río de cabecera se pueden diferenciar dos tipos de hábitat: los rápidos y los pozones. Los rápidos son áreas de erosión turbulentas, oxigenadas y heterogéneas (Brown & Brussock 1991), mientras que los pozones son lugares en donde el agua fluye de forma lenta, de deposición de materiales y con una profundidad mayor de 35 cm. En estudios llevados a cabo en ríos patagónicos, Velásquez & Miserendino (2003 a,b) encontraron que la distribución de la materia orgánica particulada gruesa (MOPG) y fina (MOPF) difería entre estos tipos de hábitat, lo que impactaba sobre las comunidades de invertebrados. Más aun, estas autoras señalaron el papel de las macrófitas en la estructuración del hábitat.
La evaluación del estado de la vegetación ribereña de ríos patagónicos como consecuencia de los usos de la tierra también ha llamado la atención de los ecólogos (Kutschker et al. 2009). Sin embargo, aún no se comparan los beneficios derivados de las especies ribereñas nativas e introducidas, especialmente en relación a la cantidad y calidad del detrito alóctono que se incorpora a los ríos (Collier 1995). La conversión de bosques a pasturas para uso ganadero, la deforestación para extracción de leña y carpintería, las plantaciones de especies exóticas y la urbanización son los tipos de uso de la tierra más frecuentes en la Patagonia argentina (Miserendino 2005; Temporetti 2006; Miserendino et al. 2008). En este trabajo nos proponemos evaluar si el uso de la tierra modifica (1) la cantidad y la distribución de las distintas fracciones de materia orgánica particulada, en relación al hábitat (pozón/rápido), y (2) la producción autotrófica en ríos de montaña.
MATERIALES Y MÉTODOS
Área de estudio
El área de estudio (Figura 1) se ubica en el NO de la Provincia del Chubut, desde los 42º S hasta los 44º S, y comprende zonas de bosque subantártico dominado por especies de Nothofagus y el bosque de transición, caracterizado por Austrocedrus chilensis (ciprés de la cordillera) y Maytenus boaria (maitén). El clima en la región es templado frío a frío húmedo cordillerano, con un marcado gradiente oeste-este de precipitaciones nivales y pluviales durante el invierno, con valores que oscilan entre 3000 mm/año en la cordillera y 150 mm/año hacia la meseta del Este. Los veranos son templado frescos, y la probabilidad de ocurrencias de heladas se registra durante todo el año (121.4 días/año). La temperatura media de la estación cálida no supera los 20 ºC, y la media anual los 9 ºC. Los ríos de la región se alimentan principalmente de las precipitaciones pluviales y nivales, cuyo régimen de descarga muestra dos picos máximos al año, el primero debido a las fuertes precipitaciones invernales y el segundo causado por el derretimiento de hielo y nieve en las montañas (Coronato & del Valle 1988). Desde el punto de vista fitogeográfico, las áreas seleccionadas pertenecen al Distrito del bosque caducifolio de la Provincia Subantártica, dominado por especies arbóreas de follaje caduco como Nothofagus pumilio (lenga), que a la latitud estudiada ocupa el límite altitudinal del bosque por encima de los 800 m.s.n.m., y N. antarctica (ñire), y por N. dombeyi (coihue) y Austrocedrus chilensis (ciprés de la cordillera) entre las perennifolias. En la transición del bosque con el Distrito occidental de la Provincia Patagónica, la vegetación alterna entre bosques de Maytenus boaria (maitén), Lomatia hirsuta (radal), Schinus patagonicus (laura) y parches de ciprés de la cordillera, con estepas arbustivas, subarbustivas y graminosas típicas del ecotono (Cabrera & Willink 1980).
 Figura 1. Ubicación de los sitios de estudio, Noroeste de Chubut, Patagonia Argentina. Código de los sitios en Tabla 1. |
Muestreo y caracterización ambiental
Se seleccionaron 18 sitios (Figura 1) en ríos cordilleranos con distintos usos de la tierra: pasturas, forestación con especies exóticas, bosque de ñire sin disturbar, bosque de ñire explotado, urbanos y preurbanos (n=3 para cada uso). Kutschker et al. (2009) presentan una caracterización detallada de los sitios muestreados. El muestreo se llevó a cabo durante marzo de 2006 debido a que es un momento estable desde el punto de vista hidrológico (Miserendino & Pizzolón 2003). En cada sitio se tomaron seis repeticiones con red Surber (250 µm de poro y 0.09 m2), de las cuales tres se localizaron en pozones y tres en rápidos. Las muestras se fijaron «in situ» con formol (10%) y luego fueron procesadas en laboratorio. En cada sitio, además, se cuantificaron parámetros físicos y químicos (Hauer & Resh 1996), el largo y el ancho de cada tramo estudiado, la temperatura del aire y del agua (en correderas), la velocidad del agua, la profundidad del río, la conductividad, la turbidez y la cantidad de oxígeno disuelto en el agua (Horiba U 10) y se caracterizó el sustrato por medio de una grilla de 1 m2 (Gordon et al. 1994).
Análisis de detrito y clorofila ‘a’
De cada muestra se separaron los principales componentes de la materia orgánica particulada (MOP). Para la obtención de la MOP se utilizaron dos tamices uno de 1000 µm y 250 µm, que permitieron separar la materia orgánica particulada gruesa (MOPG) y la fracción de materia orgánica particulada fina (MOPF), respectivamente. La MOPG, a su vez, fue clasificada en varios componentes: madera, hojarasca entera, y otros (principalmente materiales fragmentados de origen alóctono). Con este procedimiento (tamiz de 1000 µm) también se separaron y cuantificaron los componentes del detrito autóctono: macrófitas y briófitas. La materia orgánica particulada béntica total (MOPB) se estimó como la suma de MOPG y MOPF en cada una de las repeticiones. Los componentes de la materia orgánica fueron secados en estufa a 105 ºC durante 4 h, (Voelz & Ward 1990) y luego fueron pesados.
Las muestras de clorofila ‘a’ (perifítica) se tomaron a partir de cinco rocas del lecho tomadas al azar en cada sitio muestreado, que se cepillaron y lavaron «in situ». El material obtenido se analizó por espectrofotometría (Wetzel & Likens 1991). Se calculó el área de cobertura de la comunidad algal (mg/m2), para lo cual a cada roca se le estimó la superficie expuesta (Scarsbrook & Halliday 1999).
Análisis estadísticos
Las diferencias de las características ambientales por uso de la tierra se examinaron mediante modelos de ANOVA no paramétricos por rangos (Kruskal-Wallis). Además, se realizaron pares de comparaciones mediante la prueba de Mann Whitney (Sokal & Rohlf 1995). Se ponderó la significación de las diferencias de biomasa del detrito por uso de la tierra y por hábitat, lo cual se realizó mediante un análisis de la varianza de dos factores. Previo al análisis se normalizó la distribución de los datos originales utilizando la transformación log(x+1) (Ludwing & Reynols 1988). Se calcularon los radios parciales (F) en los modelos obtenidos para los efectos: uso, hábitat y para las interacciones uso y hábitat. Para ponderar la significación de las diferencias se realizó la prueba de Tukey (Sokal & Rohlf 1995). Dado que las muestras de clorofila perifítica se tomaron sólo en las correderas, se examinaron las diferencias por uso de la tierra mediante la prueba de Kruskal Wallis (Sokal & Rohlf 1995).
RESULTADOS
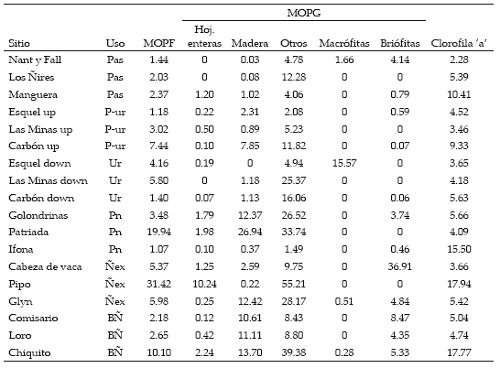
Las características físico-químicas de los cursos de agua difirieron entre los sitios (Tabla 1). En general, se observó que los sitios de bosque de ñire presentaron una temperatura del agua significativamente menor que los de pastura y urbanos (P<0.01). El ancho del lecho mojado estuvo comprendido entre 0.9 m en el bosque de ñire explotado y 21 m en un sitio de pastura (Tabla 1). La profundidad media mínima fue 8 cm y correspondió a un sitio de bosque de ñire explotado, y la profundidad media máxima fue 33 cm en un sitio forestado con especies exóticas (Tabla 1). Los mayores valores de conductividad del agua se registraron en los ambientes urbanos y preurbanos y los menores en los bosques de ñire sin disturbar (Tabla 1). Si bien el análisis no paramétrico no resultó en diferencias significativas por usos para la conductividad (P=0.17, Tabla 1), se observó que los ríos rodeados por pasturas presentaron mayores valores que aquellos rodeados por bosques de ñire explotados, y los de los sitios preurbanos mayores que los de bosque de ñire sin disturbar (P<0.05, Tabla 1). El nivel de oxígeno disuelto en los sitios rodeados por bosques de ñire sin disturbar fue mayor que en sitios bajo otro uso (P=0.02, Tabla 1). Las categorías de sustrato dominante correspondieron a bloque/guijón y guijón/guijarro. En algunos sitios con vegetación leñosa (ver Los Ñires, Pipo, Golondrina y Patriada en Tabla 1) se observó un predominio de sedimentos finos (arena), que en algunos casos alcanzaron valores de hasta 40%.
Tabla 1 (click aquí) . Denominación, uso predominante del suelo (Pas: pastura, P-ur: preurbano, Ur: urbano, Pn: forestación con especies exóticas, BÑ: bosque de ñire sin disturbar y Ñex: bosque de ñire explotado), características físico químicas y categorías principales de sustrato (en porcentajes) de los 18 sitios de muestreo durante el período de estudio (Marzo 2006), noroeste de Chubut.
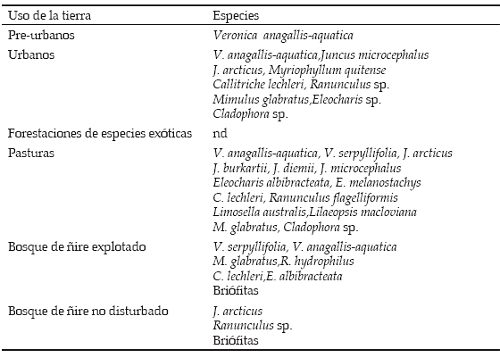
Se registraron un total de 15 especies de plantas acuáticas, de las cuales 14 estuvieron presentes en los ambientes con pastura, en contraste con los sitios forestados con especies exóticas, que no presentaron plantas acuáticas (Tabla 2). Por su parte, los ambientes urbanos presentaron una cobertura de plantas acuáticas mayor al 50% del lecho del río (Tabla 1). Las especies más representadas fueron Veronica anagallis-aquatica y Callitriche lechleri (Tabla 2). En uno de los sitios de pastura (Los Ñires) se registró el alga filamentosa Cladophora sp., y en uno de los sitios urbanos (Esquel abajo) hubo una presencia notable de Myriophyllum quitense, macrófita sumergida, acompañada de Callitriche lechleri y Ranunculus sp, y Cladophora sp. En los sitios de bosque de ñire sin disturbar se registraron juncáceas (Juncus arcticus) y Ranunculus sp., y las briófitas estuvieron en su mayoría representadas en bosque de ñire con y sin intervención (Tabla 2).
Tabla 2. Vegetación acuática por uso de la tierra (n=3), correspondientes a 18 sitios de ríos de cordillera patagónica muestreados durante marzo de 2006, nd: no detectado.
 |
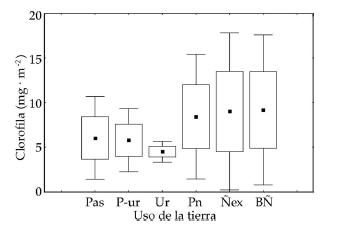
Los valores de clorofila ‘a’ estuvieron comprendidos entre 2 y 18 mg/m2 en ambientes de pastura y bosque de ñire explotado, respectivamente (Tabla 3). En general, los valores menores se registraron en los sitios urbanos, preurbanos y de pastura, aunque las diferencias observadas no fueron significativas (P=0.84, Figura 2).
Tabla 3. Valores medios de biomasa (g.m-2) de las distintas categorías del detrito (n=6) y de clorofila a (mg.m-2) por sitio de muestreo durante marzo 2006. Pas: pastura, P-ur: preurbano, Ur: urbano, Pn: forestación con especies exóticas, BÑ: bosque de ñire sin disturbar y Ñex: bosque de ñire explotado.
|
|
Figura 2. Valores medios de clorofila perifítica (mg.m-2) por uso de la tierra (n=3), correspondientes a 18 sitios de ríos de cordillera patagónica muestreados durante marzo de 2006. Media: cuadrados oscuros, barras: máximo y mínimo, cajas: intercuartiles (25-75%). Pas: pastura, P-ur: preurbano, Ur: urbano, Pn: forestación con especies exóticas, BÑ: bosque de ñire sin disturbar y Ñex: bosque de ñire explotado.
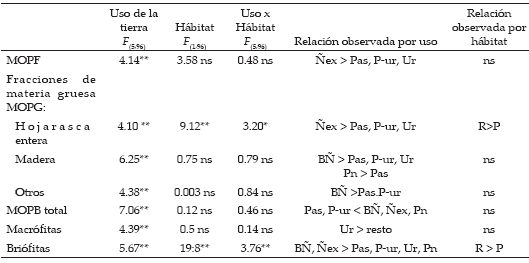
La MOPF varió entre 1 y 31 g/m2, y se registraron valores significativamente mayores en los sitios de bosque de ñire explotado que en los de pastura, urbanos y preurbanos (Figura 3, Tabla 4). La biomasa de hojas enteras (material alóctono) varió entre 0 y 2 g/m2 y, en general, los sitios vegetados con especies leñosas (nativas o exóticas) presentaron los mayores valores (Tabla 4). Sin embargo, sólo el bosque de ñire explotado presentó valores significativamente mayores que los usos pasturas, preurbanos y urbanos. A su vez, la biomasa de madera fue más abundante en sitios con vegetación leñosa que en los urbanos o de pastura. El bosque de ñire sin disturbar presentó valores significativamente mayores a los sitios de pastura, urbanos y preurbanos, y el bosque de exóticas presentó una mayor biomasa que los sitios de pastura (P<0.001). La MOPB total fue menor en los ambientes de pastura y preurbanos que en los sitios con vegetación leñosa (P<0.005). En relación con el material autóctono, se encontró mayor biomasa de macrófitas en los sitios urbanos, y mayor biomasa de briófitas en los sitios de bosque de ñire con y sin intervención (Tabla 4). En relación con el tipo de hábitat, en general se observó una mayor acumulación de MOPF en los pozones que en los rápidos, pero las diferencias no fueron significativas. La hojarasca entera y la biomasa de briófitas fue mayor en los rápidos que en los pozones para todos los tipos de uso de la tierra (Figura 3, Tabla 4).
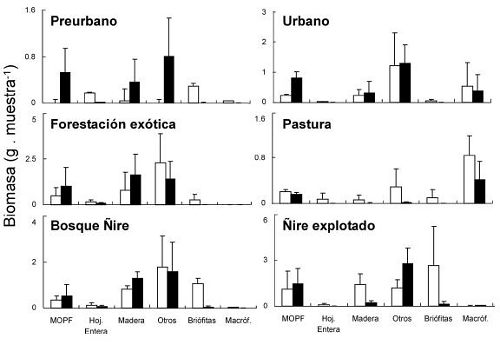 |
Figura 3. Biomasa media total (n=3, ±DE) de distintas categorías de detrito por uso de la tierra en rápidos (barras claras) y pozones (barras negras) correspondiente a 18 sitios de ríos de cordillera en el noroeste de Chubut (Marzo 2006).
Tabla 4. Resultados de análisis de dos vías ANOVA examinando los efectos del usos de la tierra y el hábitat en la MOPF y las fracciones de la MOPG y la MOPBt en los 18 ríos cordilleranos. Las variables fueron transformadas como log (x+1), Significación: *: P<0.05; **: P<0.005, resultado del análisis a posteriori de Tukey. R: rápido, P: pozón. Pas: pastura, P-ur: preurbano, Ur: urbano, Pn: forestación con especies exóticas, BÑ: bosque de ñire sin disturbar y Ñex: bosque de ñire explotado.
 |
DISCUSIÓN
En este estudio se observaron diferencias significativas en las características físico-químicas y en la distribución de las distintas fracciones del detrito en relación al uso de la tierra, lo que es consistente con estudios recientes llevados a cabo en países de los Hemisferios Norte y Sur (Collier et al. 2000; Riley et al. 2003; Thompson & Towsend 2004; Danger & Robson 2004). Si bien los ríos estudiados fueron de orden bajo a mediano, algunos de los sitios presentaron un porcentaje de sedimentos finos mayor que el esperado, y esto se relacionó con ciertos usos. Quinn & Linklater (1993) sostienen que la aceleración de los procesos de sedimentación es uno de los efectos más comunes en ríos que atraviesan áreas sometidas al pastoreo. Esto fue documentado en un sitio de pastura (Los Ñires), que presentó un alto porcentaje de arena como consecuencia del constante aporte de materiales de la ribera causado por el pisoteo del ganado y por la ausencia de vegetación ribereña. Por otra parte, en un sitio de bosque de ñire explotado (Pipo) también se observó una mayor deposición de arena, posiblemente debido a la fuerte obstrucción del cauce, provocada por restos vegetales descartados durante la extracción de madera (madera, ramas y hojarasca) (Kutschker et al. 2009). En este sitio, las cortas de leña afectaron, incluso, a árboles de la zona ribereña o de amortiguación, y se tradujo además en una alta biomasa de la MOPF. Una situación similar se observó en un sitio forestado con pinos (Patriada), en el que se detectó una gran cantidad de sedimentos finos y valores importantes de MOPF. Esto podría estar potenciado por un incendio producido en la zona en años recientes. Dwire et al. (2005) documentaron un aumento notorio y persistente de la MOPF luego de un incendio forestal en ríos del oeste de Wyoming.
Los patrones de temperatura del agua observados fueron los esperados y se relacionaron con la presencia de vegetación ribereña. Es decir, la temperatura fue mayor en aquellos sitios sin canopeo (i.e., los de pasturas y los urbanos), y fue menor en los ríos que atravesaron el bosque de ñire. Estos resultados son similares a los encontrados por Collier et al. (2000) en ríos de Nueva Zelanda, y a los de Scrimgeour & Kendall (2003) en ríos de Canadá. En general, los mayores valores de la conductividad del agua se registraron en los usos urbano, preurbano y pasturas, lo que es probable que refleje la alteración físico-química del agua provocada por los usos de la tierra, el aporte de nutrientes, materiales en suspensión, contaminantes y otros.
Los valores de la clorofila perifítica registrados en este estudio son comparables a los encontrados en tributarios de la cuenca alta del río Chubut afectados por la ganadería extensiva (Miserendino 2009). Si bien esperábamos un incremento de este parámetro como respuesta a una mayor incidencia de luz al cauce y al posible aporte de nutrientes en los ríos rodeados de pasturas (Collier & Winterbourn 2000), los rangos de variación de la clorofila perifítica prácticamente se solaparon en todos los usos estudiados. Esto es consistente con lo observado por Scrimgeour & Kendall (2003) para ríos neozelandeses sometidos a pastoreo. En otro estudio, Scarsbrook & Halliday (1999) tampoco observaron diferencias significativas en la cantidad de clorofila ‘a’ y los distintos usos de la tierra, pero sí mostraron un incremento en la clorofila perifítica a medida que el curso de agua se distanciaba de las zonas forestadas.
La participación de briófitas en los sitios de bosque nativo con o sin intervención fue significativamente mayor que la de los sitios de pasturas y de pinares. Riley et al. (2003) realizaron las mismas observaciones comparando ríos de áreas de uso agrícola con ríos en bosque nativo. Por otra parte, y de acuerdo a lo esperado, los sitios urbanos mostraron mayor biomasa de macrófitas con respecto al resto de usos de la tierra. En los ambientes urbanos y periurbanos, el aporte de nutrientes (nitrógeno y fósforo), ya sea por fuentes puntuales o difusas, sumado a una mayor exposición solar, suele favorecer la proliferación de macrófitas (Suren 1993). Si bien las plantas acuáticas favorecen la recirculación de los nutrientes, ofrecen refugio y sustrato a las comunidades de invertebrados, pueden resultar en un recurso espacial pobre si monopolizan el lecho del canal (Barbour et al. 1999). Este no es un dato menor si se considera que más de 50% del lecho en el sitio Esquel aguas abajo estuvo colonizado por macrófitas.
El tipo de vegetación presente en la zona ribereña es un determinante crítico del ingreso de detritos a los cursos de agua (Cillero et al. 1999; Mollá et al. 2006). En términos relativos, se puede caracterizar a la entrada de materiales alóctonos al cauce en sitios forestados como constante en masa, distribución y composición. En cambio, en los sitios de pastura, por lo general la entrada es baja y no constante (Riley et al. 2003). En este estudio, el material alóctono fue importante en todos los usos de la tierra incluyendo ambientes urbanos y de pasturas. Sin embargo, en términos de biomasa total, la MOPG fue significativamente mayor en los sitios con vegetación leñosa, nativa o exótica (Scarsbrook et al. 2001), con respecto a los sitios de pasturas. En su mayoría, este patrón se reflejó en todas las fracciones analizadas de la MOPG. La contribución de madera, tanto en sitios de bosque nativo como exótico, fue mayor que la de los sitios de pasturas. Esto incrementa de manera fuerte la disponibilidad de madera como sustrato dentro del río. Sin embargo, Thompon & Towsend (2004) advierten que las bacterias y los hongos pueden subutilizar la madera de pino en relación a la que aportan los bosques autóctonos. Esto puede tener consecuencias sobre los niveles tróficos superiores. En el presente trabajo no observamos diferencias de biomasa de la hojarasca entera ni del material fragmentado entre los sitios de bosque nativo (con y sin intervención) y el exótico; es decir, la contribución alóctona del detrito fue similar en términos de biomasa. No obstante, varios autores observan que la calidad del detrito proveniente de especies nativas o exóticas, en términos de palatabilidad y de tasa de descomposición, puede tener muchas implicancias ecológicas (Abelho & Graça 1998; Braillie & Davies 2002; Danger & Robson 2004).
Estas observaciones resultan muy importantes en relación al manejo de los corredores ribereños y a la hora de realizar tareas de mitigación o de restauración de ríos en la cordillera patagónica. La reintroducción de especies arbóreas, así como la retención o la protección de parches de bosque nativo en los corredores ribereños, puede mitigar la escasez de MOPG en los ríos que atraviesan ambientes sometidos a pastoreo. Por otra parte, el mejoramiento de las prácticas silviculturales, tales como la correcta disposición del material de descarte luego de las cortas y la sectorización de los accesos del ganado a los cursos de agua, favorecerán las condiciones no sólo de las riberas sino del hábitat dentro de los ríos (e.g., disminución de los procesos de sedimentación). Estás prácticas, que ya han sido puestas en marcha en otros países, muestran un escenario más favorable en ríos sometidos a distintos disturbios antrópicos (De Grooth et al. 2007).
AGRADECIMIENTOS
A todo el personal del LIESA (UNPSJB) por la colaboración en las tareas de campo y a la Lic. Adriana Kutschker por la identificación de la vegetación acuática. Este trabajo fue financiado por el PIP 5733 – CONICET y por la AWARE PROJECT FOUNDATION P-001036 (USA). Contribución Nº 51 del LIESA. Agradecemos a dos árbitros anónimos que contribuyeron a mejorar el manuscrito.
BIBLIOGRAFÍA
ALLAN, JD. 2004. Landscapes and riverscapes: The influence of land use on stream ecosystems. Ann. R. Ecol., 35:257-284.
ABELHO, M & MAS GRAÇA. 1998. Litter in first-order stream of a temperate deciduous forest (Margaraça Forest, central Portugal). Hydrobiologia, 386: 147- 152.
BARBOUR, MT; J GERRITSEN; BD SNYDER & JB STRIBLING. 1999. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. US EPA, Office of Water: Washington, D.C. USA.
BRAILLIE, BR & TR DAVIES. 2002. Influence of large woody debris on channel morphology in native forest and pine plantation in the Nelson region, New Zealand. New Zeal. J. Mar. Fresh., 36: 763- 774.
BROWN, AV & PP BRUSSOCK. 1991. Comparation of benthic invertebrates between riffles and pools. Hydrobiologia, 220:99-108.
CABRERA, A & A WILLINK. 1980. Biogeografía de América Latina. Monografía N°13. Secretaría General de la Organización de los Estados Americanos (OEA). Washington D.C. USA.
CILLERO, C; I PARDO & ES LÓPEZ. 1999. Comparisons of riparian vs. over stream trap location in the estimation of vertical litterfall inputs. Hydrobiologia, 416:171-179.
COLLIER, KJ. 1995. Environmental factors affecting the taxonomic composition of aquatic maroinvertebrate communities in lowland waterways of Northland, New Zealand. New Zeal. J. Mar. Fresh., 29:453-465.
COLLIER, KJ & MJ WINTERBOURN. 2000. New Zealand stream invertebrates: Ecology and implications for management. New Zealand Limnological Society. Pp. 414.
COLLIER, KJ; JS BRIAN & JM QUINN. 2000. Biodiversity of stream invertebrates faunas in a Waikato hill- country catchment in relation to land use. New Zealand Entomologist, 23:9-22.
COLLIER, KJ; JC RUTHERFORD; JM QUINN & RJ DAVIES-COLLEY. 2001. Forecasting rehabilitation outcomes for degraded New Zealand pastoral streams. Water Sci. Technol., 43:175-184.
CORONATO, FR & HF DEL VALLE. 1988. Caracterización hídrica de las cuencas hidrográficas de la provincia del Chubut. Publicación Técnica. CENPAT-CONICET, Puerto Madryn, Chubut, Argentina. Pp. 183.
DANGER, AR & BJ ROBSON. 2004. The effects of land use on leaf-litter processings by macroinvertebrates in an Australian temperate coastal stream. Aquat. Sci., 66:1-09.
DE GROOT, JD; SH HINCH & JS RICHARDSON. 2007. Effects of logging second-growth forest on headwater populations of coastal Cutthroat Trout: A 6-year, multistream before and after field experiment. T. Am. Fish. Soc., 136:211-226.
DWIRE, KA; J MONROE; H RHODES; MK DIXON & SE RYAN. 2005. Stream Characteristics and Aquatic Macroinvertebrates Following Wildland Fire in Western Wyoming. Spring Meeting 2005. American Geophysical Union.
FLORY, E & A MILNER. 1999. Influence of ribereñan vegetation on invertebrate assemblages in a recently formed stream in Glacier Bay National Park, Alaska. J. N. Am. Benthol. Soc., 18(2): 261- 273.
GORDON, ND; TA MCMAHON & BL FINLAYSON. 1994. Stream hydrology, an introduction for ecologists. Wiley & Sons, New York. USA.
HAUER, FR & VH RESH. 1996. Benthic macroinvertebrates. Pp. 339-369 en Hauer, FR & GA Lamberti (eds.). Methods in Stream Ecology. Academic press, San Diego, California, USA.
KUTSCHKER, A; C BRAND & ML MISERENDINO. 2009. Evaluación de la calidad de los bosques de ribera en ríos del NO del Chubut sometidos a distintos usos de la tierra. Ecologia Austral, 19:19-34.
LUDWING, JA & JF REYNOLDS. 1988. Stadistical Ecology. Wiley-Interscience. Pp. 333.
MISERENDINO, ML. 2009. Effects of flow regulation, basin characteristics and land-use on macroinvertebrate communities in a large arid patagonian river. Biodiversity & Conservation, 8(7):1921-1943.
MISERENDINO, ML. 2005. Interacciones bosque río implicaciones para los ecosistemas acuáticos. Patagonia Forestal, XI(4):14-17.
MISERENDINO, ML & L PIZZOLÓN. 2003. Distribution of macroinvertebrate assemblages in the Azul-Quemquemtreu river basin, Patagonia, Argentina. New Zeal. J. Mar. Fresh., 23(3):525-539.
MISERENDINO, ML; C BRAND & CY DI PRINZIO. 2008. Assessing urban impacts on water quality, benthic communities and fish in streams of the Andes Mountains, Patagonia (Argentina). Water Air and Soil Pollution, 194:91-110.
MOLLÁ, S; S ROBLES & C CASADO. 2006. Seasonal Variability of Particulate Organic Matter in a Mountain Stream in Central Spain. Internat. Rev. Hydrobiol., 91(5):406-422.
MORLEY, SA & RK JAMES. 2002. Assesing and Restoring the Health of Urban Streams in the Puget Sound Basin. Conserv. Biol., 16(6):1498-1509.
NEWBOLD, JD; DC ERMAN & KB ROBY. 1980. Effects of logging on macroinvertebrates in streams with and without buffer strips. Can. J. Fish. Aquat. Sci., 37:1076-1085.
OSBORNE, LL & DA KOVACIC. 1993. Riparian vegetated buffer strips in water-quality restoration and stream management. Freshwater Biol., 29:243-258.
QUINN, JM & W LINKLATER. 1993. Effects of silvicultural and agricultural land use practices on stream habitat and invertebrates in the Kinleith area. Consultancy report PPL 053/2. NIWA, Hamilton.
RILEY, R; CR TOWSEND; DK NIYOGI; CA ARBUCKLE & KA PEACOCK. 2003. Headwater stream response to grassland agricultural development in New Zealand. New Zeal. J. Mar. Fresh., 37:389-403.
SCARSBROOK, MR & J HALLIDAY. 1999. Transition from pasture to native forest land-use along stream continua: effects on stream ecosystems and implications for restoration. New Zeal. J. Mar. Fresh., 33:293-310.
SCARSBROOK, MR; J QUINN; JM HALLIDAY & R MORSE. 2001. Factors controlling litter input dynamics in streams draining pasture, pine, and native forest catchments. New Zeal. J. Mar. Fresh., 35:751-762.
SCRIMGEOUR, GJ & S KENDALL. 2003. Effects of livestock grazing on benthic invertebrates from a native grassland ecosystem. Freshwater Bio. 48: 347-362.
SOKAL, RR & FJ ROHLF. 1995. Biometry. 3rd Edition, W.H. Freeman and Company. New York. USA.
SUREN, AM. 1993. The effects of urbanization on the invertebrate fauna of the Avon and Heathcote Rivers. New Zealand freshwater miscellaneous report. 36. NIWA, Christchurch. Nueva Zelanda.
TEMPORETTI, PF. 2006. Efecto a largo plazo de los incendios forestales en la calidad del agua de dos arroyos en la subregión Andino-Patagónica, Argentina. Ecología Austral, 16(2):157-166.
THOMPSON, RM & CR TOWSEND. 2004. Land-use influences on New Zealand stream communities effects on species composition, functional organization, and food-web structure. New Zeal. J. Mar. Fresh., 38:595-608.
VELÁSQUEZ, SM & ML MISERENDINO. 2003a. Análisis de la materia orgánica alóctona y organización funcional de macroinvertebrados en relación con el tipo de hábitat en ríos de montaña de Patagonia. Ecología Austral, 13:67-82.
VELÁSQUEZ, SM & ML MISERENDINO. 2003b. Habitat type and macroinvertebrate assemblages in low order Patagonian streams. Archiv fur Hydrobiologie, 158(4):461-483.
VOELZ, NJ & J WARD. 1990. Macroinvertebrate responses along a complex regulated stream environmental gradient. Regul. River. Res. & Manage., 5:365-374.
WARD, JV. 1989. The four dimensional nature of lotic ecosystems. J. N. Am. Benthol. Soc., 8(1):2-8.
WETZEL, RG & GE LIKENS. 1991. Limnological analysis. 2nd ed. Springer-Verlang, New York. USA.
Por: Carolina Isabel Masi1, 2, * & María Laura Miserendino 3
1. Lab. de Entomología, IADIZA, CCT-CONICET, Mendoza, Parque General San Martín, Mendoza, Argentina
2. PROBIOL, UNCuyo
3. CONICET – Laboratorio de Investigaciones en Ecología y Sistemática Animal (LIESA), Facultad de Ciencias Naturales, Universidad Nacional de la Patagonia San Juan Bosco, Esquel, Chubut, Argentina
*Laboratorio de Entomología, IADIZA, CCT-CONICET, Parque General San Martín, Mendoza
Fuente: Rev. Ecol. austral v.19 n.3 Córdoba, Argentina