Trihalometanos en aguas de consumo humano
Resumen
Los trihalometanos (THMs) son subproductos de desinfección que resultan de la cloración de las aguas. Los THMs engloban a sustancias como el cloroformo (CHCl ), el 3 bromodiclorometano (CHBrCl ), el clorodibromometano (CHBr Cl) 2 2 y el tribromometano (CHBr ). La Agencia Internacional para la 3 Investigación del Cáncer ha clasificado al cloroformo y al bromodiclorometano en el grupo 2B que incluye a las sustancias posiblemente carcinogénicas en humanos. Debido a su toxicidad y a que el agua de consumo humano constituye la principal vía de exposición del hombre a estos compuestos, su presencia en las aguas de consumo humano está limitada por la Directiva Europea 98/83/CE a 100 ìg/L. En esta revisión se destacan los aspectos más relevantes sobre su toxicidad, reglamentación, determinación, concentración en aguas, variaciones estacionales y eliminación.
Palabras clave: trihalometanos, cloración, toxicidad.
Introducción
El tratamiento de desinfección de las aguas para abastecimiento público se remonta a los años 1804 y 1807 en Paisley y Glasgow (Escocia), respectivamente, donde se instalaron los primeros sistemas de filtración permanente a través de arena que conseguían retener buena parte de la carga bacteriana del agua. En 1902 y 1912 aparecen las primeras plantas municipales de cloración permanente en Middelkerke (Bélgica) y Niagara Falls (Nueva York), respectivamente. Lentamente, la utilización de cloro como desinfectante se fue implantando en el mundo desarrollado y, hasta la actualidad, pocos son los países que no lo empleen o lo hayan empleado en el pasado como desinfectante [1].
El objetivo de la cloración del agua de consumo es eliminar la materia orgánica y todos aquellos microorganismos patógenos presentes en ella. No cabe duda que enfermedades de origen hídrico como el cólera, la fiebre tifoidea y la disentería han disminuido radicalmente debido a la desinfección de las aguas con cloro [2,3].
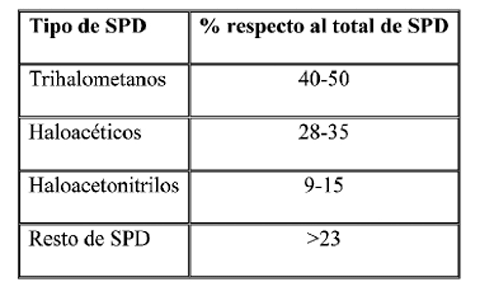
Cuando el cloro libre reacciona con la materia orgánica existente en el agua, se forman subproductos de desinfección (SPD) entre los que destacan los trihalometanos (THMs), haloacéticos, haloacetonitrilosy halocetonas, haloaldehidos, fenoles clorados, etc. [4,2,5-7]. En la tabla 1 se muestran los porcentanjes de cada uno de los SDP generados en las aguas de consumo humano tras la cloración.
Tabla 1. Porcentaje de cada tipo de subproducto de desinfección (SPD) con respecto al total de ellos tras un proceso de cloración del agua de consumo.
 |
El principal precursor de los SPD es la materia orgánica natural (MON), la cual se define como una matriz compleja que se genera por residuos agrícolas (ácidos húmicos y fúlvicos) y ganaderos y, en menor proporción, por vertidos urbanos. La concentración de MON puede variar en función del origen de las aguas y afecta significativamente en algunos aspectos del tratamiento de las aguas como el rendimiento de los procesos de oxidación, coagulación y adsorción que son aplicados para la desinfección y estabilidad biológica. Como resultado, la MON afecta a la calidad del agua potable [8,9].
Los niveles finales de SPD pueden ser minimizados por reacciones de oxidación, por procesos de coagulación-floculación-sedimentación y filtración, por paso a través de membranas o por adsorción sobre carbón activado [7]. Otros métodos efectivos para controlar los SPD son el uso de desinfectantes alternativos como el ozono [10], cloraminas, dióxido de cloro y, lo más reciente, es el empleo de radiación ultravioleta [7,11] o la mezcla de oxidantes generados electroquímicamente (EGMOs/ electrochemically generated mixed oxidants) [12].
Trihalometanos (THMs)
Los THMs son compuestos derivados del metano donde tres de los cuatro átomos de hidrógeno del metano se reemplazan por átomos de halógenos (CH X), normalmente cloro, bromo o incluso, una 3 combinación de los dos. Al citar a los THMs nos referimos generalmente al triclorometano (cloroformo, CHCl ), 3 bromodiclorometano (CHBrCl ), clorodibromometano (CHBr Cl) y 2 2 t r i b r omome t a n o (CHBr ) . Es t o s THMs , g e n e r a d o s 3 involuntariamente durante el proceso de cloración del agua, son volátiles y tóxicos y no fueron descubiertos en las aguas de bebida hasta 1974 [4]. Entre todos ellos, destaca el cloroformo por ser el compuesto que representa la fracción más importante [5]. En la tabla 2, se presentan las fórmulas y los nombres principales de los THMs más comunes [13].
Tabla 2. THMs más comunes.
 |
Hay que recordar que la principal fuente de exposición del hombre a estos THMs es el agua de consumo humano [14, 15] y que el interés toxicológico de estos compuestos reside en que diversos estudios han clasificado a los THMs como sustancias carcinógenas relacionadas con el inicio de distintos tipos de cánceres (vejiga, colón, recto, etc.) [16-20].
Toxicidad de los THMs
La exposición a THMs en mamíferos causa efectos tóxicos en el hígado, el riñón y en los sistemas nervioso y reproductivo [21-24].
Estudios en animales han mostrado que el cloroformo en altas dosis es cancerígeno y que otros THMs son mutagénicos [13]. Aunque los estudios epidemiológicos asocian los THMs con un riesgo de cáncer de vejiga urinaria, estos subproductos de cloración también han sido asociados a cáncer colorrectal y defectos en neonatos de madres expuestas [13]. En animales de experimentación, diversos estudios han demostrado que la exposición a THMs puede dar lugar a la formación de tumores en el hígado [25] y el riñón [23], así como a abortos [22,26] y disminución de la motilidad espermática [27]. Las
dosis de referencia consideradas por la USEPA (Agencia de Protección Medioambiental Americana) para los distintos THMs se enumeran en la Tabla 6.
La Agencia Internacional para la Investigación del Cáncer (International Agency for Reasearch on Cancer, IARC) clasificó al cloroformo y al bromodiclorometano en el grupo 2B que incluye a las sustancias posiblemente carcinogénicas en humanos [28]. En el caso del bromodiclorometano y el bromoformo sólo existen suficientes evidencias sobre su carcinogenicidad en animales de experimentación [14, 15]. La IARC insiste, sin embargo, en clasificar al bromoformo como compuesto “no clasificable respecto a su carcinogenicidad en humanos” y lo incluye en el Grupo 3 [15]. El dibromoclorometano ha sido incluido en el grupo IIID de posibles carcinógenos para humanos sin datos en humanos [29].
Recientemente se han aplicado los valores de odds-ratio obtenidos de estudios norteamericanos a los niveles medios de exposición a THMs de la población española, atribuyendo un riesgo aumentado de cáncer de vejiga de un 20%, con unos 600 fallecimientos anuales en la población española [30].
Cantor y col. [28,31] estudiaron la relación entre los diversos tipos de cánceres y los niveles de THMs en agua potable. El estudio comprendió 76 condados americanos, en donde más del 50% de la¿ población se abastecía de agua del sistema público. El hallazgo más consistente fue una relación entre índices de mortalidad por cáncer de vejiga y los niveles de THMs en el agua de abasto. Dicha asociación se observó en ambos sexos.
El cloroformo es un sedante del sistema nervioso central (SNC). El efecto tóxico inmediato del cloroformo es la pérdida de la conciencia, pudiendo después sobrevenir al coma y la muerte [32]. El cloroformo no presenta evidencias significativas de teratogenecidad, pero sí de carcinogenicidad. Esta carcinogenicidad del cloroformo parece ser mediada por un mecanismo no genotóxico [29].
La dosis letal oral del cloroformo no se ha determinado en el ser humano. Se han descrito muertes tras ingestas de 10 mL y casos de supervivencia en personas que han ingerido 500 mL [33]. Se considera que la dosis letal media de cloroformo para el hombre es de aproximadamente 44 g o 630 mg/kg de peso corporal, para una persona de 70 kg. Sin embargo, se han descrito casos de supervivencia tras una ingesta de más de 250 g de cloroformo [1,32,34,35]. La dosis letal más baja de cloroformo en el hombre que ha sido publicada es de 210 mg/kg de peso corporal [36]. Incluso la ingestión de una dosis tan pequeña como 440 mg produce irritación gástrica y una mayor peristalsis, al igual que algo de narcosis local en el tracto intestinal [1,34]. Actualmente, la ingesta diaria tolerable (TDI/Tolerable Daily Intake) del cloroformo para exposiciones orales basadas en el incremento de quiste hepático está fijada en 6,2 g/kg peso corporal día , mientras que para inhalación está en 0,14 mg/m3 [24].
Respecto a los THMs bromados existen datos limitados sobre sus efectos en humanos. Muy pocos estudios han examinado la asociación entre el cáncer y la exposición a los THMs bromados. Sin embargo, parece claro que la toxicidad de estos THMs bromados está relacionada con su metabolismo que ocurre por rutas oxidativas y reductoras [37]. Los THMs bromados son considerados altamente tóxicos por ser mucho más cancerígenos y mutagénicos que sus análogos clorados [38-40]. Las dosis letales 50 (LD50) agudas oscilan entre 450 y 969 mg/kg para el bromodiclorometano; 800- 1200 mg/kg para el dibromoclorometano y 1388-1550 mg/kg para el bromoformo [37].
Los estudios de genotoxicidad indican que el bromodiclorometano (DDCM) es débilmente mutagénico, probablemente debido a la conjugación con glutatión que sufre. Sin embargo, este compuesto afecta al sistema renal produciendo adenomas en las células de los túbulos renales y adenocarcinomas y tumores intestinales [29]. El bromodiclorometano por vía oral (0,25-150 mg/kg) produce cáncer en riñón, hígado e intestino tanto de la rata como del ratón [41]. La dosis máxima tolerada de bromodiclorometano en ratones machos se estimó en 100 mg/kg de peso corporal (dosis inyectada
intraperitonealmente cada dos días) [1,42].
El bromoformo produce efectos tóxicos similares a los producidos por el cloroformo. La dosis máxima tolerada de bromoformo (dosis inyectada intraperitonealmente cada dos días) también fue de 100 mg/kg de peso corporal [1,42].
THMs en aguas de consumo humano
La concentración de los distintos THMs en aguas de consumo humano depende de diversos factores tales como la naturaleza del agua, el pH, la temperatura, la calidad del agua, la concentración de cloro utilizada en la cloración (que a su vez dependerá de la estación del año), la concentración de bromo, la presencia de disolventes orgánicos de carbono y el tiempo de contacto [43,44].
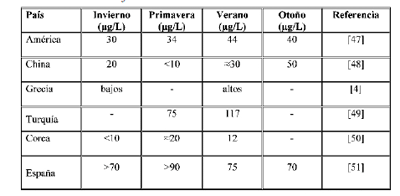
Estudios recientes sobre la formación de THMs en las aguas de consumo muestran que las variaciones estacionales están correlacionadas con la calidad del agua y la temperatura de ésta [45- 51]. En China, se ha observado que las aguas de abasto poseen altas concentraciones de THMs en otoño y verano, debido a la alta concentración de materia orgánica (producida por las algas), a las altas concentraciones de cloro utilizadas y a las altas temperaturas durante estas estaciones. En la tabla 3 se muestra la variación estacional de los THMs en aguas de consumo humano de distintos
países.
Tabla 3. Variación de los niveles de THMs en las aguas de abasto en función de las estaciones del año
 |
Las concentraciones de los THMs bromados parece depender de la presencia de bromuro inorgánico en las aguas [4, 52]. Altas concentraciones de bromo se suelen detectar en regiones áridas con elevadas tasas de evaporación, como el Mediterráneo, el sureste de Australia y el este de los EE.UU [52]. Por ello, los sistemas de tratamiento de aguas con altos contenidos en iones bromuro, deben implementar procesos donde se disminuyan las concentraciones de precursores orgánicos, para incrementar la relación bromo libre/materia orgánica, y evitar, después de la cloración, la oxidación de THMs clorados por THM bromados.
Cuando se usan sistemas de desinfección de aguas de consumo humano con ozono se puede llegar a reducir significativamente la formación de los THMs, pero también se pueden obtener THMsbromados cuando los niveles iniciales de bromuro son altos [53].
Diversos estudios han demostrado que la ozonización antes de la cloración puede llegar a reducir la formación potencial de THMs [54,55]. Sin embargo, otras investigaciones han concluido que la ozonización seguida de la cloración muestra un aumento en los niveles de THM más que una disminución [57-60].
Los niveles de THMs bromados en aguas de consumo humano oscilan entre niveles indetectables hasta 183 ppb para el bromodiclorometano y, entre concentraciones por debajo del límite de detección y 280 ppb para el dibromoclorometano y bromoformo [37].
En Estados Unidos, la exposición media a bromodiclorometano por parte de la población a través de las aguas superficiales se estima en 20 g/persona/día. Para el dibromoclorometano la media de exposición a través de los sistemas de aguas superficiales se estima en 9,4 g/persona/día y para el bromoformo la exposición se reduce a 2,4 g/persona/día [37].
Prevención de la formación de THMs en aguas
Para disminuir los niveles de THMs en agua, existen técnicas tradicionales (Tabla 4) que no sólo disminuyen los niveles de THMs sino que además disminuyen la carga microbiana de las aguas.
Levesque y col. [60] muestran cómo el almacenamiento de agua puede llegar a disminuir los THMs, debido a su volatilización y cómo la disminución de THMs es mayor en recipientes no cubiertos que en recipientes cubiertos.
Tabla 4. Reducción de los niveles de THM en aguas mediante el empleo de distintas técnicas.
 |
Determinación de trihalometanos
Los THMs en agua se determinan principalmente por cromatografía de gases (GC) utilizando detectores de captura electrónica (ECD) o detectores de masa electrónica (EMD) [29]. Hoy en día, la concentración de THMs es determinada por GC y un detector de captura electrónica usando el método de la EPA 551 (Agencia de Protección Ambiental Norteamericana) [61,62].
La preparación de la muestra es una de las fases más críticas del análisis y requiere una labor muy meticulosa. En esta fase, los componentes de interés son separados de la matriz y son preconcentrados para mejorar la selectividad, sensibilidad, fiabilidad, exactitud y reproducibilidad de los análisis [45]. Además, estos pretratamientos son capaces de emplear menores cantidades de disolventes y reactivos [63-65]. A continuación se citan las técnicas más empleadas para la extracción de THMs en matrices acuosas :
a) Inyección acuosa directa (DAI): Esta es una de las técnicas más empleadas por su facilidad. Las muestras de agua se inyectan directamente en el cromatógrafo de gases y no requiere preconcentración, por lo que hay menos pérdida de muestras volátiles y menos contaminación por manipulación. El principal inconveniente es el deterioro de la columna por el uso de productos orgánicos volátiles y sales inorgánicas.
Grob y Habich describieron el DAI-GC-ECD acoplado que aplicaron para la determinación de halocarbonos en muestras de agua [66,67].
Desde entonces muchos estudios han utilizado este método para la determinación de THMs en aguas [68-72] e incluso el DAI-GC también ha sido acoplado a un detector de masas [73,74]. Los límites de detección obtenidos utilizando este método en diferentes muestras de aguas oscilan entre 3 y 5 g/L [71,73], pero, actualmente, se están consiguiendo límites de detección mucho más bajos (en torno a 0,01 g/L) [61].
b) Extracción líquido-líquido (LLE): Esta técnica ha mejorado con los años, disminuyendo el volumen de disolvente utilizado a 0,5-2 mL. Varios estudios han comparado distintas técnicas como la LLEGC- ECD, LLE-GC-MS, purga y trampa (PT-GC-MS) y espacio en cabeza (HS-GS-ECD) [75], y han revelado que la LLE-GC-ECD es la más sensible para la determinación de THMs.
c) Técnica de espacio en cabeza (Headspace, HS): La técnica más utilizada es la HS-SPME donde se utiliza una fibra de sílice fundida cubierta con un polímero recubierto. La principal ventaja de esta técnica es permitir la volatilización de la muestra que debe ser analizada. La manipulación de la muestra es mínima lo que disminuye los errores [76]. Los límites de detección obtenidos para THMs en muestras de aguas usando este método están comprendidos entre 0,0004-1,2 g/L, dependiendo del detector que se le acople al cromatógrafo [61].
d) Técnica de muestreo de membrana: Se conoce como microextracción en fase líquida (HF-LPME) en donde se utiliza una membrana de fibra hueca (HF). Presenta la ventaja de que puede ser automatizada y que no usa disolventes: La introducción de los analitos se realiza directamente a través de la membrana por medio de un proceso llamado pervaporación [60,76,78-80]. Los límites de detección obtenidos utilizando este método analítico se encuentran comprendidos entre 0,00043 y 2,8 ìg/L [61].
Legislación
En respuesta a las preocupaciones sobre los efectos adversos de THMs, desde 1979 se han publicado distintos reglamentos que limitan los niveles de estos tóxicos en el agua potable. Mientras la OMS (Organización Mundial de la Salud) ha fijado guías provisionales para aquellos THMs que presenten contenidos más altos (Tabla 5), la USEPA ha establecido niveles guía para cada uno de los THMs [37,78,79] (Tabla 6). La normativa Europea (Directiva 98/83/CE) [80] establece que la concentración total de THMs en el agua de consumo no puede superar los 100-150 ìg/L. De acuerdo con esta Directiva, el RD 140/2003 [81] estableció un límite máximo de THMs totales de 150 ìg/L hasta el año 2008 y 100 ìg/L a partir del año 2009.
Tabla 5. Valores guía para los distintos THMs establecidos por la OMS (WHO, 2008)
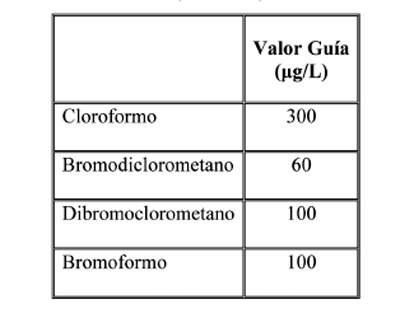 |
Tabla 6. Niveles máximos en aguas de bebida y Dosis de Referencia fijadas por la USEPA en 2006 para distintos THMs
(EPA, 2006)
 |
MCL: maximum contaminant level : nivel máximo de contaminación = el más alto nivel del contaminante que está permitido en el agua de bebida
RfD: Reference dose. Dosis de referencia = estimación de la exposición oral diaria para el ser humano que es probable que no tenga un riesgo apreciable de efectos deletéreos durante toda una vida.
Bibliografía
1. Publicaciones científicas 506 (1987) Guías para la calidad del agua potable. Organización Panamericana de la Salud. 343.
2. Golfinopoulos SK, Nikolaou AD (2005) Survey of disinfection by-products in drinking water in Athens, Greece. Desalination 176:13-24.
3. Calderon RL (2000) The epidemiology of chemicals contaminants of drinking water. Food Chem Toxicol 38(12): S13- S20.
4. Rook JJ (1974) Formation of haloforms during chlorination of natural water. Water Treat Exam 23:234-236.
5. Nissinen TK, Miettinen IT, Martikanen PL, Vartiainen T (2002)Desinfection by-products in Finnish drinking water. Chemosphere 48:9-20.
6. Panyapinyopol B, Kanokkantapong V, Maraba TF, Wattanachira
S, Pavasant P (2005) Kinetics of trihalomethane formation from organic contaminants in raw water from the Bangkhen water treatment plant. J Environ Sci Health 40:1453-1555.
7. Guay C, Rodriguez M, Serodes J (2005) Using ozonation and chloramination to reduce the formation of trihalomethanes and haloacetic acids in drinking water. Desalination 176:229-240.
8. Villanueva CM, Cantor KP, Grimalt JO, Malats N, Silverman D, Tardon A (2006) Bladder cancer and exposure to water
disinfection by-products through ingestion, bathing, showering and swimming in pools. Am J Epidemiol 165:148-156.
9. Singer PC (1995) Humic substances as precursors for potentially harmful disinfection by-products. Water Sci Techonol 40:25-30.
10. Kumar K, Margerum DW (1987) Kinetics and mechanism of general-acid-assisted oxidation of bromide by hypoclorite and hypochlorous acid. Inorg Chem 26:2706-2711.
11. SD Richardson, AD Thruston Jr., TV Caughran, PH Chen, TW Collette, TL Floyd, KM Schenck, BW Lykins Jr., G Sun, G Majetich: Identification of new drinking water disinfection byproducts formed in the presence of bromide. Environ.Sci. Technol. 33: 3378-83.
12. Craik SA, Weldon D, Finch GR, Bolton JR, Belosevic M (2001) Inactivation of Cryptosporidium parvum Oocysts using medium
13. Sánchez Zafra A. (2008). Efectos de los trihalometanos sobre la salud. Hig. Sanid. Ambient. 8: 280-290.
14. IARC. (1991a). Bromodichloromethane. IARC Monographs Volume 71: 1295-1304.
15. IARC.(1991b). Bromoform. IARC Monographs Volume 71: 13091316.
16. Garcia-Villanova RJ, García C, Gomez JA, García MP, Ardanuy R (1997) Formation, evolution and modeling of trihalomethanes in the drinking water of a town: I. At the municipal treatment utilities. Water Res 31:1299-1308.
17. Hsu CH, Jeng WL, Chang RM, Chien LC, Han BC (2001) Estimation of potential lifetime cancer risks for trihalomethanes
from consuming chlorinated drinking water in Taiwan. Environ Res 85:77-82.
18. Lee KJ, Kim BH, Hong JE, Pyo HS, Park SJ, Lee DW (2001) A study on the distribution of chlorination by-products (CBPs) in treated water in Korea. Water Res 35:2816-2872.
19. King WD, Marrett LD, Woolcott CG (2000) Case-control study of colon and rectal cancers and chlorination by-products in treated water. Cancer Epidemiol Biomarkers Prev 9:813-818.
20. Villanueva CM, Cantor KP, Gordier S, Jaakkola JJK, King WD, Lynch CF (2004) Disinfection by products and bladder cancer. A pooled analysis. Epidemiol 15:357-367.
21. Chu I, Secours V, Marino I, Villeneuve DC (1980) The acute toxicity of four trihalomethanes in male and female rats. Toxicol Appl Pharm 52:351-353.
22. Bielmeier SR, Best DS, Guidici DL, Narotsky MG (2001) Pregnancy loss in the rat caused by bromodichloro methane. Toxicol Sci 59:309-315.
23. Hard GC, Boorman GA, Wolf DC (2000) Re-evaluation of the 2- years chloroform drinking water carcinogenicity bioassay in Osborne-Mendel rats supports chronic renal tubule injury as the mode of action underlying the renal tumor response. Toxicol Sci 53(2):237-244.
24. WHO (World Health Organization) (1998) Chloroform (addendum to vol.2. Health criteria and other supporting information) In: Guidelines for Drinking-Water Quality, second. Ed. World Health Organization, Geneva.
25. George MH, Olsen GR, Doerfler D, Moore T, Kilburn S, De Angelo AB (2002) Carcinogenicity of bromodichloromethane administered in drinking water to male F344/N rats and B6C3F1 mice. Int J Toxicol 21:219-230.
26. Narotsky MG, Pegram RA, Kavlock RJ (1997) Effect of dosing vehicle on the development toxicity of bromodichloromethane and carbon tetrachloride in rats. Fundam Appl Toxicol 40:30-36.
27. Klinefelter GR, Suarez JD, Roberts NL, De Angelo AB (1995) Preliminary screening for the potential of drinking water
disinfection by-products to alter male reproduction. Reprod Toxicol 9:571-578.
28. García-Villanova R (2003) Nuevo siglo, nuevos riesgos sanitarios y ambientales en el agua. Salud Ambiental 3(2):77-85.
29. Health Canada. (2010). Guidelines for Canadian Drinking WaterQuality. http://www.hc-sc.gc.ca/ewh-semt/pubs/watereau/ trihalomethanes/
30. Villanueva CM, Kogevinas M, Grimalt JO (2001) Cloración del agua potable en España y cáncer de vejiga. Gac Sanit 15:48-53.
31. Hogan MD, Chi PY, Hoel DG, Mitchell TJ (1979). Association between chloroform levels in finished drinking water supplies and various site-specific cancer mortality rates. J Environ Pathol Tox 2:873-887.
32. Whipple GH, Sperry JA (1909). Chloroform poisoning-liver necrosis and repair. Bulletin of the Johns Hopkins University, 20:278.
33. Dueñas A y Pérez-Castrillón JL. (2001). Cloroformo. En: Intoxicaciones agudas en medicina de urgencia y cuidados críticos. Capítulo 65, 217-218. Masson, Barcelona.
34. Secher, O (1971) Physical and chemical data on anaesthetics. Acta anaesthesiologica scandinavica 42 (Suppl.): 1.
35. Gosselin RE, Smith RP, Hoidge HC (1984) Clinical Toxicology of Commercial Products. 5th Baltimore, Williams & Wilkins.
36. Dreisbach RH (1974) Handbook of poisoning. Los Altos, CA, Lange Medical Publications, pp. 275.
37. EPA (United States Environmental Protection Agency). (2005). Drinking water criteria document for brominated trihalomethanes. Office of Science and Technology. Washington , D.C. EPA-822-R-05-011.
38. Owen DM, Amy GL, Chowdhury ZK, Paode R, McCoy G, Viscosil K (1995) NOM characterization and treatability. J
AWWA 87(1):46-63.
39. Richardson SD, Thruston AD, Rav-Acha C, Groisman L, Popilevsky I, Juraev O, Glezer V, McKague AB, Plewa MJ, Wagner ED (2003) Tribromopyrrole, brominated acids, and other disinfection byproducts produced by disinfection of drinking water rich in bromide. Environ Sci Technol 37:3782-3793.
40. Plewa MJ, Wagner ED (2004) Chemical and biological characterization of newly discovered iodoacid drinking water disinfection by-products. Environ Sci Technol 38:4713-4722.
41. Lauwerys R. (1994). Hidrocarburos Halogenados. En: Toxicología industrial e intoxicaciones profesionales. Capítulo 3: 253-280. Masson, Barcelona.
42. Cardeihac PT, Fair KPC (1973) Inhibition by castration of aflatoxin induced hematoma in carbon tetrachloride-treted tars. Toxicol Appl Pharm 26:393-394.
43. Hamidin N, Qiming YJ, Des WC (2008) Human Health risk assessment of chlorinated disinfection by-products in drinking water using a probabilistic approach. Water Res 40:2921-2930.
44. Nikolaou AD, Golfinopoulos SK, Arhonditsis GB, Kolovoyiannis V, Lekkas TD (2004) Modeling the formation of chlorination by-products in river waters with different quality. Chemosphere 55:409-420.
45. Toroz I, Uyak V (2005) Seasonal variations of trihalomethanes (THMs) in water distribution networks of Istanbul City. Desalination 176:127-141.
46. Clark RM, Lykins BW (1994) DBP control in drinking water: cost and performance. J Environ Eng 120:759-782.
47. Krasner SW, Wright JM (2005) The effect of boiling water on disinfection by-product exposure. Water Res 39(5): 855-864.
48. Chen C, Zhang X-J, Zhu L-X, Liu J, He W-J, Han H-D (2008) Disinfection by-products and their precursors in a water
treatment plant in North China: Seasonal changes and fraction analysis. Sci Total Environ 397:140-147.
49. Lee KJ, Kim BH, Hong JE, Pyo HS, Park S-J, Lee DW (2000) A study on the distribution of chlorination by-products (CPBs) in treated water in Korea. Water Res 35 (12): 2861-2872.
50. Platikanov S, Puig X, Martín J, Tauler R (2007) Chemometric modelling and prediction of trihalomethane formation in Barcelona’s water works plant. Water Res 41: 3394-3406.
51. Batterman S, Huang W, Wang Z, Zhang L (2000) Reduction of ingestion exposure to trihalomethanes due to volatilization. Environ Sci Technol 34(20): 4418-4424.
52. Agus E, Voutchkov N, Sedlak DL (2009) Disinfection byproducts and their potential impact in the quality of water produced by desalination systems: A literature review. Desalination 237: 214-237.
53. Patermarakis G, Fountoukidis E (1990) Disinfection of water by electrochemical treatment. Water Res 24:1491-1496.
54. Richardson SD (2003) Disinfection by-products and other emerging contaminants in drinking water. Trends Anal Chem
22(10):666-684.
55. Jacangelo JG, Demarco J, Owen DM, Radtke SJ (1995) Selected processes for removing NOM: an overview. J AWWA 84: 64-77.
56. Amy GL, Tan L, Davis ML (1991) The effects of ozonation and activated carbon adsorption on trihalomethane speciation. Water Res 25:191-202.
57. Trussell RD, Umphress MD (1978) The formation of Trihalometanes. J AWWA 70: 604.
58. Siddiqui MS, Amy GL, Murphy BD (1999) Ozone enhanced removal of natural organic matter from drinking water sources. Water Res 31(12):3098-3106.
59. Chiang PC, Chang EE, Liang CH (2002) NOM characteristics and treatabilities of ozonation processes. Chemosphere 46:929- 936.
60. Levesque S, Rodríguez MJ, Serodes J, Beaulineu C (2006) Effects of Indro drinking water handling on trihalomethanes and haloacetic acids. Water Res 40: 2921-2930.
61. Pérez JL, Herrero S, García C, Moreno B (2008) Determination of trihalomethanes in water samples: a review. Anal Chim.Acta 629:6-23.
62. USEPA (1990) Method 551. Determination of chlorination disinfection by-products and chlorinated solvents in drinking
water by liquid-liquid extraction and gas chromatography with electron-capture detection, Environmental Monitoring Systems Laboratory, Office of Research and Development, Cincinnati.
63. Hyötyläinen T, Riekkola ML (2004) Approaches for on-line coupled liquid chromatography-gas chromatography. Anal Bioanal Chem 378:1962-1982.
64. Demeestere K, Dewulf J, Witte BD, Langenhove HV (2007) Sample preparation for the analysis of volatile organic compounds in air and water matrices. J Chromatogr A 1153:130- 144.
65. Somenath M (2003) Sample preparation techniques in Analytical Chemistry. Willey, New Jersey 1-458.
66. Grob K, Habich A, High J (1983) Effect of water on retention time. J High Resolut Chrom 6:34-35.
67. Grob K (1984) Further development of direct aqueous injection with electron-capture detection in gas chromatography. J Chromatogr A 299:1-11.
68. Biziuk M, Namiesnik J, Czerwinski J, Gorlo D, Makuch B. Janicki W, Polkowska Z (1996) Occurrence and determination of
organic pollutants in tap and surface Waters of the Gdansk district. J. Chromatogr A 733:171-183.
69. Wolska L, Olszewska C, Truska M, Zygmunt B, Namiesnik J (1998) Volatile and semivolatile organo-halogen trace analysis in surface water by direct aqueous injection GC-ECD. Chemosphere 37:2645-2651.
70. Buszewski B, Ligor T (2001) Application of different extraction methods in tap water quality control. Water Air Soil Pollut 129:155-165.
71. Golfinopoulos SK, Lekkas TD, Nikolau AD (2001) Comparison of methods for determination of volatile organic compounds in drinking water. Chemosphere 45:275-284.
72. Polkowska Z (2004) Determination of volatile organohalogen compounds in urban precipitation in Tricity area (Gdansk,
Gdynia, Sopot). Chemosphere 57:1265-1274.
73. Pyle SM, Gurka DF (2002) Volatile organic analysis by direct aqueous injection. Talanta 41:1845-1852.
74. Aeppli C, Berg M, Hofstetter TB, Kipfer R, Schwarzenbach RP (2008) Simultaneous quantification of polar and non-polar volatile organic compounds in water samples by direct aqueous injection-gas chromatography/mass spectrometry. J Chromatogr A 1181:116-124.
75. Nikolaou AD, Lekkas TD, Golfinopoulos SK, Kostopolou MN(2002) Application of different analytical methods for determination of volatile chlorination by-products in drinking water. Talanta 56:717-726.
76. Geme G, Brown MA, Simone Jr P, Emmert GL (2005) Measuring the concentrations of drinking water disinfection by-products using capillary membrane sampling.flow injection analysis. Water Res 39:3827-3836.
77. Teksoy A, Alkan U, Baskaya HS (2008) Influence of the treatment process combinations on the formation of THM species in water. Separation and Purification Techn 61:447-454.
78. EPA (United States Environmental Protection Agency). (2006). 2006 Edition of the Drinking Water Standards and Health Advisories. Office of Water. Washington, D.C. EPA 822-R-06- 013.
79. WHO. 2008. Guidelines for Drinking-water Quality. THIRD EDITION INCORPORATING THE FIRST AND SECOND ADDENDA. Volume 1. Recommendations.
80. Directive 98/83/EC. Concerning the quality of water intended for human consumption, 3rd November 1998.
81. Real Decreto 140/2003, de 7 de febrero, por el que se establecen los criterios sanitarios de la calidad del agua de consumo humano.
Fuente: Revista de Toxicología
Asociación Española de Toxicología