Resistencia a insecticidas
Cuando se aplica un insecticida en un área para controlar una plaga, raramente se exterminan todos los insectos.
Al menos algunos sobreviven al tratamiento.
Estos individuos que sobreviven, son exactamente iguales a los demás de su especie, pero tienen un “mecanismo de defensa” invisible que les salva la vida.
 |
Este mecanismo es la resistencia.
Se ha descrito la resistencia como la respuesta atenuada de una población de especies animales o vegetales, a un plaguicida o a un agente enemigo, como consecuencia de su aplicación.
Esta es otra forma de decir que una plaga consigue hacer más difícil o incluso imposible que se le mate con un plaguicida determinado, como consecuencia de un uso continuo de este.
Las plagas heredan la resistencia, transfiriendo de esta forma, a sus descendientes, la capacidad de resistir a un plaguicida.
En cierto casos, cuando se trata de una población de una plaga con aplicaciones reiteradas de un solo químico, esa población adquiere también resistencia a otros químicos análogos.
Esta es la resistencia cruzada.
Este fenómeno obedece al hecho de que todos los insecticidas semejantes o estrechamente afines tienen la misma forma de acción y es por ello que el mecanismo de defensa del insecto resistente, es eficaz también contra el nuevo insecticida.
 |
El que una plaga consiga resistir a dos o más plaguicidas con diferentes clases o formas de acción, es lo que llama resistencia múltiple
Esto ocurre cuando la plaga tiene varios mecanismos de defensa, con los cuales hace frente a diferentes tipos de insecticidas.
La resistencia fue descubierta en 1908, en USA, al no poderse controlar, con una mezcla sulfocálcica, las cochinillas de los árboles frutales.
En los 20 años siguientes, otras cinco o seis plagas adquirieron resistencia a los plaguicidas.
Después en 1945, comenzó a extenderse ampliamente el empleo de DDT juntamente con otros plaguicidas nuevos.
No pasó mucho tiempo sin que apareciesen casos de resistencia, cuyo número aumentó rápidamente.
En 1966, se informó que unas 180 especies de plagas resistían a uno o más pesticidas.
 |
En 1968, el número de especies de plagas se había elevado a 228 y el incremento continúa.
Podría pensarse que si un insecticida no se usa ya contra una plaga resistente, ésta pudiera volver a ser susceptible al insecticida en cuestión, después de algunos años.
Así ha ocurrido en algunos casos, pero la población de insectos logró de nuevo rápidamente una gran resistencia después de solo uno o dos tratamientos.
A los fines prácticos, una vez que un insecto ha desarrollado resistencia a un insecticida particular, ya no hay forma de restablecer la eficacia de éste contra ella.
Las dos consecuencias graves de la resistencia son la pérdida de eficacia de uno o más plaguicidas y el trabajo y el costo que exige el desarrollo de nuevos productos.
Cuando la eficacia de un insecticida comienza a disminuir, la primera reacción es, normalmente, aumentar la dosis y/o el tiempo entre aplicaciones.
Las consecuencias de estos cambios es que probablemente se cause un daño al aplicador o receptor del servicio.
Para evitar estas consecuencias , no hay que excederse nunca en la dosificación del marbete, ni abreviar los intervalos.
Se debe investigar, en la práctica la aparición de signos que delaten un aumento en la dificultad de dominar una plaga determinada a pesar del uso apropiado del insecticida.
Estos signos permiten sospechar una adquisición de resistencia.
Otros signos son el incremento de la población, de los daños, presencia de excrementos, etc.
A veces tales signos son muy sutiles y pueden pasar desapercibidos durante algún tiempo.
Por otro lado, con frecuencia se culpa a la resistencia de la escasa eficacia que pueda tener la lucha contra las plagas, cuando en realidad este resultado obedece a la utilización de prácticas inapropiadas (elección del producto, formulación, equipo de aplicación, lugares de aplicación, etc.)
Cuando se ha demostrado, en forma fehaciente a través de cuidadosos ensayos, la resistencia al plaguicida que se está utilizando, la solución más sencilla y rápida del problema es, por lo general, el empleo de otro producto químico de otra forma de acción sobre la plaga.
El pesticida sucedáneo debe ser alguno que no haya resistencia cruzada.
Debe recalcarse la posibilidad de que la sustitución del plaguicida por otro producto químico cuando la resistencia ha aparecido, resulte una solución pasajera del problema.
No hay seguridad que la resistencia al nuevo producto no aparezca a corto plazo.
Recomendaciones
Se deberá tener desde el principio de los servicios de control de plagas con un plan de rotación de principios activos.
En nuestro país, no hay estudios publicados sobre resistencia de insectos, pero se puede asegurar que tanto en mosca domestica como en Blatella germanica (cucaracha alemana), existen lugares o focos de resistencia, en el primer caso podemos citar la ciudad de Crespo (Entre Rios) y el segundo en muchos restaurantes y consorcios de la Ciudad de Bs.As, Córdoba y grandes ciudades.
En caso de iniciar tratamientos en lugares que fueron atendidos por otras empresas o particulares, y no se pueda determinar o averiguar que productos y/o principios activos se utilizaron:
1.- Utilizar productos que por su precio y dificultad de obtenerlos, no hayan sido aplicados por otros controladores.
2.- Realizar un mix con dos productos de diferentes grupos químicos de distinta forma de acción (para mezclarlos se deberá consultar a los fabricantes para saber si son compatibles y en que proporción se pueden mezclar)
Recordar, que cuando se mezclan dos productos puede suceder:
a. Antagonismo: un principio activo inactiva al otro o los dos se inactivan.
b. Potenciación: mutua y de uno a otro, en estos casos se debería utilizar menor dosis para obtener el mismo efecto y que el aplicador y el cliente no corran riesgos innecesariosc. Nada: es el ideal, los insecticidas conservan su poder en forma inalterable.
3.- Utilización de productos sin poder residual.
4.- Utilización de cebos tóxicos. (geles o cebos en granos). Es muy difícil que se genere resistencias en productos cuya forma de control sea vía ingestión.
5.- Utilización de inhibidores de crecimiento, que impiden que los insectos lleguen al estado reproductivo.
FACTORES QUE AFECTAN EL DESARROLLO DE RESISTENCIA A INSECTICIDAS
1- GENÉTICOS: número y frecuencia de alelos resistentes. Grado de dominancia y expresividad de los alelos resistentes.
2- BIOLÓGICOS: duración del ciclo de vida, progenie por generación, monogamia, poligamia, comportamiento de alimentación, movilidad, refugios, etc.
3- OPERACIONALES
a) Insecticida: naturaleza química, relación con los insecticidas usados, tipo de formulación.
b) Aplicación: dosis de aplicación, umbral de aplicación, alternancia de aplicación, mantenimiento de refugios.
Los insecticidas de segunda generación (organofosforados, carbamatos, piretroides) son los más extensivamente utilizados.
La resistencia a un insecticida y, en términos generales a cualquier producto tóxico natural o sintético, se traduce en una disminución de la mortalidad observada en una población sometida a un tratamiento constante.
Este fenómeno, que se manifiesta con individuos que toleran dosis normalmente letales para los individuos denominados sensibles en las primeras utilizaciones del producto, se basa en una evolución genética de las poblaciones.
Ejemplo, existe una población donde coexisten naturalmente individuos susceptibles y resistentes, siendo más exitosos los susceptibles (90%), cuando aparece la presión con insecticida mueren principalmente los susceptibles y la población se enriquece en individuos resistentes. Ambos se reproducen por igual y llegamos a una población con un 33% de individuos resistentes. Si continúa la presión con insecticida se llega a una población final con un 76% de individuos resistentes.
¿Cómo se detecta la resistencia?
Se detecta por medio de pruebas toxicológicas que consisten en estudiar la mortalidad provocada por dosis crecientes de tóxico. De este modo se puede caracterizar cada población por una curva que se puede comparar con la de una población susceptible de referencia.
Estas comparaciones permiten definir el grado de resistencia, que es un parámetro estadístico que expresa el factor por el que se tiene que multiplicar la dosis que induce una determinada mortalidad en los individuos sensibles para producir la misma mortalidad en los resistentes.
DL 50 cepa resistente
GRADO DE RESISTENCIA =——————————
DL 50 cepa susceptible
Donde la DL 50 es la dosis de insecticida necesaria para eliminar el 50% de la población expuesta.
Los grados de resistencia son muy variables. Hay cepas de moscas domésticas , que tienen GR hasta 50000, por lo tanto se necesita cincuenta mil veces más insecticida para matar un determinado porcentaje de individuos resistentes que el que se necesita para matar el mismo porcentaje de individuos susceptibles.
Ante la evidencia de aparición de resistencia en una población natural de insectos hay, por lo menos, 2 maneras de intentar contrarestarla:
1. a ciegas2. en forma racional, por lo que es necesario realizar estudios sistemáticos que nos den la información sobre las causas que produjeron la resistencia y la forma de contrarrestarla.
Para el punto dos, debemos conocer a que se debe la resistencia, determinando la naturaleza de las diferencias que existen entre un individuo susceptible y uno resistente, en el plano bioquímico, fisiológico y genético.
Mecanismos de resistencia
Los principales mecanismos de resistencia se pueden dividir , según T.Sparks, en comportamentales y fisológicos y/o bioquímicos.
Comportamentales.
Se refieren a cambios en la actividad de los insectos que alteran el contacto con los residuos de insecticidas y preferencia huésped-hábitat.
Estos mecanismos pueden ser:
- estímulo dependiente. Cuando el cambio de comportamiento requiere la presencia del insecticida. Aumenta la repelencia y la irritabilidad.
- estímulo independiente. Cuando la población de insectos prefiere distintos hábitos que los normales. No requiere el contacto con el insecticida.
El cambio de comportamiento como mecanismo de resistencia es difícil de detectar por ensayos biológicos ya que están diseñados para encontrar diferencias en la supervivencia de individuos que toleran más dosis de insecticida. Los bioensayos fuerzan el contacto insecto-insecticida, ya sea porque aplican una cantidad fija por tópico o porque lo obligan a estar expuestos a una superficie tratada un determinado tiempo, siendo difícil detectar y cuantificar un cambio de comportamiento.
De todos modos la clasificación sobre mecanismos de resistencia es simplemente para facilitar su estudio, porque en la práctica se observa con frecuencia que las poblaciones con alto nivel de resistencia tienen mecanismos combinados.
Thomas Sparks realizó un relevamiento de aquellos casos en los que se estudio mecanismos de resistencia incluyendo los comportamentales, y observó que en un 27% de los casos se debía a comportamentales estímulo independiente y un 8% estímulo dependiente, es decir que en aquellos trabajos en los que se evaluó si había cambios de comportamiento se encontró que en el 35% de los casos había resistencia por comportamiento.
Por otro lado se encontró que en un 27% de los casos se debe a cambios bioquímicos y fisiológicos sin alterar el comportamiento de la población y un 27% en los que se combinan comportamiento más cambios bioquímicos y fisiológicos.
Ver figura 1
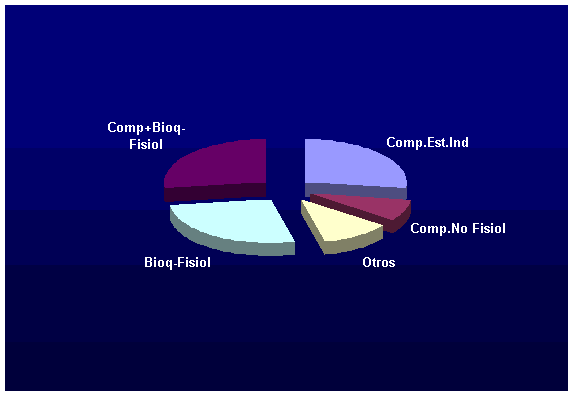
figura 1 interacción entre mecanismos de resistencia
siguiendo el análisis encontramos que, la mayoría de los casos de resistencia por comportamiento se da en aquellas especies muy hiperactivas donde pequeños cambios en cualquiera de las etapas del comportamiento provocan cambios en la interacción insecto-insecticida. Así como el mayor porcentaje de resistencia por comportamiento reportada, se registra en mosquitos (16,4%), moscas domésticas (20%) y otras moscas (22,7%). El resto se reparte entre cucarachas y otros insectos.

Si se realiza el análisis según la familia de insecticidas involucrada (sólo los neurotóxicos), el mayor porcentaje de casos reportados se da en los que poseen mayor capacidad repelente o irritante como el DDT y piretroides.
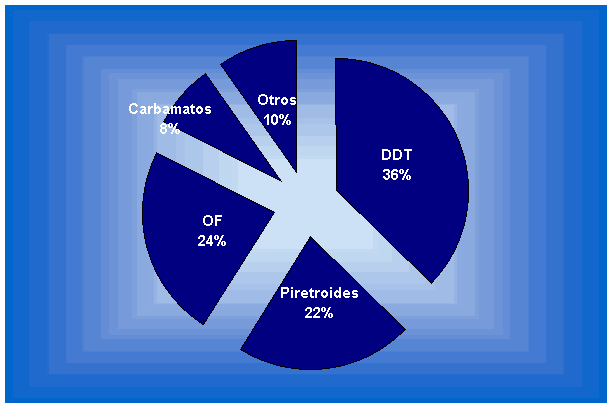
MECANISMOS FISOLOGICOS Y BIOQUIMICOS
Son los más frecuentes, los más fáciles de evaluar y los que producen mayor nivel de resistencia. El nivel de resistencia se mide como:
DL50 cepa resistente
Grado de resistencia= ————————–
DL50 cepa susceptible
Siendo la DL50 la dosis de toxico necesaria para producir el 50% demortalidad de los insectos expuestos. El nivel de resistencia expresa cuantas veces más tóxico hay que aplicar a la cepa resistente para obtener la misma mortalidad que en la cepa susceptible.
Nos referiremos ahora a los mecanismos fisiológicos y bioquímicos que afectan a los insecticidas llamados de segunda generación, siendo todos neurotóxicos.
Los mecanismos fisiológicos incluyen alteraciones en os principales pasos que sufre un insecticida al interactuar con el insecto:
menor velocidad de penetración
mayor capacidad de almacenar y/o excretar insecticida sin metabolizar
La velocidad de penetración reducida es un mecanismo posible hacia varios insecticidas; el gen responsable de dicho mecanismo ( gen pen) simplemente retarda el volteo del insecto cuando está solo, pero combinado con otro factor de resistencia tiene efecto sobre la mortalidad final. Se encontró que la Musca domestica resistente la velocidad de penetración se reduce entre 2 y 5 veces, pero se determinó que la velocidad depende básicamente del insecticida, la dosis ( a mayor dosis las diferencias de velocidad de penetración en cepas susceptibles y resistentes tienden a desaparecer) y el solvente.
El efecto biológico del gen que codifica penetración reducida ha sido estudiado entre otros, por Patio y G, quienes encontraron importantes diferencias en la fracción fosfolipídica de la cepa resistente y susceptible. No se sabe todavía si la mayor cantidad de fosfolípidos se debe al gen pen y como afecta la velocidad de penetración.
Los mecanismos bioquímicos incluyen alteraciones en la capacidad detoxicante y en la sensibilidad del sitio de acción.
Mayor metabolismo degradante
Es el mecanismo más frecuente en las cepas resistentes. El efecto final de intoxicación es un equilibrio entre lo que llega al sitio de acción para ejercer su acción tóxica y lo que se degrada para ser excretado. Si el paso degradativo está aumentado habrá menos concentración de tóxico en el medio interno del insecto y este tolerará mayores concentraciones externas de insecticida.
Los principales caminos degradativos de los insecticidas neurotóxicos son:
- estearasas
- oxidasas
- transferasas
- estearasas
tres de las principales familias de insecticidas neurotóxicos (OF, carbamatos y piretroides) son ésteres y pueden ser hidrolizados por estarasas. El aumento en actividad degradativa mediada por estearasas es un mecanismo de resistencia muy importante en los organofosforados, a veces importante en los piretroides y poco importante en los carbamatos. Dentro de las estearasas podemos diferenciar : carboxiestearasas
fosforotriestearasas,
según produzcan hidrólisis de grupos carboxiester o fosforotriester.
- oxidasas
de función mixta (MFO) son enzimas universalmente distribuidas que juegan un rol importante en la degradación de casi todas las familias de insecticidas ( excepto ciclodienos)
- transferasas
las transferasas juegan un rol más modesto ya que se limitan a la detoxicación de fosforados y lindano. Estas enzimas catalizan un primer paso en el proceso de detoxicación de organofosforados transfiriendo un grupo arilo o alkilo al átomo de sulfuro del glutation reducido. Dependen de la presencia de glutation.
El incremento de uno o más de estos mecanismos degradativos en la misma cepa puede ocasionar la llamada resistencia cruzada y resistencia múltiple. En la resistencia cruzada la cepa se hace resistente a más de una familia s insecticidas por un único mecanismo, mientras que en la resistencia múltiple varios mecanismos confieren resistencia a varias familias de insecticidas. Ambos fenómenos traen aparejados inconvenientes adicionales en el manejo de la resistencia ya que limita las opciones alternativas en elcontrol de la plaga.
El incremento en el nivel de carboxiestearasas produce resistencia específica hacia aquellos insecticidas con grupo carboxiester, por ejemplo el malation, sin cruzar con otros insecticidas organofosforados. Por el contrario el incremento en el nivel de oxidasas de función mixta es un mecanismo que afecta a prácticamente todas las familias de insecticidas produciendo patrones de resistencia cruzada.
Alteración del sitio de acción
Teniendo en cuenta que la acción insecticida se debe a la unión perfecta del mismo sitio de acción, cualquier alteración en éste produce cambios en la acción tóxica.
Para entender el mecanismo de resistencia por sitio de acción alterado repasaremos el mecanismo de transmisión nerviosa.
La neurona transmite el impulso nervioso a lo largo del axón. En estado de reposo el medio interno es negativo respecto al externo por distintas concentraciones de iones sodio (Na+) y potasio (K+). Cuando llega el impulso nervioso cambia la permeabilidad de la membrana para permitir la entrada de Na+ y disminuir la diferencia de potencial. La membrana nerviosa recupera rápidamente su estado de equilibrio mediante un movimiento de iones Na+ y K+ a través de canales específicos.
Cuando un impulso nervioso llega a la sinapsis ya no hay contacto entre membranas, necesitándose un medidor químico que estimule la membrana postsináptica. Este mediador químico es la acetilcolina (Ach). La Ach es una sustancia estimuladora, mientras esté la estimulación nerviosa continuará. Por ello una vez que ejerció su acción debe ser degradada por la acetilcolinesterasa (AchE)
Los insecticidas organofosforados y carbamatos son acetilcolinesterásicos y ejercen su acción tóxica inhibiendo la enzima Ache y alterando la transmisión nerviosa normal.
Los insecticidas piretroides y DDT actúan a nivel de la membrana nerviosa en un sitio muy cercano a los canales Na+ y K+, disminuyendo la velocidad de cierre de los mismos y perturbando la transmisión nerviosa central.
Alteración de la AchE como causa de la resistencia.
El mejor ejemplo de sitio de acción alterado como causa de resistencia a insecticidas es la Ache con menor sensibilidad a los fosforados y / o carbamatos, acetilcolinesterasas de este tipo se encontraron en un número pequeño pero creciente de cepas de artrópodos.
La correlación entre la insensibilidad de Ache y resistencia es la mejor prueba que la inhibición de la enzima es efectivamente el modo de acción de los inhibidores colinesterásicos.
El nivel de alteración de la Ache se mide conel índice de insensibilidad
Constante de inhibición Ache susceptible
I.I. =——————————————————–
Constante de inhibición Ache resistente
Cuanto más rápido se inhibe la susceptible respecto a la resistente, mayor es la alteración de la enzima
Gen Kdr como causa de resistencia
Los insecticidas piretroides y DDT interfieren con la velocidad de cierre de los canales iónicos quedando la membrana nerviosa exitada en forma permanente y produciendo lesiones primarias críticas, puntos de partida de cadenas de eventos que conducen a ls muerte.
Se han reportado cepas de insectos resistentes a piretroides y DDT con un gen llamado kdr (resistencia al volteo). Los datos disponibles acerca del mecanismo del kdr provienen principalmente de estudios electrofisiológicos donde se observa que los insecticidas no alteran la función nerviosa.