Purificación de Aguas por Fotocatálisis Heterogénea: Estado del Arte. Parte 1
Julián Blanco Gálvez, Sixto Malato Rodríguez, Claudio A. Estrada Gasca,
Erick R. Bandala, Silvia Gelover y Teresa Leal
1. INTRODUCCIÓN
Por diversas razones, el proceso de tratamiento y/o purificación de aguas mediante fotocatálisis heterogénea con dióxido de titanio como catalizador es, hoy por hoy, una de las aplicaciones fotoquímicas que más interés ha despertado entre la comunidad científica internacional. Por un lado, la fotocatálisis heterogénea, a diferencia de la mayoría de los procesos fotoquímicos, no es selectiva y puede emplearse para tratar mezclas complejas de contaminantes [1]. Por otro lado, la posibilidad de la utilización de la radiación solar como fuente primaria de energía, le otorga un importante y significativo valor medioambiental[2-3]; el proceso, constituye un claro ejemplo de tecnología sostenible.
La primera publicación sobre este proceso de degradación de contaminantes en fases tanto acuosa como gaseosa, se debe a Carey y aparece en 1976 [4]. Desde entonces, un análisis histórico de la evolución del desarrollo del proceso fotocatalítico para la purificación de aguas permite identificar cuatro etapas claramente diferentes. En una primera etapa con escasas publicaciones, aproximadamente entre 1976 y 1985, sólo unos pocos grupos científicos trabajan en el tema; no se vislumbra todavía una aplicación concreta. La segunda etapa, de mediados de la década de los 80 y hasta los primeros años de la década de los 90, coincide con una creciente preocupación e inquietud de la comunidad científica internacional sobre temas medioambientales; en ella se plantea la posibilidad de aplicar este proceso al tratamiento de contaminantes en agua [5-6]. El éxito de las primeras experiencias da lugar a una masiva incorporación de grupos de investigación al estudio del tema. En esta situación, a finales de los 80, como resultados de extrapolaciones muy optimistas de los resultados obtenidos hasta entonces, llegó a considerarse al proceso fotocatalítico como un posible método universal para la degradación de contaminantes orgánicos.
La tercera etapa, que se puede enmarcar entre mediados y finales de la década de los 90, es una especie de antítesis de la etapa anterior. Se registra una profusión de resultados contradictorios, y los estudios de investigación básica y de sus aplicaciones generaron un debate sobre las posibilidades reales de aplicación del proceso. Se enfatizaron los inconvenientes provenientes de las limitaciones para producir grandes cantidades de radicales hidroxilo y de la lentitud del proceso de degradación global. Se obtienen resultados alentadores al estudiar sistemas casi reales, simultáneamente con otros resultados negativos o dudosos, y se genera así mucha confusión en la percepción del público no científico.
La cuarta etapa, en la que nos encontramos actualmente, se caracteriza por una visión más conservadora y realista de las posibilidades de la tecnología asociada, enfocada en aquellas aplicaciones iniciales que parecen más prometedoras. Ya no se cree que el proceso de fotocatálisis, tal y como se conoce y se define en la actualidad, pueda ser algo universal, pero en cambio se han identificado aplicaciones específicas y concretas en las que la tecnología, desarrollada adecuadamente, puede resultar viable y competitiva.
La Figura 1 muestra el crecimiento del número de referencias y patentes relacionadas con eliminación fotocatalítica heterogénea de compuestos tóxicos y nocivos tanto en agua como en aire, entre 1976 y 1998.
 |
Como ya se ha indicado, la fotocatálisis heterogénea pertenece al grupo de las denominadas Tecnologías avanzadas de oxidación, conjuntamente con otros procesos basados también en la generación de radicales oxidantes. A su vez, este grupo es sólo una fracción de las herramientas desarrolladas por el hombre para el tratamiento de aguas. Aunque no existe una regla general, ya que cada aplicación potencial de la fotocatálisis debe desarrollarse individualmente, las siguientes directrices generales acotan en un sentido amplio las condiciones en las que puede esperarse que un determinado caso real pueda ser abordado mediante técnicas de fotocatálisis con posibilidades de éxito:
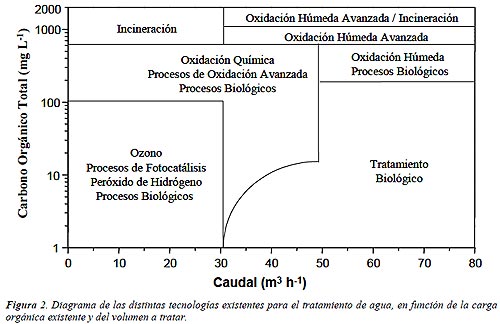
Concentración máxima orgánica de varios cientos de mg L-1. Los procesos de fotodegradación son razonablemente eficientes cuando la concentración de los contaminantes es baja o media, hasta unos pocos de cientos de ppm de orgánicos. Si bien el límite varía con la naturaleza de los contaminantes, la fotocatálisis no es normalmente una opción conveniente si las concentraciones superan el valor de 1 gr L-1 (a menos que se recurra a una etapa previa de dilución).
Contaminantes no biodegradables. Los tratamientos biológicos son en general más económicos, pero si los contaminantes no son biodegradables, los procesos fotocatalíticos se pueden constituir en una alternativa de mucho valor.
Contaminantes peligrosos presentes en mezclas de orgánicos complejos. Una de las principales ventajas de la fotocatálisis, su escasa o nula selectividad, permite que se puedan tratar también a los contaminantes no biodegradables que puedan estar presentes en una mezcla compleja con otros compuestos orgánicos. Si bien el proceso puede usarse para tratar aguas que contienen un único contaminante, sus ventajas comparativas aumentan cuando es necesario tratar este tipo de mezclas complejas.
Contaminantes cuyo tratamiento convencional es difícil. La fotocatálisis, como cualquier otra técnica novedosa de tratamiento, es especialmente útil en aquellos casos en los que los métodos convencionales son complejos y/o costosos. La iniciativa privada, imprescindible para el completo desarrollo comercial de la tecnología o tecnologías asociadas al proceso, asumirá los riesgos inherentes más fácilmente en estos casos.
La Figura 2 muestra una clasificación de las distintas tecnologías existentes para el tratamiento de contaminantes en agua, entre ellas los procesos de fotocatálisis. En la actualidad, la degradación fotocatalítica de la práctica mayoría de contaminantes orgánicos que aparecen normalmente disueltos en agua ha sido extensamente estudiada. La lista incluye, entre otros muchos, detergentes, pesticidas y compuestos complejos de residuos industriales con alta carga de materia orgánica [7-8].
 |
2. CONTROL DEL PROCESO
En el Capítulo 1, Sección 5, se discutieron los aspectos fundamentales del proceso. De allí surge con claridad que, para llegar a la completa mineralización de un determinado contaminante, pueden aparecer y desaparecer previamente toda una serie de compuestos intermedios de la reacción. Por lo tanto, para poder verificar la viabilidad del proceso fotocatalítico como técnica para la degradación de contaminantes, resulta importante demostrar la eliminación no solo de los compuestos iniciales, sino también de todos los compuestos intermedios que se generen, hasta la completa desaparición de todos los compuestos no deseables, aún en el caso de tener inicialmente un único contaminante.
Un ejemplo de este proceso es el que aparece representado en las Figuras 3 y 4. La Figura 3 muestra que, bajo irradiación solar y en presencia de TiO2 en suspensión, la fotodescomposición del pesticida pirimetanil (insecticida no sistémico con una solubilidad en agua de 0.12 g/L a pH 6.1 y 25ºC). Como puede observarse, mientras que el compuesto inicial se degrada totalmente de forma rápida, el carbono orgánico total lo hace mucho más lentamente y queda remanente una pequeña proporción del mismo.
 |
La Figura 4 muestra la formación y descomposición de los principales compuestos intermedios [9], que aparecen identificados en la Figura 5, mediante la aplicación de espectrometría de masas acoplada con cromatografía de gases y líquidos.
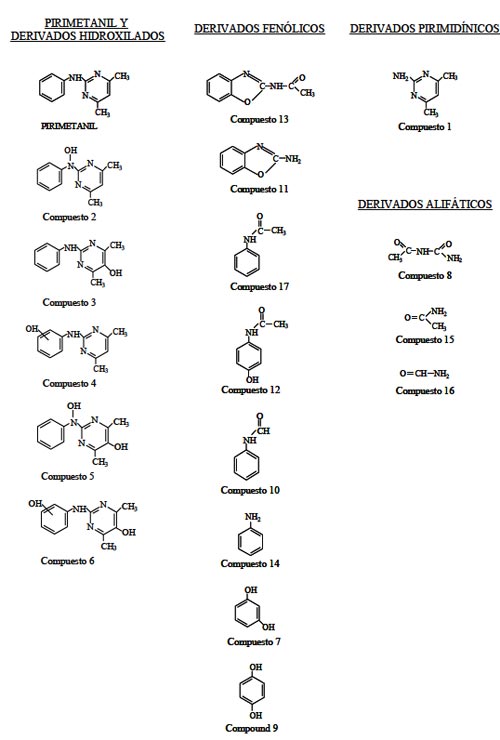 Figura 5. Estructuras químicas del pirimetanil y sus compuestos derivados obtenidos durante la degradación fotocatalítica mediante TiO2 [9]. |
El gran número de compuestos intermedios detectados durante la degradación del pirimetanil demuestra la complejidad del proceso fotocatalítico y sugiere la existencia de varias rutas de degradación. Según se aprecia en dicha Figura 4, estos compuestos intermedios aparecen y degradándose de forma simultánea, quedando solamente dos de ellos remanentes y resistentes al proceso fotocatalítico. Estos compuestos, identificados como los compuestos 15 y 16, presentan estructuras nitrogenadas que se encuentran entre las pocas que presentan una elevada resistencia al ataque del radical hidroxilo. Dada la elevada dificultad de seguimiento de todos los productos intermedios posibles, se puede seguir la evolución del proceso de fotocatálisis de forma fiable mediante el seguimiento del Carbono Orgánico Total, también realizado en el ejemplo y obteniendo valores concordantes con las concentraciones de los compuestos finalmente remanentes; otra forma de realizar este seguimiento de la mineralización final puede ser a través de la evolución de la formación de CO2. La identificación de los distintos productos intermedios es útil para comprender el mecanismo del proceso de foto-oxidación hasta CO2 y elementos simples que normalmente van a ser inorgánicos; este tema se discute en el Capítulo 5.
En definitiva, en las aplicaciones prácticas del proceso de degradación oxidativa, no basta la mera desaparición de los contaminantes; es imprescindible también la conversión de, al menos un importante porcentaje del carbón orgánico en carbón inorgánico, en forma de CO2. El fin del proceso es la mineralización completa de todo el carbono orgánico, para asegurar que tanto el contaminante como cualquier otro producto intermedio formado durante el proceso fotocatalítico han sido degradados. En algunos casos, la degradación parcial del contaminante puede ser aceptable si el producto final es un producto inocuo. Por lo tanto, para un adecuado seguimiento del proceso fotocatalítico se utiliza una ampliavariedad de mediciones químicas; las más importantes se describen brevemente a continuación.
Demanda Química de Oxígeno (DQO). Es la medida del oxígeno necesario para oxidar la materia orgánica e inorgánica susceptible de oxidación contenida en una muestra. Su determinación se basa en la oxidación enérgica de la materia orgánica e inorgánica que se encuentra en el agua, en un medio fuertemente ácido con una solución valorada de dicromato de potasio. Los valores de este parámetro están asociados al grado de avance de la oxidación de los contaminantes, por lo que la determinación seriada de DQO es una herramienta útil de seguimiento del proceso.
Demanda Bioquímica de Oxígeno (DBO). Este parámetro se obtiene mediante una prueba empírica estándar, y mide la cantidad de oxígeno utilizado para la biodegradación de materia orgánica e inorgánica contenida en una muestra. El oxígeno se consume también en la oxidación de materia inorgánica como sulfuros o sales ferrosas. La prueba usa un tiempo fijo de incubación; la medición de oxígeno consumido en un período de 5 días (DBO5) es la más comúnmente empleada. Puede medirse también el oxígeno consumido hasta que no haya modificación alguna en la concentración de éste, lo que puede tomar entre 30 y 90 días de incubación (DBOultima). El procedimiento es sencillo: se determina el oxígeno disuelto al inicio y al final del tiempo de incubación preestablecido. La DBO es simplemente la diferencia entre la concentración inicial y final de oxígeno disuelto.
Carbono Orgánico Total (COT). El carbono orgánico total mide la cantidad de dióxido de carbono producida en la mineralización total de una muestra. A diferencia del DQO, su valor es independiente del estado de oxidación de los compuestos presentes en el sistema. Por ejemplo, iguales concentraciones de CH4, CH3OH o CH2O dan idénticos valores de COT. El COT se determina inyectando una porción de la muestra en una cámara de reacción a alta temperatura, la cual está empacada con un catalizador oxidante. El agua es vaporizada y el carbón orgánico oxidado a CO2 y agua. El CO2 generado es transportado por el gas portador y medido en un analizador infrarrojo no-dispersivo. Esta medición proporciona la cantidad de carbón total por lo que el carbón inorgánico debe ser determinado de manera separada y el COT obtenido por diferencia. El seguimiento del proceso mediante esta herramienta es importante porque valores de COT cercanos a cero son los únicos que garantizan que no se acumulen contaminantes recalcitrantes, intermediarios de mayor persistencia, capacidad de acumulación o toxicidad que los iniciales. La determinación del COT es un índice del grado de avance de la oxidación, y una herramienta indispensable para el seguimiento del proceso fotocatalítico.
Las mediciones de DBO, DQO y COT dan diferente información del estado del sistema y en cierta medida son complementarias. Las mediciones de DBO permiten seguir la evolución de los compuestos biodegradables. Combinada con el COT permite conocer el cambio en la proporción de biodegradabilidad al avanzar la fotocatálisis. De igual forma, el cambio de concentración de la DQO a lo largo del tiempo, genera una estimación de la susceptibilidad a la oxidación química por parte de la materia presente a lo largo del tratamiento. En tanto, el COT provee información sobre la disminución en concentración de la materia orgánica y por ende del grado de mineralización debida a la fotocatálisis. El COT es la manera más conveniente y directa de determinar la cantidad de materia orgánica, pero para conocer cuáles son las fracciones del COT que pueden ser oxidados ya sea química o bioquímicamente deben medirse la DQO y la DBO, respectivamente.
Determinación de productos inorgánicos. El seguimiento del proceso de fotocatálisis también puede realizarse indirectamente, midiendo el pH, o las concentraciones de iones inorgánicos como cloruro, nitrato, nitrito, fosfato, amonio y sulfato, entre otros, que resultan de la eliminación u oxidación de los heteroátomos presentes en la estructura química de los contaminantes degradados como resultado del proceso oxidativo. En muchos casos, la determinación de la variación de la concentración de los iones respecto a tiempo es una manera simple y barata de llevar a cabo el control del proceso. Existen varias metodologías para estas determinaciones, que van desde métodos rápidos y precisos que requieren instrumentación importante, hasta simples valoraciones volumétricas.
Toxicidad. La determinación de la toxicidad provee una prueba clave de la eficiencia de un proceso de degradación fotocatalítica, cuyo resultado esperado es la generación de una matriz libre de efectos nocivos sobre el ambiente. En el caso del agua, el producto deseable es un efluente que pueda ser vertido en cualquier cuerpo receptor sin afectar a ninguna de las especies del ecosistema. No existe una metodología única, o un organismo único de prueba de toxicidad que demuestre el cumplimiento de esta norma de conservación y protección ambiental, y es necesario usar un amplio repertorio de pruebas y organismos acuáticos bien definidos. El tipo de prueba y los organismos empleados dependerán del tipo de toxicidad que se desea determinar y el nivel de la cadena trófica sobre el cual se requiere determinar el efecto. Las metodologías más comunes para la determinación de toxicidad aguda son el sistema Microtox®, mortalidad de Daphnia magna y peces (Pimephales promelas) para la evaluación en bacterias, invertebrados y vertebrados, respectivamente. La toxicidad crónica se determina mediante pruebas de crecimiento de Ceriodaphnia dubia y Arbacia punctulata e inhibición de crecimiento de Selenastrum capricornutum, invertebrados los dos primeros y alga la tercera. La determinación de toxicidad es también un parámetro vital en el acoplamiento de los procesos de degradación fotocatalítica con tratamientos biológicos.
3. PARÁMETROS QUE INFLUYEN EN EL PROCESO
Un gran número de parámetros influyen tanto cualitativa como cuantitativamente en el proceso de oxidación-reducción fotocatalizado y que, como consecuencia, resultan determinantes en la eficiencia global del proceso. A continuación se mencionan algunos de los más importantes.
pH. Normalmente, el proceso de fotocatálisis es más eficiente en medio ácido (3 ≤ pH ≤ 5). El pH afecta las propiedades superficiales del catalizador y a la forma química del compuesto a degradar, y ello se manifiesta en alteraciones de la velocidad de degradación y en la tendencia a la floculación del catalizador. Adelantando conceptos que se discuten en el Capítulo 4, diremos que el dióxido de titanio es anfótero, con un punto isoeléctrico variable según el método de síntesis. Por ejemplo, el P25 Degussa (70% anatasa; 30% rutilo) posee un valor de punto isoeléctrico alrededor de pH 6,5 [3] mientras que para el TiO2 de Sigma o Janssen (>99% anatasa) el valor del punto isoeléctrico es pHpie ≈ 2 [10-11]. El control del valor pH – pHpie es de mucha importancia para lograr resultados reproducibles y optimizados.
Características del catalizador. Este tema se discute en detalle en el Capítulo 7. Aquí adelantaremos algunos conceptos básicos. En general, son características ventajosas para un fotocatalizador una alta área superficial, una distribución de tamaño de partícula uniforme, forma esférica de las partículas y ausencia de porosidad interna. Normalmente se emplean polvos cuyas partículas tienen radios micrométricos (en el Capítulo 7 se discutirán las propiedades de las nanopartículas). La anatasa parece ser la forma cristalina con mejores propiedades fotocatalíticas y esto ha sido atribuido, entre otras razones, a la mayor capacidad de fotoadsorción de la anatasa por oxígeno molecular y sus formas ionizadas y a su baja rapidez relativa de recombinación de pares hueco-electrón (ver Capítulo 5). Las partículas están formadas por cristales que, en general, presentan una amplia variedad de defectos que determinan de manera importante su reactividad química (ver Capítulo 7). Con el fin de aumentar su eficiencia fotocatalítica, el TiO2 ha sido sometido dopado con diversos iones metálicos, y también se ha intentado sensibilizar el catalizador a longitudes de onda mayores, (luz visible) empleando tintes o colorantes tanto orgánicos como organometálicos. Hasta ahora, no se han obtenido resultados plenamente positivos; este tema puede consultarse en el Capítulo 7.
El dióxido de titanio producido por Degussa bajo el nombre comercial de P25 es el catalizador no soportado más empleado ya que hasta ahora ha mostrado una mayor efectividad. Sin embargo, posee un área superficial específica baja (50 m2/g), las dimensiones de partícula no son uniformes y cerca del 30% de su estructura cristalina es rutilo.
Temperatura. La velocidad de las reacciones fotocatalíticas no se modifica apreciablemente con la variación de la temperatura del sistema, aún en ensayos llevados a cabo utilizando radiación solar. Este comportamiento es típico de reacciones iniciadas fotoquímicamente, por absorción de un fotón.
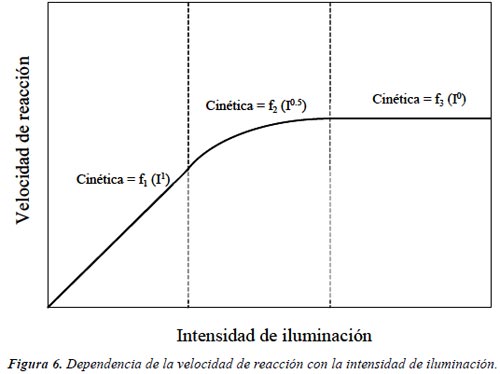
Intensidad de la radiación. La Figura 6 muestra esquemáticamente la influencia de la intensidad de la radiación sobre la velocidad de reacción. El cambio de un orden parcial de 1 a 0,5 significa que la recombinación de ebv – y hbc + comienza a limitar el aprovechamiento de los fotones disponibles, y el cambio a un orden cero indica que el sustrato no puede generar más pares [13] aun cuando aumente la intensidad de la radiación (ver Capítulo 5). Estos resultados son especialmente relevante para el diseño de los colectores cuando se usa radiación solar.
Los colectores de canal parabólico, usados inicialmente para el tratamiento de agua, han sido reemplazados por sistemas de bajo flujo radiativo; la eficiencia de estos últimos sistemas de colección solar está basada en el alto porcentaje de fotones UV de la componente difusa del espectro solar y en la baja dependencia del proceso fotocatalítico con la intensidad de la radiación [14-15].
 |
Es importante notar que aproximadamente un 50% de los fotones UV disponibles en la radiación solar se encuentran en la componente difusa. Esto implica que las tecnologías de bajo flujo radiativo pueden ser capaces de duplicar la cantidad de fotones UV incidentes en el fotoreactor.
Diseño del reactor. Los parámetros derivados del diseño y del tipo de reactor también juegan un papel importante en el resultado final de la reacción. Factores como la geometría, la óptica, distribución de luz, tipo de flujo, etc. van a influir sobre el rendimiento final del mismo. Este tema se trata en los Capítulos 9-11.
Naturaleza y concentración del contaminante. Una de las ecuaciones más sencillas y usadas para describir la cinética del proceso fotocatalítico es la de Langmuir-Hinshenlwod:
| (dC/dt)inicial = – k K C /(1 + K C) | (1) |
Esta ecuación modela originalmente un mecanismo de reacción en el que participan un pre-equilibrio de adsorción y una reacción superficial lenta. En la práctica, se ha demostrado que otros mecanismos pueden igualmente conducir a la ecuación (1), que debe considerarse como una ecuación empírica y sencilla que permite modelar el comportamiento del sistema.
La ecuación (1) es una función implícita de la concentración y representa una transición gradual desde un comportamiento de primer orden a otro de orden cero al aumentar la concentración C. Los factores discutidos anteriormente (pH, temperatura, el catalizador, la intensidad de radiación, etc.) influyen sobre los valores de k y K. Estos parámetros son también muy sensibles a la naturaleza del contaminante, como lo demuestra la Figura 7, que representa una versión linealizada de la ecuación de Langmuir-Hinshelwood, la ecuación (2), que vincula la inversa de la velocidad con la inversa de la concentración.
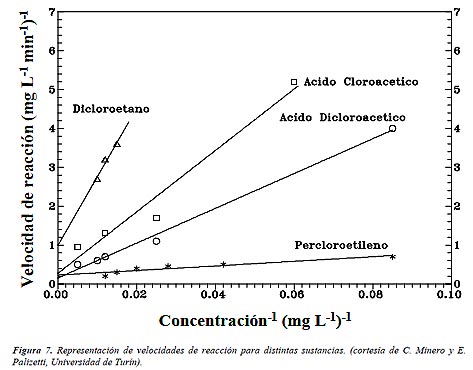 |
| – {(dC/dt)inicial}-1 =k-1 + (k K)-1 C-1 | (2) |
La reacción puede hacerse más compleja debido a la existencia de uno o varios compuestos intermediarios cinéticamente importantes. La ley cinética debe tomar en cuenta este hecho, que provoca una ralentización del proceso de desaparición del reactivo de acuerdo con la ecuación (3), donde la suma del denominador corresponde a todos los compuestos intermediarios que aparezcan en el proceso.
| dC / dt = – k K C / (1 + KC + Σ KiCi) | (3) |
Aditivos. Determinadas sustancias puede incidir de forma importante a la eficacia del proceso de fotocatálisis, ya sea inhibiendo o acelerando la velocidad de degradación del contaminante. Algunos aniones inorgánicos como cloruros, sulfatos y fosfatos inhiben el proceso; otros, como nitratos y percloratos, apenas si tienen influencia sobre la velocidad. La inhibición se relaciona con la adsorción de dichos iones sobre el catalizador, que compite con la adsorción del contaminante, especialmente cuando favorezcan la recombinación de pares ebc – – hbv +.
Por su parte, los agentes oxidantes son imprescindibles para la degradación del contaminante, ya que participan en la reacción de oxidación: son los responsables de una de las dos semirrreacciones (la captura de huecos); cuanto más eficaz sea el agente oxidante para capturar huecos, mayor será la velocidad del proceso [16]. Este tema se discute en más detalle en los Capítulos 5 y 8.
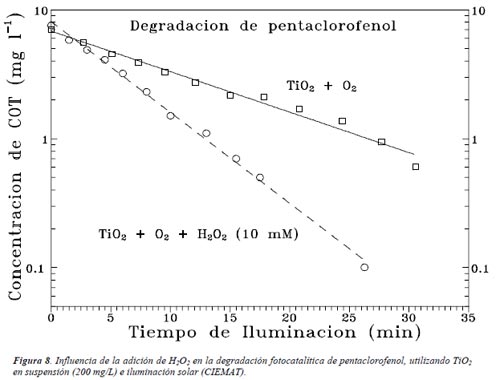
El oxígeno es el oxidante más empleado, ya que es el más barato y no compite con el sustrato en el proceso de adsorción. Se ha comprobado que cuando desaparece el oxígeno disuelto en el agua y no existe ninguna otra especie oxidante, el proceso fotocatalítico se detiene totalmente. Después del oxígeno, el peróxido de hidrógeno es el agente oxidante más extensamente estudiado. En la gran mayoría de los casos, la velocidad del proceso aumenta de acuerdo con la siguiente secuencia: O2 < H2O2 < (H2O2 + O2). La Figura 8 muestra el caso de la degradación de pentaclorofenol por O2 y por mezclas H2O2 + O2. Como ya se describió en el Capítulo 1, el papel del H2O2 es múltiple; en el proceso de fotocatálisis heterogénea es capaz de reaccionar tanto con huecos como con electrones, y generar en ambos procesos radicales •OH; además, es capaz de oxidar directamente algunos de los intermediarios, generando en el proceso radicales •OH adicionales. Como se vio en el Capítulo 1, el peróxido de hidrógeno se usa en los procesos de fotooxidación homogénea, con radiación UV de longitud de onda entre 290 y 320 nm.
| H2O2+e–BC –> OH–+ • OH | (4) |
| H2O2+h+BV –>2 • OH | (5) |
 |
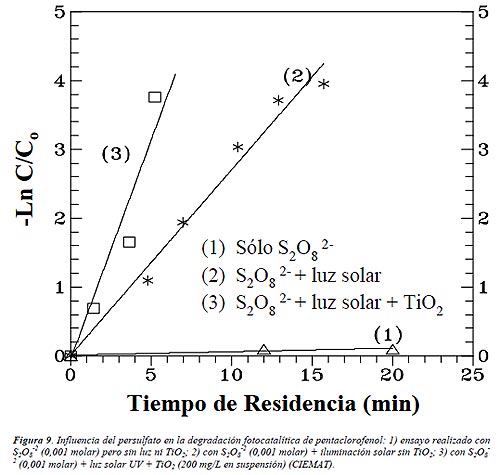
También se utilizó exitosamente el ión persulfato (S2O8 2-) con compuestos muy diferentes [17-18]. El persulfato aumenta la velocidad de la reacción fotocatalítica porque evita y reduce la probabilidad de recombinación, genera radicales hidroxilo adicionales y, además, produce radicales •SO4/ que son también fuertemente oxidantes:
| S2O82-+e – BC –>• SO –4 + SO2-4 | (6) |
| SO–4+ H 2 O –> • OH + SO 2-4 + H+ | (7) |
La captura de electrones (ecuación (6)) y la generación de radicales •OH adicionales es responsable de un aumento aproximado en un orden de magnitud de la velocidad cuando se agrega peroxodisulfato. En la Figura 9 puede apreciarse que la adición de persulfato, a pesar de ser un agente oxidante de por sí, en ausencia de luz y de TiO2, no da lugar a un fenómeno apreciable de degradación del compuesto pentaclorofenol (PCP). Bajo iluminación se observa la degradación fotoquímica, que se vuelve mucho más rápida cuando se añade, finalmente, TiO2.
 |