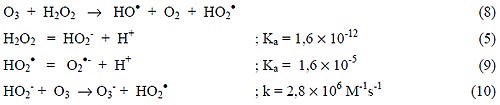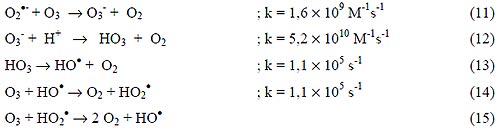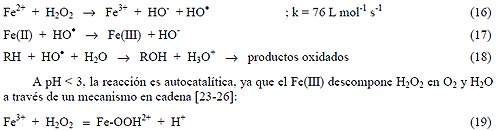Procesos avanzados de oxidación: Parte 1: Procesos avanzados de oxidación para la eliminación de contaminantes
Xavier Domènech, Wilson F. Jardim y Marta I. Litter
1. INTRODUCCIÓN
La creciente demanda de la sociedad para la descontaminación de aguas contaminadas de diversos orígenes, materializada en regulaciones cada vez más estrictas, ha impulsado, en la última década, al desarrollo de nuevas tecnologías de purificación.
En la práctica, la aplicación de los métodos de tratamiento debe tener en cuenta fundamentalmente la naturaleza y las propiedades fisicoquímicas de las aguas o efluentes a tratar [1]. Las aguas contaminadas por la actividad humana pueden, en general, ser procesadas eficientemente por plantas de tratamiento biológico, por adsorción con carbón activado u otros adsorbentes, o por tratamientos químicos convencionales (oxidación térmica, cloración, ozonización, permanganato de potasio, etc.). Sin embargo, en algunos casos estos procedimientos resultan inadecuados para alcanzar el grado de pureza requerido por ley o por el uso ulterior del efluente tratado. En estos casos y cada vez más crecientemente, se está
recurriendo en los países industrializados al uso de las llamadas Tecnologías o Procesos Avanzados de Oxidación (TAOs, PAOs), muy poco aplicados y, peor aún, menos difundidos en los países de economías emergentes como los de América Latina. La mayoría de las TAOs puede aplicarse a la remediación y destoxificación de aguas especiales, generalmente en pequeña o mediana escala. Los métodos pueden usarse solos o combinados entre ellos o con métodos convencionales, pudiendo ser aplicados también a contaminantes de aire y suelos.
Permiten incluso la desinfección por inactivación de bacterias y virus. Las TAOs [2-6] se basan en procesos fisicoquímicos capaces de producir cambios profundos en la estructura química de los contaminantes. El concepto fue inicialmente establecido por Glaze y colaboradores [3, 7-8], quienes definieron los PAOs como procesos que involucran la generación y uso de especies transitorias poderosas, principalmente el radical hidroxilo (HO•). Este radical puede ser generado por medios fotoquímicos (incluida la luz solar) o por otras formas de energía, y posee alta efectividad para la oxidación de materia orgánica. Algunas TAOs, como la fotocatálisis heterogénea, la radiólisis y otras técnicas avanzadas, recurren además a reductores químicos que permiten realizar transformaciones en contaminantes tóxicos poco susceptibles a la oxidación, como iones metálicos o compuestos halogenados.
El cuadro que sigue da un listado de las TAOs, clasificadas en procesos no fotoquímicos y procesos fotoquímicos.
 |
Existen otras tecnologías que pueden incluirse también entre las TAOs, como el tratamiento con barreras permeables reactivas de Fe metálico (Fe cerovalente) [9-10] y la oxidación con K2FeO4 (Fe(VI)) [11]. Sin embargo, en este capítulo nos referiremos sólo a aquellas tecnologías que involucran principalmente al radical HO•.
El siguiente cuadro resume las ventajas de estas nuevas tecnologías sobre los métodos convencionales.
 |
Las TAOs son especialmente útiles como pretratamiento antes de un tratamiento biológico para contaminantes resistentes a la biodegradación o como proceso de postratamiento para efectuar un pulido de las aguas antes de la descarga a los cuerpos receptores [12].
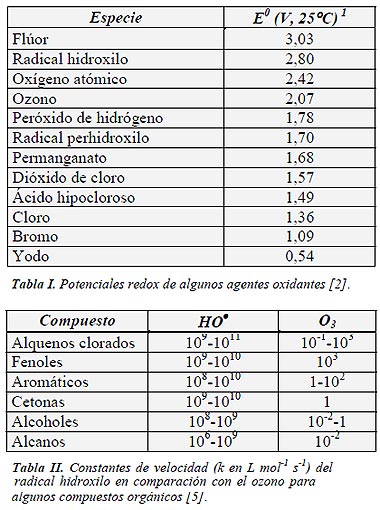
¿Cuál es la explicación de la eficiencia de estas técnicas? Los procesos involucrados poseen una mayor factibilidad termodinámica y una velocidad de oxidación muy incrementada por la participación de radicales, principalmente el radical hidroxilo, HO•. Esta especie posee propiedades adecuadas para atacar virtualmente a todos los compuestos orgánicos y reaccionar 106-1012 veces más rápido que oxidantes alternativos como el O3. La Tabla I, que presenta potenciales de oxidación de distintas especies, muestra que después del flúor, el HO• es el oxidante más enérgico. En la Tabla II se puede observar la gran diferencia en las constantes de velocidad de reacción de distintos compuestos con el radical hidroxilo y con el ozono. De todos modos, debemos destacar que, para ser eficientes, las TAOs deben generar altas concentraciones de radicales hidroxilo en estado estacionario.
 |
Las TAOs tienen actualmente un grado de desarrollo y comercialización variado, en constante cambio a medida que se avanza científica y tecnológicamente en el tema. Las técnicas de ozonización en medio alcalino, UV/H2O2, UV/O3, UV/H2O2/O3, UV/Fenton y UV/TiO2 están total o parcialmente comercializadas.
2. TECNOLOGÍAS AVANZADAS DE OXIDACIÓN NO FOTOQUÍMICAS
Estas TAOs originan especies reactivas potentes, principalmente el radical hidroxilo, a través de la transformación de especies químicas o mediante la utilización de distintas formas de energía, con excepción de la irradiación luminosa.
2.1. Ozonización en medio alcalino
El ozono puede reaccionar en forma directa con un sustrato orgánico a través de una reacción lenta y selectiva, ecuación (1), o de una reacción radicalaria favorecida en medio alcalino (rápida y no selectiva), ecuación (2) [3, 8, 13-14]:
1 Los potenciales dados en este capítulo están referidos al electrodo normal de hidrógeno.
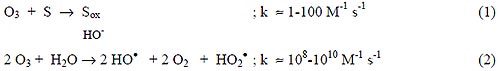 |
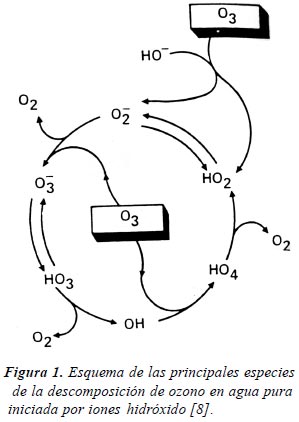
Las constantes de velocidad con compuestos orgánicos difieren mucho para ambos tipos de procesos, tal como se ha mostrado en la Tabla II. La primera reacción es de importancia en medios ácidos y para solutos que reaccionan muy rápido con el ozono; ejemplos de ello son los compuestos orgánicos no saturados, con grupos cromofóricos o con grupos aminos. La segunda reacción puede iniciarse de distintos modos, con especies tales como HO–, HO2 –, HCOO –, Fe2+ o sustancias húmicas. Por lo tanto, en principio, la ozonización es sensiblemente más eficiente en medios alcalinos. La Figura 1 muestra un esquema de las principales especies de la descomposición de ozono en agua pura iniciada por iones hidróxido [8].
 |
Este camino indirecto es menos selectivo, ya que las especies formadas tienen gran capacidad oxidante. Existen sin embargo compuestos refractarios, como los ácidos acético y oxálico, productos de oxidación intermedia en ozonización y otros procesos de hidroxilación, que resisten la mineralización. La materia orgánica reaccionará, por lo tanto, por una combinación de ambas reacciones, dependiendo de la composición del agua tratada, del pH y de la dosis de ozono. Debe tenerse cuidado de no elevar excesivamente el pH, debido a la acción atrapadora de HO• competitiva de los iones bicarbonato y carbonato (esta competencia ocurrirá en toda TOA cada vez que se formen HO• en soluciones carbonatadas):
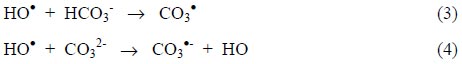 |
El ozono es un poderoso oxidante y eficiente bactericida, aplicado exitosamente desde hace mucho tiempo como desinfectante de aguas potables. Su uso ha permitido un notable mejoramiento del gusto, color, características de filtración y biodegradabilidad de las mismas. Se ha empleado con éxito en la decoloración de caolín y de pulpa de celulosa y, en general, como tratamiento de efluentes acuosos extremadamente contaminados. El ozono se transforma sólo en O2 y H2O, y el método no es tan tóxico como otros tratamientos convencionales que usan Cl2 o ácido crómico. Como los compuestos orgánicos tratados con este reactivo producen aldehídos, cetonas o ácidos carboxílicos, la ozonización es un buen pretratamiento para procesos biológicos, y versátil para técnicas combinadas. No produce trihalometanos (THM) u otros compuestos clorados, uno de los principales problemas de otros tratamientos como la cloración o el óxido de cloro. El ozono puede producirse fácilmente in situ por descarga eléctrica en corriente de aire, y no deja olores ni gustos residuales. En contraposición con los beneficios anteriores y desde el punto de vista operacional y de ingeniería, el uso de ozono no es trivial como el uso de un oxidante totalmente miscible con el agua, como el peróxido de hidrógeno, puesto que involucra procesos de transferencia de la molécula gaseosa a la fase acuosa, existiendo entonces limitaciones de transferencia de masa [15]. Por ello, el proceso requiere eficiente agitación, haciendo necesario el uso de difusores, mezcladores en línea, venturis y torres de contacto. Este aspecto agrega altos costos de inversión a su utilización. Para la destrucción completa de un compuesto se necesita, además, una relación molar bastante alta de O3 a contaminante (mayor que 5:1), con el consiguiente aumento de costos. Como hemos dicho, en algunos casos el método no conduce a mineralización completa. No permite trabajar a temperaturas muy altas, ya que el burbujeo del gas puede volatilizar compuestos iniciales o intermedios. El tratamiento no tiene propiedades de desinfección residuales. Como las aguas tratadas no deben contener ozono residual, deben introducirse desgasadores finales en el circuito, aumentando más aún el costo del proceso.
2.2. Ozono/H2O2
La ozonización transforma los contaminantes en compuestos más simples, más refractarios al reactivo. Se logra una mejoría agregando agua oxigenada [16]. El H2O2 es un ácido débil, un poderoso oxidante y un compuesto inestable, que dismuta con una velocidad máxima al pH de su pKa:
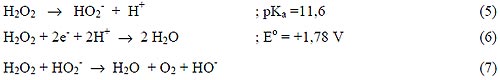 |
El uso de dos o más oxidantes combinados permite aprovechar los posibles efectos sinérgicos entre ellos, lo que produce una destrucción adicional de la carga orgánica. Sin embargo, como existe una gran dosis de empirismo en el uso de mezclas oxidantes, es difícil prever el rendimiento, que debe determinarse en ensayos de laboratorio. Entre las posibles mezclas de agentes oxidantes, la combinación peróxido de hidrógeno y ozono es sin duda la más usada. El proceso pretende combinar la oxidación directa (y selectiva) del ozono con la reacción rápida y poco selectiva de los radicales HO• con los compuestos orgánicos.
El H2O2 puede iniciar la descomposición de O3 por transferencia de electrones [3]. La reacción genera HO• consumiendo H2O2 y O3, ecuación (8), a través de un mecanismo en cadena mostrado en las Ecuaciones (5) y (9) a (15):
|
|
El proceso es caro pero rápido, y puede tratar contaminantes orgánicos presentes en muy bajas concentraciones (ppb), a pH entre 7 y 8; la relación molar óptima O3/H2O2< es ≅ 2:1. El proceso se acelera a pH alcalino, como se deduce de los pre-equilibrios (5) y (9) [8]. El tratamiento ha resultado efectivo para descomponer compuestos organoclorados como tricloroetileno, tetracloroetileno, etc. Por lo tanto, es excelente para el postratamiento de aguas sometidas a tratamientos de desinfección con cloro o dióxido de cloro. Uno de los principales campos de aplicación es la degradación de plaguicidas presentes en aguas [17]. También se ha usado en la decoloración de compuestos de aguas residuales de la industria papelera y otros procesos industriales. Bellamy y colaboradores [18] trataron con esta mezcla aguas subterráneas contaminadas con percloroetileno (PCE), tricloroetileno (TCE), trans-1,2-dicloroetileno (DCE) y tetracloruro de carbono (CTC). La mejor relación molar H2O2/O3 fue de 0,5, y la velocidad de remoción (que respondía a una cinética de 1er. orden) siguió el orden PCE < TCE < DCE. Karimi y otros (1997) [19] lograron reducir niveles iniciales de hasta 447 μg/L de TCE y 163 μg/L de PCE en una planta de tratamiento de agua en Los Ángeles (EEUU), alcanzando niveles inferiores al límite impuesto por la legislación local (5 μg/L). Ormad y otros [20] usaron la mezcla H2O2/O3 para tratar aguas residuales de la producción de los plaguicidas dificol y tetradifon, que contenían además clorobencenos, DDT y otros compuestos organoclorados. La oxidación se realizó usando la relación molar H2O2/O3 0,5, pH 9,4 y hasta 1,5 g de O3/g TOC inicial. Con elevadas dosis de ozono, se logró la remoción de varios compuestos presentes en la muestra original; sin embargo, no pudo eliminarse totalmente la carga orgánica original, y se detectó la formación de numerosos subproductos hidroxilados residuales.
2.3. Reactivo de Fenton
Los conocidos ensayos de Fenton de fines del siglo XIX demostraron que las soluciones de peróxido de hidrógeno y sales ferrosas eran capaces de oxidar los ácidos tartárico y málico, y otros compuestos orgánicos[21]. Más tarde, Haber y Weiss sugirieron que se formaba HO• [3, 22]por la reacción (16). Dichos radicales podían reaccionar luego por dos vías, la oxidación de Fe(II) (una reacción improductiva) y el ataque a la materia orgánica:
|
|
Actualmente se cree que otras especies, de Fe(IV) o Fe(V) (como FeO3+ y complejos de ferrilo), son en realidad los agentes activos del proceso [23-25] y [28-29]. En presencia de exceso de peróxido, la concentración de Fe2+ es pequeña con relación a la de Fe3+, ya que la reacción (20) es más lenta que la (16) [23]. Ambos radicales, el HO• y el HO2 • reaccionan indiscriminadamente con la materia orgánica, pero el segundo es menos reactivo. La constante de velocidad para la reacción de ion ferroso con H2O2 es alta, y el Fe(II) se oxida a Fe(III) en segundos o minutos en exceso de H2O2. Se cree por ello que la destrucción de residuos por el reactivo de Fenton es simplemente un proceso catalizado por Fe(III)–H2O2, y que el reactivo de Fenton con exceso de H2O2. es esencialmente un proceso de Fe3+/H2O2. Por ello, estas reacciones ocurren también con iones metálicos de transición como el Fe(III) o el Cu(II), y se las conoce como reacciones tipo Fenton:
|
|
El grado y la velocidad total de mineralización son independientes, en general, del estado de oxidación inicial del Fe. En cambio, la eficiencia y la velocidad inicial de mineralización son mayores cuando se parte de Fe(II); como contrapartida, las sales de Fe(III) producen una concentración estacionaria de Fe(II). Se debe usar aquí también un pH menor que 2.8.
El proceso Fenton ha resultado efectivo para degradar compuestos alifáticos y aromáticos clorados, PCBs, nitroaromáticos, colorantes azo, clorobenceno, PCP, fenoles, fenoles clorados, octacloro-p-dioxina y formaldehído. Son muy pocos los compuestos que no pueden ser atacados por este reactivo, entre ellos la acetona, el ácido acético, el ácido oxálico, las parafinas y los compuestos organoclorados [30]. Es un buen oxidante de herbicidas y otros contaminantes de suelos tales como hexadecano o Dieldrin. Puede descomponer solventes para limpieza a seco y decolorar aguas residuales con distintos tipos de colorantes y otros residuos industriales, reduciendo su DQO [31]. También se ha aplicado exitosamente el reactivo de Fenton en la reducción de DQO de aguas municipales y subterráneas y en el tratamiento de lixiviados. Es útil como pretratamiento de compuestos no biodegradables [25].
Las ventajas del método son varias: el Fe(II) es abundante y no tóxico, el peróxido de hidrógeno es fácil de manejar y ambientalmente benigno. No se forman compuestos clorados como en otras técnicas oxidantes, y no existen limitaciones de transferencia de masa por tratarse de un sistema homogéneo. El diseño de reactores para la aplicación tecnológica es bastante sencillo [30]. En contraposición, requiere la adición continua y estequiométrica de Fe(II) y H2O2, es decir, necesita una alta concentración de Fe. Sin embargo, debe tenerse en cuenta siempre que un exceso de Fe (II) puede causar condiciones para el atrapamiento de HO•, como se ha mencionado, de acuerdo con las ecuaciones (17), (23) y (24).
A pH > 5 se genera Fe(III) particulado; si bien se generan así barros que obligan a su posterior gestión, es frecuente alcalinizar las aguas al final del proceso con el agregado simultáneo de un floculante para eliminar el hierro remanente.
Teóricamente, la relación estequiométrica molar H2O2/substrato debe oscilar entre 2 y 10 cuando se usa el reactivo para la destrucción de compuestos solubles. Sin embargo, en la práctica esta relación puede ser a veces de hasta 1000, ya que en muestras ambientales el compuesto a destruir siempre viene acompañado de otros que también pueden ser atacados por el HO•. La relación peróxido/Fe/compuesto puede ser mantenida por adición intermitente del oxidante o fijada al inicio de la reacción.
En el laboratorio, el agregado del metal se realiza tradicionalmente en forma de sales ferrosas puras, pero en escalas mayores el uso de éstas se vuelve prohibitivamente caro, y normalmente se usa Fe2(NH4)2SO4, que contiene 20% de hierro activo. Se han usado otros compuestos de hierro, incluyendo sólidos como la goetita, por ejemplo, en la destrucción de tricloroetileno [32]. No se logra en estos casos, por lo general, la mineralización completa; se forman intermediarios resistentes al tratamiento, (ácidos carboxílicos) que reaccionan muy lentamente con el HO•, y predomina la reacción improductiva (17). A veces, como muestra la Figura 2, pueden formarse productos más tóxicos que los iniciales, como quinonas, cuya presencia debe controlarse cuidadosamente.
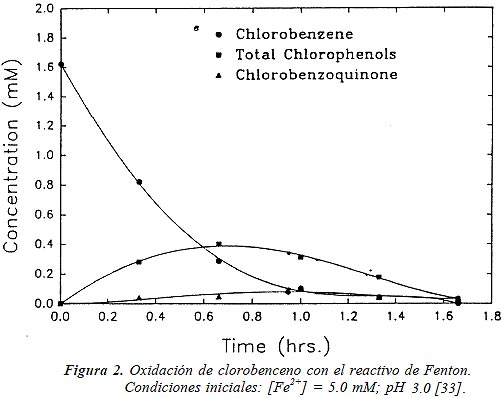 |
Recientemente, Rivas y colaboradores [34] estudiaron la oxidación con el reactivo de Fenton de ácido p-hidroxibenzoico (pHB), un contaminante común en efluentes de la industria de alimentos. Se estableció una relación molar óptima Fe/H2O2/pHB de alrededor de 5 × 10-3/2.65/1 × 10-2. El agregado de alcohol terbutílico, un atrapador de HO•, influye poco en el proceso, lo que sugiere la participación de otros radicales, como se señaló más arriba. La formación de fenol, catecol, hidroquinona y trihidroxibenceno sugieren un mecanismo de degradación vía descarboxilación.
También pueden destruirse con el reactivo de Fenton ácido fórmico, fenol, 2,4- diclorofenol, 4-clorofenol y nitrobenceno [35]. El tratamiento oxidativo hace disminuir apreciablemente la carga orgánica original, aumentando la biodegradabilidad. Usando diferentes relaciones molares H2O2/4-clorofenol y H2O2/Fe2+, se pudo concluir que la primera regula la extensión de la destrucción del compuesto, mientras que la segunda controla la cinética de destrucción.
2.4. Oxidación electroquímica
La aplicación de corriente eléctrica (2-20 A) entre dos electrodos adecuados [36]. en agua produce reacciones químicas primarias, con la generación de HO•, que oxida luego la materia orgánica:
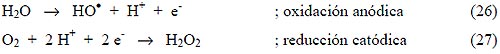 |
La eficiencia del sistema puede mejorarse por agregado de Fe(II), y el proceso se conoce como electro-Fenton. Si se usa un ánodo de sacrificio de Fe, que provee cantidades estequiométricas de Fe para la reacción de Fenton, el proceso se conoce como peroxicoagulación. Por ejemplo, la degradación por oxidación anódica de una solución de anilina mediante una corriente de 20 A conduce a un 18 % de eliminación del carbono orgánico total (COT) al cabo de 6 horas. Si el proceso se lleva a cabo empleando el método electro-Fenton, se consigue un 61% de disminución del COT al cabo de 2 horas, mientras que por peroxicoagulación se elimina un 91 % en sólo 1 hora en iguales condiciones.
2.5. Radiólisis γ y procesos con haces de electrones
Estos procesos se basan en la generación de electrones altamente reactivos, iones radicales y radicales neutros por exposición de las aguas a tratar a haces de partículas másicas u ondas electromagnéticas de alta energía [37]. Se puede usar rayos γ (Gammacell, 60Co) [38], rayos X o aceleradores de haz de electrones como los de tipo Van-de-Graaf o los lineales (LINAC) [39].
Cuando el haz de electrones penetra en el agua, los electrones pierden energía por colisiones no elásticas con las moléculas de H2O, y se generan especies reactivas:
|
|
Las tres primeras especies son los productos primarios de la radiólisis del agua. Los eaq y los H• son reductores fuertes, que atacan a la materia orgánica por mecanismos diferentes: mientras que e–aq produce abstracción de átomos de halógeno (Eo = 2,77 V), H• produce adición o abstracción de hidrógeno. Por su parte, el HO• actúa como oxidante, como en otras TAOs.
El método es ideal para el tratamiento de compuestos orgánicos volátiles (en inglés, VOCs) y semivolátiles (SVOCs) en aguas subterráneas, residuales, potables y lixiviados.
Ataca principalmente a compuestos halogenados como los bifenilos policlorados (en inglés, PCBs), difícilmente oxidables y atacables por HO•[38]. Los compuestos pueden ser mineralizados o bien degradados a productos de menor peso molecular. El método no genera residuos, barros u otros desechos que necesiten tratamiento posterior, ni compuestos tóxicos como las dioxinas. Como contrapartida, si las dosis de radiación son bajas, se pueden formar aldehídos, ácidos orgánicos y SVOCs resistentes. El proceso requiere alto consumo eléctrico, no es efectivo económicamente para concentraciones altas de contaminantes y, por lo tanto, es un método relativamente caro. Se encuentra en etapa de planta piloto pero se prevé una implementación comercial cercana. La combinación con ozono aumenta su eficiencia, debido a la rápida formación de especies reactivas adicionales. En un contexto relacionado, existen algunas plantas de irradiación de barros cloacales con radiación γ (60Co), cuyo objetivo esencial es la desinfección de los mismos para permitir su uso agrícola.
2.6. Plasma no térmico
El plasma es considerado el cuarto estado de la materia que contiene iones y electrones libres (gas eléctrico). El plasma puede generarse, en forma no térmica, por una descarga eléctrica o bombardeo de un gas con un haz de electrones de alta energía; la energía de los electrones en el plasma es de unos 10 eV, lo que equivale a temperaturas elevadas. Estos plasmas son buenas fuentes de especies reactivas altamente reductoras y oxidantes, como O(3P), HO•, N, H, NH, CH, O3, O2(1Δ), los propios electrones de plasma, etc. La presencia de estas especies permite la utilización del método en múltiples aplicaciones: remoción de SOx y NOx de gases de escape, descomposición de hidrocarburos alifáticos y alifáticos halogenados, tratamiento de gases de salida industriales y de incineradores, tratamiento de VOCs en suelos y aguas subterráneas (previa transferencia a la fase vapor por bombeo), tratamiento de sólidos contaminados con VOCs (previa aplicación de calor y fluidización en un gas inerte), etc. [40].
La técnica no genera subproductos tóxicos, como dioxinas o furanos, opera a presiones y temperaturas cercanas a la ambiente, no requiere combustible (minimiza residuos secundarios), y puede eliminar simultáneamente orgánicos peligrosos y emisiones del tipoSOx/NOx, No requiere catalizadores. Existen facilidades a gran escala en Europa que usan generadores de plasma de distintos tipos: de barrera dieléctrica, corona pulsado, de lecho electrificado empaquetado, de haces de electrones, etc. [40].
2.7. Descarga electrohidráulica – Ultrasonido
Esta tecnología usa ultrasonido de alta potencia (de 15 kHz hasta 1 MHz), y se aprovecha la cavitación electrohidráulica, es decir, el crecimiento y colapsado cíclico de burbujas de gas. El gas implota y se alcanzan temperaturas y presiones locales muy altas (4.000-10.000 K y 1.000-10.000 barios en el centro de las burbujas colapsadas) [3]. La degradación de materia orgánica por sonólisis ocurre a través de tres procesos: reacciones de H2O supercrítica (véase 2.8), pirólisis directa, y reacciones con los radicales generados por la reacción térmica (29), o por las reacciones (31)-(33) en presencia de oxígeno. La reacción (30) muestra la formación de peróxido de hidrógeno que, junto con el HO•, es un oxidante útil.
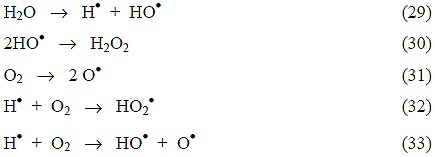 |
La técnica es económicamente competitiva y simple, y la degradación se completa en tiempos breves (minutos a horas) [41]. El método es muy bueno para tratar sustratos volátiles, ya que la combustión se realiza directamente dentro de las burbujas calientes colapsantes. Se aplicó para abstraer el cloro de clorobenceno y m-diclorobenceno, para descomponer hidrocarburos alifáticos y alifáticos clorados (CCl4, CHCl3), para degradar p-nitrofenol, TNT, para descomponer y decolorar colorantes azo, para degradar Tritón X-100 y surfactantes relacionados, para descomponer totalmente H2S, paratión, para degradar éter metilterbutilíco (MTBE), etc. Puede mejorarse por agregado de H2O2, O3 ó Fe(II), y por eliminación de O2 y operación en atmósfera inerte (Ar).
Se ha descrito recientemente la degradación de surfactantes [42], de azobenceno y colorantes relacionados (incluyendo el aumento de eficiencia a través de reacciones de Fenton) [41] y los efectos sinérgicos de la sonólisis combinada con la ozonólisis para la oxidación de azobenceno y naranja de metilo [43]. Este último procedimiento (proceso “sonozono”) aumenta notablemente la velocidad de transformación. El aumento del coeficiente de transferencia de masa del O3 debido a efectos mecánicos (mayor mezclado y ruptura de las burbujas de gas), favorece la disolución del O3 en agua, y la descomposición térmica de ozono en burbujas colapsantes parece ser el principal mecanismo para la destrucción de contaminantes, a través de la generación de HO• [44].
 |