La eliminación de SO2 en gases de combustión
La producción de numerosos bienes de consumo está generando, desde hacia varias décadas, una serie de contaminantes gaseosos que se acumulan en la atmósfera, interaccionando posteriormente con el medio y provocando indeseables alteraciones en el ecosistema. En el caso concreto del azufre, se lanzan aproximadamente 100 millones de toneladas procedentes, casi en su totalidad, de la combustión del carbón. El consumo de carbón para producir energía eléctrica sigue aumentando debido a su disponibilidad, relativa estabilidad en el precio y por la ausencia de problemas relacionados con el almacenamiento del combustible usado, como viene sucediendo en las plantas de energía nuclear.
El azufre contenido en el carbón se encuentra en un 50% como pirita, siendo el resto azufre orgánico y la menor cuantía corresponde a sulfatos. Durante la combustión, prácticamente todo el azufre se oxida a SO2, mientras que sólo un 1-2% se elimina como SO3.
La evolución del SO2 varía dependiendo de las condiciones. En la chimenea, las cenizas básicas adsorben y fijan el SO2 como sulfito o incluso sulfato si en la zona inferior de la chimenea la temperatura es suficientemente elevada. En la atmósfera, cualquiera que sea el proceso químico que tiene lugar en la misma, el SO2 es oxidado a ácido sulfúrico y sulfatos, especialmente sulfato amónico. La extensión de las reacciones depende, entre otros factores, de la temperatura, humedad, intensidad de la luz y como la atmósfera es un sistema dinámico, existen siempre diferentes tipos de reacciones predominantes. Algunas de estas posibles vías de evolución del SO2 hacia sus compuestos oxidados comprenden en primer lugar, reacciones fotoquímicas donde radicales como OH, HO2 y CH3O2 actúan como oxidantes alcanzando velocidades de formación de SO3 de hasta un 4% por hora. En segundo término, reacciones química y fotoquímica de oxidación del SO2 en presencia de óxidos de N2 y/o hidrocarburos (especialmente alquenos). También existen estos procesos químicos en el medio acuoso formado por las gotas de agua, acelerados por la presencia de sales metálicas (Fe y Mn) y amoniaco. Finalmente, el SO2 se oxida en reacciones heterogéneas sobre las partículas sólidas, actuando éstas como núcleos de crecimiento.
El efecto del SO2 sobre el ecosistema abarca problemas en vías respiratorias y gastrointestinales, mutaciones en microorganismos, etc, en el mundo animal, como la necrosis en plantas. El efecto más visible e inmediato se observa sobre áreas urbanas y forestales con niveles de polución altos, como consecuencia de la llamada lluvia ácida, que puede precipitar a grandes distancias del foco fijo de emisión de SO2.
Centrados en la combustión del carbón y debido a la gran atención puesta en el problema de la contaminación por SO2, asegurada por las cada vez mas rígidas enmiendas de diferentes paises sobre la calidad del aire, existen numerosas tecnologías operativas y una creciente inversión en investigación y desarrollo de alternativas más eficientes y rentables.
Las tecnologías se dividen en tres categorías, dependiendo de su localización en el proceso de combustión. La tecnología de precombustión abarca procesos físicos, como el simple lavado que elimina los compuestos más solubles como los sulfatos y los procesos químicos, donde se eliminan principalmente los compuestos orgánicos de azufre. En un proceso convencional se puede llegar a eliminar hasta un 50% del azufre pirítico y un 30% del azufre total.
Las tecnologías de reducción del azufre durante la combustión comprenden fundamentalmente la utilización de un lecho fluidizado donde se queman partículas de carbón en un lecho móvil formado por partículas finas de dolomita o carbonato cálcico y el SO2 es retenido junto con la escoria como sulfato. Desde la década de los ochenta, las unidades comerciales trabajan a alta presión (1200-1500 kPa), obteniendo una mayor eficacia en la combustión y utilizan dolomita en lugar del carbonato cálcico.
Dentro de la tercera categoría, en los llamados procesos de desulfuración en la postcombustión, la mayoría de las tecnologías están basadas en la absorción del SO2 a través de reacciones ácido-base sobre diferentes materiales secos o húmedos. La inyección de dolomita o carbonato cálcico sin humedad da lugar a óxidos, sulfitos y sulfatos que son recolectados en precipitadores electrostáticos o ciclones. La eficacia de estos procesos no supera el 50% en la eliminación de los óxidos de azufre y existe el problema adicional del aumento de cenizas volantes en salida. En los llamados procesos húmedos se emplean hidróxidos, además del carbonato cálcico. Existe un problema importante en todo este tipo de procesos, ya que al oxidarse el sulfito precipitan sulfatos ácidos de difícil eliminación. El uso de hidróxido cálcico aumenta la eficacia del proceso debido a la menor acidez generada en el medio, pero la cantidad de material de desecho es excesiva (por cada tonelada de carbón, son necesarios 200 kg de hidróxido de calcio). Existen otras tecnologías de absorción en medio acuoso que sustituyen el calcio por hidróxido de magnesio, donde el material desechable puede ser regenerado. Pero este proceso es excesivamente costoso debido al elevado aporte de energía necesario, por lo que se ha sustituido por el llamado proceso doble, donde se emplea, además de hidróxido sódico, el de calcio, material más barato que sirve para regenerar el primero a partir del sulfato sódico formado. Los últimos procesos presentan una eficacia del 90% en la eliminación del SO2 y cenizas volantes pero, aparte del inconveniente del escalado y la corrosión, el almacenamiento de los productos de reacción está llegando a ser un problema tan importante como el del SO2, debido a su elevada producción (se estima necesaria una tonelada de carbonato cálcico por cada cinco de carbón). El filtrado por acción del agua que se produce en los depósitos de las sales generadas aumenta la extensión de su acción contaminante.
Dentro de los procesos clasificados en postcombustión, en los últimos años se está implantando el desarrollo de materiales de alta superficie, empleándose como adsorbentes o catalizadores. En el primer caso, la utilización de carbón activado surge como una nueva alternativa frente a la elevada generación de productos sin posibilidad de reutilización (1), y la aplicación de la catálisis presenta la ventaja de la obtención de subproductos que pueden ser empleados como materia prima en otros procesos industriales. En la oxidación del SO2, la obtención de un subproducto con gran salida en el mercado, como el ácido sulfúrico, atrae la atención dentro del campo de la catálisis (2).
Desde el punto de vista práctico, la tecnología de producción de ácido sulfúrico, incluido el estudio de los catalizadores, ha sido ampliamente desarrollada, existiendo abundante información en publicaciones y patentes, aunque siempre para unas concentraciones elevadas de SO2 del 10-15% y concentraciones de O2 características de las diferentes tipos de plantas de fabricación de ácido sulfúrico.
La reacción de oxidación del SO2 en fase gas es exotérmica y su estequiometría viene dada por la siguiente ecuación:
SO2(g) + ½O2(g) ® SO3(g) + 98 kJ/mol (1)
Teóricamente se comprueba que para concentraciones bajas de SO2, del orden de ppm, se alcanzan conversiones superiores al 90% cuando la temperatura es inferior a 500°C, mientras que a temperaturas superiores a 700°C, las conversiones de equilibrio se reducen al 50%. Además, en el equilibrio termodinámico y para una determinada temperatura, la disminución de la presion parcial del SO2 en la alimentación incrementa la conversión del SO2 a SO3. Este comportamiento resulta atractivo a la hora de utilizar un sistema catalítico que opere con concentraciones de SO2 y O2 de chimenea, típicas de una planta térmica de carbón, como 400-1000 ppm de SO2 y 3-5% de O2.
Los dos tipos de catalizador empleados en la industria del ácido sulfúrico son, por orden cronológico, el catalizador de platino soportado y el basado en sales de vanadio y metales alcalinos. El material de platino ha quedado obsoleto debido a su elevado precio, donde se incluye el proceso de recuperación del metal noble, y a la pérdida de actividad catalítica por la fuerte abrasión y deposición de sulfatos sufrida. A partir de la década de los cuarenta se empieza a imponer el uso generalizado del segundo catalizador. Este material está constituido por tierra de diatomeas que actúa como soporte inerte y una fase activa formada por pirosulfatos de vanadio y metales alcalinos como sodio, potasio y cesio. Estos pirosulfatos son activos en la oxidación del SO2 cuando se encuentran en fase líquida. La presencia del metal alcalino, Me, da lugar a la formación de sales eutécticas de V-Me-SOx, cuyos puntos de fusión dependen de los porcentajes de cada componente, y se encuentran en el rango de temperaturas de 300-400°C (3). Cuanto mayor es el peso atómico del metal alcalino, más bajo es el punto de fusión del eutéctico. Aún así, el potasio es el metal empleado debido al elevado coste del cesio. El rango de temperatura donde el catalizador alcanza conversiones superiores al 90% se encuentra entre 430-470°C. El valor exacto de la temperatura efectiva depende de las condiciones de operación, como velocidad espacial, concentración de reactantes, etc.. Con respecto al soporte, la sílice amorfa de la diatomea parece proporcionar las propiedades mecánicas y texturales adecuadas, como resistencia a la abrasión, choque térmico y macroporosidad, en donde el líquido se distribuye homogéneamente. Con respecto a la composición del catalizador, el parámetro más influyente es la relación atómica K/V que se encuentra entre un 3 y 4, siendo el rango de porcentaje de V2O5 más amplio, 6-9%. El catalizador comercial se puede encontrar en forma de pellets, o como cilindros de pocos centímetros de longitud y diámetro (4).
La desactivación de este tipo de catalizadores se debe, principalmente, a la deposición física de cenizas volantes sobre la fase activa. Actúan como agentes adherentes el sulfato de hierro y el ácido sulfúrico. La presencia de arsénico, cloro y flúor también provoca la pérdida de vanadio por la formación de compuestos volátiles, como por ejemplo, el oxicloruro de vanadio, especialmente si el vanadio se encuentra en su forma reducida. La vida media del catalizador en una planta de fabricación de ácido sulfúrico es de 15 años, perdiéndose un 6% de catalizador por año como resultado de la limpieza realizada para eliminar los sólidos adheridos. La forma física de los catalizadores es un factor importante en la desactivación por deposición de cenizas y su escalado a una central térmica no resultaría ventajoso por la gran pérdida de carga que, además, se produciría. Por tanto, el diseño de una nueva estructura de canales paralelos resolvería las dificultades reales de operación anteriormente señaladas. Este arquetipo podría corresponder a una estructura monolítica con una apertura de celda determinada y dependiente de la concentración de cenizas transportadas por la corriente de salida (en el caso de centrales térmicas el valor medio es de 20 g/Nm3 y el diseño del monolito correspondería a un modelo «high dust»).
Una de las aplicaciones industriales en centrales térmicas en donde utilizan monolitos ha tenido como objetivo la mejora de la eficacia en la eliminación de cenizas volantes por los precipitadores electrostáticos. Una fracción del SO2 es convertido en SO3, que se adsorbe sobre las cenizas aumentando su constante dieléctrica y la eficacia de su captura en los precipitadores electrostáticos. Para ello, se emplean soportes monolíticos de sílice impregnados con las correspondientes sales de vanadio y metal alcalino (5).
Otra aplicación importante ha sido desarrollada en sistemas de depuración simultánea de NOx y SO2 en centrales térmicas. El llamado proceso SNOxtm, donde interviene entre otros, Haldor Topsoe A/S y explotado bajo licencia de la empresa ABB Environmental Systems (6), emplea el catalizador másico VK38 (Haldor Topsoe) en forma anular. La eliminación de las cenizas de los gases efluentes es una etapa incorporada previamente a la oxidación del SO2. Aún así, la limpieza del catalizador tiene que llevarse periodicamente, incrementando el coste global del proceso (se ha estimado en $550,000 por año el coste del «screening» para una planta de 510 MW). El desarrollo de un catalizador monolítico másico, por tanto, supondría un avance en la descontaminación de gases desde el punto de vista técnico y económico.
En el presente resumen, presentamos un catalizador de estas características basado en tierra de diatomeas, fabricado y ensayado a escala de laboratorio (7). El escalado a tamaño industrial de dimensiones 10x10x50 cm ha sido llevado a cabo con éxito. Las características de la estructura monolítica de celdas cuadradas se resumen en la tabla 1 y la composición de la fase activa en la tabla 2.
Tabla 1 Tabla 2Densidad, g/cm3 0.7
Número de celdas/cm2 4.5
Apertura nominal de celda, cm 0.4 Porcentaje en peso de V2O5 6-8
Espesor nominal de pared, cm 0.1 Relación atómica K/V 3-4
Area geométrica, cm2/cm3 7.0
Resistencia mecánica, kg/cm2 450
Con respecto al soporte, la diatomea es el componente mayoritario, junto con cierto tipo de aglomerantes permanentes con objeto de conseguir las propiedades plásticas necesarias para la extrusión de la pasta húmeda a escala industrial. Las sales de vanadio y potasio están incorporadas al soporte
Las condiciones de operación de los ensayos de actividad catalítica realizados con el material extruido 10×10 se muestran en la tabla 3.
Tabla 3Concentración de SO2, ppmv 200-1000 GHSV (en C.N.), h-1 3500-6000
Concentración de O2, ppmv 3-5 vL (en C.N.), m/s 0.4-0.9
Temperatura, °C 450-480 AV (en C.N.), m/h 7-11
GHSV, velocidad espacial; vL: velocidad lineal y AV: velocidad del gas con respecto al área de contacto.
A partir de los resultados experimentales del catalizador 10×10 realizados en laboratorio, se ha obtenido una ecuación que permite predecir el comportamiento del sistema. Estos datos se ajustan a una ecuación de velocidad de primer orden, de forma que para diferente velocidad espacial y relación de entrada de reactantes SO2/O2, se obtiene una constante global de velocidad de la reacción de oxidación del SO2 a SO3:
ln (1-xSO2) = -kt (2)
donde xSO2 es la conversión de SO2 (vol.), k la constante de velocidad (h-1) y t el tiempo de residencia (h).
La relación de entrada de reactantes SO2/O2 condiciona la composición final de la fase activa V2O5-K2O-SOx existiendo, en las condiciones de operación seleccionadas, una linealidad entre la constante k y la relación de entrada de los reactantes SO2/O2. A partir de esta relación lineal y teniendo en cuenta la ecuación 2, se calculan las curvas teóricas de actividad catalítica, representadas como 1/GHSV frente a conversión de SO2. En la figura 1 se muestran estas curvas teóricas junto a los datos experimentales para una temperatura de reacción de 450°C. Se observa la buena correlación existente entre los valores empíricos y los calculados.
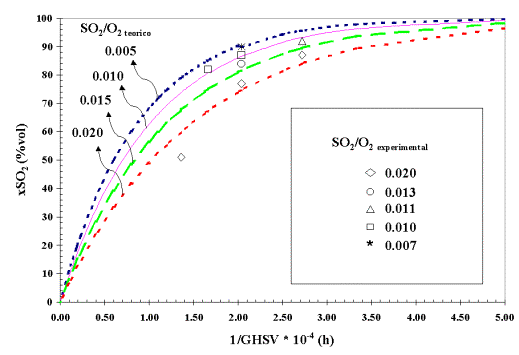
Figura 1. Ajuste de los datos experimentales a la ecuación cinética para diferente relación de entrada SO2/O2 (% vol.).
La desactivación catalítica debido a la estabilización y precipitación de sales de V4+ por efecto de la temperatura, es un factor que se suma al estudio del comportamiento del material extruido. Con objeto de conocer el efecto de la reducción de la sal de vanadio, se han realizado pruebas enfriando y restaurando las condiciones de operación en etapas sucesivas. Se comprueba que después de un cierto tiempo, la actividad catalítica recupera sus valores iniciales. Experimentos en presencia de cenizas y vapor de agua han sido asimismo ensayados, obteniendo los mismos resultados de estabilidad en la actividad del material.
El coste de este catalizador monolítico está estimado en $25/litro. Para reducir la concentración de SO2 hasta niveles legalmente aceptables en una central térmica de 250 MW, tratando todo el efluente y operando a GHSV de 5000 h-1, el coste total de catalizador se calcula en $14.4 106. En el caso concreto de la tecnología SNOxtm en la central térmica de Ohio Edison Niles, el coste total estimado de la planta de demostración fue de $31.4 106. Teniendo en cuenta el volumen de gas tratado, el precio del catalizador monolítico necesario, trabajando a una GHSV de 5000 h-1, correspondería a un 2.7% del coste global de proyecto.
BIBLIOGRAFIA:
(1) Chiyoda Chem. Eng. Const. Co. JP 07241441, 1995.
(2) S.G. Masters, J. of Catal. 166, 16-24, 1997.
(3) S. Hähle, A. Meisel, Kinetics and Catalysis, vol. 12, p. 1276, 1971.
(4) Haldor Topsoe A/S, US 4781902, 1988; BASF AG, DE 4000609, 1991.
(5) M.L. Mark, A. Vavere, R.A. Wright, Proc. of the Amer. Power Conf., vol. 58(1), p.326, 1996; EPRI, US 5011516, 1991.
(6) D.C. Bocio, W.H. Kingston, Proceedings & Utilization of High-Sulfur Coals V, ed. B.K. Parekh & J.G. Groppo, 1993. Elsevier Science Publishers
(7) CSIC, ES 9601955, 1996.