La electrocoagulación: una alternativa para el tratamiento de aguas residuales
Resumen
Uno de los desafíos mayores que enfrenta hoy la humanidad es proporcionar agua limpia a una inmensa mayoría de la población mundial. Por ello, hay una necesidad urgente de desarrollar técnicas innovadoras, más eficaces y económicas para el tratamiento de aguas residuales. La electrocoagulación, una tecnología conocida desde principios del siglo XX, ha evolucionado, siendo eficazmente aplicada en la actualidad para el tratamiento de las aguas residuales de la industria del papel, la minería y la industria de metales pesados. Además, la electrocoagulación se ha aplicado para tratar agua que contiene la pérdida de alimentos, grasas, tintes, partículas suspendidas, entre otros. Desde esta perspectiva, la electrocoagulación se convierte en un proceso electroquímico que puede tener resultados exitosos en su aplicación, optimizando los factores que lo conforman, alcanzando el reto de proteger, conservar y recuperar el recurso hídrico.
Palabras clave: Tratamiento de aguas residuales. Electrocoagulación. Electrólisis. Electrodos. Coagulación, Electroflotación.
Introducción
La necesidad actual de proveer agua para una creciente población mundial, que satisfaga las demandas de agua potable, de aguas de riego y agua para la industria crea el reto de investigar y adaptar tecnologías que permitan la protección, conservación y recuperación del recurso hídrico.
Una de las grandes problemáticas -que al mismo tiempo se convierte en una preocupación de la industria- es la eficiencia en el uso del agua, situación esta que ha llevado a la industria a implementar programas de uso eficiente del agua, los cuales plantean estrategias para un manejo sostenible del preciado líquido.
El reuso y recirculación son operaciones que hacen parte de las estrategias de manejo del agua. Sin embargo, es indispensable realizar tratamientos a las aguas residuales. Éstos deben satisfacer aspectos tales como ser adecuados para el propó- sito, tener una alta efectividad y unos bajos costos, y adicionalmente traer ventajas ambientales.
En este artículo se plantea la electrocoagulación como una alternativa tecnológica para el tratamiento de aguas residuales, haciendo énfasis en su aplicación para la remoción de grasas y aceites que se encuentran formando una emulsión con el agua.
Electrocoagulación
La electrocoagulación es un proceso que utiliza la electricidad para eliminar contaminantes en el agua que se encuentran suspendidos, disueltos o emulsificados. La técnica consiste en inducir corriente eléctrica en el agua residual a través de placas metálicas paralelas de diversos materiales, dentro de los más comúnmente utilizados están el hierro y el aluminio. La corriente eléctrica proporciona la fuerza electromotriz que provoca las reacciones químicas que desestabilizan las formas en las que los contaminantes se encuentran presentes, bien sea suspendidas o emulsificadas. Es así que los contaminantes presentes en el medio acuoso forman agregados, produciendo partículas sólidas que son menos coloidales y menos emulsificadas (o solubles) que en estado de equilibrio. Cuando esto ocurre, los contaminantes forman componentes hidrofóbicos que se precipitan y/o flotan y se pueden remover fácilmente por algún método de separación de tipo secundario.1-3
En el proceso de electrocoagulación hay generación de coagulantes in situ por la disolución de iones de aluminio o de hierro de los electrodos de aluminio o hierro respectivamente. La generación de iones metálicos tienen lugar en el ánodo y en el cátodo hay liberación de burbujas de hidrógeno gaseoso las cuales ayudan a la flotación de las partículas floculadas, las mismas que serán retiradas posteriormente4
La electrocoagulación es utilizada en la remoción de contaminantes de muy diversas aguas residuales, tales como las de la industria de galvanoplastia, electro-plateado metálico, fábricas de envasados, industria del papel (desperdicios de molinos de papel), peleterías, molinos de acero, efluentes con contenido de cromo, plomo o mercurio y efluentes con contenido de aceites como los generados por talleres de maquinaria, refinerías, talleres de reparación de autos, transporte, almacenamiento y distribución de aceites, efluentes de la industria alimentaria, lavanderías e industria textil, y finalmente ha sido utilizada en la remoción de los contaminantes de las aguas para consumo humano y residuales domésticas 3-12
Evolución de la electrocoagulación
La electrocoagulación ha sido una tecnología emergente desde 1906 con la primera patente concedida en Estados Unidos. 13 Con el tiempo se presentaron problemas de tipo financiero o de regulación de incentivos para que la industria adoptara esta técnica2 , pero son conocidos desarrollos anteriores. Desde el siglo XIX, en 1888, se efectúo el primer ensayo reportado en Londres por Webster, este proceso utilizaba ánodos de hierro soluble, proceso que fue investigado luego en otras localidades de Inglaterra. La caída de potencial entre los electrodos distantes una pulgada entre sí fue de 1.8 vatios y la corriente anódica de 0.6 Amp/pie2. Cinco años más tarde, Wolff electrolizó una solución concentrada de sal para producir cloro y soda cáustica que utilizaba para esterilizar aguas negras en Brewster, NY.
En 1896 se usó en Lousville, Kentucky, una modificación del proceso de Webster para coagular agua cenagosa del río Ohio, proceso en el que se utilizó ánodos de hierro y aluminio, los cuales fueron efectivos en coagular el agua, pero sin una reducción importante en el oxígeno consumido.
Webster en 1908 el proceso se utilizó en Santa Mónica con reducciones de 40% de materia orgánica. Bull en 1911 electrolizó una salmuera con ánodo de grafito interponiendo una membrana de asbesto entre los electrodos. Una modificación del proceso Webster -llamado Landreth- se utilizó en 1914 en Nueva York, en éste se añade cal para mejorar la conductividad del electrolito.
En 1930 este proceso dejó de tener interés para la industria aunque como hecho aislado fue utilizado en 1932, en Alemania, con eficiencia del 50% en reducción de la DBO de aguas residuales. La falla de estos procesos se debió al alto costo de energía y a la necesidad de recambiar los electrodos. En 1947, en URSS, se utilizó el proceso con electrodos de hierro, obteniendo remociones de 70-80% de DBO.
Unos años más tarde, en 1958, el profesor Mendía de la Universidad de Nápoles utilizó esta técnica para desinfectar las aguas negras de ciudades costeras. En este proceso se mezcló 25-30% en volumen de agua de mar antes de la electrólisis.
En Noruega se combinaba 20% de agua de mar con las aguas residuales en la electrólisis para la remoción de fosfato utilizando electrodos de carbón.
Aunque la eficiencia del proceso fue buena hubo problemas de corrosión.
Se han reportado trabajos en URSS en donde se utilizó el proceso para remover partículas dispersas de aceite, grasa y petróleo5 .
En 1971, en Vancouver del Norte, se utilizaron ánodos de aluminio para disolverlos y coagular aguas negras.
Este proceso operó a un costo ligeramente inferior al requerido con alumbre.
Aspectos técnicos
El reactor para la electrocoagulación
El reactor utilizado para realizar la electrocoagulación en una operación por batch, en su forma más simple, está formado por una celda electroquímica con un ánodo y un cátodo dispuestos en forma vertical2 y conectados a una fuente de energía externa.
El material anódico se corroe eléctricamente debido a la oxidación, mientras que el cátodo permanece pasivo3
.
El diseño formado por un par de electrodos no es el más adecuado a la hora del proceso ya que para obtener una rata adecuada de disolución del metal se requiere de electrodos de gran área superficial, es por esta razón que se utilizan celdas con electrodos monopolares en paralelo o conectados en serie3
.
El sistema para la electrocoagulación requiere de una fuente de corriente directa, un regulador de densidad de corriente y de un multímetro para leer los valores de corriente3
En la Figura 1 se muestran dos reactores para electrocoagulación con electrodos en paralelo3
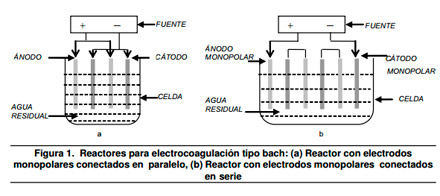 |
Existen otros tipos de reactores para la electrocoagulación, uno de los más populares es el tipo filtro prensa, está formado por una unidad de cobertura en forma de caja con un ánodo, un cátodo y una membrana como se muestra en la Figura 2. Este sistema hace que su operación y mantenimiento sea relativamente simple4
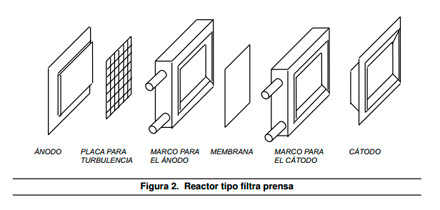 |
Para la remoción de metales se usa el reactor de electrodo cilíndrico rotativo en el cual el cátodo gira en el centro de la celda y el ánodo se encuentra fijo como se muestra en la Figura 4. Esta disposición permite aumentar la transferencia de masa en los electrodos y remover partículas de metal del cátodo. Finalmente, también es usado para la remoción de metales, un reactor de lech fluidizado mostrado en la Figura 5. Este permite aumentar el área específica superficial mejorando la eficiencia del proceso4
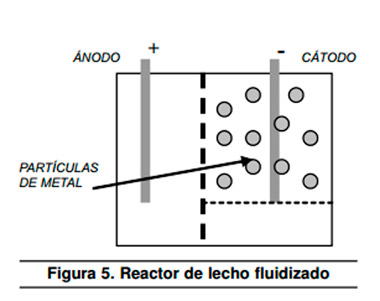 |
Los materiales usados en el ánodo deben ser dimensionalmente estables, tales como el acero que se utiliza en los reactores para la recuperación de metales, los electrodos más modernos son fabricados de titanio con una pequeña capa de óxidos de metales nobles. Sin embargo, el material más comúnmente utilizado es el aluminio.
El cátodo puede ser de metal, grafito, fibras de carbón, acero o titanio.
Proceso de electrocoagulación
Durante la electrólisis ocurren una serie de procesos físicos y químicos que se pueden describir de la siguiente manera:
El lado positivo sufre reacciones anódicas, mientrasque el negativo sufre reacciones catódicas.
Las placas de metal, tales como hierro o aluminio son utilizadas como electrodo de sacrificio o placa consumible que aporta iones al sistema. Estos iones liberados neutralizan las cargas de las partículas desestabilizando los sistemas de suspensión de los contaminantes dando inicio a la coagulación.
Los iones liberados remueven cualquier contaminante, bien sea por reacción química y precipitación o agregando materiales coloidales que bien pueden flotar o precipitarse. Además, como el agua contiene partículas coloidales, aceites u otros contaminantes, éstos se mueven a través del campo eléctrico aplicado y pueden ionizarse, sufrir reacciones de electrólisis o de hidrólisis o formar radicales libres que alteran las propiedades físicas y químicas del agua y de los contaminantes, resultando en un estado reactivo y excitado lo cual es causa de la liberación, destrucción o insolubilidad de los contaminantes3
.
Para aumentar la eficiencia de remoción de los iones indeseables, se puede hacer pasar el agua residual a través de una serie de celdas que tienen electrodos compuestos de varios metales. Los parámetros como pH, conductividad y potencial de óxido-reducción deben ser ajustados de acuerdo con el tipo de contaminante3,13
Factores que afectan la electrocoagulación4
Densidad de corriente: El suministro de corriente al sistema de electrocoagulación determina la cantidad de iones de aluminio Al +3 o hierro Fe +2 liberados por los respectivos electrodos.Cuando se usa una corriente demasiado grande, hay una transformación de energía eléctrica en energía calórica que calienta el agua. Una densidad de corriente demasiado grande produciría una disminución significativa en la eficacia. La selección de la densidad de corriente podría realizarse teniendo en cuenta otros parámetros de operación como pH y temperatura.
Presencia de NaCl: La sal aumenta la conductividad del agua residual. Se ha encontrado que los iones de cloruro pueden reducir los efectos adversos de iones como HCO3-y SO4= pues la presencia de iones carbonatos o sulfatos pueden conducir a la precipitación de Ca+2 y Mg+2 produciendo una capa insoluble depositada sobre los electrodos, que aumentaría el potencial entre los electrodos decreciendo así la eficiencia de la corriente. Se recomienda, sin embargo, que para un proceso de electrocoagulación normal se mantengan cantidades de Cl- del 20%4 .
pH: El efecto del pH en la electrocoagulación se refleja en la eficiencia de la corriente y se relaciona con la disolución del hidróxido del metal, se ha encontrado que el rendimiento del proceso depende de la naturaleza del contaminante y la mejor remoción se ha observado para valores de pH cercanos a 7. No obstante a pH neutral el consumo de energía es alto, debido a que hay variación de la conductividad. Cuando la conductividad es alta, el efecto del pH no es significativo. El pH después de la electrocoagulación podría incrementarse para aguas residuales ácidas pero decrecer para aguas alcalinas. El incremento de pH a condiciones ácidas ha sido atribuido a la reacción del hidrógeno en el cátodo dada por H2O +2e ?H2 + 2OH-4.
Temperatura: Los efectos de la temperatura sobre la electrocoagulación no han sido muy investigados, pero se ha encontrado que la eficiencia en la corriente incrementa inicialmente hasta llegar a 60º C punto donde se hace máxima, para luego decrecer. El incremento de la eficiencia con la temperatura es atribuida al incremento en la actividad de destrucción de la película de óxido de aluminio de la superficie del electrodo.
Aplicación de la electrólisis a una emulsión aceite-agua
Emulsión aceite-agua 5
Una emulsión es una dispersión en la cual el aceite constituye la fase dispersa y el agua forma la fase continua.
Un ejemplo es la leche que constituye una emulsión que está formada por grasa dispersa en una fase acuosa. Esta emulsión es estabilizada por la presencia de agentes emulsificantes tales como surfactantes. Para la leche el emulsificante natural es la caseína, esta es una proteína que contiene grupos fosfatos. Los grupos aniónicos en la molécula de surfactante previene la agregación y coagulación de las gotas de aceite vía repulsión electrostática14, como se esquematiza en la Figura 6.
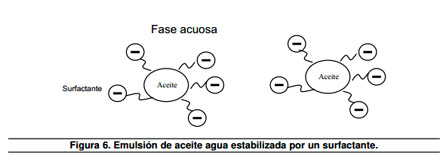 |
Durante la electrólisis y en el caso de utilizar un ánodo de sacrificio de hierro (Fe) éste es oxidado a Fe+2 el cual es nuevamente oxidado a iones Fe+3
.
La reacción es:
Con la electrólisis la fuerza iónica del medio incrementa y la electrogeneración de cationes con su alta carga de+3 neutraliza eficientemente la superficie cargada de las moléculas de surfactante.
Simultáneamente, el hidrógeno es liberado en el cátodo, según la reacción:
El pH 3 del medio aumenta como consecuencia de la electrólisis. El resultado de la reacción, ecuaciones 1 y 2, es que la emulsión es desestabilizada y las partículas de aceite coloidal comienzan a agregarse, como es esquematizado en la Figura 7.
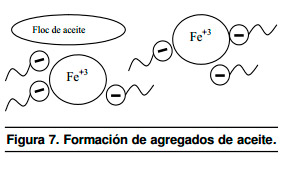 |
Formación de un lodo rico en aceite
La reacción entre el Fe+3 formado electroquímicamente y los OH – formados en el cátodo produce hidróxido férrico5, según la reacción:
Las gotas de aceite desestabilizadas flotan en el hidróxido férrico formado, llegando a la superficie donde es removido con facilidad por una operación de desnatado.
Un sistema patentado para la electrocoagulación que utiliza un electrodo de hierro como electrodo de sacrificio opera a 20 voltios con un rango de corriente de 15 – 35 amperios. El agua residual requiere suficiente conductividad para la operación de la celda y para prevenir neutralidad del material del electrodo14
Electroflotación 14,15
La electroflotación es un proceso que utiliza aire para inducir la formación de pequeñas burbujas mediante la electrólisis del agua generando hidró- geno y oxígeno gaseosos. Este proceso puede ser alternado con la electrocoagulación para la remoción efectiva de las partículas floculadas.
En trabajos realizados, combinando estos procesos, se ha logrado una reducción de 14 mg/l de un agua residual con un contenido inicial de aceite de 280 mg/l.
Ventajas y desventajas de la electrocoagulación 1, 5,
Ventajas:
• Los costos de operación son menores que los de procesos convencionales usando polímeros.
• Requiere de equipos simples y fáciles de operar, con la suficiente libertad operacional para manejar los problemas encontrados en su funcionamiento.
• Puede generar aguas potables, incoloras e inodoras.
• Elimina requerimientos de almacenamiento y uso de productos químicos.
• Genera lodos más compactos y en menor cantidad, que involucra menor problemática de disposición de estos lodos.
• Los flóculos formados por la electrocoagulación son similares a los producidos químicamente, pero más grandes, contienen menos agua ligada, son antiácidos y más estables y pueden ser separados rápidamente por filtración.
• Ausencia de magnesio en los lodos por la no utilización de éste en el proceso.
• Alta efectividad en la remoción de un amplio rango de contaminantes.
• Purifica el agua y permite su reciclaje.
• Reduce la contaminación en los cuerpos de agua.
• Produce efluentes con menor cantidad de SDT comparado con los tratamientos químicos, si esta agua se reusa, los bajos niveles de SDT contribuye a bajos costos de tratamiento de aguas.
• Remueve las partículas coloidales más peque- ñas, ya que el campo eléctrico aplicado las pone en movimiento más rápidamente facilitando la coagulación.
• Las burbujas de gas producidas, pueden llevar el contaminante a la superficie de la solución, donde puede concentrarse fácilmente, ser recuperado y removido.
Desventajas:
• Reposición de los electrodos de sacrificio.
• Los lodos contienen altas concentraciones de hierro y aluminio, dependiendo del material del electrodo utilizado.
• No es efectivo en la remoción de DBO soluble, proveniente de solventes y anticongelantes.
• El uso de electricidad puede ser costoso en muchos lugares.
• Una película de óxido impermeable puede formarse en el cátodo que lleva a la pérdida de eficiencia del proceso.
Referencias
1. ECKENFELDER, W.W. and CECIL, L. K. Application of New Concepts of PhysicalChemical Wastewater Treatment .Vanderbilt University; Nashville, TN.: Pergamon Press, Inc.
2. HOLT, Peter K., BARTON, Geoffrey W., and MITCHELL, Cynthia A. The future for electrocoagulation as a localised water treatment technology. Chemosphere 59 (2005) 355–367 [on line]. Recibido el 20 de abril de 2004, aceptado el 19 de octubre de 2004. Disponible en: www.elsevier.com/locate/ chemosphere
3. MOLLAH, M. Yousuf A., SCHENNACH, Robert, PARGA, Jose R., and COCKE, David L. Electrocoagulation (EC) — science and applications. Journal of Hazardous Materials B84 (2001) 29–41[on line]. Recibido el 23 de julio de 2000; aceptado el 23 de diciembre de 2000. Disponible en www.elsevier.nl/locate/ jhazmat
4. GUOHUA, Chen. Electrochemical technologies in wastewater treatment. Separation and Purification Technology 38 (2004) 11–41[on line]. Recibido el 19 de septiembre de2003; aceptado el 13 de octubre de 2003. Disponible en: www.elsevier.com/locate/seppur
5. IBANEZ, JORGE G., TAKLMOTO MARTHA M. and VASQUEZ, RUBEN C. Laboratory Experiments on electrochemical remediation of the environment: electrocoagulation of Oily Wastewater. En: Journal of chemical education. Vol 72, No. 11. Noviembre 1975, 1050-1052p.
6. GUOHUA, Chen, XUEMING, Chen, and POLOCK, Yue. Electrocoagulation and electroflotation of restaurant wastewater. En: Journal of environmental engineering. Septiembre de 2000, 858-863p.
7. JIANTUAN, Ge, JIUHUI, Qu, PENGJU, Lei and HUIJUAN, Liu. New bipolar electrocoagulation–electroflotation process for the treatment of laundry wastewater. Separation and Purification Technology 36 (2004) 33–39 [on line]. Recibido el 11 de enero de 2003; aceptado el 22 de abril de 2003. Disponible en www.elsevier.com/ locate/seppur
8. TAK-HYUN, Kim, CHULHWAN PARK, JINWON, Leec, EUNG-BAI, Shin, and SANGYONG, Kim. Pilot scale treatment of textile wastewater by combined process (fluidized biofilm process–chemical coagulation–electrochemical oxidation). Water Research 36 (2002) 3979–3988 [on line]. Recibido el 6 de agosto de 2001; aceptado el 27 de febrero de 2002. Disponible en: www.elsevier.com/locate/watres
9. RATNA, Kumar, SANJEEV, Chaudhari , KARTIC C., Khilar , and S.P., Mahajan. Removal of arsenic from water by electrocoagulation. Chemosphere 55 (2004) 1245–1252 [on line]. Recibido el 18 de febrero de 2003; aceptado el 31 de diciembre de 2003. Disponible en: www.elsevier.com/locate/ chemosphere
10.PING, Gao, XUEMING, Chen, FENG, Shen, and GUOHUA, Chen. Removal of chromium(VI) from wastewater by combined electrocoagulation–electroflotation without a filter. Separation and Purification Technology xxx (2004) xxx–
xxx [on line]. Recibido el 8 de marzo de 2004; aceptado el 13 de octubre de 2004. Disponible en: www.elsevier.com/locate/seppur
11.KOPARAL, A. Savas, OGUTVEREN, Ulker Bakir. Removal of nitrate from water by electroreduction and electrocoagulation. Journal of Hazardous Materials B89 (2002) 83–94 [on line]. Recibido el 22 de mayo de 2001; aceptado el 11 de julio de 2001Disponible en www.elsevier.nl/locate/jhazmat
12.KOBYA, Mehmet , TANER CAN, Orhan and BAYRAMOGLU, Mahmut . Treatment of textile
wastewaters by electrocoagulation using iron and aluminum electrodes. Journal of Hazardous Materials B100 (2003) 163–17894 [on line]. Recibido el 26 de noviembre de 2002; aceptado el 12 de marzo de 2003. Disponible en: www.elsevier.nl/locate/jhazmat
13.OROZCO JULIO, ALVARO. La densidad de carga del electrólito como parámetro de control del proceso de electrocoagulación. En. Revista Ainsa. Vol.5 Nº 2 (1985): p.3-30.
14.PETTERSON. JAMES W. Industrial Wastemater Treatment Technology. Butterworth Publishers, Stoneham, Ma Second edition. 1985, p 273-302
15.JIA-QIAN, Jiang, GRAHAM, Nigel, ANDREA, Cecile, KELSALLC, Andrea, KELSALLC, Geoff H. and BRANDON, Nigel. Laboratory study of electro-coagulation–flotation for water treatment. Water Research 36 (2002) 4064– 4078 [on line]. Recibido el 5 de diciembre de 2000; aceptado el 11 de marzo de 2002. Disponible en www.elsevier.com/locate/watres.
Por: Álvaro Arango Ruiz
Fuente: www.redalyc.org
VER ARCHIVO DE ARTÍCULO