Intoxicación por plaguicidas. Parte II
INSECTICIDAS ORGANOFOSFORADOS
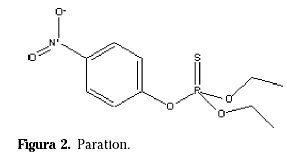
Los insecticidas organofosforados (O-P) son muy tóxicos y liposolubles y su fórmula general deriva del ácido fosfórico, como se aprecia en la estructura química del paratión (Fig. 2). Pertenecen a diferentes familias: fosfatos, fosfonatos, fosforoamidotioatos, fosforodiamidatos, varias de ellas azufradas 7 . Desde 1942 se han sintetizado más de 50.000 productos de este tipo.
Se emplean como insecticidas, acaricidas, nematicidas y fungicidas. Algunos actúan como insecticidas de contacto y otros como insecticidas sistémicos.
Los compuestos fosforados orgánicos que contienen nitrógeno cuaternario (fosforilcolina) son, no sólo potentes inhibidores de la colinesterasa, sino directamente colinérgicos.
Algunos de ellos (soman, sarin, tabun) han sido utilizados como gases de guerra y se denominan gases nerviosos por ser ésta la diana fundamental de su acción 16,17 .
Se estima que el 40% de las cosechas son tratadas con este tipo de insecticida.
También han sido utilizados como antiparasitarios sistémicos y dérmicos y en medicina humana en el tratamiento del glaucoma y la miastenia gravis.
Su liposolubilidad y elevada tensión de vapor a temperaturas ordinarias permiten su penetración rápida por todas las vías: digestiva, cutánea y respiratoria 18 .
La absorción a través de la piel es lenta, pero se facilita por su persistencia a ese nivel, existencia de lesiones dérmicas y temperaturas cálidas.
Se distribuyen preferentemente a los tejidos ricos en lípidos, pero no se acumulan en la grasas de organismo debido a la eficacia de los procesos de biotransformación.
La facilidad para atravesar la barrera hematoencefálica y la capacidad de inhibición de la actividad colinesterasa es muy variable de unos compuestos a otros, por lo que varía su toxicidad.
Los compuestos fosforados orgánicos son ésteres que se transforman a través de las esterasas orgánicas A y B. Las esterasas de tipo A dan lugar por hidrólisis a productos tóxicamente inactivos y excretables. Las B-esterasas, entre las que se cuentan las colinesterasas, reaccionan con los compuestos organofosforados fosforilándose y quedando inhibidas. De este hecho se derivan la mayor parte de sus efectos tóxicos. Éstos se ven aumentados o reducidos en función de las vías metabólicas iniciales: el malatión es relativamente poco tóxico para los mamíferos, cuyo hígado posee una esterasa que lo detoxifica rápidamente; el paratión, por el contrario, cambia su S por un O transformándose en paraoxón, unas 10 veces más tóxico, reacción que tiene lugar con especial intensidad en la pared intestinal. El paraoxón es substrato de O-deetilación catalizada por el sistema mono-oxigenasa microsomial con producción de etanol, acetaldehído o acetato según diversas especies animales. En el hombre el paraoxón se metaboliza a paranitrofenol hidrosoluble que se excreta por orina.
En comparación con los compuestos O-C estas vías metabólicas son rápidas y la prolongación relativa de la excreción se debe a la acumulación provisional y liberación progresiva a partir de las grasas.
La eliminación se efectúa sobre todo por vía renal. La presencia de paranitrofenol y otros metabolitos en la orina ha sido considerada como un buen índice de la gravedad de la intoxicación.
Su mecanismo tóxico más importante es la inhibición de la acetilcolinesterasa que da lugar a acumulación de acetilcolina en los tejidos 19,20 .
La acetilcolina es el mediador químico responsable de la transmisión fisiológica del impulso nervioso de:
a. Las neuronas pre-ganglionares a las post-ganglionares en los sistemas parasimpáticos y simpáticos.
b. Las fibras post-ganglionares parasimpáticas a los órganos efectores y de las fibras post-ganglionares simpáticas a las glándulas sudoríparas.
c. Los nervios motores al músculo esquelético.
d. Algunas terminaciones nerviosas en el SNC.
Liberada en las terminaciones de las fibras colinérgicas en respuesta a la conducción de un potencial de acción contacta con los receptores colinérgicos en la superficie de la célula diana materializando la transmisión del impulso. Existen dos tipos de receptores para este neurotransmisor: el receptor muscarínico, de tipo receptor vinculado a proteínas G, y el receptor nicotínico que contiene un canal de Na.
Inmediatamente, tras ser liberada del receptor, es hidrolizada por la colinesterasa lo que produce la brevedad y unidad de cada impulso propagado.
Los O-P reaccionan con la zona esterásica de la colinesterasa formando una unión estable que, si no se rompe mediante el tratamiento, envejece y se hace irreversible, quedando la enzima inhabilitada para su función normal 20 .
La acetilcolina se acumula entonces en la hendidura sináptica. Una pequeña acumulación da lugar a gran estimulación, mientras que un exceso superior tiene el efecto contrario, lo que es especialmente patente a nivel del músculo esquelético y queda reflejado en la secuencia clínica.
Los O-P fosforilan otras enzimas: fosfatasa ácida, aliesterasas, lipasas, tripsina, quemotripsina, succinooxidasa, oxidasa-ácido ascórbico, deshidrogenasas, enzimas sulfidrilo…
Esto se produce a una velocidad más lenta y sin aparentes consecuencias clínicas.
Algunos de ellos presentan una neurotoxicidad tardía producida a través de la inhibición de la actividad de una proteína de la célula nerviosa a la que se ha dado el nombre de esterasa neurotóxica o esterasa diana de neurotoxicidad (NET) 21 . Los O-P neurotóxicos son aquellos que provocan una inhibición de la actividad esterásica de esta proteína superior al 80%. La NET presenta una amplia distribución en el organismo encontrándose en cerebro, médula, sistema nervioso periférico, corazón, bazo y linfocitos. La medida de su actividad linfocitaria se ha propuesto como test de neurotoxicidad en el hombre expuesto 22 .
Se ha demostrado que los O-P neurotóxicos ejercen una inhibición del transporte axonal rápido de las proteínas que se ha sugerido podría deberse a una perturbación del funcionamiento de los microtúbulos.
La neurotoxicidad se plasma en una polineuropatía muy estudiada en los pollos 23 . Entre los O-P que han producido este tipo de neurotoxicidad humana están el merfox , triclorfón y mipafox.
También se ha referido la aparición de un síndrome intermedio neuromuscular que aparece 24 a 46 horas tras la clínica colinérgica aguda y se manifiesta con una debilidad con parálisis de los músculos proximales de las extremidades y del tórax con un compromiso de la función respiratoria 24 .
En los últimos años se han descrito cuadros neuropsicológicos crónicos no bien definidos, incluyendo el Síndrome de fatiga crónica, relacionados, en unos casos, con efectos a largo plazo de intoxicaciones agudas y, en otros, con exposiciones acumulativas subclínicas 25-28 . Este tipo de efecto no ha sido confirmado por el momento.
Las intoxicaciones agudas más graves se presentan usualmente en ingestiones suicidas o accidentales.
Las dosis tóxicas varían entre los distintos compuestos, de 0,10 g en el caso del paration a 10 g del fenitrotion.
La clínica se presenta independientemente de la vía de entrada en tres grandes síndromes que se superponen 22 :
• Síndrome muscarínico:
– Aumento del peristaltismo digestivo con dolor abdominal, vómitos, diarrea a incontinencia fecal.
– Aumento del tono y peristaltismo de músculos bronquiales y urinarios con broncoconstricción y micciones involuntarias.
– Constricción del esfínter del iris y músculo ciliar con miosis y parálisis de la acomodación.
– Aumento de todas las secreciones, sudor, lacrimeo, sialorrea, hipersalivación, hipersecreción bronquial, hipersecreción gástrica e intestinal y pancreática.
– Vasodilatación periférica con rubor e hipotensión arterial.
– Bradicardia sinual y alteraciones de la conducción auriculo-ventricular.
• Síndrome nicotínico:
– Unión neuromuscular: astenia intensa, fasciculaciones, sacudidas musculares, paresias y parálisis.
– Ganglios simpáticos y suprarrenales: taquicardia, vasoconstricción periférica, hipertensión arterial, hiperexcitabilidad miocárdica. La hipersecreción adrenal produce hiperkalenia, hiperlactacidemia e hiperglucemia.
• Síndrome central:
– Cefaleas, confusión, coma, convulsiones, depresión respiratoria y alteraciones hemodinámicas.
La muerte se produce en insuficiencia respiratoria por hipersecreción y broncoconstricción en la primera fase o por parálisis respiratoria periférica o central en la segunda. Otras causas de muerte son de origen cardiovascular, habiéndose descrito arritmias, bloqueo y parada cardiaca, o por lesión anóxica cerebral irreversible. También puede producirse la muerte por la evolución a un síndrome de distrés respiratorio o en fracaso multiorgánico.
La mortalidad en las intoxicaciones graves se mantiene entre el 10 y el 25% en proporción a la dosis ingerida pese al tratamiento como se ha podido confirmar en las numerosas epidemias humanas de origen alimentario, muchas de ellas causadas por paration 29-31 .
Aunque la recuperación suele producirse sin secuelas se refieren en la literatura efectos prolongados: síndrome asténico-vegetativo, hipertensión, molestias gastrointestinales, alteraciones de conducta y otros.
La presencia de síntomas puede prolongarse largo tiempo ya que la inhibición de colinesterasas es definitiva y su regeneración se producen en tres meses. La redistribución a partir de los tejidos grasos puede provocar recaídas tras el tratamiento durante el primer mes.
En el síndrome intermedio se ha descrito parálisis de cierto número de grupos musculares incluyendo los músculos respiratorios y ha producido la muerte de algunos pacientes.
La polineuropatía retardada es de tipo mixto sensitivo-motor y produce paresterias, paresias y parálisis que pueden recuperarse totalmente en el plazo de unos meses.
La técnica de diagnóstico analítico más generalmente utilizada es la dosificación de la actividad de las colinesterasas plasmáticas o intraeritrocitarias mediante espectrofotometria UV. La más simple es la determinacion de la butilcolinesterasa plasmática o pseudocolinesterasa aunque puede dar problemas de diagnóstico diferencial con casos de disminución o inexistencia de su actividad ligada a factores genéticos (gen dibucaína resistente y gen silencioso).
Para la vigilancia de sujetos expuestos en el trabajo pueden utilizarse papeles reactivos que dan resultados semicuantitativos.
Pueden detectase directamente los productos O-P en plasma, tras extracción, mediante gas-cromatografía. En el caso del paratión es diagnóstica la presencia de paranitrofenol en orina.
El tratamiento en la intoxicación por insecticidas O-P tiene un importante componente sintomático junto al antidótico15. El tratamiento sintomático debe ser intensivo, por la frecuencia de aparición de un compromiso respiratorio grave que suele requerir intubación.
En caso de ingestión debe hacerse aspiración- lavado gástrico con especial cuidado por la misma razón que en los insecticidas O-C seguido de administración de carbón y catárticos. Si se ha producido contaminación cutánea hay que desnudar al paciente y proceder a un lavado en bañera o bajo ducha durante al menos 10 minutos.
Existen dos tipo de antídotos:
• Tratamiento vagolítico.
Se utiliza la atropina con el fin de antagonizar los efectos muscarínicos de la acetil-colina. Se administra por vía parenteral a dosis de 1 mg cada 5-10 minutos hasta conseguir atropinización. Es útil comprobar la aparición de midriasis.
Actúa selectivamente sobre el síndrome muscarínico.
• Regeneración de colinesterasas.
Se realiza mediante la administración de oximas cuyo efecto principal es promover la rotura de la unión entre la acetilcolinesterasa y la parte fosforada del insecticida. Su efectividad regeneradora ha sido muy discutida admitiéndose en la actualidad indicaciones limitadas a productos O-P con grupos alquilos de pequeña longitud y no ramificados, dimetilados o dietilados y a condición de que el tratamiento pueda ser iniciado rápidamente y que no se continúe más allá de 24 horas. La enzima fosforilada sufre un envejecimiento rápido por hidrólisis de las ligazones éster que la hace resistente a la regeneración. Se utiliza el metasulfonato de pralidoxima (PAM) a dosis de 1 g en 250 ml de suero fisiológico a pasar en 30 minutos repitiendo una hora después y cada 8 horas si persiste el cuadro.
No son útiles las técnicas de depuración renal o extrarrenal.
CARBAMATOS
Son productos derivados del ácido carbámico (Fig. 3).
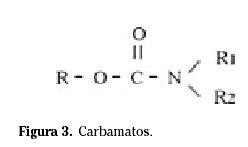
Los carbamatos simples en los que los radicales R1 y R2 son grupos H o metilo inhiben las colinesterasas y son utilizadas como insecticidas. Otros carecen de esta acción y se emplean como herbicidas o fungicidas. Se han sintetizado y comercializado a lo largo de la segunda mitad del siglo XX 32 .
Se absorben por todas ellas aunque el grado de absorción cutánea varía considerablemente de un producto a otro. Pasan rápidamente a sangre y se distribuyen a todos los tejidos. No se acumulan.
Pasan por distintas reacciones de degradación: N-demetilación, hidroxilación, O-dealquilación, sulfoxidación. Varios estudios han establecido que la hidroxilación alifática de las cadenas alquilo representa su ruta predominante de biotransformación oxidativa. Algunas de estas reacciones fracasan en separar la unión éster dando lugar a inhibidores de las colinesterasas a veces más potentes que el producto primitivo.
Los metabolitos finales entre los que se cuenta el CO 2 pueden integrarse en los tejidos o eliminarse por la respiración, leche y orina.
Los que actúan como inhibidores de las colinesterasas lo hacen por un mecanismo similar a los O-P produciendo acetilcolinesterasa carbamilada que aparece más rápidamente pero es más inestable que su equivalente fosforilado debido a que su enlace es electrovalente en lugar de covalente.
Para los carbamatos herbicidas no se han encontrado efectos tóxicos característicos o distintivos ni se ha descrito su modo de acción en los mamíferos.
Los ditiocarbamatos empleados como fungicidas tienen como metabolito común el disulfuro de carbono y sus subproductos lo que determina, más que las características individuales, su similaridad de acción en cuanto a la intoxicación aguda, su interacción con el alcohol y los efectos clínicos en la exposición repetida. Su efecto más conocido es la producción de intolerancia al alcohol.
Los síntomas y signos de la intoxicación aguda por carbamatos inhibidores de la colinesterasa son similares a los referidos en los productos O-P siendo su diferencia fundamental la relativa brevedad de la intoxicación por los primeros y su margen más amplio entre la dosis tóxica mínima y la dosis letal. Las dosis peligrosas oscilan entre 2 y 20 g con excepción del aldicarb, de mayor toxicidad.
Los carbamatos empleados como herbicidas tienen una toxicidad muy baja (DL 50 4.000-10.000 mg/kg), habiéndose descrito afectaciones de tipo ocupacional en forma de dermatitis bullosa o síntomas digestivos inespecíficos.
En relación con los carbamatos fungicidas la mayor parte de las intoxicaciones agudas se asocian a una ingesta alcohólica concomitante dando lugar a náuseas y vómitos con dolor abdominal y temblor fino de manos y lengua. También se han referido efectos irritativos locales en piel y mucosas.
La dosificación de la actividad de las colinesterasas en las intoxicaciones por compuestos del primer grupo es difícilmente interpretable dada la inestabilidad de la enzima carbamilada.
El tratamiento de la intoxicación aguda es similar al indicado en los organofosforados restringiéndose el tratamiento antidótico a la atropina. El empleo de oximas, muy discutido, no parece indicado dada la espontánea reversibilidad del enlace carbamato-colinesterasa 33 .
INSECTICIDAS PIRETROIDES
Las piretrinas eran originalmente extraídas del crisantemo. Se han sintetizado gran cantidad de piretroides a lo largo de la segunda mitad del siglo XX. En la actualidad se encuentran en más de 2.000 preparaciones comerciales 34 .
Las piretrinas naturales están representadas por 6 compuestos: cinerinas I y II, jasmolinas I y II, y piretrinas I y II.
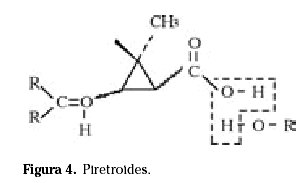
Los piretroides se clasifican en dos grupos: los de tipo 1 como la permetrina no contiene grupo ciano; los de tipo 2 (cipermetrina, deltametrina, fenvalerato) contienen ese grupo (Fig. 4). El fenvalerato actúa como insecticida de contacto y la cipermetrina y la deltametrina como insecticidas de contacto e ingestión.
Son los insecticidas más ampliamente usados en el ámbito doméstico donde han substituido casi totalmente al resto.
Tienen una baja absorción cutánea. Su baja toxicidad en mamíferos depende probablemente de su activa metabolización por hidrólisis. Algunos, como la permetrina, son débiles inductores enzimáticos.
Son moléculas neuroactivas. Las de tipo 1, sin grupo ciano, causan descargas repetitivas en las fibras y terminales nerviosos, conduciendo a hiperexcitación. Las de tipo 2, con un grupo ciano en el carbono alfa producen despolarización y bloqueo de la membrana nerviosa que conduce a la parálisis e inhiben la acción del GABA en su receptor.
Su efecto fundamental se debe a una modificación en el canal del Na de la membrana nerviosa. Parece que los piretroides interactúan con el mecanismo de apertura de forma análoga al DDT 11 .
En animales de experimentación producen ataxia, falta de coordinación, hiperexcitación, convulsiones y parálisis. Predominan unos u otros fenómenos según el tipo de molécula. En humanos es raro que se alcance la dosis tóxica, en especial con los de tipo 1. Los del tipo 2, más peligrosos, han producido parestesias, náuseas, vómitos, fasciculaciones, convulsiones, coma y edema de pulmón. Su toxicidad aguda se potencia si se asocia a O-P que bloquean su hidrólisis.
Se han descrito alteraciones cutáneas en los trabajadores, aunque su seguridad parece ser alta en la exposición profesional. Pueden producir reacciones alérgicas sistémicas y dermatitis de contacto 35 .
HERBICIDAS ORGANOCLORADOS: ÁCIDOS DICLOROFENOXIACÉTICO Y TRICLOROFENOXIACÉTICO
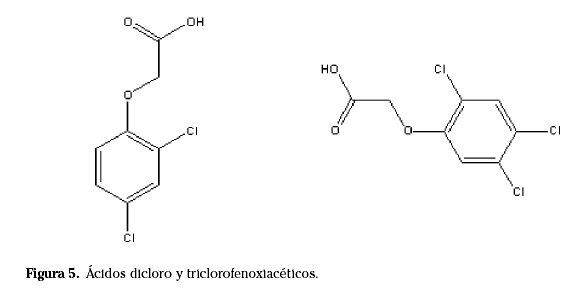
Se sintetizaron en 1941 (Fig. 5). Se han empleado como herbicidas sistémicos defoliantes; el 2,4-D es también fungicida. La mezcla al 50% de los n-butil-ésteres del 2,4-D y 2,4,5-T (conteniendo más de 30 mg/kg de TCDD) es el agente naranja empleado en la cantidad de 40 millones de litros en Vietnam del sur entre 1965 y 1971 para defoliación y destrucción de cosechas 36 . En España está comercializado al 2,4-D, sus ésteres y sus sales 1 .
Se absorben bien por vía digestiva, cutánea y respiratoria 37 . Se distribuyen a todos los tejidos y no se acumulan. Los ésteres se hidrolizan y los ácidos se excretan como tales por orina aunque hay una escasa conjugación con glicina, taurina y ácido glucurónico.
Se eliminan principalmente por la orina con una vida media entre 3 y 12 horas. Producen una inhibición en grado leve de la fosforilación oxidativa celular. Son también tóxicos musculares y nerviosos directos.
Se han descrito efectos agudos en ingestiones accidentales y suicidas y tras exposiciones profesionales a altas dosis: las intoxicaciones más graves cursan con fibrilaciones musculares, lesiones de las fibras musculares con elevación enzimática, mioglobinuria e IRA. Puede producirse fibrilación ventricular, coma, convulsiones, parálisis y muerte.
Son irritantes para la piel, ojos, vías aéreas y tubo digestivo.
El tratamiento es sintomático y se benefician, como ácidos débiles, de la alcalinización urinaria38.
En relación con su empleo profesional se han encontrado cloracné, alteraciones hepáticas, cambios neurológicos y de conducta, alteraciones del metabolismo graso y porfiria. Parece claro que, al menos el cloracné, es atribuible a la contaminación por dioxinas 39 .
HERBICIDAS BIPIRIDÍLICOS: PARAQUAT
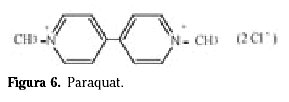
El paraquat (Fig. 6) se sintetizó en 1882 y se introdujo en el mercado como herbicida en 196240. Es un herbicida de contacto ampliamente utilizado en más de 130 países.
Actúa bloqueando los procesos de respiración y fotosíntesis de numerosos vegetales, destruyendo las zonas clorofílicas y respetando las partes leñosas. Es rápidamente inactivado a nivel del suelo y fotolábil. Comercializado en España en formulaciones del 10-20%9. Se emplea diluido de 40 a 200 veces para formar una solución para spray que se aplica mediante aparatos manuales, en maquinaria agrícola o desde el aire.
Su absorción oral es rápida, alcanzándose el pico plasmático a las 2 horas, pero débil, del 4 al 23% de la dosis ingerida 41 .
La absorción cutánea es muy débil. Por esta vía el riesgo de intoxicación es despreciable salvo que existe una lesión cutánea previa o contacto prolongado que lesiona la piel y facilita su penetración sistémica . No se absorbe por vía respiratoria 41 .
Su distribución sigue un modelo tricompartimental. Según éste el compartimento periférico superficial constituido por los tejidos ricamente vascularizados (riñón, hígado, corazón y suprarrenales) se equilibra rápidamente con el compartimento central (sangre). La concentración máxima en el compartimento periférico profundo, asimilado a los pulmones, se alcanza a las 4-5 horas tras el pico plasmático. La concentración más elevada se encuentra en el pulmón que lo acumula mediante un mecanismo específico con gasto de energía localizado en las células epiteliales alveolares y en las células clara de las vías aéreas. No existen vías de metabolización. La mayor parte de la dosis ingerida se elimina por las heces sin ser absorbida 42 .
El paraquat absorbido, independientemente de la vía, se elimina casi exclusivamente por vía renal, mediante filtración glomerular y secreción tubular activa. No hay reabsorción tubular. El aclaramiento renal es superior a 200 ml/min. Se han encontrado pequeñas cantidades en bilis y leche.
Su mecanismo de acción tóxica continúa siendo discutido. Sus efectos resultan de una reacción catalizada metabólicamente de oxidación-reducción con intercambio de un electrón que implica el NADPH como donante.
Esta reacción es seguida rápidamente de una reoxidación del radical paraquat con producción de radicales superóxidos que se combinan con los lípidos insaturados de las membranas dando lugar a nuevos radicales libres en una reacción en cadena que conduce a la muerte celular con inflamación, edema e inducción de fibrosis 43 .
A pesar de su aparente toxicidad moderada en animales de experimentación ha producido un número notable de muertes en humanos.
La dosis letal mínima por vía oral es 35 mg/Kg lo que equivale a un trago de la disolución 200 g/l (20%).
El cuadro típico de la intoxicación aguda por ingestión 41 evoluciona en tres fases:
• Fase inicial: aparecen síntomas ligados a sus efectos cáusticos: sensación dolorosa de quemadura en la orofaringe, con aparición de membranas, en esófago y estómago; vómitos intensos y a veces hemorragias; cólico y diarrea.
• Fase intermedia: se sitúa entre el segundo y el quinto día de la intoxicación con afectación visceral a 2 niveles:
1.- Insuficiencia renal en principio funcional, ligada a la hipovolemia que puede llegar a ser orgánica por lesión celular directa que evoluciona a una necrosis tubular.
2.- Insuficiencia hepática por citolisis centrolobular moderada con ictericia obstructiva.
Ambas lesiones son generalmente benignas evolucionando hacia la curación.
• Fase final: hace su aparición clínica varios días después de la intoxicación, manifestándose como una insuficiencia respiratoria progresiva irreversible con disminución del volumen de reserva inspiratoria, de la capacidad respiratoria y de la hematosis resistente a altas concentraciones de O2 que además agravan la situación. Responde a un cuadro subyacente de edema lesional con alto contenido en proteínas, inflamación de tabique e intralveolar, proliferación de neumocitos tipo II y afectación en suma de todos los elementos de la MAC del tipo descrito como daño alveolar difuso, que evoluciona a la fibrosis pulmonar en el plazo de 5 a 30 días. La muerte, que tiene lugar según diversas series en el 33-78% de los casos se produce por shock cardiogénico en menos de 3 días en las intoxicaciones sobreagudas o por insuficiencia respiratoria ligada a la fibrosis pulmonar más adelante.
Por contacto prolongado con la piel, que puede suceder en medio laboral accidentalmente, disoluciones concentradas producen lesiones cutáneas cáusticas a través de las cuales hay absorción e intoxicación sistémica en un cuadro similar al de la intoxicación por vía oral con excepción de las lesiones cáusticas digestivas.
Se han establecido los siguientes factores de gravedad 44 :
– Vía de administración oral.
– Dosis ingerida: 50 mg/Kg muerte en fracaso circulatorio en 72 horas. Entre 35 y 50 mg/Kg evolución a la fibrosis pulmonar.
– Plazo entre la última comida y la ingestión tóxica: es peor cuanto más prolongado ya que el paraquat se neutraliza con los alimentos.
– Insuficiencia renal orgánica previa.
– Concentración plasmática de paraquat en las primeras 24 h. Se trata de la curva pronóstico establecida por Proudfoot 45 cuyos límites críticos son:
– 2 mg/l a las 4 h.
– 0,6 mg/l a las 6 h.
– 0,3 mg/l a las 10 h.
– 0,16 mg/l a las 16 h.
– 0,1 mg/l a las 24 h.
Por encima de estos límites todos los tratamientos ensayados se han revelado ineficaces para alterar el pronóstico.
Se han establecido tres grados de intoxicación 41 :
– Intoxicación leve: ingestión inferior a 20 mg de ión/Kg peso se producen mínimos síntomas gastrointestinales y la recuperación es total.
– Intoxicación moderada-grave: ingestión de 20 a 40 mg de ión/Kg peso conduce a la muerte a las 3-4 semanas con fracaso renal y fibrosis pulmonar.
– Intoxicación aguda fulminante: ingestión superior a 40 mg de ión/Kg peso produce un fracaso multiorgánico y muerte en pocos días o incluso horas.
Es imperativo realizar una evacuación digestiva lo más precoz posible. Es el único procedimiento eficaz si se consigue evitar la absorción de la dosis tóxica. El lavado gástrico debe seguirse de la administración de carbón cada 4 horas. Otros absorbentes clásicamente recomendados son la tierra de Fuller y la bentonita. Aunque la diuresis forzada neutra incrementa lo ya de por sí, buena eliminación renal, ni ésta ni la hemodiálisis o la hemoperfusión se han demostrado eficaces para mejorar el pronóstico. No existe tratamiento antidótico. La oxigenoterapia empeora la evolución del cuadro respiratorio por lo que debe evitarse mientras la pO2 sea compatible con la supervivencia. La rehidratación y procedimientos de soporte y paliativos como la analgesia son muy necesarios 44 .
GLIFOSATO
Es un herbicida de uso frecuente potencialmente muy tóxico 46,47 .
Toda ingesta superior a unos 100 ml puede tener graves consecuencias: lesiones cáusticas digestivas con náuseas, vómitos y diarreas, edema pulmonar no cardiogénico, shock, fracaso renal, alteraciones hepáticas, arritmias ventriculares, trastornos de la conducta y de la conciencia y acidosis metabólica.
La intoxicación por vía oral debe tratarse mediante lavado gástrico, pese a que puede haber signos de causticación, seguido de carbón activado y catárticos 15 .
Si hay signos clínicos de gravedad, se confirma la ingesta de más de 100 ml o se detecta insuficiencia renal, puede estar indicada la hemodiálisis.
No hay tratamiento antidótico. El tratamiento es sintomático.
RATICIDAS
Aunque se han empleado como agentes raticidas productos muy tóxicos, como la estricnina o las sales de talio, los que se encuentran en el mercado en la actualidad para su empleo doméstico son de tipo anticoagulante, derivados de la hidroxicumarina y análogos 48 .
Tras su ingesta pueden producir náuseas o vómitos seguidos, de las 36 a 48 horas, y diatesis hemorrágica, con petequias, epistaxis, hematuria, hemoptisis y riesgo de hemorragias internas.
Es preciso realizar un control del tiempo de protrombina cada 12 horas aunque hay que tener en cuenta que su descenso puede apreciarse a las 24 horas de la intoxicación.
Puede realizarse tratamiento evacuante gástrico si no hay datos de anticoagulación efectiva.
El tratamiento específico consiste en la administración de fitometadiona IM (10 mg/12 h). En casos graves (tº protrombina < 10% y/o diatesis hemorrágica) se administrará vitamina K hidrosoluble por vía IV (4 mg/6 h) y transfusión de plasma fresco.
BIBLIOGRAFÍA
1. WHO. Public Health impact of Pesticides Used in Agriculture. Ginebra: WHO 1990.
2. Costa LG. Toxicology of Pesticides. A brief history. En: Costa LG, Galli CL y Murphy SD, editors, Toxicology of Pesticides: Experimental, clinical and regulatory perspectives. NATO ASI Series. Berlin: Springer-Verlag, 1986: 1-10.
3. Ray DE. Pesticide neurotoxicity in Europe: real risks and perceived risks. Neurotoxicology 2000; 21(1-2): 219-221.
4. Ferrer A, Cabral R. Collective poisoning caused by pesticides: mechanism of production-mechanism of prevention. Reviews of Environmental Toxicology 1993; 5: 161-201.
5. Homberger E, Reggiani G, Sambeth J, Wipf HK. The Seveso accident: its nature, extent and consequences. Ann Occup Hyg 1979; 22: 327-368.
6. Mehta PS, Metha AS, Metha SJ. Bophal tragedy´s health effects: A review of methylisocyanate toxicity. JAMA 1990; 264: 2781-2787.
7. Hayes WJ. Chlorinated hydrocarbons insecticides. En: Hayes WJ, Lawes ER, editors. Pesticides studied in Man. San Diego: Academic Press, 1991: 731-868.
8. Kester JE. Endocrine-Disrupting Chemicals. En: Sullivan JB, Krieger GR editors. Clinical Environmental Health and Toxic Exposures. Philadelphia: Lippincott William and Wilkins, 2001: 362-373.
9. De Liñan C. Vademécum de productos fitosanitarios. Madrid: Ediciones agrotécnicas, 2002.
10. Smith AG. Chlorinated hydrocarbon Insecticides. En: HayesWJ, Laws ER, editors. Handbook of pesticides toxicology. San Diego, California: Academic Press 1991: 731-915.
11. Nahasashi T, Frey JM, Ginsburg KS, Roy ML. Sodium and GABA activated channels as the argets of pyrethroids and cyclodienes. Toxicol Lett 1992, 64/65: 429-436.
12. Weeks DE. Endrin Food poisoning. A report of four outbreaks caused by two separated shipments of endrin-contaminated flour. Bulletin WHO 1967; 37: 499-512.
13. Murphy SD. Toxic effects in pesticides. En: Klaasen CD, Ambdur MO, Doull J, editors. Cassaret and Doull´s Toxicology: the basic science of poisons. New York: Macmillan, 1986: 543-553.
14. Lauwerys R. Toxicologie industrielle et intoxications professionelles. 3ª ed. Paris: Masson, 1990: 547-590.
15. Nogué S. Protocolos de tratamiento de las intoxicaciones de la Sección de Toxicología Clínica de la Asociación Española de Toxicología. wzar.unizar.es/stc/index.htm
16. Gunderson CH, Lehmann CR, Sidell FR, Jabbari B. Nerve agents: a review. Neurology 1992; 42: 946-950.
17. Dueñas Laita A, Nogué Xarau S, prados Roa F. Accidentes o ataques terroristas con agentes químicos. Med Clin 2001 117; 541-554.
18. Jeyaratnman J, Maroni M. Organophosphorous compounds. Toxicology 1994; 91: 15-27.
19. Durham WF, Hayes WJ Jr. Organic phosphorous poisoning and its therapy. Arch Environ Health 1962; 5: 21-47.
20. Taylor P. Anticholinesterase agents. En: Hardman JG, Limbird LE, Molinoff PB, editors. Goodmann and Gilman´s: The pharmacological basis of therapeutics, 9ª edición. New York: Macmillan, 1996: 161-176.
21. Cherniak MG. Organophosphorous esters and polyneuropathy. Ann Intern Med 1986; 104: 264-266.
22. Aaron CK, Howland MA. Insecticides: Organophosphates and Carbamates. En: Goldfrank LR, Flomenbaum NE, Lewin NA, Weisman RS, Howland MA, Hoffman RS editors. Goldfrank ´s Toxicologic Emergencies, 6ª edición. Stamford: Appleton and Lange, 1998: 1429-1444.
23. Abou-Donia MB. The cytoeskeleton as target for organophosphorous ester-induced delayed neurotoxicity (OPIDN). Chem Biol Interact 1993; 87: 383-393.
24. Sennanayake N, Karalliede L. Neurotoxic effects of organophosphorous insecticides: An intermediate syndrome. N Eng J Med 1987; 316: 761-763.
25. Pilkington A, Buchanan D, Jamal GA, Gillham R, Hansen S, Kidd M et al. An epidemiological study of the relations between exposure to organophosphate pesticides and indices of chronic peripheral neuropathy and neuropsychological abnormalities in sheep farmers and dippers. Occup Environ Med 2001; 58: 689-690.
26. Ray DE. Chronic effects of low level exposure to anticholinesterases- a mechanistic review. Toxicol Lett 1998; 102-103: 527-533.
27. Brown MA, Brix KA. Review of health consequences from high-, intermediate- and low-level exposure to organophosphorous nerve agents. J Appl Toxicol 1998; 18: 393-408.
28. Eyer P. Neuropsychopathological cnages by organophosphorous compouds-a review. Hum Exp Toxicol 1995; 14: 857-864.
29. Wishahi A, Aboul-Dahab YW, Sherif Y, El-Darawy Z. Parathion poisoning (phosphorous compound). A report on 22 children in an outbreak. Arch Pediatr 1958; 75: 387-396.
30. Diggory HJP, Landrigan PJ, Latimer KP, Ellington AC, Kimbrough RD, Liddle JA et al. Fatal parathion poisoning caused by contamination of flour in international commerce. Am J Epidemiol 1977; 106: 145-153.
31. Etzel RA, Forthal DN, Hill RH, Demby A. Fatal parathion poisoning in Sierra Leone. Bulletin WHO 1987; 65: 645-649.
32. Bey TA, Sullivan JB, Walter FG. Organophophates and carbamate insecticides. En: Sullivan JB, Krieger GR, editors. Clinical Environmental Health and Toxic Exposures. Philadelphia: Lippincott William and Wilkins, 2001: 1046-1057.
33. Howland MA, Aaron CK. Antidotes in Depth. Pralidoxime. En: Goldfrank LR, Flomenbaum NE, Lewin NA, Weisman RS, Howland MA, Hoffman RS, editors. Goldfrank´s Toxicologic Emergencies, 6ª edición. Stamford: Appleton and Lange, 1998: 1445-1449.
34. Gibly RL, Sullivan JB. Pyretrhins. En: Sullivan JB, Krieger GR, editors. Clinical environmental health and toxic exposures. Philadelphia: Lippincott William and Wilkins, 2001: 867-879.
35. Lauwerys R. Toxicologie industrielle et intoxications professionelles. 3ª ed. Paris: Masson, 1990: 563.
36. Stephenson J. Agent Orange redux. JAMA 1997; 278: 536.
37. Knopp D. Assessement of exposure to 2,4-dcichlorophenoxiacetic acid in the chemical industry: results of a five year biological monitoring study. Occup Environ Med 1994; 51:152-159.
38. Flanagan RJ, Meredith TJ, Ruprah M, Onyon LJ, Liddle A. Alkaline diuresis for acute poisoning with chlorophenoxy herbicides and ioxynil. Lancet 1990; 335: 454-458.
39. Tamburro CH. Chronic liver injury in phenoxy herbicide-exposed Vietnam veterans. Environ Res 1992; 59: 175-188.
40. Calderbank A, Farrington JA. The chemistry or paraquat and its radical. En: Bismuth Ch, Hall AH, editors. Paraquat poisoning: Mechanisms, Prevention, Treatment. New York: Marcel Dekker, 1995: 89-106.
41. Vale JA, Meredith J, Buckley BM. Paraquat poisonin: Clinical features and inmediate general management. Hum Toxicol 1987; 6: 41-47.
42. Houzé P, Baud FJ, Mouy R, Bismuth C, Bourdon R, Scherrmann JM. Toxicokinetics of paraquat in humans. Hum Exp Toxicol 1990; 9: 5-12.
43. Smith LL. The toxicity of paraquat. Adv Drug React Pois Rev 1988; 1: 1-17.
44. Pond SM. Herbicides: Paraquat and Diquat. En: Goldfrank LR, Flomenbaum NE, Lewin NA, Weisman RS, Howland MA, Hoffman RS, editors. Goldfrank´s Toxicologic Emergencies, 6ª edición. Stamford: Appleton and Lange, 1998: 1475-1484.
45. Proudfoot A. Predictive value of early plasma paraquat concentrations. En: Bismuth Ch, Hall AH, editors. Paraquat poisoning: Mechanisms, Prevention, Treatment. New York: Marcel Dekker, 1995: 275-284.
46. Lee HL, Chen KW, Chi CH, Huang JJ, Tsai LM. Clinical presentations and prognostic factors of a glyphosate-surfactant herbicide intoxication: a review of 131 cases. Acad Emerg Med 2000; 7: 906-910.
47. Sorensen FW, Gregersen M. Rapid lethal intoxication caused by the herbicide glyphosate-trimesium (Touchdown). Hum Exp Toxicol 1999; 18: 735-737.
48. Flomenbaum NE. Rodenticides. En: Goldfrank LR, Flomenbaum NE, Lewin NA, Weisman RS, Howland MA, Hoffman RS, editors. Goldfrank´s Toxicologic Emergencies. 6ª edición. Stamford: Appleton and Lange, 1998: 1459-1473.