Intoxicación por plaguicidas. Parte I
INSECTICIDAS ORGANOCLORADOS
Los insecticidas organoclorados (O-C) son compuestos aryl, carbocíclicos o heterocíclicos de peso molecular entre 291 y 545 que actúan como insecticidas de ingestión y de contacto.
Se clasifican en 4 grupos (Fig. 1) 7 :
• Derivados del clorobenzeno: DDT, metoxicloro.
• Derivados de ciclohexano (C6H6Cl6): HCH, lindano.
• Ciclodienos o derivados del indano: aldrín, dieldrín, clordano, heptaclor.
• Canfenos clorados: clordecona, toxafén.
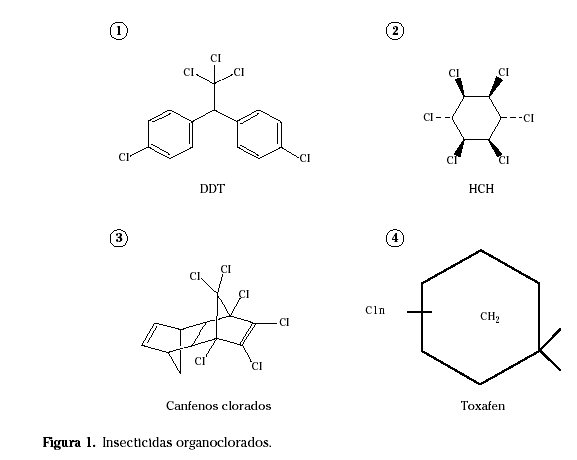
Fueron los primeros insecticidas químicos orgánicos utilizados de forma masiva a escala internacional demostrándose altamente eficaces y económicos. Sin embargo, su uso se ha visto muy restringido en los países desarrollados tras comprobarse su capacidad de bioacumulación y persistencia ambiental.
Los problemas suscitados son la presencia de residuos en alimentos y tejidos humanos y animales y su potencialidad cancerogénica y mutagénica. Algunos de ellos se han considerado disruptores endocrinos 8 .
Las intoxicaciones agudas son cada vez más raras a medida que se van desplazando del mercado. En España todavía se comercializa alguno como 9 :
– Metoxiclor: como insecticida por ingestión y contacto para 78 tipos de cosecha, ganado… En España hay presentaciones al 25% y se recomienda como insecticida de aplicación foliar.
– HCH/lindano: insecticida por inhalación, contacto e ingestión, agrícola y doméstico, pediculicida. En España se recomienda en formulaciones del 2 al 90% como insecticida de aplicación foliar con frecuencia asociado a O-P y carbamatos y de aplicación al suelo. Para aplicaciones directas sobre humanos hay un producto comercial en concentración al 1% (kife gel, loción y champú)
Su cinética está condicionada por su alta liposolubilidad y por la ineficacia de las vías metabólicas de varios de ellos que condicionan su bioacumulación.
Todos ellos se absorben por la piel y vías respiratoria y digestiva. La absorción dérmica es variable: muy baja en el caso del DDT, muy buena en el dieldrín 7 .
Su intensa lipofilia les hace muy afines a los tejidos grasos donde tienden a acumularse en proporción inversa al grado de biotransformación orgánica y de excreción. Además del tejido adiposo se concentran en otros tejidos ricos en grasas neutras como la glándula adrenal, manifestando además un efecto estrogénico 8 .
Así, el DDT y su metabolito el DDE se encuentran presentes en el tejido adiposo de forma constante, mientras que el metoxiclor, muy próximo a ellos se acumula en mínima cantidad. Los distintos isómeros del HCH se acumulan de forma muy distinta, mucho el beta y muy poco el gamma. El dieldrín se acumula mucho, mientras que su isómero el endrín se elimina con eficacia 10 .
Los procesos de biotransformación son diferentes según la familia química. Algunos se transforman en derivados tóxicos liposolubles como es el caso del DDT cuyos metabolitos DDE, DDD y DDA son lipofílicos y acumulables. Otros derivados del clorobenceno dan lugar a productos ácidos hidrosolubles que se eliminan por orina.
Los derivados del indano se transforman en compuestos epóxidos, más tóxicos, antes de hidroxilarse, igual que los derivados de ciclohexano. Así, el aldrín se epoxida a dieldrín en una reacción mono-oxigenasa dependiente del citocromo P-450. También el heptaclor, isodrín y fotoaldrín son substrato de la actividad microsomal epoxidasa. Otros análogos metilados del aldrín no sufren sin embargo epoxidación 10 .
El lindano y otros isómeros del hexaclorociclohexano producen 2,4,6-triclorofenol como producto mayor de su oxidación 10 .
La mayor parte de ellos son potentes inductores enzimáticos. Se eliminan por todas las vías y se encuentran metabolitos en bilis, heces, orina y leche.
Los O-C actúan cambiando las propiedades electrofisiológicas y enzimáticas de las membranas de la célula nerviosa, sobre todo a nivel axonal 11 . Producen un cambio en la cinética del flujo de iones Na y K a través de la membrana así como alteraciones del ion Ca y de la actividad Ca-ATPasa y fosfoquinasa. Dan lugar a un enlentecimiento de la repolarización que produce la propagación de potenciales de acción múltiples para cada estímulo.
El DDT y sus análogos actúan particularmente en el axón nervioso prolongando la apertura del canal del sodio.
Los ciclodienos, mirex y lindano parecen actuar en las terminales presinápticas. El lindano actúa también sobre el receptor GABA.
Tienen capacidad de inducción enzimática microsomial hepatocitaria. También se han descrito cambios en sistemas no microsomiales como la estimulación del sistema AMP-adenilato ciclasa, cambios hormonales por su efecto estrogénico y alteraciones inmunitarias.
Las dosis tóxicas humanas son muy variables: DDT 5 g; metoxiclor 5 g; clordano 40 mg; aldrin > 15 mg; HCH 20 g 7 .
En disoluciones con disolventes orgánicos que favorecen su absorción pueden producirse accidentes graves con cantidades inferiores de 1 g.
Los signos de intoxicación son expresión de hiperactividad neuronal. En las intoxicaciones por vía oral la secuencia clínica es la siguiente 7 :
– Fase inicial: comienza de 30 minutos a 6 horas con hiperestesias en boca y parte inferior de la cara seguida de parestesias, confusión, malestar, cefalea y fatiga. Se acompaña de vómitos de probable origen central, dolor abdominal y diarrea.
– Fase de estado: en las intoxicaciones graves se producen convulsiones con pérdida de conciencia. En las fases interconvulsivas el enfermo se encuentra confuso pero con sus constantes vitales conservadas. Puede complicarse con episodios de hiperexcitabiliad miocárdica y coma, produciéndose la muerte por parada respiratoria, edema agudo de pulmón o fibrilación ventricular. Aisladamente se han descrito casos como insuficiencia hepática o renal. Las cifras de mortalidad son variables. En el brote epidémico por endrin en Qatar y Arabia Saudí 12 en 1967 fueron hospitalizadas 874 personas de las que fallecieron 26.
Hay que hacer el diagnóstico diferencial en la primera fase con una toxi-infección alimentaria, y, cuando aparecen las convulsiones, de las producidas por otros tóxicos (estricnina, O-P), infecciones, toxemia del embarazo o epilepsia.
Puede haber diferencias clínicas entre los distintos productos. El DDT se caracteriza por producir un acentuado temblor; además, da lugar a una progresión de los síntomas que va desde los efectos leves progresando continuamente hasta las convulsiones. El resto de los productos más importantes pueden dar lugar directamente a convulsiones sin otro tipo de pródromos. En las intoxicaciones por otras vías se suman los síntomas propios de la vía de entrada.
Se han referido una serie de síntomas diversos asociados a la exposición a largo plazo en población laboral 14 : dermatitis, alteraciones digestivas (náuseas y vómitos), astenia, irritación de las mucosas respiratorias y conjuntivales, síntomas neurológicos (cefaleas, vértigo, pérdida de equilibrio).
Se pueden identificar y cuantificar estas substancias mediante técnicas cromatográficas en laboratorios especializados.
En el tratamiento 15 de las intoxicaciones agudas puede realizarse una evacuación gástrica con precauciones si se ha asociado un disolvente. Es importante la descontaminación rápida y eficaz si se ha producido impregnación cutánea.
Por lo demás el tratamiento es sintomático, de las convulsiones con diazepam, y garantizando una correcta oxigenación. No existe ningún tratamiento antidótico y los tratamientos de eliminación son ineficaces.
BIBLIOGRAFÍA
1. WHO. Public Health impact of Pesticides Used in Agriculture. Ginebra: WHO 1990.
2. Costa LG. Toxicology of Pesticides. A brief history. En: Costa LG, Galli CL y Murphy SD, editors, Toxicology of Pesticides: Experimental, clinical and regulatory perspectives. NATO ASI Series. Berlin: Springer-Verlag, 1986: 1-10.
3. Ray DE. Pesticide neurotoxicity in Europe: real risks and perceived risks. Neurotoxicology 2000; 21(1-2): 219-221.
4. Ferrer A, Cabral R. Collective poisoning caused by pesticides: mechanism of production-mechanism of prevention. Reviews of Environmental Toxicology 1993; 5: 161-201.
5. Homberger E, Reggiani G, Sambeth J, Wipf HK. The Seveso accident: its nature, extent and consequences. Ann Occup Hyg 1979; 22: 327-368.
6. Mehta PS, Metha AS, Metha SJ. Bophal tragedy´s health effects: A review of methylisocyanate toxicity. JAMA 1990; 264: 2781-2787.
7. Hayes WJ. Chlorinated hydrocarbons insecticides. En: Hayes WJ, Lawes ER, editors. Pesticides studied in Man. San Diego: Academic Press, 1991: 731-868.
8. Kester JE. Endocrine-Disrupting Chemicals. En: Sullivan JB, Krieger GR editors. Clinical Environmental Health and Toxic Exposures. Philadelphia: Lippincott William and Wilkins, 2001: 362-373.
9. De Liñan C. Vademécum de productos fitosanitarios. Madrid: Ediciones agrotécnicas, 2002.
10. Smith AG. Chlorinated hydrocarbon Insecticides. En: HayesWJ, Laws ER, editors. Handbook of pesticides toxicology. San Diego, California: Academic Press 1991: 731-915.
11. Nahasashi T, Frey JM, Ginsburg KS, Roy ML. Sodium and GABA activated channels as the argets of pyrethroids and cyclodienes. Toxicol Lett 1992, 64/65: 429-436.
12. Weeks DE. Endrin Food poisoning. A report of four outbreaks caused by two separated shipments of endrin-contaminated flour. Bulletin WHO 1967; 37: 499-512.
13. Murphy SD. Toxic effects in pesticides. En: Klaasen CD, Ambdur MO, Doull J, editors. Cassaret and Doull´s Toxicology: the basic science of poisons. New York: Macmillan, 1986: 543-553.
14. Lauwerys R. Toxicologie industrielle et intoxications professionelles. 3ª ed. Paris: Masson, 1990: 547-590.
15. Nogué S. Protocolos de tratamiento de las intoxicaciones de la Sección de Toxicología Clínica de la Asociación Española de Toxicología. wzar.unizar.es/stc/index.htm
16. Gunderson CH, Lehmann CR, Sidell FR, Jabbari B. Nerve agents: a review. Neurology 1992; 42: 946-950.
17. Dueñas Laita A, Nogué Xarau S, prados Roa F. Accidentes o ataques terroristas con agentes químicos. Med Clin 2001 117; 541-554.
18. Jeyaratnman J, Maroni M. Organophosphorous compounds. Toxicology 1994; 91: 15-27.
19. Durham WF, Hayes WJ Jr. Organic phosphorous poisoning and its therapy. Arch Environ Health 1962; 5: 21-47.
20. Taylor P. Anticholinesterase agents. En: Hardman JG, Limbird LE, Molinoff PB, editors. Goodmann and Gilman´s: The pharmacological basis of therapeutics, 9ª edición. New York: Macmillan, 1996: 161-176.
21. Cherniak MG. Organophosphorous esters and polyneuropathy. Ann Intern Med 1986; 104: 264-266.
22. Aaron CK, Howland MA. Insecticides: Organophosphates and Carbamates. En: Goldfrank LR, Flomenbaum NE, Lewin NA, Weisman RS, Howland MA, Hoffman RS editors. Goldfrank ´s Toxicologic Emergencies, 6ª edición. Stamford: Appleton and Lange, 1998: 1429-1444.
23. Abou-Donia MB. The cytoeskeleton as target for organophosphorous ester-induced delayed neurotoxicity (OPIDN). Chem Biol Interact 1993; 87: 383-393.
24. Sennanayake N, Karalliede L. Neurotoxic effects of organophosphorous insecticides: An intermediate syndrome. N Eng J Med 1987; 316: 761-763.
25. Pilkington A, Buchanan D, Jamal GA, Gillham R, Hansen S, Kidd M et al. An epidemiological study of the relations between exposure to organophosphate pesticides and indices of chronic peripheral neuropathy and neuropsychological abnormalities in sheep farmers and dippers. Occup Environ Med 2001; 58: 689-690.
26. Ray DE. Chronic effects of low level exposure to anticholinesterases- a mechanistic review. Toxicol Lett 1998; 102-103: 527-533.
27. Brown MA, Brix KA. Review of health consequences from high-, intermediate- and low-level exposure to organophosphorous nerve agents. J Appl Toxicol 1998; 18: 393-408.
28. Eyer P. Neuropsychopathological cnages by organophosphorous compouds-a review. Hum Exp Toxicol 1995; 14: 857-864.
29. Wishahi A, Aboul-Dahab YW, Sherif Y, El-Darawy Z. Parathion poisoning (phosphorous compound). A report on 22 children in an outbreak. Arch Pediatr 1958; 75: 387-396.
30. Diggory HJP, Landrigan PJ, Latimer KP, Ellington AC, Kimbrough RD, Liddle JA et al. Fatal parathion poisoning caused by contamination of flour in international commerce. Am J Epidemiol 1977; 106: 145-153.
31. Etzel RA, Forthal DN, Hill RH, Demby A. Fatal parathion poisoning in Sierra Leone. Bulletin WHO 1987; 65: 645-649.
32. Bey TA, Sullivan JB, Walter FG. Organophophates and carbamate insecticides. En: Sullivan JB, Krieger GR, editors. Clinical Environmental Health and Toxic Exposures. Philadelphia: Lippincott William and Wilkins, 2001: 1046-1057.
33. Howland MA, Aaron CK. Antidotes in Depth. Pralidoxime. En: Goldfrank LR, Flomenbaum NE, Lewin NA, Weisman RS, Howland MA, Hoffman RS, editors. Goldfrank´s Toxicologic Emergencies, 6ª edición. Stamford: Appleton and Lange, 1998: 1445-1449.
34. Gibly RL, Sullivan JB. Pyretrhins. En: Sullivan JB, Krieger GR, editors. Clinical environmental health and toxic exposures. Philadelphia: Lippincott William and Wilkins, 2001: 867-879.
35. Lauwerys R. Toxicologie industrielle et intoxications professionelles. 3ª ed. Paris: Masson, 1990: 563.
36. Stephenson J. Agent Orange redux. JAMA 1997; 278: 536.
37. Knopp D. Assessement of exposure to 2,4-dcichlorophenoxiacetic acid in the chemical industry: results of a five year biological monitoring study. Occup Environ Med 1994; 51:152-159.
38. Flanagan RJ, Meredith TJ, Ruprah M, Onyon LJ, Liddle A. Alkaline diuresis for acute poisoning with chlorophenoxy herbicides and ioxynil. Lancet 1990; 335: 454-458.
39. Tamburro CH. Chronic liver injury in phenoxy herbicide-exposed Vietnam veterans. Environ Res 1992; 59: 175-188.
40. Calderbank A, Farrington JA. The chemistry or paraquat and its radical. En: Bismuth Ch, Hall AH, editors. Paraquat poisoning: Mechanisms, Prevention, Treatment. New York: Marcel Dekker, 1995: 89-106.
41. Vale JA, Meredith J, Buckley BM. Paraquat poisonin: Clinical features and inmediate general management. Hum Toxicol 1987; 6: 41-47.
42. Houzé P, Baud FJ, Mouy R, Bismuth C, Bourdon R, Scherrmann JM. Toxicokinetics of paraquat in humans. Hum Exp Toxicol 1990; 9: 5-12.
43. Smith LL. The toxicity of paraquat. Adv Drug React Pois Rev 1988; 1: 1-17.
44. Pond SM. Herbicides: Paraquat and Diquat. En: Goldfrank LR, Flomenbaum NE, Lewin NA, Weisman RS, Howland MA, Hoffman RS, editors. Goldfrank´s Toxicologic Emergencies, 6ª edición. Stamford: Appleton and Lange, 1998: 1475-1484.
45. Proudfoot A. Predictive value of early plasma paraquat concentrations. En: Bismuth Ch, Hall AH, editors. Paraquat poisoning: Mechanisms, Prevention, Treatment. New York: Marcel Dekker, 1995: 275-284.
46. Lee HL, Chen KW, Chi CH, Huang JJ, Tsai LM. Clinical presentations and prognostic factors of a glyphosate-surfactant herbicide intoxication: a review of 131 cases. Acad Emerg Med 2000; 7: 906-910.
47. Sorensen FW, Gregersen M. Rapid lethal intoxication caused by the herbicide glyphosate-trimesium (Touchdown). Hum Exp Toxicol 1999; 18: 735-737.
48. Flomenbaum NE. Rodenticides. En: Goldfrank LR, Flomenbaum NE, Lewin NA, Weisman RS, Howland MA, Hoffman RS, editors. Goldfrank´s Toxicologic Emergencies. 6ª edición. Stamford: Appleton and Lange, 1998: 1459-1473.