Hidrotalcitas: precursores de materiales adsorbentes de SOx
|
INTRODUCCIÓN
|
Esteban Lopez-Salinas y Francisco Pedraza Archila
Instituto Mexicano del Petroleo, Subdireccion de Transformacion Industrial,
Eje Central L. Cardenas 152, G. A. Madero, 07730 Mexico, D.F., MEXICO. E-mail: [email protected]
La hidrotalcita, [Mg6Al2(OH)16](CO3).4H2O, pertenece a una clase de compuestos llamados arcillas anionicas, o bien cuando son sinteticos, se les llama hidroxidos dobles laminares [1].
La estructura de la hidrotalcita es similar a la de la brucita, Mg(OH)2, en la cual el magnesio se encuentra coordinado octahedricamente a seis grupos hidroxilo. Estos octahedros, al compartir sus orillas, forman laminas bidimensionales.
Cuando algunos cationes Mg2+ se reemplazan por Al3+, se forma la hidrotalcita y el arreglo laminar adquiere carga residual positiva.
Para compensar esta carga positiva se requiere de un anion que generalmente reside en la zona interlaminar, junto con moleculas de agua.
El anion interlaminar puede ser intercambiado por muchos otros en medio acuoso u organico.
Las hidrotalcitas o materiales similares se pueden sintetizar facilmente en el laboratorio. La variedad de familias de materiales tipo hidrotalcita que se pueden preparar es enorme y la formula general que los representa es: [M(II)1-xM(III)x (OH)2](A n-)n/x).mH2O, en donde M(II)= Mg2+, Zn2+, Ni2+, etc., M(III)= Al3+, Fe3+, Ga3+, etc., A= (CO3)2-, Cl-, (NO3)-, (SO4)2- , iso y heteropolianiones, carboxilatos, etc.
Se ha reportado que solo se pueden obtener compuestos tipo hidrotalcita cuando 0.2 ¡Â x ¡Â 0.33, ya que para valores de x fuera de este rango se formaran los hidroxidos u oxidos libres del cation en exceso, mezclados con la hidrotalcita.
En la siguiente figura se muestra una representacion de la estructura laminar de la hidrotalcita.
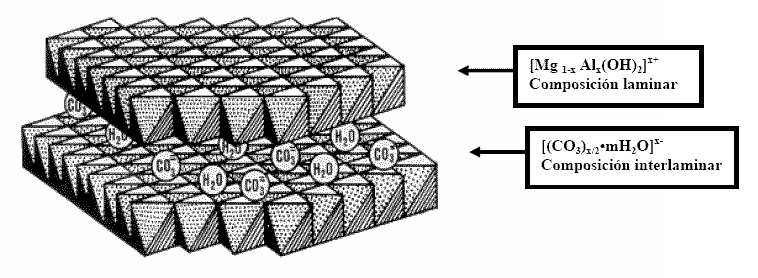
La carga residual positiva de los cationes trivalentes, que siempre se encuentran en menor cantidad que los divalentes, causa que los primeros se distribuyan uniformemente entre los segundos (eléctricamente neutros) y no puedan estar muy cerca entre ellos, debido a la repulsión electrostática.
En consecuencia, un material tipo hidrotalcita representa una ruta o un buen precursor para formar óxidos mixtos binarios (y probablemente hasta terciarios) en donde se busca la mezcla homogénea de los componentes.
La temperatura de calcinación tiene un efecto muy importante sobre las hidrotalcitas y provoca diversos cambios en sus propiedades fisico-químicas.
Por ejemplo para el caso de una hidrotalcita tratada térmicamente: (i) a temperaturas menores de 150 °C se expulsan las moléculas de agua interlaminar sin alterar la estructura laminar, (ii) entre 300 y 500 °C, tiene lugar la deshidroxilación de las láminas y descomposición del carbonato, que trae consigo el colapso del arreglo laminar, (iii) entre 500 y 600°C se forma una solución sólida de Mg(Al)O y (iv) a temperaturas superiores a 600°C se produce MgO libre y la espinela MgAl2O4.
Los productos de la calcinación de las hidrotalcitas tienen la capacidad de reconstruir la estructura inicial laminar cuando se ponen en contacto con soluciones acuosas que contengan al anión inicial, u otro diferente.
Descubrimientos recientes en nuestros laboratorios indican que la reconstrucción también puede llevarse a cabo en fase gaseosa al poner en contacto con el medio ambiente y a temperatura ambiente una hidrotalcita calcinada (hasta 800 °C) de Mg-Al o Mg-Ga , que sin necesidad de proporcionarle energía reaccionará con el vapor de agua y el CO2 del ambiente. La fuerza de los sitios básicos en las hidrotalcitas calcinadas arriba de 600 °C es 150 veces mayor que en el caso de MgO puro (calcinado a 600°C) [2].
Adicionalmente, no solo los valores de área específica en las hidrotalcitas calcinadas arriba de 600 °C son entre 3 y 4 veces mayores, sino que la resistencia a la sinterización en condiciones de 50 % vapor de agua /50 % N2 es de 3 a 4 veces mayor que el MgO [2].
Es claro que debido a estas características que combinan basicidad, alta área superficial y resistencia a la sinterización, sea de interés el utilizar las hidrotalcitas calcinadas como precursores de materiales adsorbentes de gases ácidos, tales como el perjudicial SOx.
Los procesos de desintegración catalítica e hidroprocesamiento producen una gran cantidad de H2S y SOx.
El H2S se envía a las plantas Claus, en donde por razones de equilibrio, solamente se recupera el 97 % del azufre, y por lo tanto el gas de cola debe de ser tratado antes de enviarse a la atmósfera.
Compuestos de azufre tales como: COS, CS2, H2S, etc., pueden oxidarse a SOx y capturarse después con un adsorbente de alta capacidad, que puede ser regenerado posteriormente con H2, convirtiendo el SOx en H2S y devolviéndolo a las plantas de azufre.
Por otro lado, la cantidad de SOx emitida por el regenerador de una unidad de desintegración catalítica (FCC) es función de la cantidad de azufre de la carga, el rendimiento a coque y de la conversión. 45-55 % del azufre de la carga se convierte en H2S en el reactor, 35-45% permanece en los productos líquidos, y 5-10 % se deposita sobre el catalizador con el coque.
Este azufre contenido en el coque es el que se oxida a SOx en el regenerador de la unidad FCC produciendo una mezcla de aproximadamente 90 % SO2 y 10 % SO3. En la remoción de SOx de las emisiones del proceso FCC se han usado comúnmente espínelas de magnesio con cerio y vanadio [3].
La actividad de estos materiales y el mecanismo de remoción del SOx está bien caracterizado, aunque su eficiencia depende de la composición y el método de preparación.
Recientemente en los Estados Unidos de América, la Agencia de Protección Ambiental ha limitado las emisiones de SOx de las unidades de FCC a 300 ppm, equivalente a 9.8 Kg. de SOx / 1000 Kg. de coque quemado. La creciente abundancia relativa de petróleos crudos más pesados y con mayor contenido de compuestos orgánicos de azufre, así como la implantación de regulaciones cada vez mas estrictas de emisiones de SOx, han motivado la búsqueda de mejores materiales adsorbentes de SOx.
|
Preparación de las hidrotalcitas
|
La síntesis de materiales tipo hidrotalcita ha sido motivo de diversas monografias que han sido revisadas y en donde se puede consultar en detalle los métodos para su obtención [4,5].
Cabe hacer notar que recientemente, para obtener hidrotalcitas en las cuales las láminas forman algo similar a un “castillo de naipes” formando agregados esféricos de alta porosidad, se ha reportado un procedimiento novedoso en el cual la velocidad de agitación y el tiempo de adición de la sal de Mg son los parámetros más importantes [6].
Mediante este procedimiento, la distribución de micro y mesoporos es similar a las hidrotalcitas convencionales, pero la cantidad de macroporos es mucho más elevada. Las hidrotalcitas (HT) empleadas en este trabajo se prepararon mediante coprecipitacion a pH entre 8.5-9.5 utilizando una solucion acuosa de Mg(NO3)2.6H2O y Al(NO3)3.9H2O conteniendo cantidades tales de sales de Mg y Al para obtener la relacion molar Mg/Al deseada (Mg/Al= 1.0, 1.5, 3.0, 4.0 y 5.0), segun la estequiometria de la siguiente formula: [MgaAlb(OH)2(a+b)](CO3)b/2.mH2O. Por ejemplo, la obtencion de una hidrotalcita de Mg/Al=1 se llevo a cabo de la siguiente manera.
Primero se preparo una solucion acuosa (A) con 17.19 g. de Mg(NO3)2.6H2O y 25.16 g. de Al(NO3)3.9H2O en 50 cm3 de agua. Por otro lado se preparo una solucion acuosa (B) conteniendo 4.63 g. de K2CO3 y 17.01 g. de KOH en 150 cm3 de agua.
Las dos soluciones (A) y (B) se gotearon lentamente en un matraz conteniendo 150 cm3 de agua a 70¡ÆC en agitacion, en donde el pH se registro continuamente y se controlo ajustando la velocidad de adicion de las soluciones (A) y (B).
La lechada obtenida se separo y lavo repetidamente en una centrifuga.
Posteriormente, la pasta blanca obtenida se seco en una estufa a 100¡ÆC durante 48 h. Finalmente, el material se calcino en una mufla a temperaturas indicadas por espacio de 2 a 6 h.
|
Evaluacion de la capacidad de adsorcion de SOx
|
La cantidad de SO2 adsorbido sobre las hidrotalcitas calcinadas se determino en un analizador termico gravimetrico (ATG), mediante el cual se pudo llevar a cabo las etapas de oxido-reduccion, adsorcion y purgado in situ.
La prueba se efectuo mediante los siguientes pasos: (1) Colocacion de 20 a 30 mg. de hidrotalcita previamente calcinada en la canastilla del ATG, (2) limpieza y estabilizacion de la muestra calentando hasta 650 ¡ÆC en atmosfera de aire (20 cm3/min), (3) purgado con flujo de N2 (20 cm3/min), (4) adsorcion de SO2 (1.5 %SO2/aire, 20 cm3/min) a 650¡ÆC hasta saturacion total, (5) purgado con N2, (6) reduccion a 650¡ÆC con H2 ( 20 cm3/min) durante aproximadamente 1 h, (7) purgado con N2 durante 10-15 min. a 650 ¡ÆC, (8) reactivacion de la muestra con flujo de aire (20 cm3/min) a 650 ¡ÆC durante 30 min.
Un segundo ciclo de adsorcion de SOx se puede llevar a cabo (siguiendo los pasos anteriormente descritos) para formar asi una secuencia de ciclos de adsorcion, que indicara la estabilidad de las hidrotalcitas calcinadas.
Como se puede observar en la Tabla 1, los valores de area especifica son entre 150 y 252 m2 g-1 para las hidrotalcitas calcinadas a 650 ¡ÆC con Mg/Al entre 5 y 1, respectivamente. Entre mayor es el contenido de Al mayor es el area especifica.
Por otro lado, cuando las hidrotalcitas se calcinan a 800 ¡ÆC ocurre una disminucion entre 33-35 % en comparacion con los valores obtenidos a 650¡ÆC, pero aun asi representan valores considerablemente mayores a los de una MgO calcinada a esta temperatura (. 50 m2 g-1).
Tabla 1 Características texturales de las hidrotalcitas en función de la relación Mg/Al y de la temperatura de calcinación.

La eficiencia de remoción de SOx se muestra en la Tabla 2, en donde es claro que entre mayor sea el contenido de MgO en la hidrotalcita mayor será la capacidad de adsorción hasta valores de entre 66.5-71.8 % peso MgO en los cuales la cantidad adsorbida es máxima.
La velocidad de adsorción de SOx se incrementa directamente con el contenido de MgO.
Tabla 2 Adsorción total de SOx con hidrotalcitas de diferente relación Mg/Al calcinadas a 650 °C.

Después de adsorber el SOx es necesario su remoción mediante la reducción con H2. En la Tabla 3 se puede observar que después de 1 h. de reducción se puede remover mas de 90 % de SOx en las hidrotalcitas con Mg/Al entre 1~3, y son las que presentan la mayor velocidad de reducción. Por otro lado, las de Mg/Al entre 4~5 son más lentas para reducir el SOx adsorbido.
Tabla 3. Reducción con H2 a 650 °C de hidrotalcitas con diferente relación Mg/Al.

La temperatura de calcinación es otro parámetro importante en la transformación de hidrotalcitas en materiales de alta capacidad de adsorción.
Por ejemplo, de los resultados de la Tabla 4 se puede concluir que la mayor cantidad de SOx que una hidrotalcita puede adsorber se da entre 650 y 800 °C. Sin embargo, aunque a 800 °C se observe el mayor grado de adsorción, esta es más lenta que a 650°C.
Estos resultados sugieren que probablemente los sitios básicos que se forman alrededor de 650 °C, asociados a una solución sólida Mg(Al)O, sean mas activos que los sitios básicos que se forman a 800 °C, asociados a una espinela MgAl2O4 dispersa en MgO.
Tabla 4 Adsorción de SOx en una hidrotalcita Mg/Al=1.5, en función a la temperatura de calcinación.

Otra de las propiedades deseables de un material adsorbente es su estabilidad con respecto a soportar varios ciclos de adsorción-desorción.
Los resultados de 4 ciclos de adsorción de SOx y reducción con H2 muestran en la Tabla 5 que la capacidad de adsorción es muy similar a la inicial, notándose un 18 % de aumento en la velocidad de adsorción en el cuarto ciclo con respecto al primero.
Tabla 5 Adsorción de SOx con hidrotalcita (Mg/Al=3) calcinada a 700°C en función del número de ciclos (ciclo = adsorción-reducción).

|
Conclusiones y recomendaciones
|
El uso de hidrotalcitas como precursores de materiales adsorbentes de SOx ofrece grandes ventajas con respecto a los aditivos convencionales tales como MgO y MgAl2O4, hasta ahora empleados.
De hecho recientemente, la compania Intercat ofrece un aditivo que se agrega directamente al catalizador de FCC para la reduccion de SOx llamado SOXGETTERÆË cuya composicion se basa en compuestos tipo hidrotalcita [6].
Sin embargo, es posible todavia mejorar la eficiencia de adsorcion de SOx en materiales obtenidos via hidrotalcita examinando la influencia de parametros tales como: (1) tipo de anion interlaminar, (2) tipo de secado, (3) variacion del pH de coprecipitacion, (4) metodo de obtencion (p. ej. Sol-gel).
En sustitucion al Mg, la basicidad intrinseca que pudiera aportar otro cation divalente podria venir de la misma familia de los alcalino-terreos, (Ca2+, por ejemplo), pero es poco probable que al utilizar otros cationes divalentes de los metales de transicion se generen propiedades basicas mejores que las que proporciona el Mg.
Por otro lado, la afinidad que tiene la hidrotalcita o sus productos de calcinacion, aunada a las propiedades antes mencionadas, la hace un material de gran potencial para adsorber CO2 del ambiente y contribuir a solucionar los problemas del efecto invernadero.
Bibliografía 1. S. Miyata, Clays and Clay Minerals 23, 369 (1975).
2. H. Schaper, J. J. Berg-Slot, W. H. J. Stork, Applied Catalysis 54, 79 (1989).
3. Fluid Catalytic Cracking: Science and Technology en J. S. Magee, M. M. Mitchell, Jr. (editores), Elsevier Science Publishers B. V., 76, 531 (1993).
4. W. T. Reichle, Solid State Ionics 22 135 (1986).
5. F. Cavani, F. Trifirò, A. Vaccari, Catalysis Today 11 173 (1991).
6. Sherman D. Cox and Kenneth J. Wise, Mat. Res. Soc. Symp. Proc. Vol. 371, 151 (1995). 7. U.S. patents: 4,946,581, 4,952,382, 4,866,019.