Hidrotalcitas como precursores de Oxidos Mg-Al sobre arcilla usados en la reducción de emisiones SOx
Resumen
Los óxidos de azufre (SOx) son unos de los importantes contaminantes atmosféricos. Dentro de las refinerías el proceso de FCC es el principal generador de SOx. Para evitar la emisión de este gas se utilizan los aditivos DeSOx. En el presente trabajo se prepararon aditivos a base de hidrotalcitas Mg-Al soportados en arcilla y modificados con Ce y V. Estos se caracterizaron en cuanto a sus propiedades texturales y fases presentes por DRX. Finalmente los aditivos se evaluaron en la adsorción de SOx y presentaron una alta capacidad de adsorción a las condiciones de FCC, así como una buena regeneración.
Palabras clave: aditivos DeSOx, hidrotalcitas, óxidos de azufre.
1. Introducción
Los óxidos de azufre (SOx) son unos de los principales contaminantes atmosféricos que contribuyen a la formación de la lluvia ácida. Las estaciones de generación de energía producen un 60% de las emisiones de SOx, otra contribución a las emisiones de SOx proviene de plantas petroquímicas y en específico de las unidades de craqueo catalítico fluido (FCCU). Desde 1984 la agencia de regulaciones ambientales (EPA) ha establecido un límite superior de 9.8 Kg de SOx por 1000 Kg de coque quemado (300 ppm) en FCCU. La tendencia actual es establecer niveles aún menores para estas unidades. En las unidades FCC entre el 45 y 55 % del azufre presente en la alimentación (especialmente los compuestos no-tiofénicos) se convierte a H2S, un total de 35-45% permanece en los productos líquidos y el azufre restante (entre 5-10%) se deposita en el coque que se forma en el catalizador, este azufre durante la regeneración del catalizador se desprende como SO2 y SO3.
Algunas opciones de control de los SOx en la FCCU incluyen las siguientes: a) hidrotratamiento de la carga antes del proceso FCC. b) tratar los gases que salen del regenerador y c) introducir un aditivo de transferencia de SOx en el catalizador de FCCU, el cual transfiera los SOx desde el regenerador hasta el reactor donde se liberan como H2S que cual se recupera de los efluentes gaseosos y es enviado al proceso Claus. La opción a) incluiría una planta de hidrotratamiento.
Desde el punto de vista técnico esto es factible, pero se tendría un costo elevado pues implica la construcción de una nueva planta. La opción b) Se utilizaría una corriente rica en aminas y/o carbonatos que requieren un tratamiento posterior. En contraste, el uso de los aditivos no requiere una gran inversión de capital por lo que su empleo resulta favorable.
El mecanismo aceptado para los aditivos de transferencia de SOx es el siguiente:
- Durante la regeneración del catalizador de FCCU se presentan las reacciones de formación de los SOx y sulfato:
S (en coque) + O2 → SO2 (90%) + SO3 (10%)
SO2 + ½ O2 → SO3
MxO + SO3 → MxSO4Como se indica, el aditivo debe ser capaz de oxidar el SO2 a SO3 en las condiciones en que opera la regeneración en la FCCU y almacenar el SO3 como un sulfato estable en el aditivo.
- En el reactor, donde predominan condiciones reductoras, se presenta la regeneración del aditivo y se libera H2S:
MxSO 4 + 4H2 → MxS + 4H2O → MxO + H2S + 3H2O
MxS + H2 O → MxO + H2 S
Bajo este principio diversos aditivos se han empleado de manera comercial. Con el paso del tiempo se han agregado diferentes óxidos que actúan como promotores de oxidación de SOx siendo el CeO2 el más empleado. De acuerdo al esquema antes mencionado los óxidos metálicos apropiados para la captura de SO3 son aquellos que presentan una alta capacidad de adsorción del SO3 y también deben ser capaces de formar un sulfato metálico estable en las condiciones de operación de FCCU. Debido a las características ácidas del gas tratado deberían emplearse, en principio, óxidos básicos fuertes (tales como CaO, BaO, y óxidos de metales alcalinos). Pero estos forman sulfatos metálicos altamente estables que no son reducibles, al menos en las condiciones de operación de las FCCU. Por lo que estos materiales no son útiles para este fin.
El MgO presenta una gran capacidad de adsorción. En comparación con los óxidos antes mencionados, pero el sulfato formado también es lo suficientemente estable para que su actividad se pierda rápidamente. Otro óxido que alguna vez fue empleado es la alúmina, que presenta una alta área superficial pero cuya desventaja es la baja capacidad de adsorción y poca estabilidad del sulfato respectivo.
Bajo la hipótesis de aprovechar las propiedades que presentan los óxidos de magnesio y de aluminio. Compuestos con basicidad intermedia tal como espinelas de Mg-Al se han preparado para encontrar una captura óptima de SOx.
Recientemente se han preparado materiales que presentan aluminio y magnesio en su composición. Estos son las hidrotalcitas. Si bien las hidrotalcitas presentan una baja estabilidad térmica, sus productos de calcinación son estables en las condiciones de operación de FCC y generan óxidos mixtos Mg-Al.
Se ha determinado que estos óxidos son más básicos que el MgO (Di Cosimo, 1998). Debido a estas características se considera interesante evaluarlos para verificar su funcionamiento en la captura de SOx. Por lo que, en el presente trabajo se prepararon aditivos a base de hidrotalcita de Mg-Al de relación molar Mg/Al=3, calcinada soportados en arcilla y modificados con Ce y V. A éstos aditivos se les determinaron sus propiedades texturales, las fases presentes, comportamiento térmico y se evaluó su capacidad de adsorción de SOx; así como su capacidad de regeneración a las condiciones existentes en FCC.
2. Metodología experimental
2.1 Preparación del precursor de óxidos de Mg-Al
Se preparó hidrotalcita (HT), con relación Mg/Al=3 cuya fórmula es (Mg6Al2(OH)16)CO3.4H2O, por el método de coprecipitación (Cavani y col., 1991). A partir de dos soluciones A y B. La solución acuosa A contiene las cantidades correspondientes de Mg(NO3)2.6H2O (Mallinckrodt, 99.1%) y Al(NO3)3 9H2O (Técnica Química, 99.2%). La B es una solución básica constituida por KOH (J.T.Baker, 87.9%) y (NH4)2CO3 (Mallinckrodt). La coprecipitación se llevó a cabo a pH constante (8.5 a 9.5) y temperatura ambiente.
2.2 Preparación de los aditivos HT-CeO2-V2O5/Arcilla
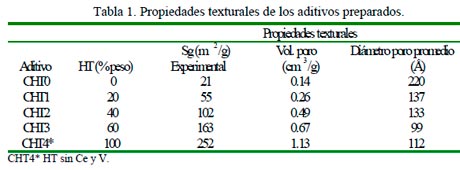
Se elaboró una serie de aditivos, CHT1-CHT4, con diferentes contenidos de HT (20, 40, 60 y 100% peso) sobre arcilla (caolín), con un 10% de CeO2 y 3% V2O5. Se preparó una lechada con HT y agua desmineralizada en un recipiente con agitación continua, posteriormente se adicionó la arcilla en suspensión. Después se adicionó una solución de Ce(NO3)3.6H2O y otra de oxalato de vanadio (patente U.S. 3,689,515). Los materiales se secaron en atmósfera de aire a 130ºC. Para obtener los aditivos, las muestras se calcinaron en atmósfera de aire a 650 ºC durante 4.5 horas.
2.3 Caracterización
Las propiedades texturales de las muestras fueron obtenidas en un equipo Micromeritics ASAP 2000, empleando la ecuación de BET a partir de la adsorción de N2 a 77 K.
Los patrones de difracción de las muestras se obtuvieron en un difractómetro Siemens D-5000 provisto con un monocromador y empleando radiación de Cu Kα (1.5406 Å) y una velocidad de barrido de 20º/0.7 s.
Los análisis térmico-gravimétricos de los precursores fueron llevados a cabo en un equipo Perkin Elmer serie 7. Para simular el proceso de FCC se utilizó un equipo TG-DTA Perkin Elmer serie 7 modificado con un juego manual de válvulas para los procesos de óxido-reducción, adsorción y limpieza del sistema. El procedimiento utilizado se presenta en la Fig. 1.
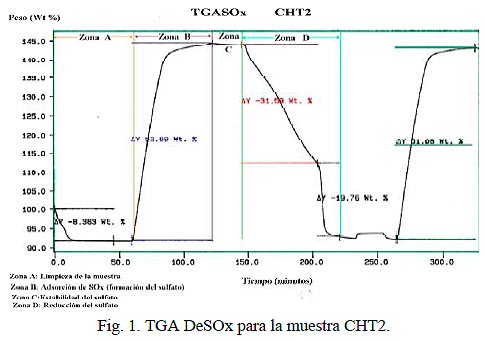 |
El aditivo (20-30 mg) se coloca en un crisol de platino y se calienta hasta 650 ºC (zona A) en atmósfera de aire. Posteriormente se inicia la adsorción de SO2 exponiendo la muestra a una mezcla gaseosa de SO2 (1.5%)/aire a la misma temperatura, observándose un incremento en el peso de la muestra (zona B), lo cual indica la adsorción de SO3 por el óxido metálico para formar el sulfato correspondiente; el tiempo de adsorción de SOx depende de la muestra. Se limpia el sistema con N2 (zona C), donde se verifica la estabilidad del sulfato formado.
Finalmente, se procede a la reducción del sulfato, reduciendo la muestra con una corriente de H2 a 550 ºC; si la reducción no se completa a esta temperatura, se calienta hasta 650 ºC en la misma atmósfera de H2 obteniéndose así nuevamente el óxido metálico (zona D), el cual se puede someter nuevamente a otro ciclo adsorción-reducción.
Con esta prueba se puede determinar la capacidad total de adsorción, velocidad de adsorción y velocidad de reducción.
Las velocidades de adsorción y de reducción se calcularon con los datos obtenidos en los 30 minutos iniciales de la prueba.
3. Resultados y discusión
3.1. Propiedades texturales
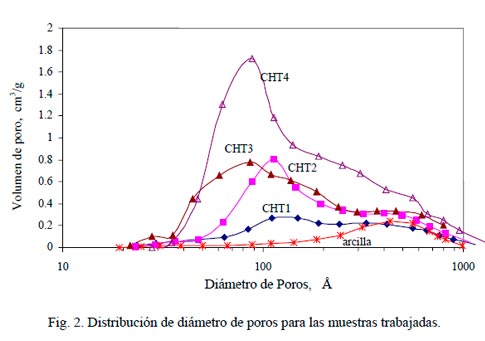
En la Tabla 1 se presentan las propiedades texturales de los aditivos. Se observa que existe un incremento en el área específica en función del contenido de HT. Este aumento es lineal, como se observa en la Fig. 1, sugiriendo que no existe interacción entre el soporte y la fase activa. Se encontró que al aumentar el contenido de HT también aumenta el volumen de poros. En la Fig. 2 se presentan la distribución del diámetro de poro de los aditivos, de la HT calcinada (CHT4) y del soporte empleado (arcilla).
Las muestras con contenidos intermedios presentan una transición suave, tanto en la forma como en los máximos, de la curva de distribución, pasando entonces desde la arcilla hasta la hidrotalcita. Lo cual refuerza la idea de la no-interacción entre el soporte y la fase activa.
|
|
3.2. DRX
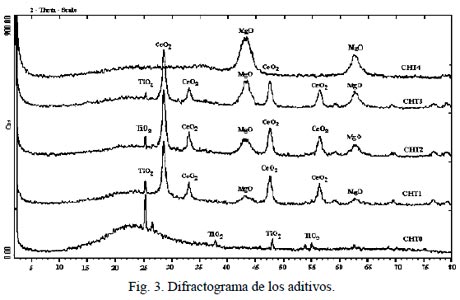
La HT, precursor de los óxidos de Mg-Al, presenta la fase cristalográfica de una hidrotalcita identificada por la ASTM con la tarjeta No. 22-0700.
En la Fig. 3 se presentan los difractogramas de los aditivos, la HT y la arcilla, CHT1-CHT3, CHT4 y CHT0 respectivamente. En estos se observan las fases cristalográficas del MgO, CeO2 y una porción (arcilla) como material amorfo.
En ésta última se detecta la presencia de anatasa, por lo que el pico representativo de ésta se puede emplear para identificar la presencia de la arcilla en los aditivos. La fase MgO está presente en todos los aditivos y como se aprecia la cantidad aumenta en función de la concentración de HT.
3.3. Análisis térmico gravimétrico y diferencial
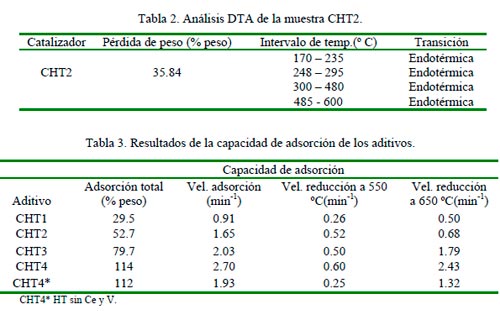
Los termogramas de los materiales presentaron una pérdida de peso entre un 35 – 40%. Un resumen de los resultados de DTA se muestra en la Tabla 2. Se observan cuatro transiciones de fase las que corresponden a las asignadas por Di Cosimo y Apesteguía (1998) a: la deshidratación de la muestra, la deshidroxilación, la descarboxilación y por último la formación de los óxidos correspondientes.
3.4. Capacidad de adsorción
 |
Los aditivos tardan aproximadamente 60 min. para saturarse completamente de SO3. Los aditivos preparados presentaron una mayor capacidad de adsorción comparados con los aditivos compuestos de espinelas (Bhattacharyya y col., 1988) i.e. aproximadamente 26%. Como se aprecia en la Tabla 3, la capacidad de adsorción de las muestras aumenta en función de la concentración de MgO. La capacidad de adsorción de la muestra CHT4 es similar a la HT sin Ce y V (CHT4*).
Con respecto a la velocidad de adsorción se observa que ésta aumenta en función del contenido de HT en los aditivos. Esto señala la importancia de la presencia del MgO en estos aditivos. Comparando las muestras CHT4 y CHT4*, se observa el papel del Ce y V, Por una parte, no existe un gran aumento la cantidad total adsorbida y por el otro aumenta la velocidad de adsorción, se concluye entonces que ambos promotores ayudan en la oxidación de SO2 a SO3.
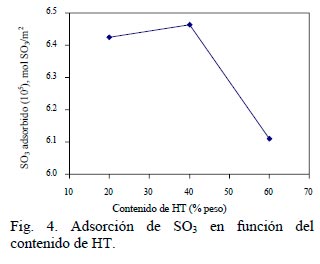
Se ha identificado como principal material absorbente al MgO. Dado que las muestras presentan diferente área, la cantidad de SOx adsorbida se calculó por unidad de área. La cantidad de SO3 adsorbido/m2 contra el contenido de HT, ver Fig. 4, presenta un máximo para la muestra que contiene 40% de HT.
 |
Lo que indica que existe un mejor aprovechamiento de las especies activas en la muestra; esto debido a una mayor cantidad de área expuesta de MgO después de la calcinación. En cuanto a la reducción de los aditivos se debe señalar que en la literatura se realiza rutinariamente la reducción a 650°C (Bhattacharyya y col. 1988). Los aditivos aquí preparados presentan una reducción bastante rápida a dicha temperatura, como se observa en la Fig. 1. En cambio en el proceso se trabaja a una temperatura de 550°C, aún a esta temperatura se observa una reducción mensurable. De los aditivos evaluados, la muestra CHT4 se regenera muy lentamente en comparación con los aditivos que contienen Ce y V. Si bien, el aumento en la velocidad de reducción puede estar relacionado con un incremento en la concentración superficial de los sulfatos; relacionado a su vez con el aumento en la cantidad de HT en la muestra; de nueva cuenta las propiedades Redox del V estén jugando un papel preponderante en este proceso. Este comportamiento es similar con lo observado previamente para aditivos basados en espinelas de Mg-Al (Bhattacharyya y col., 1988) que se atribuyó a las propiedades Redox.
Conclusiones
Los aditivos preparados a partir de hidrotalcitas y adicionados con Ce y V soportados son materiales prometedores como aditivos DeSOx ya que presentan una alta capacidad de adsorción.
La capacidad de adsorción es proporcional al contenido de hidrotalcita presente en las muestras estudiadas.La presencia de Ce y V aumentan tanto la velocidad de adsorción de SOx como la de reducción de los sulfatos en los aditivos estudiados.
Agradecimientos
Se agradece el soporte financiero al programa IMP-FIES 98-23-II, T. Bueno agradece el apoyo de CONACYT para realizar sus estudios de maestría.
Referencias
Bhattacharyya, A., Woltermann, G., Yoo, J. S., Karch, J. A, y Cormier, W. (1988). Catalytic SOx abatement: the role of magnesium aluminate spinel in the removal of SOx from fluid catalytic cracking (FCC) flue gas. Industrial Engineering Chemical Research 27, 1356-1360.
Cavani, F., Trifiró, F. y Vaccari, A. (1991). Hydrotalcite-type anionic clays: preparation, properties and applications. Catalysis Today 11, 173-301.
Di Cosimo, J.I., Díez, V. K., Xu, M., Iglesia, E. y Apesteguía, C.R. (1998). Structure and surface and catalytic properties of Mg-Al basic oxides. Journal of Catalysis 178, 499-510.
Yoo, J. S., Bhattacharyya, A. y Radlowski, C. (1994). De-SOx catalysts: a XRD study of magnesium aluminate spinel and its solid solutions. Industrial Engineering Chemical Research 39, 1444-1446.
Por: R. Cuevas1*, M. T. Bueno1, J. Ramírez1, C. Salcedo1, B. Mar2 y F. Pedraza2
Fuente: Cuevas y col. / Revista Mexicana de Ingeniería Química Vol. 2
- UNICAT, Facultad de Química, UNAM, L 225 Conjunto E, Circuito de la Investigación Científica, Ciudad Universitaria, 04510, Coyoacán, México. D.F.
- STI, Gerencia de Catalizadores, Instituto Mexicano del Petróleo