Guía mejores técnicas disponibles en España del sector de tratamiento de superfícies metálicas y plásticas. Parte 16
Guía mejores técnicas disponibles en España del sector de tratamiento de superfícies metálicas y plásticas
4.19.2 Técnicas de reducción de emisión de aguas residuales (tratamiento de aguas residuales)
Como se ha dicho y explicado en diferentes ocasiones, el arrastre es la principal causa de generación de contaminantes del sector y, en gran medida, ello es debido a la consecuente generación de aguas residuales y baños contaminados o agotados que deben ser tratados y eliminados adecuadamente.
Como norma general, se recomienda reducir todo consumo de agua en procesos y actividades auxiliares. Para no incrementar la conductividad del vertido, hay que dar preferencia a todas aquellas técnicas que, además de reducir el consumo de agua, producen una reducción o recuperación del arrastre; por ejemplo, con la implantación de un enjuague estático de recuperación, podemos reducir hasta 1/5 las necesidades de enjuague posteriores, recuperando el 70-80 % del arrastre que es, en definitiva, el responsable de la presencia de sales en las aguas a depurar.
Por ello, es importante eliminar o minimizar el uso o pérdida de materias, en particular sustancias importantes, según las técnicas descritas anteriormente. Cuando sea técnicamente factible, es recomendable utilizar técnicas de circuito cerrado priorizando las técnicas para la sustitución y/o control de sustancias peligrosas vistas hasta ahora.
Una vez generado el efluente contaminado, ya sea en forma de enjuague diluido, como de baño concentrado, es preciso proceder a su tratamiento y eliminación. Dentro del sector, a modo global, podemos establecer que todos los métodos de tratamiento consisten en:
- Utilizar una reacción química para convertir un compuesto tóxico en otro menos tóxico (o sin toxicidad). Por ejemplo, la reducción del cromo hexavalente a trivalente, o la oxidación del cianuro a cianato.
- Usar un proceso físico o químico, para convertir un efluente en:
– Una forma que pueda ser reciclada o reutilizada.
– Una forma que pueda ser más fácilmente transportada para su valorización o disposición final.
– Emplear un proceso físico o químico para prevenir la generación del efluente o, en todo caso, retrasar el momento de su generación.
Debido a que el rango de concentraciones de los diversos contaminantes presentes en los efluentes es muy amplio, y que los sistemas de tratamiento a utilizar tienen muy en cuenta su concentración, cabe realizar una clasificación de los mismos:
- Efluentes diluidos (aguas de enjuague): hasta 0,5-1 g/l de especies disueltas.
- Efluentes concentrados (baños agotados o contaminados): hasta 100 o más g/l de especies disueltas.
Todos los procesos de tratamiento finalistas que se relacionan a continuación generan un residuo más o menos concentrado (lodo) y, en mayor o menor cantidad. Cuanto más restrictivas sean las condiciones de un vertido, más cantidad y/o concentración del residuo final se deberá obtener. No es viable, mejorar la calidad de un efluente y a la vez reducir la cantidad o concentración del residuo final por una simple cuestión de balance de masas. Mejorar esta relación calidad efluente vs. cantidad/calidad residuo final, supondría un sobreesfuerzo económico en cuanto a equipos y operaciones que, en la mayoría de los casos, no tendrá demasiado sentido. Por ello, una tecnología que se base en concentraciones de vertido aceptables y poca producción de residuo final, será más razonable económicamente para la empresa que aquellas tecnologías que preconizan un “vertido cero” que lo único que van a conseguir es la concentración de los contaminantes en el residuo final obtenido; por este motivo, no puede considerarse, de forma generalizada, el vertido cero como una MTD.
4.19.2.1 Eliminación y/o separación de corrientes contaminantes en su origen
Para que el proceso de depuración de aguas residuales sea efectivo, es importante una correcta segregación de las corrientes residuales según los siguientes criterios:
- Diluidos
- Concentrados
- Ácidos
- Alcalinos
- Crómicos
- Cianurados
Se recomienda, asimismo, identificar, separar y tratar los efluentes que son problemáticos cuando son mezclados con otros efluentes, tales como:
- Cromatos (cromo hexavalente)
- Cianuros
- Nitritos
- Aceites y grasas
- Agentes complejantes
No enviar a la depuradora soluciones concentradas de difícil tratamiento, si no es de forma adecuada según la capacidad de tratamiento de la planta. En este sentido, cabe disponer de los medios para dosificar lentamente estos concentrados sobre los diluidos que sean compatibles.
Ejemplos de tratamientos específicos son:
- Nitritos: oxidación (o reducción), en medio ligeramente ácido.
- Cianuros: oxidación en medio alcalino.
- Cromo hexavalente: reducción en medio ácido o neutro, en función del reactivo usado.
Los enjuagues diluidos ácidos y alcalinos pueden mezclarse para conseguir una cierta neutralización del efluente y, de esta manera, ahorrar reactivos de depuración. En ocasiones muy concretas, estos enjuagues no presentan niveles en exceso de metales u otros contaminantes por lo que, pueden mezclarse, neutralizarse y verterse directamente; evidentemente, para llevar a cabo esta práctica, deberá estudiarse muy en detalle las condiciones para su vertido y controlar regularmente sus características. Esta posibilidad puede emplearse en plantas con poco arrastre y que vierten a colectores con destino final a plantas de depuración colectiva.
4.19.2.2 Oxidación de cianuros
La oxidación de cianuros a cianatos precipitables, puede conseguirse por diversos métodos:
- Oxidación:
– Hipoclorito sódico, a pH > 10.
– Peróxido de hidrógeno, a pH 10.
– Ácido peróxisulfúrico (Ácido de Caro), a pH 9.
– Oxígeno, pH entre 5-9.
– Ozono, pH entre 10-12.
– Oxidación anódica.
– Monopersulfato potásico .
– Destrucción térmica, a elevadas temperaturas (> 500 ºC a presión atmosférica). A mayores presiones (100 bar), se reducen las necesidades térmicas hasta 200 ºC. Este sistema se considera inviable económicamente para el sector.
– Oxidación asistida por radiación UV.
- Eliminación por intercambio iónico.
De todos los métodos descritos, debido a su facilidad de implantación y resultados, la gran mayoría de procesos se basan en la oxidación (química) del cianuro y, entre éstos, el más habitual es mediante hipoclorito sódico, llegándose a obtener valores de emisión en el vertido final hasta 0,2 mg/l en cianuro libre.
Un exceso de hipoclorito sódico, en presencia de materia orgánica procedente de restos de aceites, tensioactivos, etc. puede reaccionar dando lugar a los AOX, derivados orgánicos halogenados altamente tóxicos.
Tanto la destrucción térmica a elevadas temperaturas como la oxidación asistida por radiación UV no tienen ningún tipo de implantación en España en la actualidad.
4.19.2.3 Tratamiento de cromo hexavalente
Previa a la precipitación del cromo, es necesario reducirlo a la forma trivalente para luego precipitar en forma de hidróxido de cromo III.
El sistema convencional de reducción del cromo hexavalente consiste en adicionar bisulfito sódico (NaHSO3) a pH < 2,5. El reactivo genera vapores tóxicos (SOx) que afectan al lugar de trabajo. También puede emplearse la forma sulfito sódico (Na2SO3), en medio ácido. Esta técnica es ampliamente usada y permite alcanzar valores de emisión inferiores a 0,2 mg/l en el efluente final vertido.
Existe, asimismo la posibilidad de reducirlo, a pH neutro o ácido, añadiendo alguna sal de hierro II (p.e. sulfato ferroso). En ciertos casos, puede reutilizarse un baño agotado de decapado que contenga iones ferrosos, como reactivo para reducir el cromo hexavalente, reduciendo el consumo de reactivos. Al trabajar a pH neutro, se reduce la cantidad de sales neutras en el efluente con lo que se reduce la conductividad del efluente final. Además otra de las ventajas añadidas de este método es que los iones férricos (Fe (III)) que se obtiene con la reducción del cromo, son útiles como agentes coagulantes de los procesos posteriores mejorando la precipita ión de metales. En este caso, hay que tener en cuenta la presencia de iones sulfato en el efluente final, así como la mayor formación de lodos residuales.
Un sistema de reducción consiste en el uso de dióxido de azufre (SO2), en forma gaseosa, el cual se disuelve en el agua con mucha celeridad.
También es factible la utilización de ditionita sódica (Na2S2O4), potente reductor que trabaja a pH neutro.
Mucho menos utilizada es la reducción con peróxido de hidrógeno a pH < 3,5. En este caso, la aportación de sulfatos en las aguas residuales queda eliminada.
En todas las técnicas descritas, en condiciones normales de tratamiento, se consiguen valores de emisión hasta 0,2 mg/l en cromo hexavalente y hasta 2 mg/l en cromo trivalente y en cromo total.
4.9.2.4 Tratamiento de nitritos
Los nitritos pueden ser tanto oxidados a nitratos como reducidos a gas nitrógeno; ambas reacciones tienen lugar en condiciones ligeramente ácidas (pH sobre 4).
La oxidación se efectúa por vía química siendo el método más ampliamente utilizado, normalmente con peróxido de hidrógeno; también se realiza con hipoclorito sódico (con el riesgo de formación de AOX). La formación de nitratos, que aunque no presenten la toxicidad de los nitritos son un contaminante regulado por la legislación medioambiental pertinente en materia de vertidos, puede presentar problemas en su precipitación. Debido a que esta oxidación se lleva a cabo en medio ligeramente ácido, existe el riesgo añadido de formación de gases nitrosos (NOx) a la atmósfera. En el caso de utilizar hipoclorito, además, hay riesgo de formación de gases de cloro. Mediante esta técnica, se consiguen valores de emisión de nitritos inferiores a 20 mg/l, en condiciones normales.
También es posible su oxidación por aire, a pH 3-4, en presencia de catalizadores que aceleren la reacción como, por ejemplo, carbón activado.
Por su parte, en el proceso de reducción, los nitritos pasan, en primer lugar, a iones amonio, para luego pasar a N2, a pH 8-10; por este motivo, este sistema también es usado para eliminar el amonio del agua. Esta reducción se efectúa con ácido aminosulfónico, -ácido sulfámico- (NH2SO3H), a pH 3-4, lo que conlleva la presencia de importantes cantidades de sulfatos y la formación de ácido carboxílico. La misma problemática la tenemos si se usa sulfuro de hidrógeno, ya que se obtienen niveles de sulfatos altos en el agua tratada. El control sobre la reacción es bajo, por lo que se aconseja llevar a cabo el tratamiento por cargas; si las condiciones de la reacción son constantes, el final de la misma se alcanza cuando el pH se vuelve constante. Otro reactivo a utilizar son el ácido sulfámico, la urea y la ditionita sódica y los iones ferrosos. En caso de elevadas concentraciones de nitritos, el nitrógeno liberado en buena parte pasa a la atmósfera en forma de óxido de nitrógeno, por lo que es necesaria alguna medida adicional para su adecuada gestión (lavado de gases con una solución alcalina).
Valores de emisión de nitritos hasta 20 mg/l son alcanzables también con estas técnicas.
4.9.2.5 Neutralización, floculación y precipitación de metales
El efluente residual debe ser ajustado en pH, fundamentalmente, por la presencia de metales disueltos. En ocasiones, la simple mezcla de los efluentes, consigue un efecto de neutralización del pH, que podría incluso estar dentro de los límites de vertido, como ya se ha comentado. Pero, como decimos, la neutralización no es suficiente per se ya que, el objetivo básico, es la correcta precipitación de los metales disueltos ajustando el pH. Por tanto, debemos alcanzar determinado valor de pH para que la solubilidad de los hidróxidos metálicos precipitados sea mínima.
Cuando se plantea la neutralización del efluente, por tanto, ésta debe referirse al concepto “neutralización-precipitación”.
La precipitación de los metales se lleva a cabo ajustando el pH al valor óptimo de precipitación del metal en cuestión. Debido a la gran cantidad de metales que se combinan en un efluente, en determinadas empresas con muchos procesos diferentes, es necesario hallar un pH adecuado para la mayoría de ellos. En otro caso, sería necesario su segregación y tratamiento independiente.
Los metales precipitan en forma de hidróxido metálico, a pH’s que oscilan desde 3,5-11. Por lo general, se obtienen mejores resultados de precipitación mezclando metales de diferentes características. En algunos casos, si se supera el pH óptimo de precipitación del metal, puede suceder que éste se redisuelva en el efluente. Este fenómeno tiene lugar si se utiliza hidróxido sódico como precipitador; con hidróxido cálcico este fenómeno no es tan común. En la tabla siguiente, se facilitan valores óptimos de pH (teóricos) de precipitación para algunos metales, así como valores de pH por encima de los cuales se produce el problema de la redisolución, tanto para el hidróxido sódico (sosa) como para el hidróxido cálcico (lechada de cal).
En el caso del hierro, éste lo podemos encontrar tanto en forma ferrosa (Fe++) como férrica (Fe+++), siendo los pH’s óptimos de precipitación diferentes entre ellos: 9-12 para la forma ferrosa y 4-4,5 para la férrica; por otro lado, los hidróxidos ferrosos sedimentan mal; en la práctica, buena parte del hierro está oxidado (gracias a la agitación y aireación de los efluentes) a la forma férrica, aunque hay que tener en cuenta estos factores de cara a su correcta precipitación.
La siguiente tabla recoge estos valores:
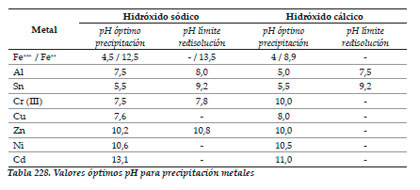 |
Tal y como se desprende de estos valores, algunos metales presentan unos márgenes de precipitación muy estrechos si tenemos en cuenta, por un lado, la necesidad de formación del hidróxido precipitable y, por otro, evitar su redisolución (Al, Cr y Zn). En estos casos, la realización de tratamientos de precipitación por fases puede ser indispensable para conseguir sedimentar eficazmente el mayor número de especies químicas.
En general, se obtienen mejores resultados de precipitación en presencia de dos o más metales diferentes en el efluente. Por este motivo, el valor óptimo de pH de neutralización-precipitación del efluente, deberá determinarse empíricamente. Ello se debe a:
- La formación de cristales mixtos, especialmente cuando están presenten varios metales divalentes.
- La formación de compuestos, sobretodo entre un metal divalente y otro trivalente.
- La adsorción de los metales sobre los que ya han precipitado a pH inferior, en particular la adsorción de iones metálicos divalentes sobre los hidróxidos de un metal trivalente.
Es decir, los valores de solubilidad de los diferentes metales se ven modificados por la co-precipitación de metales. De hecho, por este motivo, algunas plantas de tratamiento de aguas residuales, disponen de una etapa de coagulación en la que se aporta una sal metálica (cloruro férrico, sulfato ferroso, sulfato de alúmina, etc.) que favorece la precipitación de los metales presentes en el efluente. Con este sistema, se consigue acelerar la sedimentación de los metales precipitados.
Una vez se ha alcanzado el pH de tratamiento del agua residual, se ha constatado un fenómeno colateral que es un cierta recuperación del pH (el agua tiene una cierta tendencia a acidificarse), sobretodo al cabo de las 2 horas siguientes a la neutralización-precipitación. Este fenómeno que, como veremos tiene su importancia en la solubilidad de los metales precipitados, se debe en esencia a:
- Las sales básicas que se han formado inicialmente, van transformándose lentamente en hidróxidos, debido al elevado pH obtenido al finalizar la neutralización; esta transformación consume iones OH- que es la responsable del descenso del pH.
- El reactivo alcalino utilizado en la neutralización, es adsorbido sobre la superficie de los hidróxidos formados, con lo que el pH desciende.
- Los metales son oxidados a su mayor estado de valencia, liberando H+ como resultado y, por tanto, acidificando el medio.
Este ligero descenso del pH, afecta favoreciendo la solubilidad de los metales, por lo que es importante tenerlo en cuenta en relación al vertido final.
Para ayudar en el proceso de precipitación es común, además del uso de sales metálicas, el empleo de otros compuestos que favorecen su separación; entre estos compuestos podemos referir componentes orgánicos (polielectrolitos aniónicos (floculantes)) con carga eléctrica.
Su dosificación contribuye a generar más lodos, puesto que además del propio aporte del reactivo, ayudan a precipitar más los metales presentes en el agua, aunque, como ventajas, no aportan conductividad al efluente depurado.
Los hidróxidos así formados son decantados y filtrados, habitualmente, mediante filtro-prensas. Los lodos desecados (con un 60-65 % de humedad, aproximadamente) deben ser almacenados y gestionados de forma externa. En pequeñas instalaciones de depuración, es factible utilizar otros equipos de filtración y secado como, por ejemplo, sacos o bolsas filtrantes, etc., aunque el rendimiento de secado es inferior.
Si la precipitación de metales con hidróxidos no es suficiente, existe la posibilidad de precipitarlos con sulfuro de sodio, puesto que la solubilidad del sulfuro de metal es considerablemente más baja que la del hidróxido. De todas formas, este método no se utiliza prácticamente puesto que los niveles de precipitación con hidróxido son, por lo general, adecuados y la manipulación y uso del sulfuro es dificultosa y requiere de técnicas para limitar la presencia de sulfuros en las aguas (el sulfuro es tóxico) o de formación de gases (sulfuro de hidrógeno) en medio ácido.
Como normas para establecer un buen sistema de precipitación, se recomienda seguir el siguiente esquema:
- Seleccionar el pH óptimo (teórico) según la composición y concentración en metales del efluente a tratar; para ello, hay que alcanzar un valor de compromiso para el conjunto de metales, teniendo especial atención al fenómeno de redisolución para algunos metales, así como la posterior acidificación del agua.
- De acuerdo con lo anterior, es importante seleccionar el reactivo de neutralización-precipitación más adecuado; por ejemplo, si es necesario alcanzar un valor de pH alto para obtener una correcta precipitación del conjunto de metales y, alguno de ellos tiene tendencia a redisolverse usando sosa, puede emplearse la cal si con ella no tiene lugar este fenómeno. También cabe tener en cuenta que, algunos metales precipitan a pH inferior con cal que con sosa.
- Si coexisten en el efluente diversos metales, puede ser que tenga lugar una disminución de la solubilidad. La presencia de metales fácilmente precipitables favorece la precipitación de los más difíciles.
- A medida que aumenta la concentración de sales neutras (p.e. NaCl), también lo hace la solubilidad residual de los iones metálicos. Este aspecto es solucionable incrementado el pH de neutralización, esto es, aportando OH-.
- Como se ha dicho, siempre tener en cuenta la disminución de pH que tiene lugar tras la neutralización-precipitación. En otro caso, existe el riesgo de que tenga lugar cierta redisolución de aquellos hidróxidos metálicos más fuertemente básicos. Para compensar este ligero descenso del pH, es recomendable superar un poco el valor de precipitación recomendable.
Al margen de estas orientaciones, se vuelve a insistir en el hecho de realizar un estudio empírico a fondo, y así establecer los parámetros de funcionamiento óptimos de cada caso.
En ciertos casos, se precisa de sistemas de afino para garantizar un vertido en condiciones adecuadas, especialmente, en vertidos directos a cauce público o al mar. Entre los sistemas más utilizados se hallan el filtrado sobre lecho de arena y la utilización de resinas selectivas para eliminar determinados metales. En ocasiones, también es recomendable un control final de pH con ajuste automático de reactivo.
La instalación de tratamiento tiene un coste de inversión alto y requiere de espacio, formación del personal y de control y mantenimiento. Para facilitar su funcionamiento y garantizar un correcto proceso de depuración, es aconsejable automatizar todo el proceso.
Rangos de emisión asociados a estas técnicas para los diversos metales, en condiciones normales de tratamiento, se facilitan a continuación:
- Fe: ≤ 10 mg/l
- Pb: 0,05-0,5 mg/l
- Al: 1-10 mg/l
- Sn: 0,2-2,0 mg/l
- Cu: 0,2-5,0 mg/l
- Zn: 0,2-5,0 mg/l
- Ni: 0,2-5,0 mg/l
- Ag: 0,1-0,5 mg/l
- Cd: 0,1-0,2 mg/l
Es importante tener en consideración, como se ha visto, que estos valores de emisión dependen, no sólo del proceso de neutralización y precipitación en sí, sino también de las interacciones entre los diferentes metales, aniones y resto de compuestos presentes en el efluente a depurar. Una técnica que, en determinadas condiciones puede ser efectiva, en otras puede mostrarse menos eficaz o, incluso, inútil.
4.19.2.6 Electrocoagulación/floculación electrolítica
El proceso consiste en obtener iones férricos, que actuarán como coagulantes/floculantes, mediante la instalación de una célula electrolítica en la que, unos ánodos de hierro aportan los iones metálicos al sistema de depuración. Con esta técnica se reduce la aportación de sales al efluente, a pesar de la adición de cloruro sódico en la celda de reacción, con lo que es especialmente indicada en caso de problemas de conductividad del efluente depurado. Los valores de emisión obtenidos son del mismo rango que en el caso anterior.
4.19.2.7 Agentes complejantes
Como ya se ha referido anteriormente, la presencia de algunos agentes complejantes en determinados baños de proceso (desengrases, decapados y otros), dificulta enormemente la precipitación de los metales afectados dificultando, en gran medida, el alcance de los valores de emisión referidos. Entre los principales agentes complejantes citamos los siguientes: cianuros, polifosfatos, aminas, ácidos orgánicos débiles (cítrico, tartárico, etc.), amonio, EDTA, NTA y Quadrol (etilendiamino).
En general, existe toda una gama de productos comerciales, más o menos adecuados, para actuar en estas condiciones; la mayoría de estos productos son en base de sulfuro.
Básicamente, como métodos de tratamiento existen los siguientes:
- Precipitación del metal usando productos especiales.
- Eliminación del metal mediante su reducción a estado elemental.
- Oxidación del complejante.
- Precipitación del complejo.
- Tratamiento térmico (no es usado en la práctica).
A continuación, se proponen algunas alternativas concretas para conseguir la correcta precipitación del metal; la viabilidad de cada técnica deberá ensayarse previamente, según las características de cada caso:
- Alcalinizar (hasta pH 11) el agua; este sistema es factible cuando el complejo metálico es débil (p.e. en presencia de amoniaco o de complejos con aminas o pirofosfatos); un ejemplo de este tipo de tratamiento son la precipitación del níquel o del cobre en soluciones que contienen complejos amínicos.
- Alcalinizar el agua y añadir sales de hierro (II); tiene el mismo efecto que en el caso anterior, pero la presencia del hierro amplia su espectro de aplicación a otros complejantes más fuertes, tales como NTA y EDTA o Quadrol; un caso muy claro de aplicación es para el cobre.
- Más recientemente, han aparecido en el mercado un conjunto de productos comerciales que contribuyen de forma efectiva a la precipitación de los metales complejados; la mayoría de estos productos son en base sulfuro; en este sentido, bajo unas condiciones apropiadas de tratamiento, el sulfuro de sodio permite la precipitación metálica de complejos con pirofosfato, poli fosfatos, TEA, EDTA y ácido glucónico.
- Algunos compuestos como son la TMT (trimercaptotriazina) y otros, ofrecen también buenos resultados de precipitación de metales complejados, a pH 7-10, aunque la dosis normal del producto es elevada (490 ml de TMT por equivalente del ión metal) y su precio también es alto. En el caso de agentes complejantes más fuertes (p.e. EDTA), es preferible trabajar a pH ligeramente ácido (3-4), adicionando en primer lugar sales de hierro (III), (p.e. cloruro férrico); Posteriormente, se añade el TMT y se precipitan los metales.
- Los ditiocarbamatos son un conjunto de organosulfuros que han demostrado una gran efectividad en la precipitación de metales complejados, concretamente, el dimetilditiocarbamato (DMDTC); con este producto, el cobre puede ser precipitado, independientemente del complejante; otros metales que también responden al tratamiento son el níquel, el zinc y el cadmio.
- Tratamiento de los complejos metal-cianuro: los complejos de Cu, Zn y Cd son relativamente fáciles de oxidar con alguna de las reacciones expuestas en el apartado de eliminación de cianuros. Los complejos con Ni son mucho más difíciles de destruir requiriendo de mayores dosis de oxidante y de mucho más tiempo de reacción (hasta horas de tratamiento). Los complejos con hierro no pueden oxidarse y lo único que puede hacerse es su precipitación en forma de ferrocianuro ferroso, ferrocianuro férrico o ferricianuro ferroso, gracias a la dosificación de sales ferrosas; habrá que tener en cuenta que, al no haber oxidado los cianuros éstos aparecerán en los lodos residuales.
- Fluoruros: los complejos de fluoruros con boro, aluminio o sílice, no precipitan con hidróxido cálcico.
- La reducción del metal a su estado elemental puede conseguirse mediante diversas técnicas:
– Uso de agentes reductores fuertes: hipofosfito de sodio (NaH2PO2), formaldehído (HCHO), ditionita (Na2S2O4).
– Reducción catódica: se produce la reducción del metal y la oxidación del complejante; esta alternativa está poco desarrollada y no tiene gran aplicación en este momento, como veremos a continuación.
- También existen técnicas de reducción mediante la oxidación del complejante:
– Oxidación anódica: especialmente para los complejos de EDTA, con control de pH; como inconvenientes, tenemos que el tiempo de reacción es muy largo y el consumo energético alto.
– Oxidación por ozono: es mucho más rápida que el caso anterior; también es útil para complejantes fuertes como el EDTA; el proceso tiene mayor rendimiento a pH ligeramente ácido, con un menor consumo de ozono.
– Oxidación con peróxido de hidrógeno: también aplicable para complejantes fuertes (NTA); suele combinarse con radiación por UV.
Por último, citar el empleo cada vez mayor de resinas de intercambio iónico específicas: diversos fabricantes de resinas disponen de resinas selectivas para retener complejos metálicos; estas resinas son de tipo catiónico. Hay que estudiar cada caso concreto, pues la presencia de algunos complejantes fuertes (EDTA y NTA) dificulta su aplicación. En el caso de utilizar una resina selectiva, hay que tener en cuenta que, si se regenera in situ se deberá almacenar y gestionar externamente en forma de residuo peligroso; existe también la posibilidad de gestionar externamente la resina, a través de alguna empresa gestora autorizada.
Con estas técnicas, en mayor o menor grado y, salvando las dificultades, pueden alcanzarse los valores de emisión anteriormente referidos a cada metal (véase el apartado 4.19.2.5.).
4.19.2.8 Precipitación de aniones
Además de los metales, es preciso precipitar los aniones adecuadamente, según los siguientes tratamientos:
- Fluoruros con hidróxido cálcico, a pH 11,5, que se corresponde con una concentración de iones fluoruro de 7,3 mg/l; no precipitan cuando están complejados con B, Al o Si; también se dificulta su precipitación cuando existen iones amonio en el efluente. En la práctica, raramente se consigue bajar de 60 mg/l de F-. Su precipitación se favorece en presencia de otros hidróxidos, o sales de hierro (III); por ejemplo, utilizando un exceso de sales neutras de calcio (CaCl2), en determinadas condiciones, puede reducirse su concentración a valores cercanos a los 20 mg/l. Los fluoruros los encontramos en baños de decapado, matizado, etc. ácidos; al tratar los fluoruros, hay que gestionarlos a pH no demasiado ácidos, para evitar que actúen sobre algunos elementos de control de la instalación, en concreto, sobre el vidrio; los fluoruros, en medio ácido actuarán sobre este material, decapándolo lentamente lo que, al final se traducirá en el deterioro, por ejemplo, de los electrodos de control (pH y mV).
- Fosfatos con hidróxido cálcico, a pH >10; a este pH, la concentración de fosfatos se sitúa por debajo de 20 mg/l. La utilización de co