Evaluación ecotóxica y genotóxica de aguas residuales hospitalarias
Resumen
Los líquidos residuales provenientes de hospitales constituyen un riesgo potencial para los ecosistemas y la salud humana debido a la presencia de compuestos tóxicos y genotóxicos. El objetivo de este trabajo fue analizar la toxicidad y la genotoxicidad de los efluentes provenientes del Hospital de Clínicas José de San Martín (Buenos Aires). Las muestras del efluente se tomaron durante los días y horarios de mayor actividad del hospital y se separaron en dos fracciones: acuosa y orgánica (extractos). Los ensayos de toxicidad se realizaron en la fracción acuosa utilizando dos especies de algas verdes: Pseudokirchneriella subcapitata y Chlorella vulgaris. La genotoxicidad se evaluó en las dos fracciones mediante el ensayo de Salmonella/ microsomas en ausencia y presencia de mezcla S9, utilizando las cepas TA98 y TA100. Veintinueve muestras de un total de 53 muestras analizadas resultaron tóxicas para P. subcapitata (entre 18 y 55 % de inhibición), mientras que sólo 8 muestras lo fueron para C. vulgaris (entre 21 y 50 % de inhibición). Ninguna de las muestras resultó genotóxica para Salmonella, ni en los extractos ni en las fracciones acuosas. De los tres ensayos utilizados, P. subcapitata fue el más sensible, siendo el ensayo más apropiado para el monitoreo de estos efluentes.
Palabras claves: Efluentes hospitalarios; P. subcapitata; C. vulgaris; Test de Ames.
INTRODUCCIÓN
Los líquidos residuales generados en los centros de salud contienen una amplia variedad de sustancias químicas, entre las que se encuentran varios productos farmacéuticos no metabolizados o parcialmente metabolizados por los pacientes, radioisótopos, solventes y desinfectantes, los cuales son utilizados en internación, y en actividades de diagnóstico, desinfección e investigación (Kümmerer 2001; Emmanuel y col. 2005). Uno de los principales problemas ambientales causados por los efluentes hospitalarios es su descarga en los sistemas cloacales urbanos sin un tratamiento previo y, finalmente, en las aguas superficiales (Gupta y col. 2009). En la actualidad son bien conocidos los efectos tóxicos de varias concentraciones de fármacos y desinfectantes sobre los organismos acuáticos (Pro y col. 2003; Ferrari y col. 2004; Sano y col. 2005; Liu y col. 2011), muchas de las cuales podrían estar presentes en los líquidos residuales hospitalarios constituyendo un riesgo potencial para el balance biológico natural de los ecosistemas acuáticos (Santos y col. 2010). En particular, las algas fotosintéticas son de importancia en estos ecosistemas, ya que representan la base de la cadena trófica y cualquier alteración en la abundancia y composición de esta comunidad puede ocasionar efectos severos en los organismos de niveles superiores (por ejemplo, el zooplancton herbívoro). Una reciente revisión destaca la importancia de las algas fitoplanctónicas en la detección de los efectos ecotoxicológicos de bajas concentraciones de algunos fármacos encontrados en muestras ambientales (Blaise y col. 2006).
La genotoxicidad producida por los efluentes hospitalarios ha sido bien documentada (Ohe y col. 2004; Jolibois y Guerbet 2005; Ferk y col. 2009; Gupta y col. 2009;), generalmente mediante el ensayo de Ames que utiliza cepas mutadas de Salmonella typhimurium (Maron y Ames 1983). Las drogas antineoplásicas (citostáticos), por ejemplo, tienen una baja biodegradabilidad en el ambiente (Kümmerer y col. 2000) y son capaces de interferir en la estructura y función del ADN produciendo efectos citotóxicos, genotóxicos, mutagénicos, carcinogénicos o teratogénicos en los organismos (Kümmerer y col. 2000; Jolibois y col. 2003; Zounkova y col. 2010). Asimismo, los antibióticos merecen una especial atención debido a su actividad biológica y potencial ecotoxicológico sobre varios organismos, tales como las algas y los microcrustáceos, afectando el crecimiento y los procesos fisiológicos (Berto y col. 2009; Turkdogan y Yetilmezsoy 2009; Liu y col. 2011).
En el área de la Ciudad Autónoma de Buenos Aires, Argentina, las aguas residuales procedentes de los centros de salud son vertidas directamente al sistema cloacal, sin un proceso de tratamiento previo. Esta mezcla de líquidos cloacales es direccionada hacia el Río de la Plata a través del sistema cloacal municipal, alcanzando una dilución por arrastre (Instituto Nacional del Agua 2011) cuyos efectos ecotoxicológicos son difíciles de predecir. Este río es la principal fuente de abastecimiento de agua potable para una población de aproximadamente 10 millones de habitantes; por este motivo, es de suma importancia efectuar aportes para el estudio de los riesgos que podrían representar los contaminantes presentes en los efluentes hospitalarios sobre este sistema fluvial.
Para realizar este trabajo se utilizó agua cloacal proveniente del Hospital de Clínicas José de San Martín, Hospital Escuela de la Universidad de Buenos Aires, que cuenta con 130.000 metros cuadrados cubiertos de superficie. Es un hospital de alta complejidad, con un ámbito geográfico de acción muy amplio, cuyos pacientes son habitantes de la Ciudad de Buenos Aires y de los municipios vecinos. El número de camas-día disponibles para el uso de pacientes internados, actualmente es de 401 camas. El consumo de agua por día, estimado por la comisión de ingeniería del hospital teniendo en cuenta el volumen del tanque reservorio, es de aproximadamente 705 metros cúbicos (Paz y col. 2004). Debido a que las aguas residuales de los hospitales pueden contener diferentes compuestos químicos que afecten de manera indirecta a los ecosistemas acuáticos, tal como lo describen diferentes autores (Jolibois y Guerbet 2005; Gupta y col. 2009; Santos y col. 2010), es esperable que la mezcla compleja de compuestos pueda presentar efectos tóxicos y/o genotóxicos sobre el ambiente, aunque dichos compuestos se encuentren en pequeñas cantidades.
El objetivo de este trabajo fue analizar la ecotoxicidad y la genotoxicidad de los efluentes provenientes del Hospital de Clínicas José de San Martín mediante bioensayos de inhibición del crecimiento algal con dos especies de algas verdes (Pseudokirshneriella subcapitata y Chlorella vulgaris) y ensayos de genotoxicidad con Salmonella typhimurium (Test de Ames).
MATERIALES Y MÉTODOS
Toma de las muestras
El sitio de toma de las muestras fue la cámara cloacal ubicada en el sector Azcuénaga del Hospital de Clínicas José de San Martín que corresponde a los servicios de quirófanos, trasplante, quimioterapia, hematología, infectología, laboratorio de inmunogenética y farmacia (Paz y col. 2004). Debido a la variabilidad en la composición, caudal y concentración del líquido cloacal durante el día, se tomaron muestras sucesivas con intervalos de 2 horas entre las 9 y las 15 horas, que es la franja horaria de mayor actividad del hospital. Los muestreos se realizaron mensualmente entre
marzo y septiembre de 2010, durante los cinco días hábiles de la semana. Se colectaron 2 litros de efluente hospitalario en cada horario, los que luego se mezclaron y homogeneizaron para obtener una muestra compuesta representativa de 8 litros, correspondiente a cada día. Se midió el cloro residual de las muestras de cada horario in situ, mediante el método DPD (N,N-dietil-para-fenilendiamina) (American Public Health Association y col. 1992). En aquellos horarios en los que se midieron concentraciones de cloro residual, se separaron aproximadamente 600 ml adicionales de muestra (muestras individuales) para realizar los ensayos biológicos. En el laboratorio se midieron el pH y el cloro residual de la muestra compuesta de cada día. Alícuotas de 10 ml de cada muestra se filtraron a través de membranas de 0,22 μm y se preservaron a -20 ºC para realizar los ensayos de toxicidad y genotoxicidad.
Ensayo con algas
Los ensayos de toxicidad se realizaron con las muestras filtradas (0,22 μm) utilizando dos especies de algas verdes: P. subcapitata y C. vulgaris. Se utilizó la metodología de microplacas de 96 pozos (Environmental Canada 2007), manteniendo los cultivos a 22 ± 2 ºC, en agitación constante (100 revoluciones/min) y luz fluorescente “blanco-fría” (3000 luxes/ cm2) continua. Los ensayos se realizaron con cuatro réplicas, en un volumen de 200 μl por pozo de la muestra filtrada enriquecida previamente con nutrientes del medio algal Bold’s Basal Medium (Archibald y Bold, 1970), y con una densidad algal inicial de 5 x 104 células/ml obtenida a partir de cultivos en fase de crecimiento exponencial. El crecimiento algal luego del ensayo se estimó a las 96 horas mediante lecturas de absorbancia a 650 nm. Los controles crecieron en el medio Bold’s Basal Medium.
A partir de los resultados de absorbancia se calcularon los porcentajes de inhibición (%I) de aquellas muestras que mostraron diferencias significativas con respecto al control, según 100 x (Control – Muestra)/Control.
Ensayo de Ames
Para evaluar la genotoxicidad de las muestras, se utilizaron las cepas TA98 y TA100 de S. typhimurium, las cuales permiten determinar sustitución de pares de bases y corrimientos en el marco de lectura de la molécula de ADN, respectivamente. Se realizó el ensayo de incorporación en placa utilizando 2 ml de topagar fundido y mantenido a 45ºC en baño, al cual se agregaron sucesivamente 0,1 ml de la muestra a ensayar, 0,1 ml de un caldo de cultivo conteniendo entre 107 y 108 células/ml de la cepa bacteriana correspondiente y 0,5 ml de solución reguladora de fosfato ó 0,5 ml de
fracción microsomal (mezcla S9). El contenido de los tubos así preparados se mezcló y volcó inmediatamente en placas de Petri que contenían sobre la superficie 15 ml de medio mínimo suplementado con glucosa y sales de Vogel-Bonner. Se analizaron las muestras filtradas y los extractos etéreos reconstituidos y concentrados 100 veces en DMSO (extractos).
Los ensayos se realizaron con y sin mezcla S9, la cual fue preparada en el laboratorio según la técnica descrita por Mortelmans y Zeiger (2000). Como controles negativos se utilizó agua destilada estéril o DMSO, según la muestra a analizar, y como controles positivos se utilizaron 5 μg/placa de azida sódica (AS) (CAS Nº 26628-22-8) para la cepa TA100 y 10 μg/placa de 2-aminofluorene (2AF) (CAS Nº 153-78-6) para ambas cepas con fracción microsomal. El ensayo indica mutagenicidad cuando el número de unidades formadoras de colonias (UFC) en las placas conteniendo la muestra duplica las UFC en las placas del control.
Análisis estadísticos
Los %I en los ensayos algales se calcularon para las muestras cuya densidad algal promedio mostró diferencias significativas con respecto al control (P<0,05) utilizando ANOVA de un factor (Sokal y Rohlf 1979). Para establecer las correlaciones entre los %I del crecimiento algal y la cantidad de cloro residual presente en las muestras, se utilizó la matriz de correlación de Pearson con un P<0,05. RESULTADOS Y DISCUSIÓN
El pH de las muestras fue siempre levemente ácido y cercano a 6,0. De las 53 muestras analizadas, 37 presentaron cloro residual en concentraciones que oscilaron entre 0,1 y 2,0 ppm (Tabla 1).
Los bioensayos algales permiten estimar tanto
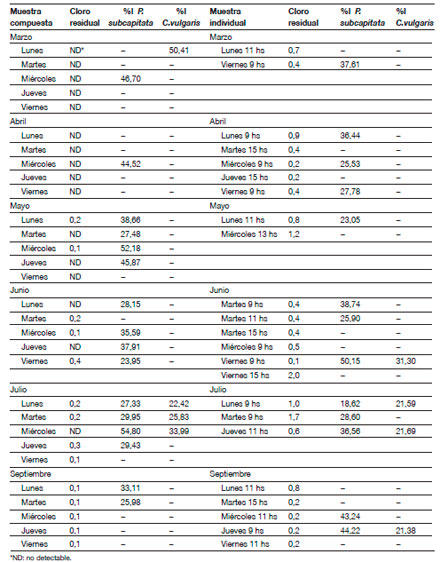 Tabla 1. Porcentajes de inhibición del crecimiento algal (%I) otenidos para P. subcapitata y C. vulgaris en las muestras compuestas y en las submuestras con cloro residual (ppm). En algunas muestras compuestas también se encontró cloro residual. |
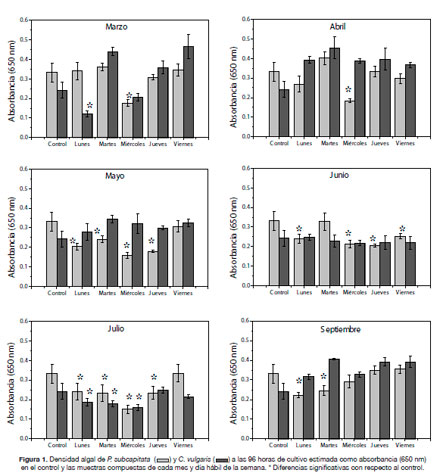
la presencia de sustancias tóxicas que inhiben el crecimiento, como la presencia de sustancias, por ejemplo nutrientes, que lo estimulan (Miller y col. 1978). El crecimiento algal de P. subcapitata y C. vulgaris a las 96 horas de cultivo en las muestras compuestas mostró tanto inhibición como estimulación del crecimiento (Figura 1), lo cual revela la presencia de ciertos compuestos tóxicos, como así también la presencia de nutrientes (probablemente fosfatos provenientes de detergentes). La respuesta fue diferente para ambas especies de algas verdes, observándose mayor inhibición en el
crecimiento de P. subcapitata con respecto a C. vulgaris. En los meses de mayo, junio y julio se observó mayor inhibición del crecimiento algal que en los otros tres meses debido a que se observaron diferencias significativas con respecto al control en la mayoría de los días hábiles (P<0,05). En cuanto a los días de la semana, en general los días lunes y miércoles mostraron una mayor toxicidad con respecto al resto, principalmente sobre P. subcapitata (Figura 1).
De las 53 muestras totales analizadas, 29 resultaron tóxicas para P. subcapitata, cuyos %I oscilaron entre 18,62 y 54,80, mientras que sólo 8 muestras fueron tóxicas para C. vulgaris, cuyos %I oscilaron entre 21,38 y 50,41 (Tabla 1). Las muestras individuales tomadas en cada horario (entre las 9 y las 15 hs) en las que se encontró cloro residual, fueron analizadas separadamente, debido a que algunos compuestos tóxicos y genotóxicos, tales como el triclorometano y los organoclorados alifáticos y aromáticos podrían formarse por el contacto del hipoclorito de sodio (NaOCl) con la materia orgánica durante las tareas de limpieza (Emmanuel y col. 2004). Por otra parte, el hipoclorito de sodio puede resultar tóxico para varios organismos acuáticos, tales como microcrustáceos, peces y moluscos en concentraciones de hasta 1 mg/l, y modificar la composición específica de comunidades fitoplactónicas en concentraciones de entre 0,05 y 0,15 mg/l (Emmanuel y col. 2004).
Varias de las muestras que contenían cloro residual mostraron inhibición del crecimiento algal, especialmente en P. subcapitata (Figura 2).
Sin embargo, no se observó una correlación positiva entre los valores de cloro residual y los %I obtenidos, lo cual indicaría que existen otros agentes tóxicos presentes en las muestras, diferentes a los que podrían producirse en presencia del cloro. Por otra parte, la concentración de cloro residual en las muestras compuestas (en las que se mezclan las aguas colectadas en todos los horarios) se encuentra reducida o desaparece, sin embargo los %I, en muchos casos aumentan. Esto pudo observarse, por ejemplo, en los días miércoles de abril, miércoles y jueves de mayo y junio, y miércoles de julio (Tabla 1).
Las aguas residuales de establecimientos hospitalarios pueden contener compuestos capaces de dañar a la molécula de ADN, tales como ciertos desinfectantes (Monarca y col. 2000) y citostáticos (Kümmerer 2001; Zounkova y col. 2010) sin que esto signifique una violación a los protocolos establecidos en los hospitales.
Ciertas cantidades de citostáticos no metabolizados y sus metabolitos son liberados a través de las excretas de los pacientes internados a las aguas cloacales (Heberer 2002). Por ejemplo, investigaciones realizadas en países desarrollados encontraron residuos de drogas citostáticas en concentraciones mayores a 1 μg/l así como efectos genotóxicos en muestras de efluentes hospitalarios (Jolibois y col. 2003; Jolibois y Guerbet 2005). Sin embargo, ninguna de las muestras del Hospital de Clínicas mostró genotoxicidad para S. typhimurium.
Algunas muestras compuestas filtradas resultaron tóxicas para la cepa TA100 (Tabla 2): día viernes de mayo (sin mezcla S9), días jueves y viernes de julio (con mezcla S9), así como las muestras filtradas individuales con cloro residual (Tabla 3): lunes y miércoles de mayo (sin mezcla S9), lunes, martes y jueves de julio (con mezcla S9). La muestra clorada del jueves de julio también fue tóxica para TA98 con fracción microsomal. La mayoría de estas muestras también resultaron tóxicas para P. subcapitata (Tabla 1). De los extractos, solamente los obtenidos en las muestras compuestas del viernes de marzo, y lunes y martes de abril resultaron tóxicas para la cepa TA100 con fracción microsomal (Tabla 2). Existen pocos datos documentados sobre los efectos combinados de fármacos en algas, pero en bacterias se han reportado efectos tóxicos sinérgicos de ciertos antibióticos con otras drogas de uso común en hospitales como los citostáticos (Kümmerer y Al-Ahmad 1997). No se descarta la posibilidad de que varios compuestos de la mezcla compleja de estos efluentes estén actuando de manera sinérgica produciendo efectos tóxicos sobre las algas debido a los altos %I obtenidos en el presente trabajo. Asimismo, un posible componente en estos efluentes como el glutaral
 |
dehído de amplio uso en actividades de desinfección, podría resultar tóxico para las algas en concentraciones entre 1,0 y 2,5 mg/l (Sano y col. 2005). Si bien el efecto de dilución de estos efluentes en aguas del Río de la Plata resulta considerable, es sabido que varios fármacos, tales como los analgésicos, antibióticos, hormonas, psicofármacos y citostáticos, entre otros, pueden encontrarse dentro del rango de concentraciones de ng/l a μg/l en aguas superficiales (Kümmerer 2001). Por otra parte, muchos de estos compuestos presentan baja biodegradabilidad en el ambiente, como por ejemplo los antibióticos del tipo quinolonas, nitroimidazoles, sulfamidas (Ingerslev y Halling-Sorensen 2000) y los citostáticos (Kümmerer 2001).
La gran diversidad de actividades en el hospital de Clínicas José de San Martín genera un efluente con posibles efectos ecotoxicológicos sobre el ambiente. Estos tipos de efluentes constituyen mezclas complejas de sustancias cuya actividad tóxica y genotóxica dependerá de las interacciones sinérgicas y antagónicas que puedan ocurrir entre sus distintos componentes.
En general, las bajas concentraciones de ciertos agentes tóxicos pueden ser químicamente no detectables por métodos analíticos lo que hace necesaria la utilización de sistemas biológicos para su detección.
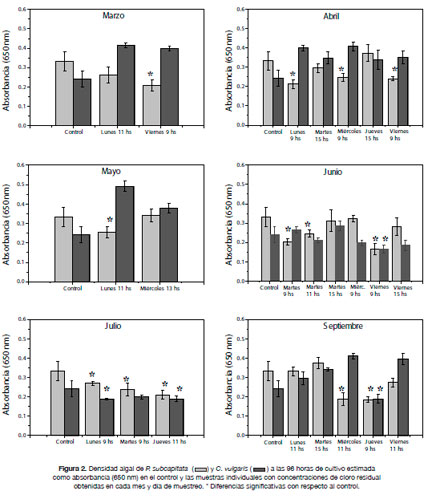 |
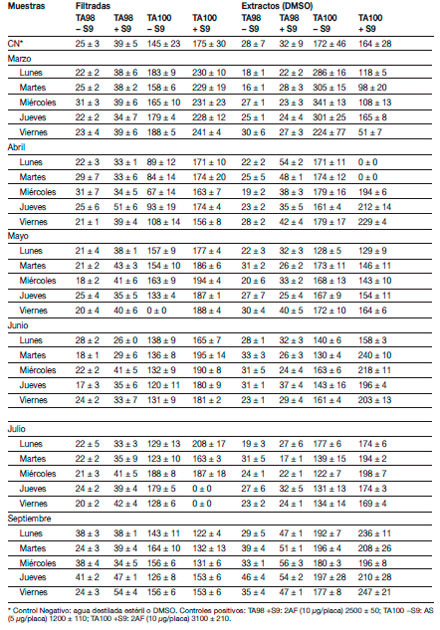 Tabla 2. Análisis de mutagenicidad de Salmonella/microsomas, en ausencia (−S9) y presencia (+S9) de activación metabólica en las muestras filtradas y en los extractos etéreos XAD-2 de cada día. |
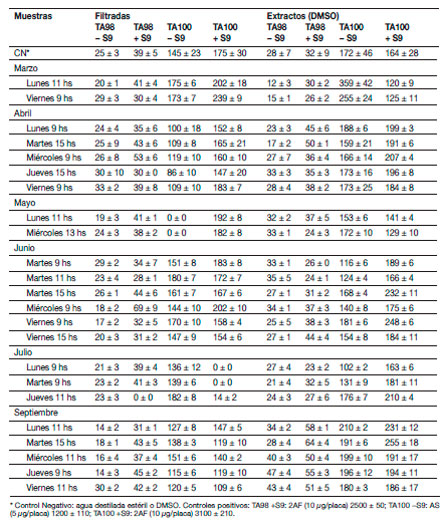
Tabla 3. Análisis de mutagenicidad de Salmonella/microsomas, en ausencia (−S9) y |
CONCLUSIONES
Más del 50 % de las muestras del efluente del Hospital de Clínicas José de San Martín resultaron tóxicas para P. subcapitata lo que sugiere un potencial riesgo ecotoxicológico para las aguas receptoras del Río de la Plata. Sin embargo, estos efluentes no presentaron riesgo genotóxico en sus componentes polares y no polares. De los tres ensayos utilizados, el ensayo algal con P. subcapitata fue el más sensible, y podría utilizarse en futuros estudios de
monitoreo y de tratamiento de líquidos residuales hospitalarios.
Agradecimientos: Este trabajo fue realizado con el apoyo de la Universidad de Buenos Aires, Secretaría de Ciencia y Técnica, UBACyT N° B035.
BIBLIOGRAFÍA CITADA
American Public Health Association, American Water Works Association y Water Pollution Control Federation. Métodos normalizados para el análisis de aguas potables y residuales. 17ª Edicion. Ed. Díaz de Santos, S.A. Madrid. 1992.
Archibald P.A., Bold H.C. Phycological studies. XI. The Genus Chlorococcum Meneghini. Univ. Texas Public., N°7015, Austin, Texas. 1970.
Berto J., Rochenbach G.C., Barreiros M.A.B., Corrêa A.X.R., Peluso-Silva S., Radetski C.M. Physico-chemical, microbiological and ecotoxicological evaluation of a septic tank/Fenton reaction combination for the treatment of hospital wastewaters. Ecotoxicology and Environmental Safety. 2009;72:1076-1081.
Blaise C., Gagné F., Eullaffroy P., Férard J.F. Microplate toxicity tests with microalgae: a review. En: Wells P., Lee K., Blaise C., editors. Microscale Testing in Aquatic Toxicology. Advances, Techniques and Practice. CRC Press, Boca Raton, USA, 2006; 269-288.
Emmanuel E., Keck G., Blanchard J.M., Vermande P., Perrodin Y. Toxicological effects of disinfections using sodium hypochlorite on aquatic organisms and its contribution to AOX formation in hospital wastewater. Environmental International. 2004;30:891-900.
Emmanuel E., Perrodin Y., Keck G., Blanchard J.M., Vermande P. Ecotoxicological risk assessment of hospital wastewater: a proposed framework for raw effluents discharging into urban sever network. Journal of Hazardous Materials. 2005;117:1-11.
Environmental Canada. Biological test method: Growth inhibition test using a freshwater algae. EPS 1/RM/25 Second Edition. 2007; 53 p. Ferk F., Mišík M., Grummt G., Majer B., Fuerhacker M., Buchmann C., Vital M., Uhld M., Lenz K., Grillitsch B., Parzefall W., Nersesyan A., Knasmüler S. Genotoxic effects of wastewater from an oncological ward. Mutation Research. 2009;672:69-75.
Ferrari B., Mons R., Vollat B., Fraysse B., Paxeus N., Lo Giudice R., Pollio A., Garric J. Environmental risk assessment of six human pharmaceuticals: are the current environmental risk assessment procedures sufficient for the protection of the aquatic environment? Environmental Toxicology and Chemistry. 2004;23:1344-1354.
Gupta P., Mathur N., Bhatnagar P., Nagar P., Srivastava S. Genotoxicity evaluation of hospital wastewaters. Ecotoxicology and Environmental Safety. 2009;72:1925-1932.
Heberer T. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: a review of recent research data. Toxicology Letters. 2002;131:5-17.
Ingerslev F., Halling-Sorensen B. Biodegradability properties of sulfonamides in activated sludge. Environmental Toxicology and Chemistry. 2000;19:2467-2473.
Instituto Nacional del Agua (INA), Laboratorio de Hidráulica (LHA). Evaluación de la calidad del agua en la franja costera sur del Río de la Plata mediante modelación numérica. Ezeiza, Buenos Aires. Subsecretaría de Recursos Hídricos, Secretaría de Obras Públicas, República Argentina 2011 Ene. 181p.
Jolibois B., Guerbet M. Evaluation of industrial, hospital and domestic wastewater genotoxicity with the Salmonella fluctuation test and the SOS chromotest. Mutation Research. 2005;565:151-162.
Jolibois B., Guerbet M., Vassal S. Detection of hospital wastewater genotoxicity with the SOS chromotest and Ames fluctuation test. Short Communication. Chemosphere. 2003;51:539-543.
Kümmerer K. Drugs in the environment: emission of drugs, diagnostic aids and disinfectants into wastewaters by hospitals in relation to other sources – a review. Chemosphere. 2001;45:957-969.
Kümmerer K., Al-Ahmad A. Biodegradability of the anti-tumor agents 5-fluorouracil, cyt-arabine and gemcitabine: impact of the chemical structure and synergistic toxicity with hospital effluents. Acta Hydrochimica et Hydrobiologica. 1997;25:166-172.
Kümmerer K., Al-Ahmad A., Bertram B., Wiebler M. Biodegradability of antineoplastic compounds in screening tests: influence of glucosidation and of stereochemistry. Chemosphere. 2000;40:767-773.
Liu B.Y., Nie X.P., Liu W.Q., Snoeijs P., Guan C., Tsui M.T. Toxic effects of erythromycin, ciprofloxacin and sulfamethoxazole on photosynthetic apparatus in Selenastrum capricornutum. Ecotoxicology and Environmetal Safety. 2011;74(4):1027-1035.
Maron D., Ames B.N. Revised methods for the Salmonella mutagenicity test. Mutation Research. 1983;113:173-215.
Miller W.E., Greene J.C., Shiroyama T. The Selenastrum capricornutum Printz algal assay bottle test: Experimental design, application, and data interpretation protocol. EPA-600/9- 78-018. U.S. Environmental Protection Agency,
Corvallis, Oregon. 1978;126 p.
Monarca S., Feretti D., Collivignarelli C., Guzzella L., Zerbini I., Bertanza G., Pedrazzani R. Influence of different disinfectants on mutagenicity and toxicity of urban wastewater. Water Research. 2000;34;17:4261-4269.
Mortelmans K., Zeiger E. The Ames Salmonella / microsome mutagenicity assay. Mutation Research. 2000;455:29-60.
Ohe T., Watanabe T., Wakabayshi K. Mutagens in surface waters. Mutation Research. 2004;567: 109-149.
Paz M., Muzio H., Gemini V., Magdaleno A., Rossi S., Korol S., Moretton J. Aguas residuales de un Centro Hospitalario de Buenos Aires, Argentina: Características químicas, biológicas y toxicológicas. Higiene y Sanidad Ambiental. 2004;4:83-88.
Pro J., Ortiz J.A., Boleas S., Fernández C., Carbonell G., Tarazona J.V. Effect assessment of antimicrobial pharmaceuticals on the aquatic plant Lemna minor. Bulletin of Environmental Contamination and Toxicology. 2003;70:290-295.
Sano L.L., Kruegera A.M., Landrumb P.F. Chronic toxicity of glutaraldehyde: differential sensitivity of three freshwater organisms. Aquatic Toxicology. 2005;71:283-296.
Santos L.H.M.L.M., Araújo A.N., Fachini A., Pena A., Delerue-Matos C., Montenegro M.C.B.S.M. Ecotoxicological aspects related to the presence of pharmaceuticals in the aquatic environment – a review. Journal of Hazardous Materials. 2010;175:45-95.
Siddiqui A.H., Ahmad M. The Salmonella mutagenicity of industrial, surface and ground water samples of Aligarth region of India. Mutation Research. 2003;541:21-29.
Sokal R.R., Rohlf F.J. Biometría. Principios y métodos estadísticos en la investigación biológica. Ed. H. Blume, Madrid. 1979; 832.
Turkdogan F.I., Yetilmezsoy K. Appraisal of potential environmental risks associated with antibiotic
consumption in Turkey. Journal of Hazardous Materials. 2009;166:297-308.
Zounkova R., Kovalova L., Blaha L., Dott W. Ecotoxicity and genotoxicity assessment of cytotoxic antineoplastic drugs and their metabolites. Chemosphere. 2010;81:253-260.
Por: Magdaleno Anahí; Juárez Ángela B. ; Paz Marta; Tornello Carina; Núñez Lidia; Moretton Juan
Fuente: www.scielo.org.ar