Estudio del ciclo hidrológico a través de los átomos
La relación entre el agua de los océanos, de la atmósfera, de la superficie de la tierra y del subsuelo en sus diferentes estados, ha sido estudiada desde mediados del siglo XIX. Por ejemplo: ¿dónde se produce la recarga de un acuífero?, ¿cuánto de esa recarga proviene de la lluvia local?, ¿cómo es la relación entre el agua subterránea y la superficial? Las respuestas a éstas y otras preguntas han sido buscadas a través de diferentes métodos y técnicas.
La molécula de agua está constituida por dos átomos de hidrógeno y uno de oxígeno.
Ahora bien, no todas las moléculas de agua son iguales, ya que tanto el hidrógeno como el oxígeno presentan diferentes isótopos, que son variedades del mismo átomo, pero con variación en su masa (cantidad de neutrones en el núcleo atómico)1.
El 99,8% de las moléculas de agua están compuestas por las variedades isotópicas de número atómico 1 para el hidrógeno (1H) y 16 para el oxígeno (16O), mientras que existe un 0,168% de moléculas formadas también por 1H pero combinado con oxígeno 18 ( 18O) y apenas un 0,032% que se forman con 2H (denominado deuterio), lo que constituye un dato de suma importancia para encontrar las respuestas que planteábamos en el párrafo inicial (ver Las distintas aguas).
Tan pronto como se descubrió la presencia de los isótopos de oxígeno e hidrógeno a fines de la década de 1920, empezó a observarse que existían diferencias significativas entre los contenidos isotópicos del agua de mar, del agua de los ríos y de la nieve; a partir de estos estudios se plantearon por primera vez los conceptos de relación isotópica y de fraccionamiento isotópico para el agua.
RELACIÓN ISOTÓPICA Y VALORES ESTÁNDAR
La relación isotópica en una muestra de agua se define como el cociente (o razón) entre la cantidad observada del isótopo menos habitual y la cantidad del isótopo más habitual.
Las diferencias en la presencia relativa de una variedad isotópica sobre otra se deben al fenómeno denominado fraccionamiento isotópico, originado a partir de procesos físicos naturales (por ejemplo evaporación, condensación), y es éste el fenómeno que le da utilidad práctica a los estudios isotópicos en hidrología. La explicación del fraccionamiento isotópico es compleja, pero su causa principal pasa por el hecho que las presiones de vapor en las moléculas son inversamente proporcionales a sus masas; por lo tanto las moléculas “ligeras” (1H2 16O) tendrán una presión de vapor algo mayor que las “pesadas” (2HH16O; H2 18O) y por ello tienen mayor movilidad relativa.
 |
El análisis de isótopos ambientales se ha convertido desde hace más de 40 años en uno de los métodos complementarios para el estudio de las aguas superficiales y subterráneas.
Así, las variaciones en la abundancia de 2 H y 18 O observadas en las aguas naturales están fuertemente relacionadas con el fraccionamiento isotópico que ocurre durante los procesos de evaporación y condensación. Esta abundancia relativa de moléculas “pesadas” conduce a dos términos muy utilizados: agua empobrecida y agua enriquecida. Por ejemplo, durante la evaporación se producirá una salida preferencial de las moléculas ligeras de la fase líquida (por ejemplo, de un lago) con lo que el agua del lago incrementará la abundancia relativa de moléculas pesadas, es decir, resultará en un agua enriquecida isotópicamente.
El agua evaporada resultará, por consiguiente, empobrecida isotópicamente.
Debido a la muy baja proporción en la que se encuentran las especies isotópicas de interés y la consecuente dificultad en la determinación de la relación isotópica, se observó que era más conveniente interpretar los resultados de los análisis a partir de la diferencia en la composición isotópica de una muestra a analizar con respecto a una que sea estándar mundial. Esa comparación (llamada “desvío”) se expresa con la letra griega delta (δ). Hacia 1953 se sugirió utilizar como estándar de referencia la relación isotópica 18O/16O y 2H/1H del agua de mar (Standard Mean Ocean Water, SMOW); con posterioridad, a partir de nuevos estudios fue necesario elaborar un nuevo estándar, que también fue obtenido a partir de las relaciones isotópicas en el agua de mar; este patrón de referencia es el más utilizado actualmente y se denomina Viena- SMOW (VSMOW).
Entonces, el contenido isotópico de una muestra se cuantifica a partir de su diferencia con VSMOW, expresado en “partes por mil” (‰), y se lo representa en gráficos bidimensionales que son de mucha utilidad para la interpretación de resultados.
EL FRACCIONAMIENTO ISOTÓPICO DURANTE EL CICLO DEL AGUA
Una de las mayores ventajas de la utilización de estos isótopos estables es que son constituyentes naturales de la molécula de agua y sus variaciones son debidas a procesos naturales, quedando fuera de la acción antrópica y constituyendo por tanto trazadores naturales del agua en el ciclo hidrológico.
Como resultado de ello, en diferentes etapas del ciclo hidrológico el agua queda “marcada”, de manera natural, con huellas isotópicas que varían en función del historial de una masa de agua en particular y de su recorrido por el ciclo hidrológico.
En diferentes etapas del ciclo hidrológico el agua queda “marcada”, de manera natural, con huellas isotópicas que varían en función d el historial de una masa de agua en particular y de su recorrido por el ciclo hidrológico.
El fraccionamiento isotópico depende estrechamente de la temperatura (es mayor a menor temperatura) y de la humedad atmosférica.
 |
Esta dependencia de la temperatura, que se da tanto en la condensación como en la evaporación, hace que las precipitaciones tengan diferente composición isotópica bajo diferentes condicionantes geográficos conocidos como “efectos” (altitud, continentalidad, latitud y variaciones estacionales). Por ejemplo en el caso de la latitud, cada una de
las descargas que se producen desde la nube genera un empobrecimiento en isótopos pesados en el vapor residual que queda en esa nube; como esto se repite durante el transporte de las masas de humedad desde los trópicos a los polos, conforme aumenta la latitud disminuirá la concentración de isótopos pesados en la precipitación (es decir la lluvia está cada vez más empobrecida).
El efecto de continentalidad se da porque a medida que las nubes ingresan al continente y se produce la lluvia, las moléculas más pesadas tendrán preferencia al momento de formar parte de la fase de condensación, por lo tanto, las lluvias producidas presentan valores cada vez más empobrecidos; esto hace que las lluvias costeras sean mucho más enriquecidas que las lluvias que caen al interior del continente y sobre las montañas.
Por otra parte, a medida que aumenta la altitud y se producen las precipitaciones, se verifica un empobrecimiento relativo en isótopos pesados.
Mediante el estudio isotópico de la molécula de agua se pueden llegar a diferenciar las posibles fuentes de alimentación que recargan un acuífero.
Por su parte, el efecto estacional (en regiones con clima templado) se da porque la lluvia es más empobrecida durante el invierno.
Entonces, analizando la composición isotópica de una muestra de agua, es posible determinar la altitud a la que se produjo la precipitación o bien la recarga (si la muestra es de agua subterránea), o determinar diferentes orígenes de frentes de tormenta en el caso de analizar muestras de lluvia.
El desvío encontrado en el agua subterránea coincide con el de su zona de recarga (precipitaciones en la montaña o el agua del lago); juntamente, el efecto de continentalidad hace que el desvío aumente en dirección a la zona montañosa del interior.
En definitiva, los diferentes procesos que tienen lugar durante el ciclo hidrológico colaboran en el fraccionamiento isotópico y de esta manera es posible relacionar la firma isotópica de una muestra de agua con condiciones de temperatura, de altura, de cantidad y latitud de las precipitaciones.
LA LÍNEA METEÓRICA MUNDIAL
El agua de lluvia constituye la principal fuente tanto de recarga de aguas subterráneas como de aporte al agua superficial; por esto, una contribución fundamental para los estudios isotópicos fue determinar que los desvíos 18O y 2H del agua de lluvia (a escala global) se relacionan por una recta llamada línea o recta meteórica mundial (LMM o, en inglés, MWL), establecida por H. Craig en 1961.
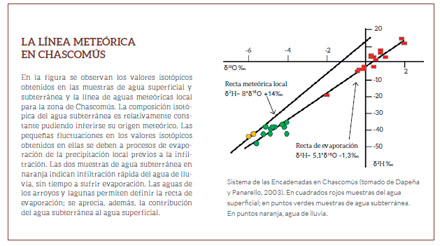
Se comprobó, también, que la lluvia de cada lugar en particular sigue una función muy similar a la MWL, usualmente llamada “recta meteórica local” (RML) (ver La línea meteórica en Pergamino).
Mediante el estudio isotópico de la molécula de agua se pueden llegar a conocer:
- Las condiciones ambientales en que se infiltró el agua en el acuífero, diferenciando aguas de distintos orígenes (altitud, estación del año, condiciones de evaporación, mezclas de aguas de origen diferente).
- Las posibles fuentes de alimentación que recargan un acuífero: aguas de precipitación directa sobre la cuenca; infiltración a través de las aguas superficiales (ríos, lagos) o procedencia de diferentes altitudes o cuencas limítrofes.
- El origen de las variaciones en la composición química de las aguas.
El proceso de evaporación también puede ser claramente representado, ya que la evaporación desplaza la composición
isotópica del agua residual a lo largo de una línea recta de pendiente menor de 8 (Ver La línea meteórica en Quequén Grande).
Actualmente están funcionando en el país 14 estaciones que remiten datos de las aguas recolectadas a una red mundial de isótopos de precipitación.
Uno de los aspectos que se destaca de los ejemplos mostrados en los gráficos es el de la importancia de contar con una buena definición de la recta meteórica local, en el lugar donde se está realizando el estudio, dado que resulta la función de entrada del sistema y su composición isotópica es buena indicadora del origen del vapor; esto es especialmente importante en un país como Argentina, debido a su compleja morfología y extensión que determinan una gran variedad de climas.
En conclusión, el estudio de los isótopos estables del agua es una herramienta de gran utilidad a la hora de comprender el modelo conceptual de funcionamiento del sistema hidrológico de una región; en conjunto con análisis químicos del agua permiten confirmar o rechazar hipótesis y, en definitiva, dar más y mejores pautas a la hora de gestionar un recurso vital.
 |
 |
 |
ISÓTOPOS DE LAPRECIPITACIÓN MUNDIAL
La AIEA y la Organización Meteorológica Mundial (OMM) iniciaron en 1961 un proyecto internacional dedicado a la medición del contenido isotópico de la precipitación a nivel mundial. Este proyecto se denominó GNIP (Global Network for Isotopes in Precipitation). En este marco, el Instituto de Geocronología y Geología Isotópica (INGEIS) que depende de la Facultad de Ciencias Exactas y Naturales (FCEN) de la Universidad de Buenos Aires y del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) creó una Red Nacional de Colectores (RNC) que integra la GNIP y permite conocer el contenido isotópico de la lluvia en distintas regiones del país. La RNC comenzó a funcionar en noviembre de 1978 con una estación ubicada en la ciudad de Buenos Aires. Luego de algunos años, llegó a tener 25 estaciones situadas en diferentes regiones del país. Entre los años 1983 a 1997, la falta de recursos económicos impidió el normal funcionamiento de esta Red y en 1990 se redujo a sólo dos estaciones. A partir de 1995, el INGEIS, gracias a la colaboración de organismos nacionales, provinciales, no gubernamentales y particulares, comenzó a instalar nuevas estaciones. Actualmente están funcionando 14 estaciones que remiten cada 4 meses las aguas colectadas al Instituto, para la determinación de 18O, 2H y 3H. El Grupo de Hidrogeología del Instituto de Geología de Costas y del Cuaternario (FCEN-UNMdP) ha instalado una serie de colectores de agua de lluvia y posee una red de muestreo tanto de aguas superficiales como subterráneas en todo el sudeste bonaerense; desde 2005 se lleva un registro periódico de datos isotópicos e hidroquímicos provenientes de esta red. Por otra parte, el grupo cuenta con un espectroscopio láser DLT-100 Liquid- Water Isotope Analyzer Automated Injection que permite hacer determinaciones de Deuterio y de 18-Oxígeno.
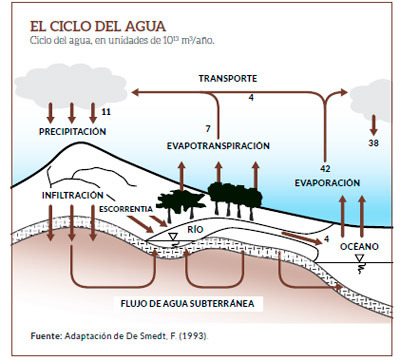
ISÓTOPOS EN EL CICLO HIDROLÓGICO
El fraccionamiento isotópico a lo largo del ciclo del agua.
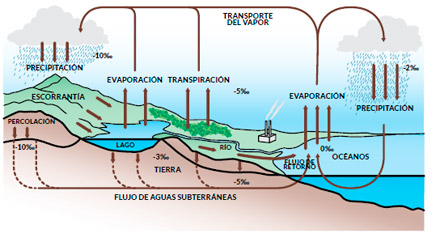 Fuente: Diario La Nación, Costa Rica, 20 de setiembre de 2009. |
Referencias
1. Se llaman isótopos a cada una de las variedades de un átomo de cierto elemento químico, los cuales varían en el núcleo atómico. El núcleo presenta el mismo número atómico, constituyendo por lo tanto el mismo elemento, pero presenta distinto número másico. Los diferentes átomos de un mismo elemento, a pesar de tener el mismo número de protones y electrones (+ y -), pueden diferenciarse en el número de neutrones. Puesto que el número atómico es equivalente al número de protones en el núcleo, y el número másico es la suma total de protones y neutrones en el núcleo, los isótopos del mismo elemento sólo difieren entre ellos en el número de neutrones que contienen.
Por: Héctor Massone
Daniel Martínez
Mauricio Quiroz Londoño
Fuente: Hydria
VER ARCHIVO DE ARTÍCULO