Estimación de Iluminación en un Fotobiorreactor Productor de Biomasa a Partir de Microalgas
Resumen
En el presente trabajo se realizó el análisis de iluminación artificial para un fotobiorreactor productor de biomasa a partir de microalgas, el cual fue diseñado previamente con fines en aplicación para la producción de biocombustibles. En el análisis, se utilizó como herramienta la técnica de contornos o también conocida como método de superficie de respuesta, para lo cual se establecieron 132 puntos de intensidad luminosa distribuidos de forma simétrica a diferentes alturas del contenedor. Se realizaron dos bioensayos uno con la iluminación en la parte inferior del recipiente usando Diodos Emisores de Luz (LED’s, por sus siglas en inglés) y el otro adicionando 3 lámparas fluorescentes más, situadas periféricamente a la mitad de la altura total del fotobiorreactor. Los resultados de las mediciones muestran una mejoría en el sistema de iluminación que favorece la reproducción continua de las microalgas, cuando se utilizó la combinación de luz emitida por LED’s y por lámparas fluorescentes. Esta combinación de sistemas de iluminación generó las condiciones para poder realizar las funciones metabólicas de las microalgas, quienes necesitan en promedio 2500 lx de forma homogénea.
Palabras clave: Eficiencia, iluminación, fotobiorreactor, biomasa, microalgas.
Introducción
Los fotobiorreactores se pueden definir como dispositivos diseñados en material transparente para el cultivo de microorganismos fotosintéticos acuáticos, que consta de un receptor solar (sistema tubular a dos niveles optimizado) y un sistema de impulsión (burbujeo de aire en un desgasificador plano), y que es operable tanto en continuo como en discontinuo, permitiendo la inyección de dióxido de carbono, el control del pH y de la concentración de oxígeno disuelto en el cultivo [1]-[5]. Así mismo, debe tener la cantidad suficiente de luz que permita realizar una función adecuada en el crecimiento y reproducción de los microorganismos. El estudio que se reporta, tuvo como objetivo determinar los niveles de iluminación en el interior de un fotobiorreactor diseñado para la obtención de biomasa a partir de microalgas, el cual utilizó dos sistemas de iluminación diferentes.
Fundamentos teóricos
Diseño de Fotobiorreactores
Las primeras propuestas en el diseño y construcción de fotobiorreactores fue en la década los 50’s, en donde se propuso utilizar luz solar y agua marina para permitir el funcionamiento de los diseños realizados. En aquellos años, los objetivos principales de las propuestas eran la obtención de cultivos de microalgas marinas, para ser utilizadas como un complemento de alimento humano [6]-[8].
En la década de los 60-70’s, en diversos países se investigó sobre el cultivo de microalgas en forma masiva con la utilización de fotobiorreactores para acelerar su producción, por lo que se diseñaron los primeros fotobiorreactores tubulares utilizando como materia prima materiales transparentes (plástico) [3], [5], [6], [7]. En la década de los 90‘s los fotobiorreactores que más se utilizaban por ser de bajo costo eran los de carrusel, con una producción de masa seca de 0.7 g por litro [2].
En el año 2000 [9], se estimó la productividad teórica en 100 toneladas anuales por hectárea de cultivo de microalgas. Este mismo año Grobblelaar et. al. [10,] definieron los diseños básicos para la producción de microorganismos fotoautótrofos como sistemas abiertos, debido a que estos cultivos están expuestos a la atmósfera y los sistemas cerrados como fotobiorreactores en los que el cultivo tienen poca o ningún contacto con la atmósfera.
Morales et al. [11], proponen el uso de fotobiorreactores en cultivos de microalgas eucariotas y cianobacterias para la producción en grandes cantidades de compuestos químicos, combustibles, tratamiento de aguas residuales, alimento para consumo humano o animal; entre otros posibles usos. Los diseños que más han recibido mayor atención son los tubulares y de placas planas, los cuales son construidos en acrílico y vidrio [2].
Otro material utilizado para la construcción de estos artefactos es a partir de bolsas de polietileno [12], las cuales tienen la ventaja de generar una tasa neta de energía mayor que la del vidrio y el acrílico, pero con la desventaja de que se tienen que cambiar cada tres años debido al opacamiento de las mismas. Algunos otros tipos básicos son el tipo carrusel, plano, con iluminación interna, tipo serpentín y el tipo tubular horizontal con sistema de agitación por aire “Airlift” [9].
Fotosíntesis de Microalgas
Todos los organismos requieren de una fuente de energía para su crecimiento. Los organismos fotótrofos son los que utilizan la luz como fuente de energía. La luz a radiación visible, es la radiación electromagnética en el rango de 400 a 700 nm, la cual es sensible al ojo humano, razón por la cual, es usada por las algas y plantas para la fotosíntesis. La radiación visible también es llamada radiación fotosintética activa (PAR por sus siglas en inglés) [13].
La fotosíntesis es el proceso en el cual los fotótrofos capturan y convierten la energía de fotones (cantidad de energía electromagnética) a energía utilizada bioquímicamente y es a través de la fotosíntesis que los fotótrofos obtienen la energía y poder reductor necesario para incorporar CO2 y la fabricación de moléculas orgánicas que se requieren para el crecimiento [13].
Cerca de la mitad de la fotosíntesis en la tierra es llevada a cabo por microorganismos y existen tres tipos principales: el púrpura fotosintético y bacteria verde, las cianobacterias (también llamadas por la botánica como alga azul-verde) y las microalgas. Las bacterias fotosintéticas y cianobacterias son procariotas, es decir, son células sin un núcleo celular definido, mientras que las microalgas tienen una organización celular tipo eucariota, la cual se refiere, a todas las células con un núcleo celular delimitado dentro de una capa lipídica. Las bacterias fotosintéticas difieren de las cianobacterias y las microalgas por sus pigmentos y el proceso fotosintético. la habilidad del rendimiento de la fotosíntesis depende de la presencia de los pigmentos absorbedores de luz, llamadas clorofilas. Estos pigmentos absorben la luz principalmente en la región azul-violeta y rojo del espectro y absorben débilmente en la región verde, es la razón por la cual los fotótrofos son de tonalidad verde [13]. Las microalgas para realizar la fotosíntesis utilizan la energía solar para metabolizar el dióxido de carbono (CO2) a metanal (CH2O) liberando oxígeno molecular (O2). Las moléculas de CH2O constituyen los bloque responsables de la formación de moléculas de glucosa en las microalgas. Este proceso se describe en la ecuación 1 [14],
CO2 + H2O + fotón -> CH2 O + O2 (1)
en donde, el CO2 metaboliza a compuestos orgánicos como azúcares utilizando la luz solar, esto se puede representar con la reacción general [14]
6CO2 + 6H2O -> C2H12 O6 + 6O2 (2)
Análisis de superficie
En el presente trabajo se realizó el estudio en la distribución de iluminación en el interior del fotobiorreactor mediante la técnica de análisis de superficie, la cual, es una técnica matemática y estadística utilizada para el modelado y análisis de problemas en donde la respuesta de interés es influenciada por diferentes variables y su objetivo es optimizar esa respuesta [15]. Cuando se trata de un rango de mediciones continuas de valores, entonces, se utiliza el método de superficies de respuesta para desarrollar, mejorar y optimizar la variable de respuesta. En general, la forma más simple de representar la función es:
y = f (x1 , x2 ) + e (3)
donde, x1 y x2, son las variables independientes, e es el residuo y representa algún error de medición sobre la respuesta, así como otro tipo de variaciones no contempladas en f . En orden de desarrollar una aproximación adecuada de f, usualmente se inicia con un polinomio de bajo orden en alguna pequeña región.
Si la respuesta puede definirse mediante una función lineal de variables independientes, entonces la función de aproximación es un modelo de primer orden, también conocido como modelo de regresión múltiple [15]. Un modelo de primer orden con dos variables independientes se puede expresar de la siguiente forma:
 |
Materiales y métodos
Con el objeto de analizar las variables que determinan la producción de biomasa y en particular evaluar la eficiencia del sistema de iluminación, se diseñó en CAD (computer-aided design por sus siglas en ingles) y construyó un fotobiorreactor (FBR). El FBR fue construido en acrílico, con una geometría cilíndrica sesgada por la base con un ángulo de inclinación 10º y una capacidad de operación de 100 L (Figura 1). Sus dimensiones son de 650 mm de diámetro interno, espesor de la lámina de acrílico 8 mm, altura máxima 448 mm, altura mínima 330.6 mm. Cuenta con un tubo de desagüe con un diámetro de 61.41 mm (situado en la parte inferior del cilindro) y otro de derrame (en la parte lateral del cilindro) de 100.86 mm de diámetro. La base es de acero inoxidable y cuenta con una lámina circular también de acero inoxidable que aloja en una distancia equidistante 10 diodos emisores de luz (LED´s por sus siglas en ingles) tipo campana de 21 LED´s cada una y una potencia de 1.3 watts.
 |
Diseño experimental
Como primera instancia, se determinó la distribución de los puntos de medición de la iluminación en el fotobiorreactor, considerando la altura y volumen del líquido que contiene las microalgas y que debe ser atravesado por la luz para llegar a todo el recipiente. En la Figura 2, se muestra una representación del diseño para las alturas con la finalidad de determinar la medición de la luz, así como también el volumen de acuerdo a la distancia recorrida para cada altura.
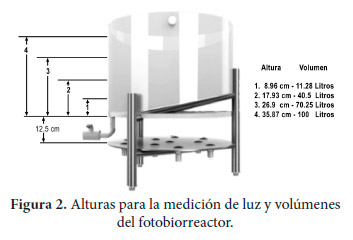 |
Se utilizó la especie de microalga clorófita Nannochloris sp con una densidad de 403 x 103 cel/ ml, en agua de mar con una salinidad de 33 ppm y se realizaron dos etapas en esta fase. La clorofila, principal pigmento de las microalgas verdes, tiene un rango de bandas de absorción de 450-475 nm y de 630-675 nm para la clorofila a y clorofila b, respectivamente.
En la primera etapa, se utilizaron 10 LED´s a 1.3 W, con una distribución equidistantemente localizada en la base metálica del fotobiorreactor, como se muestra en la Figura 3 en donde se presenta la vista superior del la base metálica y la distribución de los LED´s. Los LED´s de luz blanca son diodos azules, que emiten luz a una longitud de onda de aproximadamente 460 nm, recubiertos con una capa de un derivado de fósforo. El fósforo absorbe la luz azul y la re-emite a distintas longitudes de onda entre los 400 y 750 nm en el espectro visible, generando luz blanca. Están basados en semiconductores de InGaN (Nitruro de Indio y Galio), difíciles y raros, y por tanto caros. El ángulo de apertura de los LED’s utilizados en este trabajo fue de 20º. Este ángulo no es el de apertura máxima, sino que se refiere al doble de la apertura en la cual la intensidad luminosa ha disminuido la mitad respecto a la máxima central [18].
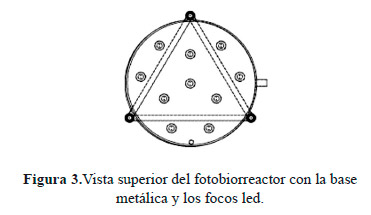 |
En la segunda fase, además de conservar la LED´s descritos anteriormente, se realizó una modificación, adicionando tres Lámparas Fluorescentes Compactas (LFC) de 15 W cada una, y una temperatura de color de 6500 K que corresponde a la luz de color blancofrío. El voltaje (V) es para 110-127V, cuenta con dos bulbos de vidrio en forma de U conteniendo vapor de mercurio a baja presión con pequeñas cantidades de un gas inerte, como el argón. La mayoría de la luz es emitida en la región visible del espectro (400–700 nm), y es por lo tanto muy cercana al espectro de la luz de día [19], con lo que se esperaba mejorar la fotosíntesis. El flujo luminoso corresponde a 810 lm y 54 lm/W. Las lámparas fueron situadas periféricamente a la mitad de la altura total del fotobiorreactor, como lo muestra la Figura 4.
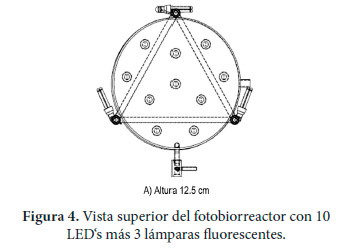 |
Para la medición de la intensidad lumínica se utilizó un medidor digital provisto de un filtro para corrección de color y factor cosenoidal. El medidor tiene una frecuencia de muestreo interna de dos veces por segundo para datos digitales. La medición de luz en el fotobiorreactor en ambos bioensayos se realizó con un plantilla a medio círculo de poliuretano color blanco, 19.4 mm de espesor, y un diámetro de 649 mm. A esta plantilla se le hicieron 21 orificios de 50.8 mm de diámetro a una distancia de centro a centro de los orificios de 70 mm. En la Figura 5, se muestra una representación de la plantilla para la medición de luz. La colecta de datos se realizó manualmente registrando las lecturas del equipo en cada orificio de la plantilla para cada una de las alturas del líquido que contiene las microalgas (Figura 2).
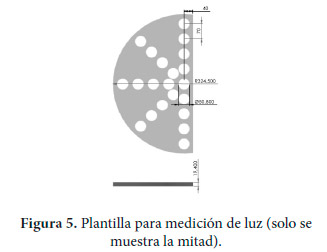 |
La luz que emiten los LED´s utilizados es una luz blanca ligeramente azulada. La cual se considera en el rango de emisión de los 6500 K, que es una forma de medir la tonalidad de la luz en grados Kelvin (K). Es decir cuando se produce luz blanca con LED se hace mediante un método similar al que se utiliza para la fluorescencia, en donde se parte de una emisión ultravioleta o azul y se convierte ésta en visible a través del uso de fósforo y dependiendo del fósforo qu se utilice se podrá obtener temperaturas de color desde muy cálidas hasta muy frías, proporcionando también distintas capacidades de reproducir colores en ese rango. Como referencia se puede indicar que la luz del día es de 5800 K, razón por la cual se optó por esta fuente de luz, ya que es muy parecida a la luz del día, pero un poco más azulada [19].
Por último se hace mención, que los datos obtenidos en los bioensayos se procesaron mediante un programa para la medición mediante la técnica de análisis de contornos mencionada con anterioridad.
Resultados y discusión
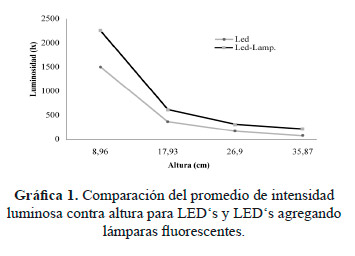
Las Figuras 6 y 7, muestran los diferentes niveles de iluminación de los dos ensayos elaborados usando la técnica de análisis de contorno para representar la dispersión de luz en el fotobiorreactor. La Figura 6 presenta el sistema con los 10 LED´s, en donde se obtuvo un promedio de 1497 Lx a una altura de 8.96 cm y un promedio de 81.30 Lx a una altura de 35.87 cm. En la Figura 7, se observan los resultados haciendo las mediciones con tres lámparas fluorescentes de 15 W cada uno agregadas al recipiente. En este caso, el promedio más alto de iluminación se observó a una altura de 8.96 cm con 2254 lx, y el menor a una altura de 35.87 cm con 211 lx. Estos resultados reflejan que el uso de lámparas fluorescentes adicionales al sistema de iluminación LED, incrementa significativamente en 50%, la iluminación en el interior del fotobiorreactor en la posición más próxima al fondo del recipiente.
Mientras que en la parte superior se incrementó 2.6 veces respecto al uso exclusivo de lámparas LED. Cuando se comparan estos resultados con los reportados por Geider y Osborne [20] como valores óptimos para realizar fotosíntesis por Nannochloris atomus, se encontró que solamente en la superficie del fotobiorreactor se obtienen los 7500 Lx que requiere para su máximo desarrollo la microalga. Sin embargo, el diseño y distribución lumínica del fotobiorreactor supera la penetración de la luz que en la mayoría de los diseños sólo alcanza valores del 10% a 30% del volumen total de los fotobiorreactores, donde la zona fótica (iluminada) alcanza apenas los primeros 2 cmde profundidad [21], [22], [23].
 |
En el presente estudio, con el sistema de iluminación más débil (LED’s) se alcanzó una disminución del 18% de la intensidad lumínica a una distancia de 8.6 cm del fondo del recipiente, lo que representa una ganancia en capacidad lumínica respecto a diseños tradicionales de fotobiorreactores. Además, si se considera que a 35.87 cm de distancia del fondo, todavía se registraron intensidades lumínicas del orden del 3% de la luz incidente al exterior del recipiente, se puede decir que el diseño del fotobiorreactor propuesto es más eficiente en la distribución lumínica.
Considerando que las microalgas requieren una iluminación homogénea de por lo menos 7500 lx [24]. La concentración de iluminación en el sistema no fue completamente homogénea pero sí superior cuando se le compara con los diseños tradicionales donde sólo la superficie superior está expuesta a la luz. Así mismo, los niveles de iluminación en este estudio son bajos, respecto a la demanda de la microalga, lo que podría afectar en los proceso de reproducción de la misma. Sin embargo, cuando se le compara con diseños tradicionales de volúmenes similares, se puede decir que el material, dimensiones y dispositivos de iluminación utilizados, proporcionan mejores condiciones de iluminación que las reportadas en otros estudios.
La Gráfica 1 muestra un comparativo que representa la tendencia para cada bioensayo, en donde se observa una mayor eficiencia de penetración de la luz en el experimento que utilizó los LED‘s junto con lámparas fluorescentes. Sin embargo, a medida que se incrementa la altura el comportamiento es semejante en ambos ensayos, esto es, a medida que aumenta la altura disminuye la luminosidad. Esta situación es completamente normal y atiende a la ley de Lambert-
Beer que establece en términos de Transmitancia (la luz que pasa a través de un medio translucido), que la intensidad de un haz de luz incidente declina significativamente a medida que pasa a través del medio absorbente de acuerdo con la siguiente expresión [25].
T =10 – ε • c • d (9)
donde: T, es la Transmitancia; ε, es el coeficiente molar de extinción; c, es la concentración molar del absorbente y d, es el recorrido o distancia a la que se mide la luz transmitida [25]. Ésta ley también indica que existen tres fenómenos responsables en disminuir la cantidad de luz después que ésta pasa a través de algún medio que lo absorba; la cantidad de materia que absorbe en el medio, la distancia que la luz tiene que viajar a través de la muestra y la probabilidad de que el fotón de cierta longitud de onda sea absorbido por el material (Coeficiente de absorción o de extinción molar del material) [25].
 |
Conclusión
Los resultados obtenidos en el análisis indican que el sistema de iluminación diseñado solamente con LED’s fue menos eficaz que el que incorporó lámparas fluorescentes, ya que la concentración más alta de luz en el centro del fotobiorreactor fue de 4.5 X103 lx a una altura de 8.96 cm, representando el 1.87 % de la cobertura total del tanque. Sin embargo, a 35.87 cm se presentó una luminosidad puntual de 104 lx en la misma posición y con una cobertura del 35.2% esto indica que en la misma posición de los LED’s se observa una disminución de la intensidad luminosa a medida que se incrementa la distancia por las sombras de las microalgas, pero se incrementa el porcentaje de cobertura por el ángulo de dispersión. Esto es importante considerarlo en el diseño de fotobiorreactores, ya que afecta directamente en el metabolismo de las microalgas quienes requieren como mínimo 2500 lx para realizar sus funciones metabólicas.
El uso de luz combinada en dirección horizontal y vertical incrementa en un 50% la intensidad luminosa en la base del fotobiorreactor, mientras que en la parte superior se obtiene un incremento del 160%. Siendo un factor importante a resaltar, la ubicación del sistema, debido a que se pueden evitar sombras y favorecer la desviación de gran parte de la luz que incide en el recipiente. La aportación más importante de este estudio fue la validación de la metodología propuesta para la evaluación de la capacidad de iluminación en fotobiorreactores, la cual emplea herramientas simples para cuantificar, representar gráficamente e incluso elaborar modelos matemáticos que permitan evaluar cuantitativamente y comparar dicha capacidad en diferentes tipos de diseños de fotobiorreactores.
Referencias
[1] Molina, E., Fernández, F., Acién, G. y Chisti, Y., (2001). Tubular photobioreactor design for algal cultures. Journal of Biotechnology, 92, 113-131.
[2] Gemma Vicente, Mercedes Martínez, José Aracil. (2004). Integrated biodiesel production: systems. Bioresource Technology, 92, 297-305.
[3] Ana P. Carvalho, Luís A. Meireles, and F. Xavier Malcata., (2006). Microalgal reactors: a review of enclosed system designs and performances. Biotechnology Progress, 22(6), 1490-1506.
[4] Gaitero, G. A.; Villicaña, O.; Paredes, J. P. y Bernart. X., (2012). Biofijación de CO2 mediante el cultivo de algas. Diseño de un prototipo de fotobiorreactor para el cultivo de Spirulina platensis. Congreso Nacional del Medio Ambiente. Extenso. España. p.1-25.
[5] Anónimo. (2012). Novedoso fotobiorreactor para el cultivo masivo de microalgas. Universidad de Alicante, España. Solicitud de patente P201200903, 19/09/2012.
[6] López, F. R., Rojas, A Barajas, A y Kafarov, V., (2009). Producción de biocombustibles de tercera generación: Diseño de fotobiorreactores a escala de laboratorio para la producción de microalgas. Corporation, the Petroleum Colombian Institute ICP – ECOPETROL, the Santander Industrial University and the Iberoamerican Science and Technology Program for Development – CYTED. Memorias del IV simposio de Química Aplicada. SIQUIA. Universidad de Quindio Armenia Colombia.
[7] Martínez, M. M., (2012). Modelos de biomasa algal para la captura de dióxido de carbono y su desarrollo en software de evaluación. Master investigación para el desarrollo Agroforestal. Universidad de Valladolid (Campus de Palencia).
[8] España, Becker, E. W., (1994). Microalgae: biotechnology and microbiology. Cambridge University Press. Reino Unido. p. 293.
[9] Pulz O., (2001). Photobioreactors: production systems for phototrophic microorganisms. Appl Microbiol Biotechnol, 57 (3), 287–93.
[10] Grobbelaar JU., (1994). Turbulence in mass algal cultures and the role of light/dark fluctuations. J. Appl. Phycol., 6, 331-335.
[11] Molina Grima E., Acién Fernández FG, García Camacho F, Chisti Y., (1999). Photobioreactors: light regime, mass transfer, and scaleup. J Biotechnol, 70, 231-47.
[12] Richmond A., (2000).Microalgal biotechnology at the turn of the millennium: a personal view. J. Appl. Phycol., 12, 441-451.
[13] López, F. A., Rojas, R. C., (2010), Diseño y Montaje de un Fotobiorreactor a Escala Laboratorio para la Producción de Microalgas, Tesis Profesional, Facultad de Ingenierías Fisicoquímicas, Universidad Industrial de Santander, Bucaramanga, Colombia.
[14] Benavente-Valdés, J. R., Montañez, J. C., Aguilar, C. N., Méndez-Zavala, A. y Valdivia, B. (2012). Tecnología de Cultivo de Microalgas en Fotobiorreactores. Revista Científica de la Universidad Autónoma de Coahuila. 7(4), 1-12. http://www.postgradoeinvestigacion.uadec.mx/ divulgacionAQM.html
[15] Nuran Bradley, (2007). The response surface methodology. Thesis master of science in applied mathematics & computer science. Indiana University South Bend, p. 73.
[16] Sánchez Saavedra, M.P. y D. Voltolina., (1996). The effect of the different photon fluence rates of blue green light on the biomass quality of a coastal diatom in pilot scale semicontinuous cultures. Scientia Marina, 60(Sup. 1), 267-272.
[17] Correa Reyes, J.G., (1993). Alimentación de Artemia franciscana con microalgas cultivadas bajo diferentes tipos de luz. Tesis profesional. Facultad de Ciencias Marinas, Univ. Autónoma de B.C., Ensenada, México, p. 56.
[18] Cronquist, A., (1989). Bótanica Básica. Compañía Editorial Continental. México, D.F.: p.655.
[19] Kommareddy, A. and Anderson, G. (2003). Study of light as a parameter in the growth of algae in a Photo-Bio-Reactor (PBR). ASAE Annual International Meeting Presentation 034057, Las Vegas, USA
[20] Geider, R. J. y Osborne, B. A, (1986). Light absorption, photosynthesis and growth of Nannochloris atomus in nutrient-saturated cultures, Marine Biology, 3(93), 351-360.
[21] Morales E., Rodríguez M., García D., Loreto C., Marco E., (2002).Crecimiento, producción de pigmentos y exopolisacáridos de la cianobacteria Anabaenasp.PCC7120 en función de pH y CO2. Interciencia, 27, 373-378.
[22] Coral C. F., Julian M. P. C., Luis B.F.C. y Rosa O. C. V., (2003). Avances en el diseño conceptual de fotobiorreactores para el cultivo de microalgas. Interciencia. Caracas, Venezuela. p. 450-456.
[23] Carvalho, A.P., Silva, S.O., Baptista, J.M. and Malcata, F. X. (2011) Light requirements in microalgal photobioreactors: an overview of biophotonic aspects. Appl Microbiol Biotechnol, 89, 1275–1288.
[24] Burgessa G, Javier G. Fernández-Velasco, (2007). Materials, operational energy inputs, and net energy ratio for photobiological hydrogen production. International Journal of Hydrogen Energy, 32, 1225–1234.
[25] Atkins, P. y de Paula, J. (2006). Physical Chemistry for the Life Sciences. New York: Oxford University Press, 699.
Por: M.C. Carlos Francisco González Hernández, M.C. Manuel de Jesús Sol Hernández,
Dr. Miguel Ángel Franco Nava.
Departamento de Metal-Mecánica y Química-Bioquímica. Mexico
Fuente: Conciencia Tecnológica No. 47