Eliminación de SO2 y NOX mediante catalizadores carbonosos procedentes de carbones de bajo rango.
|
Introducción
|
Uno de los principales objetivos de la investigación en la aplicación de la catálisis medioambiental a la limpieza de gases es minimizar los costes de producción y operación del catalizador al tiempo que se cumplen los requerimientos de emisión.
El uso de materiales carbonosos como catalizadores puede aportar soluciones en ambos sentidos.
De hecho, el aumento de las restricciones que se contemplan en la legislación que regula las emisiones de los contaminantes a la atmósfera ha generado un considerable aumento en el consumo de carbones activos para aplicaciones medioambientales en fase gas.
La necesidad de eliminar NOx y SO2 de las emisiones gaseosas de fuentes estacionarias empezó a cobrar importancia en los años 80, y fue a partir de entonces cuando la catálisis medioambiental adquirió auge.
La utilización de carbones activos para la eliminación de estos óxidos a bajas temperaturas es una opción interesante, que está siendo utilizada en Europa y Japón tanto para la limpieza de gases de combustión de carbón como de plantas incineradoras, consiguiéndose eliminaciones de hasta un 95% del SO2 y de más de un 80% de NOx de los gases de combustión.
En estos procesos el catalizador se coloca habitualmente después del precipitador y justo antes de la chimenea y puede utilizarse sólo o junto con otros dispositivos dependiendo de las características de la instalación.
El SO2 reacciona con el agua y el oxígeno presente en los gases para formar ácido sulfúrico, que es retenido por el carbón activo, en donde se acumula, siendo posteriormente regenerado.
El gas desulfurado pasa por otro reactor que también contiene carbón activo y el NOx es reducido con amoníaco en presencia de oxígeno.
En la planta situada en Arzberg (Alemania) se tratan 1.1 106 m3/h de gases con 4000 t de catalizador, reduciéndose la concentración de SO2 de 1200 ppmv a menos de 30 ppmv y el NO de 250 ppmv a menos de 100 ppmv, siendo esta planta la mayor que utiliza un catalizador carbonoso para el control de la polución.
El principal inconveniente de este proceso es el relativamente alto coste del catalizador carbonoso, por lo que, actualmente, la actividad de los grupos de investigación que trabajan en este campo se centra en el desarrollo de nuevos productos carbonosos de bajo coste y similares propiedades adsorbentes y catalíticas que los carbones activos utilizados hasta el presente (1 y las citas incluidas en su introducción, 2).
|
FUNDAMENTOS TEORICOS
|
El papel de los materiales carbonosos como catalizadores es diferente en función de las reacciones en las que participa.
Mientras que la naturaleza de la superficie carbonosa y la presencia de estructuras superficiales carbono-oxígeno juegan un papel dominante en algunas reacciones, el área superficial y la disponibilidad de los sitios activos son factores importantes en otras reacciones.
Aunque tradicionalmente se había considerado que el área superficial y la porosidad eran los parámetros que definían la calidad de un material carbonoso, actualmente se sabe que la química superficial de estos materiales juega un papel muy importante en sus propiedades adsortivas y catalíticas.
Entre las estructuras superficiales más importantes se encuentran las carbono-oxígeno, que son de las que dependen en mayor medida las características superficiales y el comportamiento de los coques activos y carbones activados.
Aunque la determinación del número y naturaleza de estas estructuras superficiales tiene medio siglo de historia, aún no ha sido completamente establecida la naturaleza precisa de los grupos funcionales que la componen.
Las estimaciones obtenidas por los investigadores utilizando diferentes técnicas analíticas difieren considerablemente debido a que la superficie carbonosa es muy compleja, difícil de reproducir e interacciona de forma distinta en ambientes diferentes.
Por otra parte, parece claro que hay numerosos tipos de grupos funcionales oxigenados que confieren a estos sustratos un carácter ácido-base. Las técnicas experimentales más habituales utilizadas para la caracterización de estos grupos oxigenados superficiales son las valoraciones ácido-base y la desorción térmica programada (TPD).
Otras técnicas más sofisticadas pueden contribuir a un mayor conocimiento de estos grupos como las espectroscopías infrarroja (FTIR) y la fotoelectrónica de rayos X (XPS), el análisis directo de la capa oxidada por reacciones químicas específicas o la polarografía. Detalles de las técnicas y de los resultados que con ellas pueden obtenerse pueden encontrarse en (3).
Las ventajas de las propiedades de los carbones activos como catalizadores o soportes catalíticos pueden resumirse en siete puntos (3): a) la estructura carbonosa es resistente tanto en medio ácido como básico, b) es estable a altas temperaturas, c) la estructura porosa puede diseñarse (“tailoring”) adaptándola a las necesidades de la reacción dada, d) los carbones activos pueden prepararse con distintos conformados, e) aunque suelen ser hidrofóbicos, pueden modificarse para aumentar su hidrofilia, f) en el caso de ser soportes la fase activa puede recuperarse por quemado y g) resultan soportes más baratos que la alúmina.
|
ESTUDIOS A ESCALA LABORATORIO
|
Eliminacion de SO2 Para la eliminación de los óxidos de azufre de los gases de combustión a temperaturas entre 20 y 180ºC, el tipo de material carbonoso utilizado es probablemente la consideración del proceso más importante en lo referente tanto a la eficacia de la adsorción como a su mantenimiento durante la operación.
Hay que tener en cuenta que la capacidad de adsorción de SO2 de chares activados preparados a partir del mismo carbón puede variar en dos órdenes de magnitud dependiendo del método de preparación.
Es por ello que se han probado numerosos productos carbonosos para esta aplicación, desde un carbón altamente activado hasta carbón sin tratar.
El mecanismo de eliminación del SO2 no está del todo claro.
La Figura 1 muestra las curvas de ruptura obtenidas al pasar una mezcla de SO2, O2, H2O y N2 a través de un lecho fijo de diferentes catalizadores manteniendo el mismo volumen de catalizador probado y el mismo tiempo de residencia.
Se observa que la adsorción del SO2 puede dividirse en tres etapas consecutivas, y cada paso como función del tiempo depende de las propiedades del catalizador (4).
En una primera etapa no se observa ruptura (breakthrough) de la curva de concentración y la velocidad de adsorción está controlada por la difusión y la adsorción del SO2 en la superficie interna del catalizador.
A medida que el proceso de adsorción va progresando se ocupa la superficie interna.
La oxidación catalítica del SO2 adsorbido a ácido sulfúrico deja libre la superficie interna y permite que continúe el proceso de adsorción.
El ácido sulfúrico formado se va transportando fácilmente a poros internos accesibles, que no son sitios de adsorción para el SO2.
La velocidad de adsorción en la fase dos está por tanto controlada por la velocidad de la reacción de oxidación catalítica que a su vez depende de la calidad de los sitios activos para la oxidación y de la estructura porosa del catalizador.
Para el coque activo la velocidad de oxidación y la de difusión son igualmente altas, mientras que para el carbón activo estudiado la velocidad de oxidación es claramente menor y para el coque de turba no se alcanza el estado estacionario de la velocidad de oxidación.
En la tercera fase, la capacidad de almacenamiento del ácido sulfúrico de los poros accesibles se agota y la presencia del mismo empieza a envenenar los sitios de adsorción disponibles para el SO2, con lo que la actividad disminuye.
Como puede verse en la Figura 1, la fase 3 comienza al mismo tiempo para el coque activo y el carbón activo, pero empieza mucho antes para el coque de turba. Este debe tener menos poros accesibles para el almacenamiento del ácido sulfúrico.
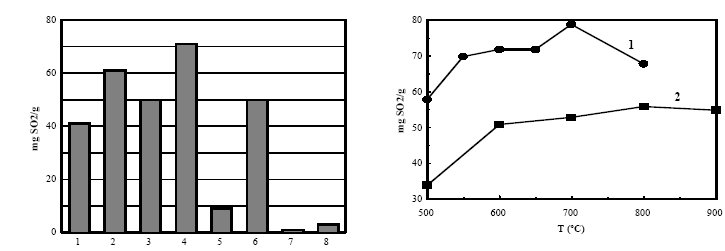
La Figura 2 muestra la capacidad de eliminación de distintos materiales carbonosos estudiados en la bibliografía y resumidos en (5).
De esta Figura puede deducirse que el área superficial no puede explicar la actividad catalítica de los catalizadores estudiados.
Puede observarse que no hay correlación directa entre el área superficial y la actividad catalítica, ni siquiera para un mismo precursor, ya que los chares 1, 2 y 3 fueron obtenidos a partir de un mismo carbón subbituminoso (1. por pirólisis a 800ºC, 2. por pirólisis a 800ºC seguida de activación con vapor de agua a la misma temperatura y 3. por pirólisis a 800ºC seguida de activación con vapor a 700ºC).
Este último aspecto puede verse confirmado en la Figura 3, obteniéndose capacidades de eliminación de SO2 diferentes sólo con variar la temperatura de carbonización de un lignito y un carbón subbituminoso.
Los últimos estudios (6) muestran que el mecanismo de oxidación catalítica del SO2 está ligado a la existencia de un tamaño óptimo de poro, independientemente de la naturaleza de la muestra y su química superficial.
El grado de oxidación de SO2 a SO3 está determinado por el potencial de adsorción dentro de los poros que está íntimamente relacionado con el tamaño de poro.
Además estos estudios demuestran que los compuestos oxigenados inhiben la oxidación del SO2, que ocurre por el oxígeno de la fase gas.
Estos resultados indican que el SO2 no es quimisorbido como se había aceptado tradicionalmente, sino que es fisisorbido con una elevada energía de adsorción debida al potencial de adsorción del interior del microporo.
El ácido sulfúrico formado durante la eliminación del SO2, que se encuentra llenando los poros, puede ser eliminado del catalizador, y con ello se regenera el catalizador, por calentamiento, actuando el carbono como reductor.
Ello produce una ligera gasificación que, por un lado, puede crear porosidad, siendo este efecto negativo a la luz de los resultados expuestos en el párrafo anterior, y por otro, deja sitios libres “frescos” (superficie libre de grupos superficiales) para su uso en otro ciclo de eliminación del SO2.
Mediante FTIR se ha podido determinar que la gasificación es selectiva a la formación complejos tipo CO. EL CO2 resulta de las reacciones secundarias entre el SO3 y los grupos tipo CO.
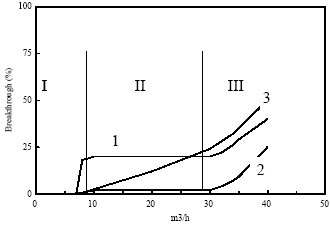
Figura 1. Curvas de ruptura típicas para la eliminación de SO2 con distintos productos carbonosos 1. Carbón activado. 2. Coque activo (ambos de carbón bituminoso y 3. Coque de turba.
 |
|
| Fig.2 Comparación de la capacidad de eliminación de SO2 de diversos materiales carbonosos (Tabla 1). |
Fig.3 Efecto de la temperatura de pirólisis en la capacidad de eliminación de SO2 de 1. Char activado de un lignito (una etapa pirólisis+activación). 2. Char activado de un carbón subbituminoso ( dos etapas). |

|
Eliminación de NO
|
La introducción de modificaciones en los dispositivos de combustión es más favorable desde el punto de vista económico que el tratamiento posterior de los gases de salida.
Sin embargo, a pesar de requerir altas inversiones y costes de operación, el tratamiento de los gases es indispensable en muchos casos para cumplir con las cada vez mayores restricciones en las emisiones de NOx autorizadas.
La reducción catalítica selectiva (SRC) es la única técnica de desnitrificación de gases efluentes que ha probado ser efectiva. Ha sido ampliamente estudiada, comercializada con éxito y aplicada a gran escala.
Durante el proceso SRC, los NOx, son reducidos selectivamente en presencia de un exceso de O2 mediante NH3 a N2 y H2O sobre un catalizador. Hasta ahora, el NH3 (o especies análogas como la urea) es el único agente reductor que es capaz de reducir los NOx selectivamente bajo condiciones oxidativas con éxito, en contraste con otros agentes reductores como CH4, H2 y CO.
Los sistemas comerciales SRC están basados principalmente en catalizadores Ti/V2O5 de alto coste, activos entre 575-675K. La localización de la unidad SCR generalmente es al final de la línea de gases, lo que tiene como desventaja la necesidad de recalentar los gases hasta la temperatura óptima de operación del catalizador.
Una solución ideal vendría dada por un catalizador de bajo coste que tuviera eficacias de eliminación del NOx elevadas a relativamente bajas temperaturas (375-425K).
En la pasada década se llevaron a cabo importantes investigaciones en ambos de los aspectos mencionados. A pesar de este esfuerzo, sólo dos sistemas catalíticos han sido aplicados comercialmente.
Shell ha comercializado un proceso basado en V2O5 soportado en titanio/sílice, mientras que el DMT ha desarrollado un proceso basado en la actividad de un carbón activado preparado a partir de una carbón bituminoso.
La tendencia actual es la investigación del uso de precursores baratos para la producción de catalizadores carbonosos o soportes carbonosos que pueden doparse con metales de transición procedentes de residuos de deshecho (2, 5).
El mecanismo de eliminación del NO en presencia de O2, H2O y NH3 sobre un catalizador carbonoso, está controlado por la química superficial.
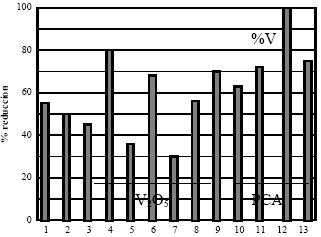
Se ha descrito la presencia de los intermedios reactivos C(O) y los complejos superficiales C-O, siendo la cantidad de los primeros la que ha podido correlacionarse bien con la capacidad de reducción del NO, aunque existe una relación de equilibrio entre la cantidad existente de ambos en la superficie. El mecanismo general propuesto está detallado en (7), y es consistente con observaciones hechas por otros autores, especialmente los resultados obtenidos con diferentes materiales carbonosos a los que se les aplica distintos tratamientos (H2SO4 ó HNO3). Lo que parece quedar claro, a partir de la Figura 4, en la que se comparan 13 sustratos carbonosos diferentes, es que la eliminación del NO no correlaciona directamente con el área superficial, que viene dada en la Tabla 2.
Asimismo, puede observarse cómo precursores con elevados contenidos en cenizas (que no son eliminadas posteriormente), permiten obtener catalizadores que rinden elevadas reducciones de NO, mejores incluso que las obtenidas con carbones activos comerciales.
Para chares de carbones de bajo rango se liberan elevadas cantidades de CO y CO2 durante un experimento de TPD, lo que induce a pensar que existen mayor cantidad de sitios activos para estos carbones.
Ello explicaría la no correlación entre la capacidad de eliminación de NO con las propiedades físicas que se observa en la Figura 4 (Tabla 2).
Sin embargo, tampoco hay una relación directa de la capacidad de eliminación del NO y la química superficial (3, 5) y parece que es precisa la existencia de un compromiso entre área superficial y cantidad de grupos oxigenados superficiales para optimizar el catalizador, es decir el número óptimo de estos grupos por unidad de superficie (8).
Ello quiere decir que se puede diseñar un catalizador carbonoso de forma que se obtenga un alto rendimiento de reducción de NO. La aplicación de tratamientos químicos con distintos agentes o los tratamientos térmicos con técnicas como el microondas (9) producen variaciones en la química superficial que pueden dirigirse tanto a la aparición de determinados grupos superficiales como a la desaparición selectiva de los mismos, siendo especialmente interesante aquellos de naturaleza ácida.
La adición de metales de transición (fundamentalmente Ni y V) procedentes de residuos de vacío o cenizas de coque de petróleo combina la revalorización de estos residuos (potencialmente dañinos al medioambiente) con la posibilidad de mejorar la actividad catalítica sin necesidad de trabajar a elevadas temperaturas, como en el caso de los catalizadores de vanadio comerciales, que obliga a recalentar los gases. La figura 5 muestra el efecto sobre la reducción de NO a 150ºC de la adición de diversas cantidades de V.
La reducción alcanza el 95% a 200ºC.
|
Eliminación simultanea SO2/NO
|
Los problemas de la utilización de los catalizadores carbonosos descritos anteriormente en la eliminación simultánea de ambos contaminantes son los mismos que los existentes para el proceso desarrollado por el DMT.
En esencia, que las pequeñas concentraciones de SO2 que salen de un primer lecho relleno de catalizador, envenenan el material carbonoso puesto en un segundo lecho para la eliminación del NO debido a la formación de sulfato amónico (recordar que se usa NH3 como reductor del NO).
Este hecho no impide que se obtengan reducciones en las emisiones de SO2 y NO del mismo orden que otros sistemas comerciales, con la ventaja de que al ser eliminados en un único proceso se podrían abaratar los costes globales de limpieza de gases.
Como ya se ha puesto de manifiesto en el apartado anterior, los tratamientos oxidativos (por ejemplo con ácido sulfúrico) mejoran las reducciones de NO, con lo que el uso de los catalizadores regenerados después de su uso en la eliminación del SO2 (en el que se forma ese ácido sulfúrico) evitaría el tratamiento de los catalizadores y permitiría la reutilización de los mismos en la segunda etapa del proceso (8).
 |
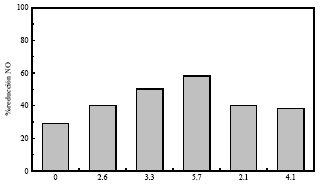 |
| Figura 4. Comparación de la capacidad de eliminación de NO de diversos materiales carbonosos (Tabla 2). | Figura 5. Influencia de la adición de V (expresado en %) en forma de V2O5 y cenizas de coque de petróleo (PCA) a un char activado. T: 150ºC |

![]() Bibliografía
Bibliografía
1. A.A. Lizzio y J.A. DeBarr. Fuel, 75, 1515-1522, 1996.
2. R. Moliner, M.J. Lázaro, I. Suelves, C. Braekman, A. Fontana, S. Vassilev. ECSC Workshop Reduction of emissions from coal utilization. Sevilla, Marzo 2000.
3. F. Rodríguez-Reinoso. Introduction to Carbon Technologies. Ed. H. Marsh, E.A. Heintz, F. Rodríguez-Reinoso. Secretariado de Publicaciones. Universidad de Alicante, 1997.
4. H. Jüntgen y H. Kühl. Chemistry and Physics of Carbon. P.A. Thrower Ed. Marcel Dekker, 1989.
5. B. Rubio y M.T. Izquierdo. Carbon, 1998, 36, 263-268.
6. E. Raymundo-Piñero, D. Cazorla-Amoros, A. Linares-Solano. Carbon, 2001, 39, 231-242. 7. H. Yamashita, A. Tomita,
7. H. Yamada, T. Kyotani y L.R. Radovic. Energy & Fuels, 1993, 85-89.
8. M.T. Izquierdo, B. Rubio, M.C. Mayoral, J.M. Andrés. Applied Catálisis B: Environmental, en prensa. 9. J. Menéndez, E. Menéndez, M.J. Iglesias, A. García, J.J. Pis. Carbon, 1999, 37, 1116-1121.
María Teresa Izquierdo, Begoña Rubio, María Jesús Lázaro y Rafael Moliner. Instituto de Carboquímica (CSIC). C/ María de Luna, 12. 50015 Zaragoza (España). E-mail: [email protected]