Deshidratación de Crudo Parte 2
|
Shirley MARFISI y Jean Louis SALAGER
|
2. METODOS DE TRATAMIENTO PARA LA DESHIDRATACIÓN
Dependiendo del tipo de aceite y de la disponibilidad de recursos se combinan cualquiera de los siguientes métodos típicos de deshidratación de crudo: Químico, térmico, mecánico y eléctrico. En general, se usa una combinación de los métodos térmicos y químicos con uno mecánico o eléctrico para lograr la deshidratación efectiva de la emulsión W/O.
El tratamiento químico consiste en aplicar un producto desemulsionante sintético denominado en las áreas operacionales de la industria petrolera como “química deshidratante”, el cual debe ser inyectado tan temprano como sea posible a nivel de superficie o en el fondo del pozo. Esto permite más tiempo de contacto y puede prevenir la formación de emulsión corriente abajo. La inyección de desemulsionante antes de una bomba, asegura un adecuado contacto con el crudo y minimiza la formación de emulsión por la acción de la bomba.
El tratamiento por calentamiento consiste en el calentamiento del crudo mediante equipos de intercambio de calor, tales como calentadores de crudo y hornos.
El tratamiento mecánico se caracteriza por utilizar equipos de separación dinámica que permiten la dispersión de las fases de la emulsión y aceleran el proceso de separación gravitacional. Entre ellos se encuentran los tanques de sedimentación llamados comúnmente tanques de lavado.
Para el tratamiento eléctrico se utilizan equipos denominados deshidratadores electrostáticos, y consiste en aplicar un campo eléctrico para acelerar el proceso de acercamiento de las gotas de fase dispersa.
La selección y preparación del tipo de desemulsionante debe coincidir con el recipiente de tratamiento de la emulsión. Los tanque de lavado que tienen largo tiempo de retención (8-24 horas), requieren desemulsionantes de acción lenta. Por otro lado, los tratadores-calentadores y las unidades electrostáticas con corto tiempo de retención (15-60 minutos) requieren desemulsionantes de acción muy rápida. Problemas como precipitación de parafinas en climas fríos, incremento de sólidos, adición de compuestos químicos para estimulación de pozos, pueden requerir el cambio del desemulsionante inyectado en línea.
2.1 Acción de la química deshidratante
Diferentes estudios (Salager 1987a) han demostrado que el mecanismo físico-químico de acción de los agentes deshidratantes o desemulsionantes está asociado a la formulación óptima del sistema (SAD = 0, siendo SAD la Diferencia de Afinidad del Surfactante).
La formulación óptima se define básicamente como un estado de equilibrio entre las afinidades del surfactante para la fase acuosa y para la fase oléica. Se han determinado cuantitativamente los efectos de las diferentes variables de formulación (salinidad, ACN, EON, WOR, temperatura, entre otras) sobre el equilibrio hidrofílico/lipofílico entre el surfactante y su ambiente físico-químico (Salager 1999, Salager et al., 1979 a,b,c).
En un sistema surfactante-agua-aceite, la formulación óptima se logra cuando en un barrido unidimensional de cualquier variable de formulación, el sistema presenta una tensión interfacial mínima o ultra-baja, acompañada en general de la aparición de un sistema trifásico en el cual la mayor parte del surfactante está en la fase media. Para el caso de emulsiones agua en crudo es poco corriente poder observar tal sistema trifásico y la inestabilidad se detecta por el progreso de la coalescencia y la evolución de la tensión interfacial dinámica.
Para conseguir esta condición en una emulsión W/O que ya contiene un surfactante lipofílico (modelo de los surfactantes naturales en el crudo), se debe añadir un surfactante hidrofílico de peso molecular promedio o bajo (modelo agente deshidratante) de manera que el parámetro característico de la mezcla produzca una emulsión inestable (Salager 1987 b). La formulación óptima es independiente de la concentración de surfactante y de la cantidad de la fase media, el surfactante es atrapado en una microemulsión (Antón y Salager 1986).
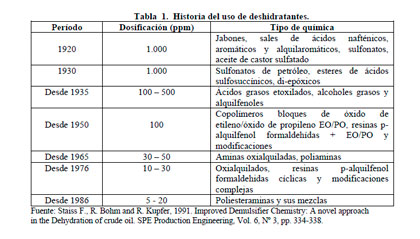
Por lo general, los desemulsionantes comerciales son mezclas de varios componentes que tienen estructuras químicas diferentes y materiales poliméricos, así como una amplia distribución de peso molecular. Están conformados por un 30 a 50% de materia activa (surfactantes) más la adición de solventes adecuados, tales como nafta aromática y alcoholes.
Entre los más utilizados están los copolímeros bloques de óxido de etileno y de óxido de propileno, las resinas alquil-fenol formaldehídas, las poliaminas, alcoholes grasos, aminas oxialquiladas y poliesteramianas y sus mezclas. En la tabla 1 se presentan algunos de los productos surfactantes utilizados como agentes deshidratantes para romper emulsiones W/O.
Estos surfactantes tienen tres efectos fundamentales una vez adsorbidos en la interfase agua-aceite: uno es la inhibición de la formación de una película rígida, otro el debilitamiento de la película volviéndola compresible y el más importante, el cambio en la formulación del sistema para alcanzar la condición de SAD = 0.
 |
2.2 Acción del campo eléctrico
La fuerza resultante entre dos gotas cargadas está dada por la Ley de Coulomb:
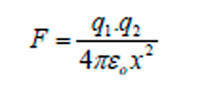 |
donde q es la carga de la gota, x es la distancia entre los centros de las gotas y εo la permitividad de la fase continua. La dirección del movimiento depende de la polaridad de la carga y del campo eléctrico. Para una gota cargada por contacto directo con un electrodo, la fuerza resultante se reescribe:
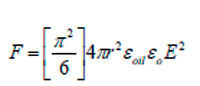 |
siendo εoil la constante dieléctrica relativa del crudo y E el campo eléctrico.
Esta fuerza ocasiona que la gota cargada migre hacia el electrodo de carga opuesta y se inicie entonces el contacto con otras gotas, permitiendo la coalescencia. Para dos gotas polarizadas de igual tamaño alineadas en el campo eléctrico, la fuerza de atracción es:
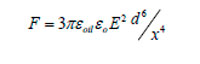 |
En un campo D.C. (corriente directa), las gotas migrarán en un patrón continuo con una velocidad determinada por la viscosidad de la fase continua. Las gotas gradualmente perderán su carga, dependiendo del tiempo de relajación de la fase continua.
En el caso de corriente continua (A.C.), una gota cargada tenderá a oscilar en una posición media entre los electrodos. Una gota puede llegar a cargarse por otros mecanismos tales como: ionización, adsorción preferencial de iones a la interfase (doble capa eléctrica) o transferencia de carga convectiva desde un electrodo por la fase orgánica (Burris 1977).
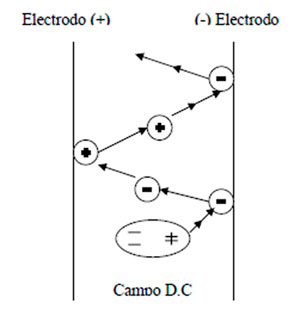
En investigaciones realizadas se ha podido estudiar el fenómeno que hace que los voltajes D.C. sean tan efectivos y permitan remover grandes cantidades de agua (Burris 1977). Este principio se esquematiza en la figura 8. En esta figura se representa un crudo fluyendo verticalmente con una sola gota de agua presente. A medida que la gota entra en el alto gradiente D.C. entre los electrodos, éste le induce una carga a la superficie de la gota, que es igual a la del electrodo más cercano, por lo que inmediatamente ambos se repelen y la gota es atraída hacia el electrodo de carga contraria.
Cuando la gota se acerca al electrodo de carga contraria, la carga superficial de la gota se altera por el gran potencial del ahora electrodo más cercano, lo que hace que sea repelida de nuevo y atraída por el electrodo de carga contraria. Este movimiento de la gota es una migración ordenada entre los electrodos. Los altos potenciales D.C. retienen a las gotas de agua hasta sean suficientemente grandes como para sedimentar.
Considerando lo anteriormente expuesto para un sistema de una emulsión W/O con miles de gotas de agua. Las gotas polarizadas (cargadas mitad positivamente y mitad negativamente) tenderán a colisionar entre sí, por lo cual la coalescencia ocurrirá más rápido. Este fenómeno también hace que gotas en medios más viscosos colisionen, y es necesario altas temperaturas.
|
Figura 8. Movimiento de una gota de agua entre dos electrodos de
polaridad dual. |
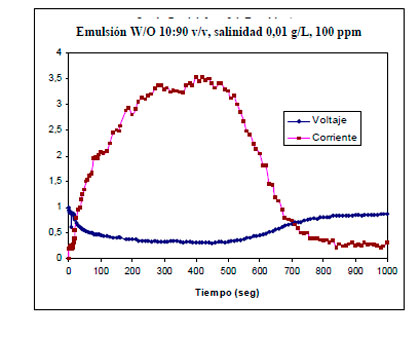
Otro ejemplo, es el perfil corriente-voltaje obtenido en la deshidratación electrostática de una emulsión agua en crudo aplicando un campo eléctrico D.C. de 1.000 Voltios/cm y una dosificación de 100 ppm de química deshidratante (resina fenol formaldehído), figura 9. Se observa que inicialmente la corriente aumenta de manera considerable, luego alcanza un máximo y después disminuye hasta valores cercanos a cero.
|
Figura 9. Perfil Intensidad de corriente-Voltaje en función del tiempo durante la deshidratación
Electrostática de una emulsión agua en petróleo crudo. |
Taylor (1988) encontró que la forma de tales perfiles puede explicarse de la siguiente manera:
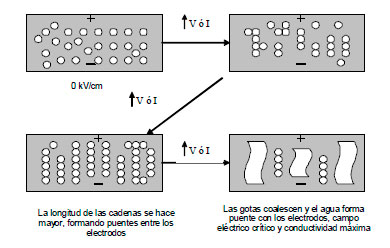
- Un período inicial durante el cual ocurre el alineamiento de las gotas en cadena como si fuera un rosario;
- Un período en el cual las cadenas de gotas de gran longitud forman un puente entre los electrodos, ocasionando un incremento en la conductividad de la emulsión;
- Un punto en el cual la conducción de corriente alcanza un máximo; y
- Una región caracterizada por una conductividad altamente errática, eventualmente disminuye a cero, como consecuencia de la disminución del nivel de agua en la emulsión debido al progreso de coalescencia de las gotas.
Taylor (1988) sugirió lo siguiente: “el proceso inicial es capacitivo, resultando quizás de la conducción superficial en las gotas de agua que se tocan, más que de la conducción a través de las gotas. Esta fase inicial es influenciada por factores como: viscosidad de la fase aceite, volumen de la fase dispersa y voltaje aplicado.
En la última región la conducción ocurre a través de las gotas (coalescencia), y la duración de está zona se ve afectada por el voltaje aplicado y la presencia de aditivos químicos; a mayor voltaje o mayor concentración de química, más rápida es la deshidratación”. En la figura 10 se ilustra esquemáticamente el proceso de electrocoalescencia.
|
Figura 10. Esquema del proceso de electrocoalescencia.
 |
3. ASPECTOS PRÁCTICOS Y TECNOLÓGICOS
3.1 Aplicación del mapa de formulación a la deshidratación de crudos
En la historia de un pozo ocurre en general un aumento paulatino del porcentaje de agua producida. Uno de los problemas más severos es el aumento de viscosidad de las emulsiones W/O con el contenido de agua, el cual provoca problemas de bombeo y de reducción de la producción.
Para encontrar solución a este problema conviene estudiar la influencia de las variables de composición conjuntamente con la de la variable generalizada de formulación SAD ó HLD. A tal efecto se usan sistemas modelos compuestos por un ternario surfactante-aceite-salmuera.
Tales sistemas poseen dos variables independientes de composición, las cuales se expresan en general, como la concentración de surfactante y la relación agua-aceite WOR (Salager 1987a).
La concentración del surfactante tiene una influencia general bien definida (Anderéz 1984). Debajo de una cierta concentración “crítica” no hay suficiente surfactante en el sistema para estabilizar una emulsión. Al contrario, el WOR tiene un efecto más difícil de entender, ya que éste se combina con el de la formulación. Se sabe (Becher 1977; Lissant 1974) que un aumento del contenido de agua de una emulsión W/O (formulación SAD > 0) termina siempre por invertirse en una emulsión O/W cuando el porcentaje de agua llega a 70-80%.
El mapa bidimensional de formulación-composición (por ejemplo, SAD-WOR) es extremadamente útil para explicar el papel de la química deshidratante cuando se añade a la mezcla agua-crudo en el fondo de pozo antes de la formación de la emulsión (Salager 1987a).
Para tratar un sistema susceptible de producir una emulsión W/O estable ubicada en B+ ó A+ (SAD > 0) por efecto de los surfactantes naturales, basta añadir un surfactante hidrofílico disuelto en una fase aceite, de manera tal que al combinarse con los surfactantes naturales produzca SAD = 0 o SAD levemente negativo, como se muestra en la figura 11, caso 1. En tales condiciones, se obtendrá una emulsión W/O inestable.
Si al mismo sistema se añade un surfactante hidrofílico disuelto en una cantidad notable de agua, de forma que el SAD resultante sea cero en la frontera A+/A- ó levemente negativo en A-, se obtendrá una emulsión O/W inestable, figura 11 caso 2. Este puede ser mejor que el caso 1 si el crudo es viscoso, ya que la emulsión W/O puede ser difícil de bombear.
Si se añade un surfactante hidrofílico y agua en cantidades suficientes para producir SAD < 0 en la zona A-, se puede obtener una emulsión O/W estable, figura 11 caso 3, lo que puede ser interesante para ciertos tipos de aplicaciones, como es el caso de transporte de crudos pesados (Grosso et al., 1984) ó la producción de emulsiones combustibles. En la mayoría de los casos el problema es diferente y consiste en añadir la química deshidratante a una emulsión ya estabilizada por surfactantes naturales. En lo que concierne a la deshidratación, el cambio de B+ (SAD > 0) al límite de B+/B- (SAD = 0) ó a B- (SAD < 0 cerca de cero), y el cambio de B+ ó A+ al límite A+/A- (SAD = 0) ó a A- (SAD < 0) producen esencialmente los mismos efectos que para un sistema pre-equilibrado. Con el objeto de que la analogía se aplique a sistemas crudo/agua es necesario que se cumpla la regla de mezcla entre los surfactantes naturales y la química deshidratante y, por otra parte, que el agente deshidratante pueda migrar rápidamente a la interfase para combinarse con los surfactantes naturales. Este último requisito implica que el agente deshidratante se incorpore al sistema en un vehículo solvente miscible con la fase externa de la emulsión que se ha de romper (Salager 1987 a).
|
Figura 11. Utilización del mapa de formulación-WOR para el tratamiento de emulsiones de
campo tipo W/O: (1) Deshidratación, (2) Desalación, (3) Producción de emulsiones O/W estables. 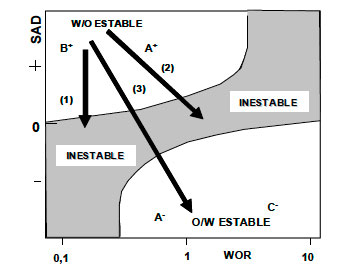 |
3.2 Pruebas de botella
Los desemulsionantes deben ser dosificados en forma continua en la relación determinada por pruebas de botella y/o pruebas de campo. Los rangos de dosificación pueden variar de 10 a 1.000 ppm, aunque generalmente con un buen deshidratante se utilizan 10 a 100 ppm.
Generalmente los crudos pesados requieren mayor dosificación que los crudos ligeros. El exceso de dosificación de desemulsificante incrementa los costos de tratamiento, puede estabilizar aun más la emulsión directa W/O ó producir emulsiones inversas O/W.
Debido a que los agentes desemulsionantes son tan numerosos y complejos para permitir su completa identificación, seleccionar el desemulsionante más adecuado es un arte. La selección está basada en pruebas empíricas de laboratorio conocidas como Pruebas de botella, las cuales se han estandarizado como técnica de selección de estos productos en los laboratorios de la industria petrolera.
Las pruebas de botella ayudan a determinar cual química puede ser más efectiva para romper la emulsión de campo. Los resultados de esta prueba indican la menor cantidad de química necesaria para separar la mayor cantidad de agua de la emulsión W/O. Para el éxito de esta prueba se requiere seleccionar una muestra representativa de la corriente de producción de la emulsión, la cual debe reunir las siguientes características (University of Texas, 1990):
1. Ser representativa de la emulsión a ser tratada.
2. Contener cantidades representativas de los químicos presentes en el sistema, tales como inhibidores de corrosión y parafinas.
3. Debe ser fresca para evitar la estabilización por envejecimiento de la emulsión.
4. Simular las mismas condiciones de agitación y calentamiento tanto como sea posible.
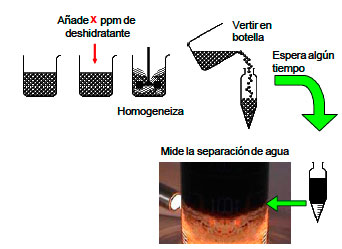
En la figura 12 se esquematiza el procedimiento para la aplicación de la prueba de botella, el cual consiste básicamente en preparar una serie de botellas graduadas y añadir 100 ml de la emulsión agua en crudo fresca o preparada en laboratorio, se dosifican diferentes concentraciones del producto deshidratante a cada botella dejando una botella sin deshidratante (botella patrón), se homogeniza la mezcla y se colocan las botellas en un baño termostático a la temperatura deseada. Cada 30 min se lee el volumen de agua coalescida y se observa la calidad de la interfase, del agua separada y de las paredes del tubo. Con esta data seconstruye la gráfica de Porcentaje de agua separada en función del tiempo, así como la gráfica de estabilidad, que permite conocer el tiempo necesario para separar ½ ó 2/3 del volumen de fase acuosa. Tales gráficas permiten determinar la eficiencia del deshidratante.
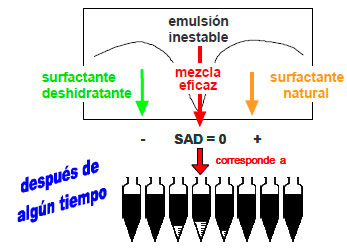
En la figura 13 se muestra el papel del deshidratante en una gráfica de estabilidadformulación, siendo la variable de formulación el SAD (Diferencia de Afinidad del Surfactante). La situación inicial es una emulsión W/O estabilizada por surfactantes naturales y partículas autóctonas del crudo. La química deshidratante es una mezcla de surfactantes de carácter hidrofílico que se solubiliza en un solvente hidrocarbonado de tipo aromático para viajar por difusión y convección por la fase externa de la emulsión, es decir, el petróleo crudo, y adsorberse en la interfase de la gota de agua. Este deshidratante combina sus efectos con los del surfactante natural, obteniéndose una mezcla eficaz que hace la emulsión inestable.
|
Figura 12. Procedimiento para la realización de la prueba de
botella. |
|
Figura 13. Acción del deshidratante dosificado en las pruebas de botella en un mapa de estabilidad-formulación |
3.3 Medición de la estabilidad
La única medida realmente absoluta de la estabilidad de una emulsión es la variación del número de gotas en función del tiempo. Tal información no se puede obtener experimentalmente sino mediante la variación de la distribución del tamaño de gota en el tiempo. Desde el punto de vista experimental, tal medición implica bien sea que se tome una muestra o que se diluya el sistema completo con un gran exceso de fase externa. El resultado del primer método depende considerablemente de la posición del muestreo y el segundo puede emplearse solo una vez porque altera el estado del sistema.
Por lo tanto, la estabilidad de una emulsión se relaciona en general con el volumen de las fases separadas. Después de algún tiempo, el sistema se separa típicamente en tres zonas: una zona central que contiene una nata o emulsión de alto contenido de fase interna y dos fases separadas: la interna (coalescida) y la externa (clarificada). Se ha demostrado recientemente que estos criterios dan resultados satisfactorios cuando se les da una buena interpretación (Salager 1999).
La figura 14 indica la fracción de volumen coalescido en función del tiempo. Esta curva posee una forma sigmoide, la cual es característica de un proceso con varias etapas. Durante un cierto período inicial no se separa ningún tipo de volumen, este periodo de iniciación corresponde a la sedimentación de gotas y al drenaje de la fase externa hasta alcanzar una
emulsión compactada en la cual las gotas “no se tocan”.
En realidad, las gotas están separadas por una película delgada de fase externa, en la cual la interacción entre las interfases empieza a jugar un papel importante y puede producir un efecto notable de retraso en el proceso de coalescencia.
Cuando las películas intergotas llegan a alcanzar un espesor del orden de 200 Å son susceptibles de romperse, provocando así la coalescencia de las gotas y la formación de un volumen de fase separado. Esta etapa corresponde a la parte ascendiente de la curva, cuya forma sigmoide puede interpretarse como la función acumulativa de una distribución normal o log-normal, lo que no es de extrañar por el carácter aleatorio del proceso de ruptura.
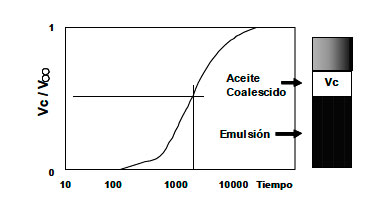
Con el fin de cuantificar la estabilidad con valor numérico, se ha propuesto usar el tiempo requerido para que coalesca la mitad (u otra fracción) del volumen de fase interna, por ejemplo, el tiempo en el cual Vc/V∞ = 1/2 ó 2/3, siendo Vc el volumen coalescido y V∞ el volumen total o fijado usado como referencia, como se muestra en la figura 15.
|
Figura 14. Fracción de volumen coalescido o
clarificado en función del tiempo. |
|
Figura 15. Variación de la estabilidad de la emulsión W/O
en función de la concentración del deshidratante para la coalescencia de 2/3 delvolumen fijado V∞. 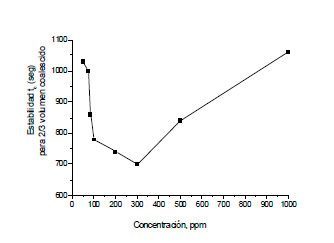 |
3.4 Cinética de adsorción de los surfactantes deshidratantes
La adsorción de un surfactante en una superficie gas-líquido o una interfase líquido-líquido produce una reducción de la tensión interfacial, que favorece tanto la deformación y la ruptura de la interfase, como la formación de sistemas dispersos (emulsiones o espumas), o la movilización del petróleo residual en la recuperación mejorada de crudos, entre otros fenómenos de gran interés industrial.
Midiendo la evolución de la tensión interfacial en función del tiempo para sistemas SOW (surfactante-aceite-agua) se puede obtener importante información sobre la cinética de adsorción del surfactante deshidratante y su influencia en la estabilidad de la emulsión.
Los efectos cinéticos más importantes en la ruptura de emulsiones son:
1. El producto más eficaz para una formulación en SAD = 0 parece ser aquél que se adsorbe más rápido en la interfase para bajar la tensión interfacial (Breen 1995; Goldszal y Bourrel, 2000).
2. La transferencia de masa del deshidratante hidrofílico desde el aceite hacia la interfase depende de: (a) Su peso molecular y estructura; (b) La fuerza motriz (hidrofilicidad); (c) Calidad de la formulación (tensión interfacial); (d) Presencia de aditivos acelerador de transferencia (Fillous et al., 1999; Salager et al., 2002).
La eficiencia de una variedad de surfactantes puede ser comparada en función de un nuevo parámetro denominado tiempo característico τD (= h2/D, h es la profundidad de adsorción y D el coeficiente de difusión; h = Γeq/C∞ siendo Γeq la concentración superficial al equilibrio y C∞ la concentración en el seno de la fase líquida, Ferri y Stebe 2000): Mientras más pequeño es el valor de τD más rápido se alcanza el equilibrio. Sí el coeficiente de difusión varía débilmente para surfactantes de tamaño similar, las diferencias en la velocidad de adsorción pueden ser atribuidas a la profundidad de adsorción; la cual está determinada por las isotermas de adsorción al equilibrio.
3.5 Sinergismo entre los surfactantes y aditivos químicos
El estudio de los efectos sinergéticos de los aditivos químicos es de gran importancia en las operaciones de producción en la industria petrolera, lo cual ha recibido recientemente atención debido al incremento de las restricciones ambientales y de los costos de producción en los cuales el uso de aditivos químicos juega un papel importante.
Los aditivos químicos son utilizados para combatir varios problemas operacionales tales como corrosión, presencia de espumas y formación de emulsiones no deseadas. Aunque se ha encontrado que la química puede ser efectiva cuando se usa sola, no hay garantía que tenga un buen rendimiento cuando están presentes como parte de un cocktail de aditivos en la producción de fluidos que entran al separador primario. Poco es conocido acerca de las interacciones entre estos aditivos químicos y sus efectos en la separación de las fases gas/aceite/agua.
Yang et al. (1996) investigaron la manera en la cual los aditivos químicos interactúan y sus efectos sobre la estabilidad de emulsiones con miras a desarrollar estrategias para la reducción del inventario de químicos.
Ambas mediciones de tensión interfacial y presión superficial han sido suficientemente aplicadas para identificar las interacciones químicas y/o los efectos sinergéticos entre los aditivos. Tales efectos fueron encontrados entre desemulsionantes, inhibidores de corrosión y agentes antiespumantes. Inhibidores de corrosión solubles tanto en agua como en aceite incrementan la estabilidad de la emulsión significativamente. En cambio, los anti-espumantes tienen poca influencia.
Hay evidencias de efectos sinergéticos entre los surfactantes naturales del petróleo crudo. Por ejemplo, fracciones fenólicas puras que se encuentran abundantemente en extractos alcalinos son interfacialmente inactivas, sin embargo, mezclas de fenoles y ácidos carboxílicos exhiben una alta actividad interfacial y en algunos casos las especies apareadas como los carboxifenoles. Indicaciones cualitativas de las interacciones y efectos sinergéticos entre fracciones de asfaltenos y resinas fueron también reportadas por Sjöblom et al. (1992).
Poco se ha encontrado en literatura acerca de los efectos sinergéticos e interacciones químicas entre los aditivos de producción, aunque la importancia de tales efectos sobre la ruptura de emulsiones fue mencionado por Urdhal et al. (1993). Trabajos recientes en el laboratorio FIRP arrojaron evidencias de tales efectos usando mezclas de deshidratantes.
Fuente: Universidad de Los Andes
FACULTAD DE INGENIERIA
ESCUELA DE INGENIERIA QUIMICA
Lab. Formulacion, Interfaces, Reología y Procesos