Desarrollo de protocolo para la propagación in vitro de Phragmipedium kovachii Atwood, Dalström & Fernández (Orchidaceae) a partir de semillas
Summary
 |
The investigation of the present job was done at the Laboratory of Cultivation of Tejidos Vegetales of the a San Martin University of Tarapoto with the objective to evaluate the efficiency of methods of cultivating in Vitro (germination, multiplication, and rooting) in Phragmipedium kovachii Atwood Dalström & Fernandez, to separate seeds for plants free of pathogens and a design was completed at random. 3×10 (methods of cultivating) and 10 repetitions.
Resumen
El presente trabajo de investigación se realizó en el Laboratorio de Cultivo de Tejidos Vegetales de la Universidad Nacional de San Martín – Tarapoto, con el objetivo de evaluar la eficiencia de medios de cultivo in Vitro (germinación, multiplicación y enraizamiento) en Phragmipedium kovachii Atwood Dalström & Fernández a partir de semillas, para plántulas libres de patógenos y se adecuó un diseño completamente al azar, 3 x 10 (medios de cultivo) y 10 repeticiones.
 |
Key Words: Bencil amino Purina (BAP), Acid Naftalacetico (ANA), Phragmipedium kovachii (semilla dehiscente), Vitamin (biotina), anti oxidant (Myo inositol), Additives (agua de coco).
INTRODUCCION
La mayoría de especies existentes en los bosques de San Martín como es el caso de orquídeas, están sufriendo un proceso de disminución de su población debido a la tala y quema de los bosques, así como la extracción de su habitad natural, como es el caso de la orquídea Phragmipedium kovachii especie recientemente descubierta en el Departamento de San Martín (2 002). Esta especie esta siendo depredada y comercializadas ilegalmente y si no hacemos nada para evitarlo pueden llegar a desaparecer. Pero esto se puede llegar a solucionar aplicando técnicas de propagación in Vitro a partir de semillas, siempre y cuando aseguremos su reproducción en cantidades adecuadas y las plantas propagadas serian distribuidas a viveros. Por tal motivo, planteamos un objetivo de desarrollar un protocolo para la propagación in Vitro del Phragmipedium kovachii a partir de semillas, evaluando medios en fase de germinación, multiplicación y enraizamiento.
Para lo cual es necesario conocer algunas referencias importantes como: la auxina (ANA) es una hormona de crecimiento, que estimula el desarrollo de raíces y que puede combinarse con la citoquinina para controlan la formación de brotes y raíces (Arditti 1990). Un medio de cultivo M&S suplementado con vitaminas, azúcar, ANA y BAP, permite una rápida germinación de las semillas y crecimiento de plántulas (Selena 1999). El medio de cultivo utilizado en fase de multiplicación para el cultivo de plantas es el M&S aumentado con BAP a 2mg/l y ANA 0.3 mg/l, y para fase de enraizamiento se complementa el medio con 1.5 g/l de carbón activado, 20g/l de sacarosa y auxina ANA (Aceves 2000). Se sugirieron también que para la fase de multiplicación se utilizara una combinación de 10 mg/l de BAP y 0,1 mg/l de ANA, para el desarrollo de plántulas con el incremento de hojas y raíz. Como también utilizar algunos aditivos en fase de multiplicación tal es el caso de agua de coco, el cual contiene fitohormonas con diferentes concentraciones como auxinas, citoquininas y giberelinas (Espinoza 2001). Para propagar semillas dehiscentes es necesario desinfectarla con una solución de hipoclorito de sodio (0.5 – 1%) por un periodo de 30 minutos (Arditti 1990). Y para propagar es necesario antes evaluar la viabilidad, luego desinfectarla con hipoclorito de sodio (0.5 – 1%) usando el método de la jeringa, para posteriormente sembrarlas, luego llevarlos al cuarto para su germinación que será entre 30 a 65 días (temperatura de 21 – 25º C, H.R. y fotoperiodo de 16/8), luego formaran plántulas de 2 a 3 cm después de 30 a 90 días de la germinación, entonces se pasa a un medio de crecimiento repitiéndose cada 30 días durante 180 a 360 días, hasta alcanzar una altura de 8 a 10cm (Rodríguez 1 996). También debemos conocer algunos datos de esta especie, por ejemplo es una planta terrestre, no forma rizomas, raíces de 64 x 4 mm, hojas plegadas a lo largo de su longitud, verde ligero, presenta una flor de 23 a 25 cm. de diámetro, son derechas y surgen del centro de las hojas, ella desnuda flores múltiples que abren consecutivamente, esto dependiendo de la especie, pubescente, púrpura con una sola bráctea verde 7 – 9 cm del escapo de largo, ovario de 8cm de largo, pubescente, marrón, bráctea floral aguda de 4 – 5.5. cm de largo. Sépalos algo cóncavos, denso de oro – marrón – pubescente; los pétalos 6 x 4.8cm ampliamente elíptico. Labelo de 5.5. – 7.5. x 3.5 – 4cm, estaminoide 1.3 x 2cm, cuerpo triangular a rombo, anteras que tocan casi los estigmas (Atwood 2002). Crece en pH a partir de 5.5. a más bajo, con temperaturas de 20 a 25º C, con humedad de 30 a 60%,la luz no tanto les afecta, dependiendo del habitad y se puede encontrar desde los 900 a 2500 m.s.n.m. (Zuiderwir 2003). Se sabe que esta especie de Phragmipedium ha sido muy debatida por haber salido ilegalmente del Perú, se puede resumir que el problema comienza cuando en la Selva del Perú (San Martín) en el mes de Junio del 2002, descubren una orquídea en forma de zapatito del tamaño de la palma de la mano, con hojas desarrolladas y verduscas, pétalos color púrpura, esta flor fue llevada a los científicos de jardines de Selby en EEUU, en julio del mismo año, el cual se dedicaron a estudiarla, lo que a una semana fue patentada como Phragmipedium kovachii, por ser única en su especie, pero el Perú presento una queja formal a los EEUU el cual arraigaron en los archivos de Selby por violar las leyes para proteger especies en peligro por los cazadores furtivos en Perú, ya que el costo superaba los $ 10 000 dólares (Rach 2004), pero se sabe que la región San Martín presenta una gran biodiversidad, y es una de las mas incomunicadas, con alta taza de desnutrición infantil, además afronta problemas de narcotráfico, terrorismo, desempleo, por eso se menciona que deberíamos rebautizar a la Phragmipedium kovachii con el nombre de Phragmipedium moyobambii o Phragmipedium peruvianum, haciendo honor al lugar de origen y denunciar el robo de esta especie salida de su lugar de origen como es San Martín – Perú (Mosquin 2003).
MATERIALES Y METODO
Materiales
Para propagar esta especie se utilizo materiales de laboratorio como: de Vidrio, M&S, vitaminas, proteínas, hormonas, equipos, reactivos y el material vegetal (cápsula dehiscente) entre otros.
Metodología
Para propagar esta especie se siguió un protocolo desde la germinación hasta el enraizamiento: Seleccionamos el material a propagar (cápsula dehiscente), luego procedimos a observar su viabilidad, si estaba en condiciones de propagarla, posterior a ello se realizo una desinfección con hipoclorito de sodio al 0.5% por un periodo de 20 minutos utilizando el método de la jeringa, todo esto en la cámara de flujo laminar. Luego procedimos a la siembra colocando en los tubos de ensayo de 25 x 150mm con el medio de cultivo establecido para cada fase y ubicarlos en el cuarto de incubación a T° de 21 a 25º C, humedad de 60% y fotoperiodo de 16/8, todo controlado por un timer. Al cabo de un tiempo las semillas comenzaron a germinar en el medio, a 8 semanas después de la siembra se observo el rompimiento de testa que cubre el embrión, posterior a ello se estableció medios para fase de multiplicación y para fase de enraizamiento, donde por cada tubo de ensayo colocamos 3 protocormos para observar los cambios que sufren.
Medio de germinación
Para lo que es germinación se utilizó el medio M&S (1962) con todos los stock, agregando a su composición vitamina (biotina) a razón de 0.33mg/l, fuente de carbono (glucosa y fructuosa a razón de 10.0g/l), con un pH de 5.1 5.4, todo esto enrazado a un litro de agua destilada, para colocar 10 ml/tubo.
Medios de multiplicación
Para esta fase se estableció tres medios de cultivo guiándonos del M&S(1962), donde en el primer medio agregamos vitamina (biotina a 0.33 mg/l), fuente de carbono (glucosa, fructuosa a 10 g/l), y aditivo (agua de coco 200 ml), con un pH de 5.11, y enrazado a 1 litro, y colocados a 10 ml/tubo de ensayo. En el segundo agregamos vitaminas (biotina a 0.33 mg/l), fuente de carbono (fructuosa a 10 g/l), hormonas: auxinas (ANA a 0.5 ml/l) y citoquinina (BAP 5 mg/l), con un pH de 5.28, enrazado a 1 litro y colocados a 10ml/ tubo. Y el tercer medio agregamos a la concentración vitamina (Biotina a 0.33 mg/l), fuente de carbono (fructuosa, glucosa a 10 g/l) anti oxidante (myo inositol 20 mg/l), hormonas: auxinas (ANA a 0.25 ml) y citoquinina (BAP a 2.5 mg/l), con un pH de 5.20 luego enrazamos a 1 litro, y colocamos 10 ml/tubo de ensayo.
Medios de enraizamiento
Para esta fase se estableció tres medios de cultivo siempre guiándonos del M&S (1962), donde en el primero agregamos vitamina (biotina a 0.33 mg/l), fuente de carbono (glucosa, fructuosa a 10 g/l), hormona: auxina (ANA a 0.5 mg/l), aditivo (agua de coco a 200 ml) con un pH de 5.12, donde enrazamos a 1 litro, agregando a 10ml/tubo. En el segundo medio agregamos vitamina (biotina a 0.33 mg/l), fuente de carbono (fructuosa 10g/l), hormonas: auxinas (ANA a 0.5 mg/l), citoquinina (kinetina 4 ml), anti oxidante (myo inositol 20 mg/l) y con un pH de 5.15, enrazado a 1 litro y colocado 10 ml/tubo. Y en el tercer medio agregamos vitamina (biotina a 0.33 mg/l), fuentes de carbono (fructuosa, glucosa a 10 g/l), hormona: auxina (ANA a 0.2 mg/l), aditivo (agua de coco a 100ml), con un pH de 5.14, todo esto enrazado a 1 litro. Y colocado a 10ml/ tubo de ensayo.
Todo estos medios colocamos en la olla autoclave a temperatura de 121º C y una presión de 15lb por un periodo de 20 minutos, luego de enfriado colocamos en el cuarto de incubación. Nos propusimos evaluar, viabilidad, germinación, contaminación, numero de hojas y altura de plántula en fase de multiplicación, así como altura de plántula y numero de hojas, numero de raíces y longitud de raíces en fase de enraizamiento.
RESULTADOS
Viabilidad
Se tomo 10 muestras al azar del total de semillas y en cada una se realizo el conteo, esto por medio del microscopio, obteniendo un promedio total del número de semillas por grupo lográndose 71.6, de los cuales el promedio de viabilidad fue de 35.6%. y las no viables de 64.4%.
Contaminación
Se evaluó presencia de microorganismos, esto a los 20 días después de la siembra, donde se obtuvo que un 50% estaban contaminadas y un 50% estaban en buen estado debido a la acción de algún patógeno, el cual se necesario eliminar los tubos contaminados.
 |
Germinación
La germinación comenzó a darse a los 30 – 35 días después de la siembra, evaluando las germinadas por cada tubo(15tubos), haciendo un recuento promedio del total de semillas, en este caso 145.9, del cual semillas germinadas fue de 36.9 con un porcentaje de 25.4%.
Rompimiento de testa
La velocidad de rompimiento de testa de semillas del Phragmipedium kovachii a los 60 días después de la siembra, en un medio de germinación durante 4 evaluaciones (semanal), obtuvo que cada semana en cada tubo evaluado (20 tubos) incrementaba el número de semillas que producían el rompimiento de testa, llegándose a obtener un total de 614 semillas/ 20 tubos evaluados en fase de germinación.
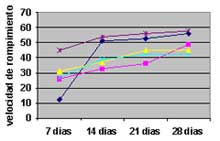 |
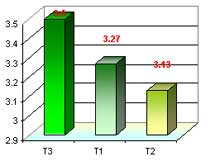
Número de hojas en fase de multiplicación
Evaluamos el número de hojas promedio en fase de multiplicación, cabe mencionar que establecimos tres medios con 10 repeticiones (3 protocormos/tubo) cada una, donde sacamos un promedio, obteniendo los siguientes datos: el T3 obtuvo un mayor número de hojas con 3.5, T1 con 3,27 y T2 con 3.13, esto a 20 semanas después de la siembra y repicada cada 30 días.
 |
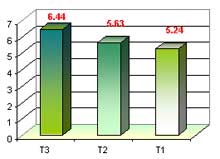
Altura de plántula en fase de multiplicación
Establecimos tres medios en fase de multiplicación con 10 repeticiones (3 protocormos/tubo) cada una, donde sacamos un promedio de altura de plántula, obteniendo los siguientes datos: el T3 obtuvo una mayor altura de plántula con 6. 44mm, T2 con 5.63mm y T1 con 5.24, altura de plántula, esto a las 20 semanas después de la siembra y repicada cada 30 días.
 |
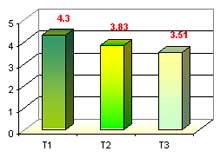
Número de hojas en fase de Enraizamiento
Evaluamos el número de hojas en fase de enraizamiento, donde establecimos 3 medios de cultivos con 10 repeticiones (3 plántulas/tubo) cada una, donde se saco un promedio, obteniéndose los siguientes datos: el T1 obtuvo un mayor número de hojas con 4.3, seguido del T2 con 3.83 y T3 con 3.51, esto evaluado a las 35 semanas después de la siembra.
 |
Altura de plántula en fase de enraizamiento
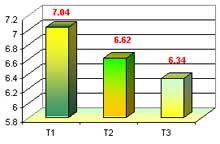
Evaluamos la altura de plántula en fase de enraizamiento, estableciéndose 3 medios de cultivos con 10 repeticiones (3 plántulas/tubo) cada una, donde al final sacamos un promedio y se trabajo, obteniéndose los siguientes datos: el T1 obtuvo una mayor altura de plántula con 7.04mm, seguido del T2 con 6.62mm y T3 con 6.34, esto evaluado a las 35 semanas después de la siembra.
 |
Número de raíces en fase de enraizamiento
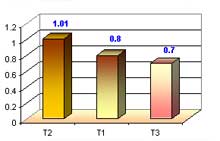
En esta etapa evaluación el numero de raíces en los tres medios de cultivo con 10 repeticiones (3 protocormos/tubo) cada uno y al final sacamos un promedio, obteniendo los siguientes resultados: el T2 obtuvo un mayor número de raíces con 1.01, seguido del T1 con 0.8 y el más bajo el T3 con 0.7, promedio de número de raíces, esto a las 40 semanas después de la siembra.
 |
Longitud de raíces en fase de enraizamiento
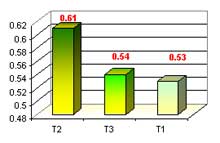
En esta etapa evaluamos la longitud de raíces en los tres medios con 10 repeticiones cada uno y al final sacar un promedio por cada uno, obteniendo los siguientes resultados: el T2 obtuvo una mayor longitud de raíces con 0.61mm, seguido del T3 con 0.54mm y el más bajo el T1 con 0.53mm, promedio de número de raíces, esto a las 40 semanas después de la siembra.
  |
DISCUSIÓN
En lo referente a Viabilidad se registro un 35.6% promedio de semillas viables, de un total de 71.6 semillas evaluadas, en un medio de germinación, esto se determina por medio del microscopio, la razón es para saber si las semillas son viables, conforme lo realizado por Rodríguez 1 996, que menciona que para determinar la viabilidad de las semillas, se puede realizar por medio del microscopio, donde se observar las semillas viables y vanas, Existe otro método como es el 2,3, 5 trifenil-tretazolium (TTZ) donde se puede distinguir las semillas viables y no viables, esto conforme lo mencionado por León (1 995).
Referente a contaminación podemos mencionar que se encontró que un 50% estaban contaminadas y un 50% bueno, esto debido a la acción de algún patógeno (Fusarium) que actuó en el medio, por esto es necesario las medidas de asepsia, es decir realizar una desinfección utilizando hipoclorito de sodio al 0.5 – 1%, conforme lo mencionado por Donayre 2 000, que indica que el material a sembrar pueda tener presencia de patógeno que pueda afectar el desarrollo y germinación, por esto es necesario desinfectar ya sea con hipoclorito de sodio o calcio, agua oxigenada (peroxido de hidrogeno) y alcoholes, en concentraciones mininas (0.1 – 0.5%). Cabe mencionar sobre desinfectantes, ARDITTI 1 999, sugiere que también podemos utilizar un agente que rompa la tensión superficial con la semillas (Tween 20) y que actúa esterilizando y desinfectándolo completamente y así evitar contaminaciones.
Lo que es germinación al cabo de 5 semanas después de la siembra en el medio de cultivo, se evaluó un total de 145.9 semillas germinadas, un promedio de 36.9 con un resultado de 25.4%, la razón es que el embrión comenzó a romper la testa, produciéndose la germinación, gracias a que el medio de cultivo influyo en la germinación donde absorbió los nutrientes que contenía el medio. Otro factor que ayudo fue las condiciones ambientales. Este resultado concuerda con lo planteado para el proceso de propagación in Vitro de Phragmipedium, por Rodríguez 1 996, donde menciona que las semillas germinan a 30 a 75 días. Referente al tiempo de germinación de las semillas, se menciona que pueden germinar de 40 a 70 días, gracias al medio de cultivo empleado y las condiciones ambientales, esto conforme lo mencionado por Donayre 2 000.
Respecto a rompimiento de testa a 60 días después de la siembra, en 4 etapas de evaluación, se produjo el rompimiento de la testa con un resultado total de 614 semillas que rompieron la testa, la razón fue que la testa al ser una estructura reticulada que cubre al embrión y esta compuesta por células indiferenciadas con cuerpos lipiditos y proteínas y al entrar en contacto con el medio de cultivo comienzo a desarrollarse y activarse realizo el rompimiento de testa, para posterior formar protocormos y después plántulas. Este resultado tiene relación con lo afirmado por Pierik 1989, cuando menciona que el proceso de rompimiento de testa es rápido y se da por las condiciones ambientales controladas.
Para lo que es número de hojas en fase de multiplicación se menciona que a 20 semanas después de la siembra se obtuvo resultados de T1 con 3.27, T2 con 3.13 y T3 con 3.5, esto nos indica que el factor determinante para la formación de brotes (desarrollo de hojas) y formación de raicillas sea la incorporación de BAP y ANA a los medios de cultivo empleados ya que ambos interactúan, aparte incluyendo otros reguladores de crecimiento que son sintetizada por los protocormos. Como lo sostiene Arditti 1 990, cuando menciona que las auxinas (ANA) y citoquininas (BAP) actúan directamente en el desarrollo de las plántulas, hojas e induce la salida de raíces, gracias a que las hormonas actúan en los procesos fisiológicos y metabólicos específicos dentro de un órgano. Se mencionar que el T2 obtuvo un bajo promedio con 3,13, con respecto al T1 con 3.27 y T3 con 3.50, debido a que no contenía agua de coco, el cual ayuda a un mejor desarrollo por contener fitohormonas, también no contenía un anti oxidante (myo – inositol) que evita fenolización o retrazo en el crecimiento. Tal como sostiene Espinoza 2 001, que afirma que para un mejor desarrollo se puede utilizar un aditivo como agua de coco, el cual posee una gran cantidad de componentes, entre ellos fitohormonas como: auxinas, citoquininas y giberelinas.
Sobre altura de plántula en fase de multiplicación se obtuvo valores de T1, con 5.24 mm, T2, con 5.63 mm. y T3 con 6.44 mm. Esto nos indica que hubo una reacción que muestran los protocormos a diversas concentraciones a que son sometidas y las variaciones que puedan contener el medio de cultivo y así puedan estimular, inhibir o modificar el desarrollo de los protocormos. Arditti 1 982, menciona que existe diferentes medios para orquídeas aparte del KNUDSON, donde incluye reguladores de crecimiento como hormonas (en pequeñas cantidades que estimulan, inhiben o modifican cualquier proceso fisiológico). Así mismo Arditti 1 990, menciona que las combinaciones de auxinas y citoquininas puede favorecer el mejor desarrollo de las plántulas, induciendo la formación de raíces, siempre que el medio permita interactuar los componentes.
Para lo que es número de hojas en fase de enraizamiento se obtuvo valores donde el T1 con 4.3 supero al T2 con 3.83 y T3 con 3.51, la adición de ANA fue el que permitió un mayor desarrollo y permitiendo la salida de raíces, esto corroborado por Aceves 2 000, que afirma que la fase de enraizamiento, se utiliza las sales minerales omitiéndose citoquininas (BAP) complementando con 1.5 g/l de carbón activado, 20g/l de sacarosa y auxinas (ANA) para favorecer el desarrollo de las plántulas. De la interacción de los medios de cultivos con respecto al número de hojas en fase de enraizamiento, respondió mejor el que tubo una dosis mas alta de hormona (auxina) y agua de coco, pero el tratamiento T2 formo menor número de hojas, en comparación al T1 y T3, debido a las hormonas utilizadas en cada medio. Espinoza 2 001, menciona que el agua de coco contiene fitohormonas (auxinas, citoquininas y giberelinas) que ayudan a un mejor desarrollo de las plántulas, siempre y cuando las concentraciones deben estar estandarizadas, para evitar problemas durante su desarrollo.
Lo referente a longitud de hojas en fase de enraizamiento se obtuvo resultados de T1 con 7.04 mm, T2 con 6.62 mm y T3 con 6.34 mm, se puede mencionar que la longitud de hojas en el T1 es de mayor en altura, de mejor desarrollo genotípico, demostrando que en este tratamiento existe un equilibrio entre las concentraciones del medio de cultivo y la constitución genética de la plántula mostrando cierta uniformidad en las hojas. Se puede mencionar también que en el T1con 7.04 mm obtuvo un buen tamaño ya que se aplico una buena concentración de agua de coco y ANA, el cual influyo mucho en la plántula, permitiendo un mayor desarrollo de las hojas y raíces, en comparación a los demás tratamiento T2 y T3. Espinoza 2001, menciona que para la fase de enraizamiento es necesario utilizar como hormona solo auxinas (ANA) a razón de 10 mg/l, y evitando usar citoquininas. Menciona Arditti 1 982, que la auxina (ANA) es una hormona que regula el crecimiento, estimula el desarrollo y formación de hojas y raíces.
Referente al numero de raíces en fase de enraizamiento se obtuvo resultados de T1 con 0.8, T2 con 1.01 y T3 con 0.7 donde el medio que obtuvo buen desarrollo fue el T2 ya que contenía auxinas (ANA), y en pequeña proporción citoquinina (kinetina) y myo – inositol. Según en lo referente a auxinas, Arditti 1 990, menciona que las plántulas responden a los cambios de medio y la composición que contengan, auxinas, ya que actúa directamente en la formación de raíces. Se menciona también que para la fase de enraizamiento, se utiliza las mismas sales MS, omitiendo citoquininas (BA). Agregado con 1.5 gr/l carbón activado, 20 gr/l de sacarosa y agregando auxinas (ANA) indicado por AVECES (2 000).
Referente a longitud de raíces en fase de enraizamiento se obtuvo resultados de T1 con 0.53 mm, T2 con 0.61 mm. y T3 con 0.54 mm. El T2 obtuvo un mayor desarrollo de raíces con 0.61mm debido a auxina permitieron un mejor desarrollo de raíces (auxinas), así como vitaminas (myo – inositol) . Arditti 1 982, menciona que las plantas para que se desarrollen deben obtener los nutrientes necesarios del medio y las condiciones favorables para su desarrollo, así como los procesos fisiológicos que ocurren en la plántula.
REFERENCIAS BIBLIOGRAFICAS
- ACEVES R. J.L. 2 000. Propagación comercial de plantas ornamentales por cultivo in Vitro de tejidos vegetales para beneficio social de la comunidad. Veracruz – México
- ARDITTI J. 1 977. Clonal Propagation of Orchids by Means of Tissue Culture _ A Manual. Pag. 203 – 293. En : Arditti (editor) Orchid Biology: reviews and Perspectives Vol. I Croneli University Press. Ithaca, New York.
- ARDITTI, J. 1 990. Lewis Knudson: His Science, His times and his legacy. Lindleyana. 5 Pp 1 – 79.
- ATWOOD J. 2 002. Phragmipedium kovachii. Jardín botánico de Missouri. EE.UU.
- BENNETT, D. 1 999. Phragmipedium – híbrido natural. Lima, Peru, Doc 5 Pag.
- CIRGERV. 1 994. Resúmenes del primer curso de propagación in Vitro de plantas ornamentales. Centro de investigación en Recursos genéticos y biotecnología. UNALM. Lima – Perú. Pp 35- 40.
- DONAYRE T. A. 2000. Métodos en la Propagación de semillas de orquídea. Laboratorio de Recursos Genéticos y Biotecnología. UNMSM. Lima – Perú.
- ESPINOZA G. A. 2 001. Proliferación de rhynchostele bictoniense (orchidaceae) a partir de semillas y explantes de material cultivado in Vitro. Universidad Nacional Autónoma de México – Laboratorio de Cultivo de Tejido vegetales.
- LEON, M. 1 995 Tesis “Conservación de Especies Peruanas de Orquídeas utilizando Técnicas de Cultivo de Tejidos In Vitro. UNALM. Pp 14 – 15.
- MC HATTON R.2 003. OCHID DIGEST. Volumen 67. Editorial Board. Oxford Road, san Marino – EEUU. Pp 216, 248 – 252.
- MOSQUIN D. 2 003. El ladrón de orquídeas Sociedad Peruana de la orquídea. Lima – Perú. http//www. Phragmipedium kovachii/el ladrón de orquídeas. com. pe.
- PIERIK R. L. M. 1 989. Cultivo in Vitro de las plantas superiores.
- RACH N. 2 004. El kovachii, emocionante Phragmipedium , supplement deSelbyana 23: 1, f.1.Houston – EEUU. Http://www.Phragmipeiumkovachii.com.
- RODRIGUEZ M.1 996. Estudio Comparativo de los Medios de cultivo In Vitro a partir de semillas en la especie Phragmipedium besseae Dodson & Kuhn. Universidad Peruana Cayetano Heredia. Maestría en Biología. Lima – Perú.
- SELENA L. A. 1 999. Propagación in Vitro de orquídeas a partir de semilla sexual. Universidad de Caldas – A. A. – Manizales – Colombia
- ZUIDERWIR R. 2 003. Phragmipedium web site (including mexipedium & selenipedium). New York – EEUU. Http://www.Phragmipedium.com.
Por: Blgo. M. Sc. W. F. RIOS RUIZ, Blgo. M. A. LEÓN MARTINEZ Y Ing. R. A. GÁLVEZ PANDURO
Laboratorio de Cultivos de Tejidos Vegetales (LCTV),
Facultad de Ciencias Agrarias (Agronomía).
Universidad Nacional de San Martín – Tarapoto, Jr. Maynas 177, Tarapoto, San Martín – Perú.
Correspondence: Ing. Roger Aly ( [email protected]), Blgo. Marco Leon ([email protected])