Cuales son los aportes de la ecotoxicología a las regulaciones ambientales
La ecotoxicología es la disciplina científica que estudia el efecto de las sustancias y compuestos químicos sobre los ecosistemas. Una característica de esta disciplina es que los conocimientos científicos y las tecnologías que desarrolla se utilizan para resolver problemas ambientales concretos. En todos los países existen normativas que regulan la presencia de compuestos químicos en el ambiente debido a sus posibles efectos tanto sobre la salud humana como sobre los ecosistemas.
Actualmente las normativas se fijan tomando en cuenta las principales características de los compuestos químicos que las hacen peligrosas para el ambiente, su toxicidad, su persistencia en el ambiente y su potencial de bioacumulación. Estas características ecotoxicológicas se estudian generalmente en el laboratorio. Las investigaciones realizadas directamente en el campo, que permiten detectar situaciones nuevas que no pueden predecirse a partir de estudios en laboratorio, también se consideran. Los estudios ecotoxicológicos son los que proporcionan la información científica que luego va a traducirse en legislaciones con distinto alcance: convenios internacionales que prohíben el uso de ciertos compuestos químicos a nivel mundial; regulaciones para las descargas de efluentes; autorizaciones para la aplicación deliberada de compuestos químicos (ej. pesticidas); evaluación y remediación sitios contaminados y clasificación de productos químicos. En este trabajo se desarrolla una revisión de los aportes de la ecotoxicología a las diferentes regulaciones, tanto a nivel internacional como nacional.
Antecedentes
El surgimiento de la ecotoxicología se relaciona con dos episodios que se produjeron como consecuencia de la contaminación del ambiente con sustancias químicas: la enfermedad de Minamata causada por el mercurio y la declinación de las poblaciones de aves silvestres por efecto de los plaguicidas clorados (Newman, 2001).
En el año 1950, en Japón, una empresa productora de acetaldehído que utilizaba mercurio como catalizador, vertía sus efluentes sin tratamiento en la Bahía de Minamata.
El mercurio, que es muy tóxico, se bioacumuló en los organismos y se transfirió a través de la cadena trófica marina, teniendo lugar un proceso de biomagnificación. Como resultado se produjo un aumento de la concentración del mercurio en aquellos organismos que ocupaban los niveles superiores de la cadena trófica, como peces predadores y aves piscívoras. Cientos de personas se intoxicaron por consumir peces contaminados con mercurio, lo cual provocó la muerte de muchas de ellas y dejó secuelas de por vida a otras.
La enfermedad de Minamata se puso de manifiesto cuando se enfermaron las personas; sin embargo, previamente se habían observado cambios en la vida marina, peces muertos, pulpos flotando, aves que se precipitaban al agua en pleno vuelo, y ataques en animales domésticos (gatos). Pero al no conocerse la causa de estos cambios no pudieron interpretarse esos hechos como una advertencia de lo que ocurriría luego con la población humana (Yorifuji, 2013).
El DDT, un compuesto orgánico clorado empleado como insecticida, se comenzó a usar durante la segunda guerra mundial. Es un compuesto tóxico, que permanece como tal en el ambiente durante mucho tiempo porque casi no se degrada y, al igual que el mercurio, se bioacumula y biomagnifica. Durante las décadas del 50 y 60, se observó una declinación de las poblaciones de aves silvestres en el hemisferio norte; se identificó al DDT y a otros pesticidas clorados usados en la agricultura como los agentes causantes de ese efecto.
Estos dos hechos (la tragedia de Minamata y la declinación de poblaciones de aves silvestres) mostraron la necesidad de conocer los efectos de las sustancias y compuestos químicos una vez presentes en el ambiente.
La ecotoxicología, disciplina que estudia justamente el efecto de los contaminantes químicos sobre los ecosistemas, surgió asociada con esa necesidad (Newman, 2001).
El famoso libro que Rachel Carson escribió en el año 1962, Primavera Silenciosa, sobre la declinación de las poblaciones de aves por efecto de los pesticidas, tuvo un gran impacto sobre la opinión pública; marcó la toma de conciencia sobre el efecto que las actividades humanas podían causar sobre la vida silvestre y sobre la necesidad de tomar acciones para protegerla (Werner y Hitzfeld, 2012).
Por otra parte, muchos autores asocian la difusión que alcanzó el libro de Rachel Carson con el surgimiento de una nueva rama del derecho, el derecho ambiental. Es una rama del derecho joven en comparación con otras, es muy extensa, y abarca muchos aspectos, por ejemplo la regulación de los compuestos químicos tóxicos, los recursos naturales o la protección de especies en peligro de extinción (Wright y Welbourn, 2002).
A partir de la conferencia de Naciones Unidas sobre Ambiente Humano que tuvo lugar en Estocolmo en el año 1972 se crearon, en muchos países, ministerios y secretarías de ambiente, y se promulgaron leyes ambientales.
Se consolidaron, a partir de esa fecha, programas de investigación, educación y regulación relacionados específicamente con la presencia de sustancias químicas en el ambiente. A partir de los años 60, se comenzó a controlar mediante legislación específica la liberación de sustancias tóxicas al ambiente, tanto desde los efluentes líquidos y gaseosos como aquellos de aplicación deliberada (por ejemplo, los pesticidas).
Hacia 1980 apareció otro problema en relación con las sustancias tóxicas, el cual requería un enfoque diferente y más complejo para su regulación.
En los tejidos de animales que vivían en las regiones árticas (osos polares, focas) se encontraron compuestos como pesticidas clorados y bifenilos policlorados, pese a que los mismos no se utilizaban en esas regiones. Se comprobó que estos contaminantes se podían transportar a través de la atmósfera hacia regiones muy alejadas del sitio de emisión. Estos compuestos se denominan Compuestos Orgánicos Persistentes (COPs), son muy resistentes a la degradación y muy bioacumulables y tóxicos (Wright y Welbourn, 2002). En el año 2004 entró en vigencia el Convenio de Estocolmo, al cual adhirieron la mayoría de los países, que prohibió el uso de compuestos orgánicos persistentes (COPs). La Argentina adhirió al Convenio de Estocolmo a través de la ley 26.011 del año 2004.
El caso del mercurio es similar al de los COPs, en el sentido que es persistente, puede transportarse a largas distancias, se bioacumula, biomagnifica y además es muy tóxico para el ser humano. El Convenio de Minamata, firmado recientemente por muchos países, tiene como objetivo proteger la salud humana y el ambiente de las emisiones y liberaciones por actividades humanas del mercurio y sus compuestos (PNUMA, 2014).
Los compuestos químicos en el ambiente
Las sustancias y compuestos químicos pueden llegar al ambiente a través de distintos caminos: el vertido de efluentes industriales y domésticos, derrames accidentales, el uso de pesticidas y fertilizantes en la agricultura, la disposición de residuos en rellenos sanitarios y desde sitios contaminados, entre otros. Una vez en el ambiente los compuestos químicos se transportan entre los distintos compartimentos (aire, agua y suelo), pueden transformarse y entrar en contacto con los organismos.
Las sustancias y compuestos químicos presentes en el ambiente pueden causar daños tanto sobre la salud de las personas como sobre los ecosistemas y en muchos casos, ambos daños coexisten. En el caso de Minamata, la contaminación con mercurio afectó tanto a la población humana como a la vida marina.
En la cuenca Matanza-Riachuelo, la contaminación del río causó efectos dañinos sobre el ecosistema acuático y sobre la salud de las personas que habitan en las cercanías de la cuenca (Causa Mendoza, 2015). El estudio de los efectos de los contaminantes sobre el ecosistema acuático entra dentro del ámbito de estudio de la ecotoxicología, mientras que los efectos sobre la salud de las personas están abordados por la toxicología ambiental.
Evidentemente existe una relación estrecha entre ambas, ya que muchos compuestos químicos que son dañinos para el ser humano también lo son para los organismos que habitan en el ecosistema.
Con el fin de proteger a los organismos y a los ecosistemas de los efectos dañinos que pueden causar las sustancias tóxicas, es necesario regular directamente las fuentes de contaminación e imponer restricciones para el uso de productos químicos. Esto se logra a través de legislación, que abarca convenios internacionales que prohíben el uso de compuestos químicos (por ejemplo, el Convenio de Estocolmo para Bifenilos Policlorados y Pesticidas Organoclorados), regulaciones locales que establecen las cantidades máximas de una sustancia o compuesto que puede volcarse a un cuerpo de agua o especifican el procedimiento para autorizar el uso de pesticidas.
Propiedades relevantes de los compuestos químicos desde el punto de vista ambiental
La toxicidad es una propiedad fundamental, pero la persistencia del compuesto químico en el ambiente determina si el mismo tiene el potencial de causar efectos a largo plazo. Aquellos compuestos degradables fácilmente, sea por mecanismos fisicoquímicos o mediante su biodegradación por los microorganismos, van a permanecer poco tiempo en el ambiente, y sus efectos tóxicos sobre los organismos serán de corta duración. Las sustancias y compuestos que se bioacumulan pueden causar toxicidad a largo plazo, ya que la toxicidad es una función de la carga tóxica en el organismo.
Las propiedades relevantes de las sustancias y compuestos químicos desde el punto de vista ambiental son la toxicidad, la persistencia en el ambiente y el potencial de bioacumulación.
Toxicidad : efectos de los compuestos químicos sobre distintos organismos
La toxicidad es el grado al cual un compuesto o mezcla es capaz de causar efectos nocivos a los organismos, por ejemplo muerte, inhibición del crecimiento, inhibición de la reproducción.
¿Cómo se determina la toxicidad de un compuesto químico?
Mediante la realización de ensayos de toxicidad, con distintos organismos, algas, crustáceos, peces, plantas, lombrices, por ejemplo. No existe un instrumento que pueda medir toxicidad. Las concentraciones de las sustancias que causan efectos nocivos se pueden medir con un instrumento, cromatógrafo, espectrofotómetro, pero la “toxicidad” se puede determinar solamente sobre un material vivo (Jorgensen, 2010).
¿Cómo se realiza un ensayo de toxicidad ?
En un ensayo de toxicidad, se expone a un grupo seleccionado de organismos a distintas concentraciones de sustancias y compuestos químicos puros, mezclas de sustancias o muestras ambientales durante un determinado período de tiempo. Las muestras ambientales pueden ser efluentes, suelos, sedimentos, y generalmente contienen muchas sustancias químicas diferentes.
Veamos dos ejemplos simplificados de ensayos de toxicidad, uno realizados con peces y otro realizado con algas.
Se han expuesto 10 peces a distintas concentraciones de una sustancia química, durante 96 horas; al finalizar este período se contó el número de organismos vivos y muertos para cada concentración ensayada.
Los resultados obtenidos se presentan en la Figura 1. Se realizó un control(sin el agregado de la sustancia) con 10 peces, que estaban todos vivos al finalizar el ensayo.
Analizando los resultados se observa que cuando los organismos están expuestos a concentraciones bajas de la sustancia (1,5 mg/l) no hay ningún organismo muerto; por el contrario, cuando están expuestos a concentraciones de 100 mg/l todos los organismos expuestos mueren.
La respuesta de los organismos está en relación con la concentración de las sustancias tóxicas: la exposición a concentraciones mayores causa efecto (en este caso mortalidad) sobre un mayor número de organismos. La relación entre la concentración del tóxico a la cual los organismos están expuestos y la respuesta de los organismos frente a la acción del tóxico, está descripta por lo que se denomina la relación concentración-respuesta.
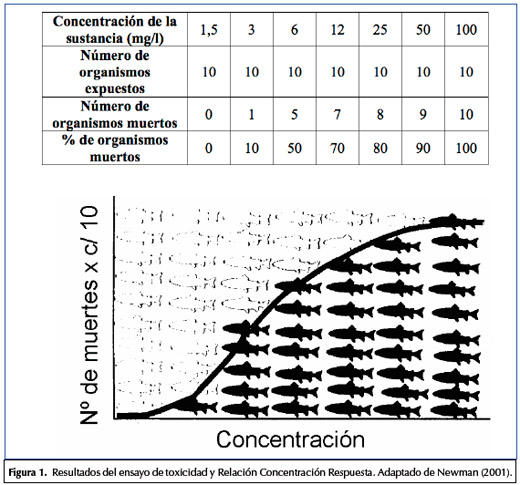 |
A partir de la relación concentración- respuesta se pueden establecer parámetros como la Concentración Letal 50 (CL50), que es la concentración del tóxico que mata al 50% de los individuos expuestos. Según los resultados del ejemplo presentado, el valor de la CL50 correspondería a una concentración cercana a 6 mg/l de la sustancia evaluada.
Si realizamos el mismo ensayo con distintas sustancias, y obtenemos la CL50 para cada una, este parámetro nos permite comparar la toxicidad de esas sustancias: las más tóxicas son aquellas para las cuales el valor de CL50 es menor, o en otras palabras, aquellas que a menores concentraciones causan efectos sobre un número mayor de organismos.
En el ensayo con algas se estudian los efectos de las sustancias sobre su crecimiento. En la Figura 2 se ve una observación al microscopio del alga que se utiliza para los ensayos de toxicidad. Estas algas son unicelulares, tienen forma de media luna y se reproducen por división. El ensayo consiste en colocar un número de células de algas en recipientes que contienen un medio de cultivo, con concentraciones crecientes de la sustancia cuya toxicidad se desea evaluar e incubarlos con luz continua y a temperatura controlada durante 72 horas.
 |
En la Figura 3 se puede observar el resultado de un ensayo de toxicidad empleando estas algas; si bien no se ven las algas, sí se puede ver un color verde, que es más intenso cuando el recipiente contiene un mayor número de algas las cuales se deben contar en el laboratorio al microscopio.
Se ve que en los recipientes que contienen mayores concentraciones de la sustancia a evaluar las algas no crecieron, no se ve color, y a menores concentraciones crecieron en forma similar al control. En un ensayo como este se determina la concentración de la sustancia que inhibe en un 50% el crecimiento de las algas respecto al control (Concentración inhibitoria 50, CI50) (Norma IRAM 29111).
¿Cómo se expresan los resultados de los ensayos de toxicidad ?
Los resultados de los ensayos de toxicidad se realizan con distintos organismos y se expresan con distintos parámetros como la CL50 y la CI50. Un parámetro importante quese determina a partir de estos ensayos es el NOEC (concentración para la que no se observa efecto), que es la mayor concentración de tóxico para la cual no se observa un efecto estadísticamente significativo respecto del control.
Persistencia de los compuestos químicos en el ambiente
El término “persistencia” se aplica a los compuestos orgánicos que no sufren transformaciones ni se degradan una vez liberados al ambiente. Si un compuesto permanece sin modificaciones en el ambiente durante largos períodos de tiempo y además es tóxico, las consecuencias serán más importantes que si se transformara en productos de degradación menos nocivos (Wright y Welbourn, 2002; SGA, 2013).
Los principales mecanismos de degradación en el ambiente son la fotólisis (degradación por efecto de la luz), la hidrólisis (ruptura de la molécula por reacción con agua) y la biodegradación.
La biodegradación es la ruptura de un compuesto orgánico por actividad de los microorganismos. La biodegradación completa, o mineralización, es la oxidación del compuesto orgánico, que es transformado en agua y dióxido de carbono por los microorganismos. Algunos compuestos orgánicos se biodegradan parcialmente, se altera la estructura química del compuesto original, pero se forman nuevos compuestos, cuya toxicidad es necesario evaluar.
La biodegradabilidad es una propiedad intrínseca de un compuesto químico y se estudia en el laboratorio utilizando microorganismos. Para el caso de los detergentes de uso doméstico e industrial se debe demostrar su biodegradabilidad como requisito regulatorio para la aprobación de los mismos.
Potencial de bioacumulación
La bioacumulación de una sustancia o un compuesto químico se produce cuando la cantidad que ingresa a un organismo es mayor que la que el organismo elimina. Como resultado de este proceso, la concentración del contaminante en el organismo es más elevada que la concentración en la fuente.
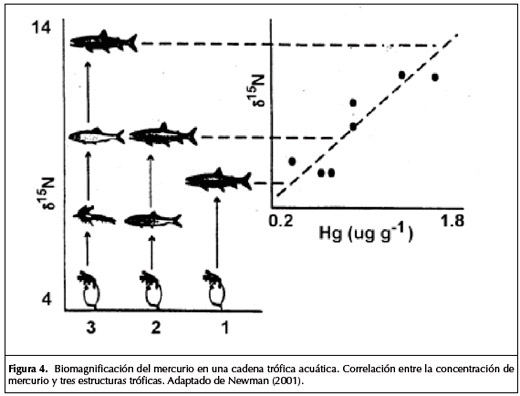 |
La acumulación de una sustancia a lo largo de niveles sucesivos de la cadena trófica se denomina biomagnificación. (Figura 4).
En la parte izquierda de la Figura 4 se presentan tres estructuras tróficas para la trucha: la trucha que se alimenta de zooplancton (estructura 1); la trucha que se alimenta de otro pez que a su vez se alimenta de zooplancton (estructura 2) y la trucha que se alimenta de otro pez, que se alimenta del camarón que a su vez se alimenta de zooplancton (estructura 3). El nivel trófico que ocupa la trucha en cada una de las tres estructuras tróficas se determinó mediante la cuantificación de la proporción de un isótopo del nitrógeno (15N) respecto del nitrógeno (14N) en el tejido de los organismos.
La relación entre ambos (d 15N) aumenta con cada intercambio trófico. En la mitad derecha de la figura están representadas las concentraciones de mercurio en las truchas de cada estructura y los valores para el d 15N para las truchas. Se evidencia una relación clara entre la concentración de mercurio y el nivel trófico de los individuos, indicando el fenómeno de biomagnificación.
Las sustancias con un elevado potencial de bioacumulación son peligrosas. Aunque las cantidades que lleguen al ambiente sean pequeñas, tanto los animales en el ecosistema como las personas pueden estar expuestos a altas concentraciones a través de la ingesta de organismos que bioacumularon la sustancia (por ejemplo, consumo de peces), como se demostró en el caso de la biomagnificación del mercurio en la bahía de Minamata.
¿Cómo se incorporan los conocimientos brindados por la ecotoxicolog ía en las regulaciones (legislaciones ambientales )?
Una vez identificadas las sustancias tóxicas y las concentraciones potencialmente dañinas de las mismas, es necesario limitar mediante regulaciones la cantidad de estas sustancias presentes en el ambiente.
El conjunto de normas que regulan las sustancias químicas en el ambiente contempla distintas situaciones: descargas de efluentes, aplicación deliberada de compuestos químicos (pesticidas), sitios contaminados, registro y clasificación de
productos químicos, entre otros. Una vez establecidos los límites es necesario realizar el monitoreo químico y biológico del medio receptor para verificar la eficacia de las acciones de control (Werner y Hitzfeld, 2012).
Para explicar cómo proceden los organismos encargados del control ambiental, vamos a ejemplificar con el vertido de compuestos químicos a cuerpos de agua superficiales desde efluentes líquidos.
Límites para el vertido de efluentes a cuerpos de agua superficiales
Las concentraciones de los compuestos químicos en los efluentes se fijan de forma tal que una vez diluidos en el cuerpo receptor, no afecten a los organismos que allí habitan.
En el procedimiento se definen los usos de cuerpo receptor, las características del mismo según los usos (niveles guía) y las concentraciones máximas admisibles para los vuelcos de efluentes.
Usos para los cuerpos de agua superficiales
En una primera etapa las autoridades de control ambiental asignan los usos para los cuerpos de agua superficiales. Algunos de los posibles usos son: fuente de provisión de agua para consumo humano, fuente de provisión de agua para consumo de animales (ganado), agua para agricultura (riego), agua para uso recreacional y preservación de flora y fauna acuática.
Caracter ísticas de calidad de las aguas según los distintos usos
Para que un cuerpo de agua pueda ser adecuado para un determinado uso, el agua debe reunir ciertas características de calidad fisicoquímica y microbiológica. Por ejemplo, si el oxígeno disuelto en el agua es muy bajo, los peces y otros organismos acuáticos no pueden respirar y ese cuerpo de agua no tiene las condiciones adecuadas para la preservación de la vida acuática.
Si en el agua tenemos sustancias tóxicas en concentraciones que afectan a la salud humana y a los organismos del ecosistema, el agua no reúne las condiciones adecuadas para uso como fuente de agua potable, ni para la preservación de la vida acuática. Por lo tanto para cada sustancia y compuesto tóxico que pudiera estar presente en el agua y de acuerdo a su uso, se deben establecer las concentraciones que no causen efectos adversos.
¿Cómo se fijan las concentraciones que no causan efectos adversos ?
Para fijar esas concentraciones, para el caso del uso como fuente de agua potable (apta para consumo humano con tratamiento convencional) se toma en cuenta el efecto de las sustancias sobre la salud humana y la eficacia de remoción de contaminantes que pueda tener el tratamiento que se realizará al agua para potabilizarla (por ejemplo, etapas de coagulación, sedimentación, filtración y desinfección).
¿Cómo se establece el valor de concentración que no causa efectos adversos sobre los organismos del ecosistema para una determinada sustancia? Para establecer las concentraciones de las sustancias tóxicas que no deben superarse en el cuerpo de agua con el fin de preservar la vida acuática, las agencias reguladoras utilizan distintas metodologías que no difieren sustancialmente.
Se emplea la información que proviene generalmente de los resultados obtenidos con ensayos de toxicidad realizados en el laboratorio, con distintas especies, como describimos en ítem ensayos de toxicidad.
¿De qué datos se dispone? De los valores de CL50, CI50, NOEC para las distintas sustancias, obtenidos mediante ensayos de toxicidad con distintas especies. Las agencias regulatorias utilizan toda la información actualizada disponible en la literatura científica.
Se utilizan dos enfoques para establecer el valor de la concentración que no causa efectos sobre los organismos (Calow y Forbes, 2003).
El término que se usa en inglés para nombrar esta concentración es PNEC (Predicted No-Effect Concentration). En la Figura 5 se representan los dos enfoques.
Enfoque 1: Factores de seguridad
Con los resultados de ensayos de toxicidad sobre varias especies, se elige aquel que corresponde a la especie más sensible, o sea el valor menor de CE50 o de NOEC.
En la mayoría de los casos los datos provienen de ensayos de laboratorio a corto plazo (agudos) realizados sobre unas pocas especies, entonces, ¿cómo extrapolar los datos de efectos a corto plazo a datos de efecto a largo plazo (crónicos)?, ¿cómo extrapolar los datos obtenidos sobre una especie al resto de las especies?, ¿cómo extrapolar los datos obtenidos en ensayos de laboratorio a un ambiente natural?
 |
Se utilizan factores de seguridad, también llamados factores de aplicación. Se elige el resultado obtenido con la especie más sensible y se divide ese resultado por un factor de seguridad, 10, 100 o 1000. Este factor es inversamente proporcional a la cantidad y calidad de los datos de toxicidad que se disponga. Como resultado de este procedimiento se obtiene un valor de PNEC, concentración por debajo de la cual se estima que no se producirán efectos adversos sobre los organismos del ecosistema.
Enfoque 2: Distribución de la sensiblidad de las especies
Es otro método para derivar el valor de PNEC. A partir de los resultados de NOEC obtenidos mediante ensayos crónicos para muchas especies, se construye una curva de distribución de frecuencias. Esta distribución se utiliza para estimar el valor de concentración que no supere el valor de NOEC para un porcentaje definido de especies; se adopta generalmente como criterio para establecer el valor de PNEC la concentración que proteja al 95% de las especies evaluadas.
En los dos enfoques descriptos se considera que si algunas especies están protegidas, el resto de las especies del ecosistema lo estarán también.
Niveles guía de calidad de agua
Los valores de concentración (PNEC) encontrados por alguno de los dos métodos antes descriptos, se establecen como “niveles guía de calidad” para mantener y proteger el uso asignado al recurso hídrico. En este caso, corresponden a los niveles guía para protección de vida acuática, los cuales se miden en el cuerpo de agua y se basan solamente en conocimientos científicos.
Cuando se establecen los niveles guía de un compuesto químico para la protección de vida acuática, no sólo se considera su toxicidad sobre organismos acuáticos, sino también su potencial de bioacumulación y su toxicidad sobre el ser humano. Si la sustancia es bioacumulable y puede biomagnificarse, las concentraciones que se esperan por ejemplo
en los peces, pueden ser tales que resulten tóxicas para los humanos cuando consuman esos peces. Así, se pueden llegar a establecer valores de niveles guías más restrictivos que si se consideraran solamente los valores de toxicidad sobre organismos acuáticos (SSRHN, 2003).
Los niveles guía deben ser revisados y actualizados en forma periódica, de manera de incorporar los avances científicos sobre los efectos de los compuestos químicos. En Argentina a partir del año 1998 se inició la elaboración de niveles guía de calidad de agua ambiente en el ámbito de la Subsecretaría de Recursos Hídricos con el objetivo de contar con pautas referenciales de calidad asociadas a la salvaguardia de los componentes bióticos involucrados en los distintos usos asignados al agua ambiente en Argentina. Los procedimientos utilizados para la fijación de niveles guía para protección de biota acuática fueron similares a los antes descriptos (SSRHN, 2003).
La Agencia de Protección Ambiental de los Estados Unidos (EPA) emplea una variante de este procedimiento: utiliza como mínimo la información para 8 especies y establece mediante un cálculo la concentración a adoptar como Nivel Guía (Stephan y col., 1985). En resumen, se considera que si en el cuerpo de agua la concentración de cada una de las sustancias se mantiene por debajo del Nivel Guía, no se espera que se observen efectos adversos sobre los organismos acuáticos, pero existen riesgos si ese nivel se supera (Bertoletti y Zagatto, 2008; SSRHN, 2003).
El valor para el Nivel Guía puede modificarse a medida que se realicen nuevos descubrimientos o nuevos avances científicos que hagan necesario cambiar estos valores, o incluir nuevas sustancias al listado.
Por ejemplo, el nonilfenol o el tributilestaño se incluyeron en la medida que se demostraron sus efectos perjudiciales.
Si bien estamos ejemplificando para los Niveles Guía de calidad de agua, procedimientos similares se emplean para establecer los niveles guía de calidad de suelos y sedimentos.
¿Cómo se fijan las concentraciones en los efluentes?
Cuando se quiere preservar la calidad del agua para un uso determinado o mejorar la calidad de la misma cuando haya una situación de contaminación, se debe actuar sobre las fuentes de contaminación. Se establecen regulaciones que fijan límites para distintos parámetros para autorizar el vertido de efluentes líquidos, industriales y cloacales a cuerpos de agua superficiales o a colectoras cloacales. Se controlan parámetros fisicoquímicos (pH, oxígeno disuelto, sólidos sedimentables, temperatura), microbiológicos (Escherichia coli) y químicos (mercurio, plomo, cadmio, detergentes) con el fin de proteger la vida acuática y la salud humana.
Estos límites, medidos sobre el efluente, se denominan estándares y son de cumplimiento obligatorio; se fijan de forma tal que los contaminantes en los efluentes, una vez diluidos en el cuerpo receptor, no superen los niveles guía de calidad de agua para el uso establecido. Los estándares se establecen para cada parámetro en las distintas cuencas hídricas. Las descargas a cuerpos de agua deben contar con un “permiso de vuelco”, que estipulan límites de concentración para compuestos químicos relacionados con el tipo de industria.
Como describimos anteriormente al definir los niveles guía, cuanto más tóxico sea un determinado compuesto, menor será la concentración de este compuesto permitida en el ambiente; la persistencia del compuesto y su potencial de bioacumulación se consideran para fijar los estándares que no representen un riesgo para los ecosistemas. Por ejemplo, la concentración máxima de mercurio en un efluente que descargue a colectora cloacal o cuerpo de agua en provincia de Buenos Aires debe ser menor de 0,005 mg/l; para arsénico la concentración máxima debe ser menor de 0,5 mg/l. El mercurio es más tóxico que el arsénico, y además se bioacumula, con lo cual la concentración que se permite volcar es más baja (Resolución 336, Autoridad del Agua Provincia de Buenos Aires, 2003).
La determinación de toxicidad en efluentes como herramienta para el control ambiental
Los efluentes son generalmente mezclas de muchos compuestos químicos; predecir la toxicidad de las mezclas complejas a partir de su composición es muy difícil, si no imposible (Jorgensen, 2010). Es por esto que en muchos países se realizan ensayos con el efluente completo, para evaluar su toxicidad. Las agencias regulatorias de muchos países implementaron el control de la toxicidad de los efluentes como un parámetro de cumplimiento obligatorio, por ejemplo, EE.UU., Brasil, Canadá, países europeos, Australia, Nueva Zelanda.
Los ensayos de toxicidad para el control de efluentes se realizan empleando procedimientos normalizados utilizando crustáceos, algas, peces y bacterias luminiscentes.
Distintas normas, (ISO, AFNOR, EPA, IRAM, etc.) describen los procedimientos para la realización de estos ensayos. Se estudia de esta forma el efecto sobre los organismos causado por todas las sustancias presentes en el efluente.
En Argentina, el Subcomité de Métodos Biológicos del Organismo Nacional de Normalización (IRAM) ha elaborado y publicado varias normas para la realización de los ensayos (ver cuadro). Este grupo de estudios de normas adapta a condiciones nacionales procedimientos normalizados internacionalmente, como por ejemplo la inclusión en las normas de especies autóctonas como organismos de ensayo.
¿Cómo se lleva a cabo el procedimiento para evaluar la toxicidad de un efluente?
Los ensayos de toxicidad se realizan sobre el efluente. Se exponen los organismos a diferentes concentraciones porcentuales del efluente en agua de calidad adecuada para el ensayo. Dependiendo de la composición química, algunos efluentes son tóxicos sobre uno u otro organismo ensayado, por lo que se recomienda realizar los ensayos sobre más de una especie; de esta manera se puede emplear el resultado obtenido con la especie más sensible (Bertoletti y Zagatto, 2008).
Una vez realizados los ensayos de toxicidad los resultados se expresan como se mencionó anteriormente: CE50, CL50, o CI50 y estos parámetros están expresados en porcentaje del efluente.
¿Cuál es la magnitud del parámetro “toxicidad” del efluente que se considera aceptable para el vuelco a un cuerpo receptor?
Esa magnitud va a depender de los caudales del efluente y del río al que se vuelque el efluente: la dilución del mismo en el cuerpo receptor deberá ser tal que no cause toxicidad aguda ni crónica, contemplando situaciones de bajo caudal.
 |
Los ensayos de toxicidad sobre efluentes se emplean como estrategia regulatoria con el fin de detectar la presencia de compuestos tóxicos no analizados químicamente; permiten evaluar el efecto conjunto de todas las sustancias y compuestos químicos detectando efectos sinérgicos, aditivos o de potenciación. Así mismo son útiles para predecir efectos en situaciones de sequía con un bajo caudal del cuerpo receptor y verificar la eficacia de los tratamientos de efluentes para remover toxicidad (Bertoletti y Zagatto, 2008).
En el caso de vertido de efluentes a colectoras, en algunos países (por ejemplo en España y Francia), se controla la toxicidad de los efluentes que luego serán tratados en plantas de tratamiento comunitarias. La toxicidad es un parámetro difícil de remover y las plantas comunitarias, que vuelcan luego a cuerpos receptores, no deben volcar toxicidad. La toxicidad se evalúa mediante ensayos con dafnias o bacterias luminiscentes.
Las autoridades fijan un máximo para el parámetro toxicidad que se puede volcar a la colectora, que varía según la jurisdicción. Cobran además un canon de saneamiento destinado a financiar los procesos de tratamiento de agua residual y este canon está determinado por la cantidad y calidad del efluente. La calidad incluye parámetros como DBO, DQO, que son comunes en la mayoría de los países y además la toxicidad del efluente vertido a la colectora. (Román Sánchez y col., 2013; Agencia del agua Sena-Normandía, 2015).
Monitoreo biológico
Los organismos residentes en los cuerpos de agua (algas, peces, invertebrados) completan allí la mayor parte de su ciclo de vida y por lo tanto están expuestos de manera continua a todos los contaminantes que lleguen al cuerpo de agua: efluentes industriales y domésticos, arrastre de pesticidas por agua de lluvia, entre otros. El biomonitoreo tiene como objetivo detectar cambios en la biota que pueden ser indicadores de efectos causados por los vuelcos, no detectados por los análisis químicos y de toxicidad realizados sobre el efluente. El biomonitoreo no es predictivo, ya que detecta efectos que han ocurrido, pero se utiliza para revisar si las acciones de control son suficientes o es necesario modificarlas.
Aguiluchos, sábalos y ostras.
A continuación vamos a describir algunos casos destacados que muestran la importancia del biomonitoreo en los estudios ecotoxicológicos y su aporte para regular el uso de sustancias químicas.
Las Ostras, los caracoles y el tributilestaño
Un caso relevante fue el del tributil- estaño (TBT por sus siglas en inglés), utilizado en pinturas antiincrustantes que se usan para impedir que se peguen algas y larvas de animales en los cascos de los barcos. La primera observación de los
efectos del TBT tuvo lugar en la bahía de Arcachon, Francia, una zona dedicada al cultivo comercial de ostras y a la navegación recreativa.
Durante el período 1960 a 1980 hubo un incremento significativo del número de embarcaciones en la bahía. En el año 1970, en Arcachon se observó imposex en un caracol (las hembras se masculinizaron), lo que determinó la desaparición
del caracol en la zona. Si los efectos nocivos se hubieran limitado a la desaparición de esa especie, no se hubiera tomado probablemente ninguna medida, pues este caracol atacaba a las ostras en los criaderos y era considerado una especie dañina. Sin embargo, el efecto del TBT se extendió rápidamente a las ostras en 1979, afectando la supervivencia de las larvas. Las ostras adultas no se podían comercializar debido a que el TBT provocó además deformaciones en su caparazón. Las pérdidas económicas fueron enormes (Santillo y col., 2004).
Estas observaciones se realizaron antes de disponer de técnicas analíticas suficientemente sensibles para describir en forma precisa la distribución del TBT en el ambiente. El gobierno francés, tomando en cuenta la información que establecía una relación entre la presencia de TBT y la afectación de la cría de ostras, prohibió en 1982 la aplicación de pinturas con TBT.
La toxicidad del TBT sobre las especies animales que se incrustan en los cascos de los barcos había sido muy estudiada pero los efectos sobre los organismos marinos no blanco se habían focalizado solamente sobre la toxicidad aguda y no permitieron identificar efectos subletales
como el imposex. El TBT interfiere también con el metabolismo del calcio, provocando deformación en el caparazón y mortalidad en las larvas de ostras (Santillo y col., 2004).
El descubrimiento del imposex en la Argentina se realizó en Mar del Plata en el año 2001; mientras se realizaba una tesis de doctorado sobre caracoles marinos (Penchaszadeh, 2009); se observó que las hembras no estaban en condiciones de reproducirse y que la población estaba formada por individuos viejos. Era la primera vez que se encontraba este fenómeno en la Argentina.
Años más tarde , investigadores del Centro Nacional Patagónico (CENPAT), del Museo Argentino de Ciencias Naturales, de la Universidad Nacional de Mar del Plata y el Centro Austral de Investigaciones Científicas de Tierra del Fuego (CADIC) realizaron un monitoreo de la contaminación con TBT en puertos patagónicos, utilizando el fenómeno de imposex en moluscos como bioindicador (Bigatti y col., 2009, 2011).
El estudio fue muy amplio, efectuado sobre 4700 km costeros, (desde Mar del Plata hasta Lapataia, cerca de Ushuaia, en Tierra del Fuego). Analizaron 41 puntos, tanto zonas portuarias como zonas de control entre puertos. Obtuvieron muestras de 1802 caracoles pertenecientes a 12 especies distintas y en siete de ellas observaron por primera vez el fenómeno de imposex. Los análisis químicos revelaron la presencia de TBT en todas las zonas portuarias, donde también se observaba el fenómeno de imposex. En las zonas prístinas, el porcentaje de imposex fue nulo (Bigatti y col., 2009). El monitoreo finalizó en el año 2008.
En el trabajo realizado, se comprobó que algunas especies son más sensibles que otras; esas especies son fáciles de encontrar y recolectar en los sitios de estudio, por lo cual pueden emplearse para realizar estudios de biomonitoreo e inferir así la contaminación con TBT.
Si se encuentra una población afectada, inmediatamente se sospecha que se está en presencia del contaminante (Bigatti y col., 2009; Penchaszadeh, 2011).
En Argentina el uso de pinturas que contienen TBT está prohibido desde el año 1998 para los barcos para usos recreativos (Prefectura Naval Argentina, Ordenanza 4/1998).
El fenómeno de imposex está muy difundido en casi todos los puertos del mundo, por ello se prohibió el uso del TBT en el año 2008 (Penchaszadeh, 2011). Sin embargo, trabajos más recientes en Argentina indican que no hay disminución de la presencia de este biocida en los caracoles ni en los sedimentos (Penchaszadeh, 2011). La permanencia media en el agua de este contaminante está estimada en nueve meses y cinco años en sedimentos, pero los datos del mes de diciembre del 2010 no mostraron disminuciones notorias de los niveles de TBT pese a su proscripción hace tres años (Penchaszadeh, 2011).
El TBT actúa como un disruptor endocrino, un compuesto exógeno que altera la función del sistema endocrino y como consecuencia causa efectos adversos sobre los organismos y sobre las poblaciones. Se sabe que los moluscos en las zonas portuarias acumulan TBT en sus tejidos y hay personas que suelen pescar caracoles para consumo, pero aún no se han evaluado los efectos sobre la salud humana.
El aguilucho langostero y el monocrotofos
Otro ejemplo de la transferencia a la legislación de los resultados de investigaciones en el ámbito de la ecotoxicología a través de biomonitoreo, tuvo lugar en nuestro país, con el caso del aguilucho langostero. A comienzos de la década del
noventa, técnicos de organismos públicos (INTA, SENASA) y ONGs de América del Norte, detectaron mortandades graves en la población del Aguilucho Langostero (Buteo swainsoni) en Argentina (Figura 6).
La estimación del número total de individuos afectados para la Región Pampeana fue de más de 20000 aguiluchos, aproximadamente el 5% de la población mundial estimada para la especie en aquel momento (Sarasola y col., 2007).
Realizados los análisis correspondientes, se determinó que el causante era el Monocrotofós que se aplicaba a las pasturas para controlar a las tucuras. Por un lado se prohibió en todo el país el uso de este plaguicida. (Resolución 189/99 de SAGPYA-SENASA). Por otro lado se implementó un programa de Monitoreo Ecotoxicológico de Biodiversidad de aves silvestres el cual continúa en la actualidad. El monitoreo del impacto de los agroquímicos sobre especies de vida silvestre permite detectar a tiempo problemas de toxicidad de los productos que se usan para control de plagas; y tomar decisiones sobre los usos de los fitosanitarios. Las aves son excelentes indicadores de impacto ambiental y de riesgos para la salud humana, debido a que lo que es peligroso para las aves será probablemente también peligroso para los mamíferos (Zaccagnini, 2004).
 |
Los sábalos y los PCBs
Los humanos consumen peces como alimento; la concentración máxima de distintos contaminantes en los peces está regulada (en Argentina, por el Código Alimentario).
Las poblaciones de peces de importancia pesquera se monitorean para determinar residuos de plaguicidas (organoclorados y algunos organofosforados) y de bifenilos policlorados (PCBs). Todas estos compuestos debido a su lipofilicidad se bioacumulan en las grasas presentes en el tejido muscular, que es la porción habitualmente consumida como alimento. Estos compuestos son tóxicos, por lo que el consumo de peces contaminados puede afectar la salud humana (Seigneur y col., 2014).
El análisis de contaminantes en tejidos de peces del Río Uruguay fue realizado por la CARU (Comisión Administradora del Río Uruguay); se analizaron sábalos, bogas, surubíes, dorados, bagres amarillos, patíes y viejas de látigo. Los resultados obtenidos en los biomonitoreos realizados durante el período 2010-2011 confirmaron bajos niveles de contaminación en peces, con tendencia decreciente respecto de años anteriores y en todos los casos muy por debajo de los límites aceptados para consumo humano (Seigneur y col., 2014).
En contraste, la situación en el Río de la Plata es muy diferente; aquí los investigadores encontraron niveles elevados de PCBs en sábalos (Prochilodus lineatus) (Figura 7), en concentraciones superiores a las recomendadas para consumo humano. Es así que la pesca de sábalo, tanto artesanal como comercial, se prohibió en la provincia de Buenos Aires en el año 2000 (Seigneur y col., 2014).
Evaluación de sitios contaminados
Existen muchos sitios contaminados, por ejemplo con hidrocarburos debido a derrames de petróleo, con metales tóxicos por actividades mineras o con compuestos peligrosos por disposición inadecuada de residuos. La limpieza (remediación) de estos sitios es generalmente muy costosa y compleja y no siempre es factible alcanzar los niveles de concentración previos al evento de contaminación.
Sin embargo, la existencia de contaminación química en el suelo u otros sustratos no representa automáticamente un riesgo. Lo que se considera prioritario es evaluar la probabilidad de que las personas o la biota estén expuestas a concentraciones que produzcan efectos adversos sobre las mismas. (Wright y Welbourn, 2002).
El procedimiento que se utiliza para tomar decisiones respecto de la limpieza de un sitio o las acciones de remediación es la evaluación de riesgo. La evaluación de riesgo en los sitios contaminados se realiza tanto para la salud humana como para la protección de los ecosistemas (evaluación de riesgo ecológico).
De manera sintética, el procedimiento de evaluación de riesgo ecológico se realiza de la siguiente manera: una vez determinadas las concentraciones de los compuestos químicos presentes en el sitio (concentraciones de exposición) se las compara con los valores correspondientes de PNEC (concentraciones de no efecto). Si las concentraciones en el sitio superan los valores de PNEC, se considera que la presencia de esos contaminantes representa un riesgo, es decir que hay probabilidad de que se produzcan efectos adversos sobre el ambiente por la presencia de esos contaminantes
(ver Figura 5) (Calow y Forbes, En las legislaciones para evaluación de sitios contaminados, se listan una serie de contaminantes con sus correspondientes concentraciones máximas que no deben superarse, si se superan se considera que el sitio está contaminado y se deben realizar acciones de remediación.
 |
Los ensayos de toxicidad fueron incluidos por ejemplo en la legislación española (Real Decreto 9/2005) a los fines de considerar un suelo como contaminado. Esta legislación propone, para aquellos casos en que se considere prioritaria la protección de los ecosistemas, la realización de ensayos de toxicidad en laboratorio con organismos del suelo y con organismos acuáticos.
En Argentina, el Programa para la Gestión Ambiental de Sitios Contaminados (PROSICO), (Resolución SAYDS N° 515/06), realiza acciones tendientes a la identificación, análisis y recomposición de sitios contaminados. La evaluación de riesgo ecológico es la herramienta propuesta para determinar la necesidad y magnitud de la recomposición de daños sobre los ecosistemas causados por la contaminación ambiental.
La eficacia de las acciones de remediación se evalúa mediante monitoreo químico para comprobar la remoción de los contaminantes, ensayos de toxicidad para comprobar que la remoción de los contaminantes se acompañe de remoción de la toxicidad y monitoreo biológico para evaluar la restauración ecológica (Calow y Forbes, 2014).
Productos que van deliberadamente al ambiente.
Caso Pesticidas
A nivel mundial, las leyes y regulaciones para los pesticidas consideran los efectos tóxicos, tanto sobre el ambiente como sobre el ser humano, así como estudios acerca de la movilidad y la persistencia en el ambiente.
En Argentina se debe demostrar, previamente a su comercialización, que un producto fitosanitario es eficaz para el fin que se destina y no entraña riesgos indebidos para la salud y el medio ambiente.
El manual de procedimientos del Servicio Nacional de Sanidad Agropecuaria (SENASA) establece en el Anexo de la Resolución 305/99 la información requerida para el uso de productos fitosanitarios, entre otras la información ecotoxicológica.
En el capítulo 7 de dicho manual, “Efectos tóxicos sobre otras especies”, se especifican los estudios de toxicidad (aguda y crónica) que deben realizarse sobre aves, organismos acuáticos (peces, dafnias, algas), abejas, artrópodos benéficos, lombrices de tierra y microorganismos del suelo (nitrificadores). La metodología utilizada para la realización de estos ensayos es similar a la que describimos anteriormente.
Se debe estudiar también la degradación y la bioacumulación de dichos productos. En función de las características de los productos, y de las concentraciones estimadas de los mismos en el ambiente, el SENASA evalúa y autoriza (o no) el uso de los productos y establece las restricciones. Durante los años 1950 y 1960 la mayoría de los plaguicidas que se usaban eran compuestos organoclorados y organofosforados. Como se mencionó anteriormente, el uso de pesticidas organoclorados fue prohibido paulatinamente en muchos países y reemplazado por otros principios activos, como carbamatos y organofosforados. La prohibición de ciertos usos de los organofosforados así como el surgimiento de insectos resistentes, condujo a un reemplazo gradual por otras clases de insecticidas como los piretroides. Estos insecticidas sintéticos son mucho menos persistentes que los organoclorados y menos tóxicos sobre mamíferos que los organofosforados, pero los peces y otros organismos no blancos son sensibles a concentraciones extremadamente bajas, muchas veces no detectables por técnicas analíticas. Se requiere entonces un sistema de monitoreo permanente y una constante revisión de las regulaciones por demanda de la población o porque surge nueva información científica (Werner y Hitzfeld, 2012).
Un ejemplo reciente fue la revisión de la autorización del uso de pesticidas de tipo de los neonicotinoides; mediante estudios de biomonitoreo, surgió nueva evidencia científica que estableció una asociación entre pesticidas y enfermedades en los insectos polinizadores.
Esto derivó en la restricción del uso de estos pesticidas en algunos países europeos (Maxim y Van del Sluijs, 2013).
Sistema Globalmente Armonizado de Clasificación y Etiquetado de Sustancias Químicas (SGA)
El SGA es un sistema de clasificación de productos químicos armonizado internacionalmente, desarrollado por las Naciones Unidas. Este sistema armoniza los criterios empleados para la clasificación y el etiquetado de sustancias químicas y así proporciona las bases para uniformizar la información relativa a los peligros que puedan presentar esas sustancias.
¿Cómo surge el SGA?
En la Agenda 21 (Capítulo 19) de la Conferencia de Naciones Unidas (1992), se estableció la necesidad de un sistema de clasificación y etiquetado de sustancias químicas armonizado a nivel mundial.
¿Por qué la Organización de Naciones Unidas desarrolló el SGA?
Con el fin de evitar que para una misma sustancia química se proporcionen informaciones diferentes acerca de las propiedades físicas, los peligros sobre la salud y sobre el ambiente. También para facilitar los intercambios comerciales de los productos, los cuales debían etiquetarse diferente según el país al que se exportaban porque los criterios que se empleaban para la clasificación eran distintos.
La armonización para la clasificación y etiquetado de productos ya se había logrado en el sector de transporte para los peligros físicos (por ejemplo, inflamabilidad, corrosividad) y para la toxicidad aguda, mediante el trabajo del comité de expertos de las Naciones Unidas para el transporte de mercancías peligrosas. El objetivo fue ampliar el alcance de la armonización a los trabajadores y consumidores.
El sistema a desarrollarse debía tomar en cuenta los sistemas de clasificación ya existentes y emplear símbolos de fácil comprensión.
¿Cómo se encaró la tarea de desarrollo del SGA?
En el año 1999 el Comité de Expertos en Transporte de Mercancías Peligrosas de Naciones Unidas se dividió en dos subcomités: el de expertos en transporte y el (nuevo) de expertos del SGA. Este nuevo subcomité trabajó en la redacción del documento, con la colaboración de la Organización Internacional del Trabajo (OIT), Organización para el Desarrollo Económico (OCDE) y el Subcomité de Transporte de Mercancías Peligrosas de Naciones Unidas entre otros. Dentro del subcomité, las decisiones se toman por consenso entre los países que forman parte del mismo y del cual Argentina es miembro pleno. La primera edición del documento es del año 2003. El documento se revisa en forma periódica cada dos años y se publica una nueva edición revisada. En este momento se encuentra vigente la 5ta edición revisada publicada en el año 2013 y durante el año 2015 aparecerá la 6ta edición revisada. Se lo conoce como “Libro Violeta” o “Libro púrpura”.
 |
¿Cómo está organizado el Libro?
El SGA considera tres grupos de peligros: peligros físicos, peligros para la salud y peligros para el ambiente. Dentro de cada grupo, distingue clases de peligro.
¿Cómo es el procedimiento de clasificación?
Para cada clase de peligro, el SGA establece las propiedades intrínsecas que debe presentar una sustancia para incluirla dentro de esa clase y, según el grado de peligrosidad de la sustancia, la categoría dentro de la clase
¿Cómo es el procedimiento de clasificación de los peligros sobre el ambiente?
El SGA considera dos clases de peligros para el ambiente, “peligros para el medio ambiente acuático” y “peligros para la capa de ozono”.
La clase “peligros para el medio ambiente acuático” incluye tres categorías de peligro agudo y cuatro categorías de peligro a largo plazo.
¿Cuáles son las propiedades intrínsecas que se utilizan para incluir una sustancia dentro de alguna de las categorías de peligro agudo para el medio ambiente acuático?
La propiedad clave que define este peligro es la toxicidad aguda sobre organismos acuáticos, determinada mediante los ensayos que describimos anteriormente, realizados sobre dafnias, peces y algas. Los valores de CE50, CL50 y CI50
obtenidos mediante estos ensayos permiten incluir y categorizar la sustancia dentro de la clase, como se puede ver en la Tabla 1.
Para definir el peligro a largo plazo, además de la toxicidad se debe tomar en cuenta el tiempo que esa sustancia va a permanecer en el ambiente.
Una sustancia que “desaparece” rápidamente no podrá causar efectos a largo plazo sobre los organismos. Por lo tanto, la degradación rápida de una sustancia es una propiedad clave para definir el peligro a largo plazo; una sustancia no degradable tiene potencial para causar efectos a largo plazo. Los resultados de ensayos de toxicidad crónicos en conjunto con las propiedades de degradabilidad de una sustancia se consideran para incluirla o no dentro de alguna categoría de peligro a largo plazo. El potencial de bioacumulación se tiene también en cuenta; si bien la bioacumulación no es un peligro en sí misma, va a resultar en una mayor carga del tóxico en el organismo.
¿Es un documento cerrado?
Como señalamos anteriormente, el libro se actualiza cada dos años, no es un documento cerrado. En lo que concierne a peligros sobre el ambiente, por ejemplo en la tercera edición se incluyó una nueva clase “peligros para la capa de ozono”. Clases de peligro que podría incluirse a futuro serían: peligros para los organismos del suelo y peligros relacionados con sustancias que afectan el sistema endocrino de peces.
¿El documento contiene clasificación de las sustancias?
No, proporciona un procedimiento para clasificarlas según sus propiedades intrínsecas, es método para clasificar peligros. El SGA utiliza la expresión “clasificación de peligro” para indicar que sólo se consideran las propiedades intrínsecas peligrosas de la sustancia.
¿Es de cumplimiento obligatorio?
Es de aplicación voluntaria en cada país. Muchos países ya lo han implementado, incorporando el documento a su normativa (Canadá, EE.UU., la Unión Europea, Brasil, Chile, Uruguay). En Argentina, la Resolución 801 de abril del 2015 obliga a rotular, confeccionar las hojas de seguridad de productos químicos según el SGA en el ámbito laboral.
Se dispone de normas voluntarias para la confección de hojas de seguridad y etiquetado que siguen los lineamientos del SGA (IRAM 41400 e IRAM 41401). Asimismo, Argentina recibió apoyo internacional de la Unión Europea a través del Proyecto Econormas y del Banco Interamericano de Desarrollo (BID) para la implementación del sistema.
¿El SGA incluye procedimientos para autorizar el uso de productos?
No. La autorización para los usos la establece la autoridad de aplicación correspondiente: por ejemplo, SENASA para pesticidas, ANMAT para productos desinfectantes. Como puede verse, en el procedimiento desarrollado en el SGA para la clasificación de sustancias y productos químicos se han incluido los conocimientos brindados por la ecotoxicología respecto de las propiedades relevantes de las sustancias y productos químicos desde el punto de vista ambiental.
Bibliografía
Agencia del agua Sena-Normadía (Agence de l’eau Seine- Normadie) www.eau-seine-normandie. fr/.Consultado 2015.
Bertoletti E, Zagatto PA. (2008). Ecotoxicologia Aquática, Princípios e Aplicações, Ed. Rima, 472 páginas.
Bigatti G, Averbuj A, Primost MA, Cledón M, Zabala S, Teso S, Cumplido M, Penchaszadeh PE. (2011). Contaminación costera en la Argentina: compuestos órgano-estañosos (TBT) y malformaciones sexuales (imposex) en caracoles marinos. En: Problemática de los ambientes costeros: Sur de Brasil, Uruguay y Argentina, Marcomini & López (Eds.), pp. 161-178.
Bigatti G, Primost MA, Cledón M, Averbuj A, Theobald N, Gerwinski W, Arntz W, Morriconi E, Penchaszadeh PE. (2009).
Biomonitoring of TBT contamination and imposex incidence along 4700 km of Argentinean shoreline. (SW Atlantic: From
38S to 54S). Mar. Pollut. Bull. 58: 695-701.
Calow P, Forbes V. (2003). Does ecotoxicology inform Ecological Risk Assessment? Environ. Sci. Technol. 37: 146A-151A.
Calow P, Forbes VE. (2014). Ecotoxicology. Chichester: John Wiley & Sons, Ltd.
Causa Mendoza. Centro de Información Judicial, especial Riachuelo – (www.cij.gov.ar/adj/ expedientes_riachuelo01.pdf). Consultado enero 2015.
Jorgensen SE. (editor). (2010). Ecotoxicoloy, a derivative of Encyclopedia of Ecology. New York: Elsevier-Academic Press, 402 pp.
Maxim L., Van der Sluijs J. (2013). Seed-dressing systemic insecticides and honeybees. Late lessons from early warnings: science, precaution, innovation. European Environmental Agency Report 1/2013, pp. 369-406.
Newman, M. (2001). Fundamentals of Ecotoxicology. Boca Raton: Lewis/CRC Publishers.
Penchaszadeh, PE. (2011). Efectos contra-natura por contaminación con estaño en zonas portuarias. Agencia de Ciencia, Tecnología y Sociedad, Universidad de La Matanza, 15 de agosto del 2011. (http://www.ctys.com.ar/index. p?idPage=20&idArticulo=1160).
Penchaszadeh, P E . ( 2 0 1 1 ) . Sustancias tóxicas provocan la masculinización de hembras en zonas de alto tráfico marítimo. Centro de Divulgación Científica de la Facultad de Ciencias Exactas y Naturales de la UBA. La Nación 30/06/09.
PNUMA. (2014). El convenio de Minamata sobre el mercurio y su implementación en la región de América Latina y el Caribe”, folleto, versión abril 2014.
Prefectura Naval Argentina Tomo 6. Régimen para la protección del medio ambiente, Ordenanza N° 4/1998 Normas para la prevención de la contaminación de las aguas proveniente de embarcaciones deportivas y de placer. Disposiciones para los clubes náuticos, guarderías, puertos recreativos y astilleros de embarcaciones. http://www.prefecturanaval. gov.ar/web/es/html/dpla_ordenanzas. php
Real Decreto 9/2005, del 14 de enero del 2005, BOE número 15, N° 895. (Legislación española).
Román Sánchez IM., Carra I, Sánchez Pérez JA. (2013). El uso sostenible del agua: tributos medioambientales y nuevos procesos de descontaminación mediante energías renovables. Estudios de Economía Aplicada 31: 197-216.
Santillo D, Johnston P, Langston W. (2004). Agents antisalissures au tributyletain (TBT): histoire de navires, d’escargots et d’imposex. Signaux précoces et leçons tardives: Le principe de precaution 1896 – 2000. Série sur les problemes environnementaux N° 22, Institut français de l´environnement, pp. 221-237.
Sarasola JH, Galmes MA, Santillán MA. (2007). Ecología y conservación del Aguilucho Langostero (Buteo swainsoni) en Argentina. Hornero 22: 173-184.
Seigneur G, Picotti G, Villamil E. (2014). Análisis de contaminantes en peces del Río Uruguay. Comisión Administradora del Río Uruguay, Informe bianual 2010-2011, Programa de Conservación de la Fauna Íctica y de los Recursos Pesqueros del Río Uruguay, Capítulo 7, 172- 185.
SGA, Sistema Globalmente Armonizado de clasificación y etiquetado de productos químicos, 4ta revisión. (2013). (http:// www.unece.org/trans/danger/ publi/ghs/ghs_rev02/02files_s. html).
SSRHN. (2003). Marco conceptual para el establecimiento de Niveles Guía Nacionales de calidad de agua ambiente. Metodología para el establecimiento de Niveles Guía de calidad de agua ambiente para la protección de la biota acuática. Subsecretaría de Recursos Hídricos, Argentina.
Stephan CE, Mount DI, Hansen DJ, Gentile JH, Chapman GA, Brungs WA. (1985). Guidelines for deriving numerical water quality criteria for the protection of aquatic organisms and their uses. U.S. Environmental Protection Agency, National Technical Information Service-PB 85 – 227049.
Werner I, Hitzfeld B. (2012). 50 years of ecotoxicology since Silent Spring – A review. Gaia 3: 217-225.
Wright D, Welbourn P. (Editores) (2002). Environmental toxicology. Cambridge Environmental Chemistry Series/11. Cambridge: University Press, 621 pp. Yorifuji T, Tsuda T, Harada M. (2013). Minamata disease: a challenge for democracy and justice, Late lessons from early warnings: science, precaution, innovation. Environmental European Agency Report N° 1/2013, 92 -130.
Zaccagnini ME. (2004). Por qué monitoreo ecotoxicológico de diversidad de aves en sistemas productivos. Larrea, E. (Ed.) INTA expone 2004, Volumen III INTA, Buenos Aires, pp. 69-89.
AGRADECIMIENTOS
A la Lic. Graciela Seigneur, Lic. Carlos Gómez y Lic. Leonardo Pflüger.
Al Instituto Nacional de Tecnología Industrial, a la Facultad de Ciencias Exactas y Naturales, CONICET, ANPCyT y UBA.
Por: Estela Planes*1 y Julio Fuchs2,3
1 INTI-Química. Edificio 38. Instituto Nacional de Tecnología Industrial.
2 IQUIBICEN, Departamento de Química Biológica, FCEN-UBA Ciudad Universitaria
3 Universidad Argentina John F. Kennedy