Contaminantes emergentes en aguas, efectos y posibles tratamientos
Resumen
Actualmente existe un creciente interés por los contaminantes emergentes (CE), ya que son compuestos de distinto origen y naturaleza química, cuya presencia en el medioambiente, o las posibles consecuencias de la misma, han pasado en gran medida inadvertidas, causando problemas ambientales y de riesgo para la salud. Estos compuestos se encuentran diseminados en el ambiente y se han detectado en fuentes de abastecimiento de agua, aguas subterráneas e incluso en agua potable. Son compuestos de los que relativamente se conoce poco, en cuanto a su presencia, impacto y tratamiento;en la mayoría de los casos son contaminantes no regulados, que pueden ser candidatos a regulación futura, dependiendo de investigaciones sobre sus efectos potenciales en la salud y los datos de monitoreo con respecto a su incidencia; por lo tanto, son susceptibles de investigación. Este artículo revisa algunas de los principales CE (pesticidas, productos farmacéuticos, drogas ilícitas, compuestos de “estilo de vida”, aseo personal y otros), el origen, uso y efectos nocivos; de igual manera analiza algunos tratamientos en potencia, para su eliminación. El uso de tratamientos fisicoquímicos, biológicos y avanzados, entre otros, se revisa. Particularmente, los tratamientos combinados se destacaron por su importancia en la eliminación de CE, ya que combinan tanto tratamientos fisicoquímicos, como biológicos, los cuales individualmente muestran alguna deficiencia.
Palabras clave: contaminantes emergentes, aguas residuales, medioambiente
Introducción
El término de contaminantes emergentes (CE) generalmente se utiliza para referirse a compuestos de distinto origen y naturaleza química, cuya presencia en el medio ambiente no se considera significativa en términos de distribución y/o concentración, por lo que pasan inadvertidos; no obstante, ahora están siendo ampliamente detectados y tienen el potencial de acarrear un impacto ecológico, así como efectos adversos sobre la salud1, 2. La característica de estos grupos de contaminantes es que no necesitan estar constantemente en el ambiente para causar efectos negativos, puesto que sus altas tasas de transformación/remoción se pueden compensar por su introducción continua en el ambiente1
. Se ha establecido que estos compuestos entran en el ambiente a través de algunas fuentes y vías, tales como aguas residuales de tipo doméstico e industrial3, 4, de los residuos de las plantas de tratamiento5 , de los efluentes hospitalarios6 , de las actividades agrícolas y ganaderas7 y de los tanques sépticos8 ,los cuales contienen un gran número de componentes orgánicos específicos y CEs que se producen a diferentes concentraciones en las aguas superficiales, cuyos criterios de calidad ambiental aún no se han podido especificar9, 10 y las plantas de tratamiento convencionales de aguas residuales no están diseñadas para eliminarlos11, 12; motivo de preocupación científica y para las entidades ambientales reguladoras9, 10.
Los CE comprenden una amplia gama de compuestos químicos, productos farmacéuticos, productos de cuidado personal, agentes tensoactivos, plastificantes y aditivos industriales, que no están incluidos en el monitoreo actual de programas de tratamiento de aguas; también incluyen la síntesis de nuevos compuestos químicos o cambios en el uso y disposición de los productos químicos ya existentes13, 14, de los cuales existe una limitada información disponible sobre el efecto que puede causar en la salud humana y en la ecología15. Por estas razones, la mayoría de las nuevas investigaciones han centrado sus estudios en la aparición de estos contaminantes orgánicos en aguas superficiales, como las utilizadas en actividades domésticas16, que luego reciben tratamiento químico; en aguas de arroyos17; aguas residuales con tratamiento biológico18, y en agua potable (de consumo humano)19, entre otras, ya que estas son más susceptibles de contener concentraciones mayores de CEs que las aguas subterráneas 2, 20. Este artículo muestra una revisión de los principales CE, sus efectos, y posibles tratamientos para su eliminación.
Tipos de contaminantes emergentes en el agua
Pesticidas o plaguicidas
Los pesticidas son sustancias o mezclas de sustancias destinadas a prevenir, destruir, repeler o mitigar las plagas. Debido a la regulación de la cual han sido objeto, se han estudiado durante décadas y, en consecuencia, se tiene un razonable conocimiento sobre su presencia y destino en el medio acuático. En los últimos años la preocupación en torno a estos productos se centra en los metabolitos, productos de degradación, que han sido en su mayor parte ignorados hasta la fecha y que se ha visto que pueden ser más tóxicos que los compuestos a partir de los cuales se generan21, 22, 23. Los estudios han demostrado que los metabolitos de plaguicidas a menudo se detectan en aguas subterráneas en concentraciones más altas en comparación con los compuestos precursores24, 25.
En un estudio realizado por el Reino Unido26, se reportaron concentraciones de metabolitos de plaguicidas medidos en las aguas subterráneas. Estos metabolitos se originaron a partir de compuestos no autorizados en el Reino Unido como DDT, heptacloro y atrazina. Estas tres sustancias hacen parte de la lista de las doce sustancias tóxicas más utilizadas en el mundo, incluidas en el tratado de las Naciones Unidas de mayo de 2001 en Estocolmo, Suecia; un total de 127 países adoptaron este tratado. Estas sustancias orgánicas están prohibidas ya que son persistentes, bioacumulables y poseen características de toxicidad capaces de ocasionar efectos adversos al ambiente y a la salud como cáncer hepático y defectos congénitos en personas y animales27. Parsons et al, llevaron a cabo una evaluación del riesgo a partir de metabolitos de plaguicidas, tanto para los EE. UU como para el Reino Unido. Para el Reino Unido, 54 productos fueron identificados como metabolitos de pesticidas. Los compuestos con mayor índice de riesgo fueron los metabolitos de cianazina, seguidos por los de isoproturon, flufenacet, el tebuconazol y el dicamba28.
El glifosato es ahora el herbicida más usado en el mundo, con aumentos dramáticos en el uso agrícola desde la introducción de cultivos resistentes al glifosato. La degradación microbiana produce amino metilfosfónico (AMPA) y se ha comprobado que el AMPA causa problemas en la salud. La alta solubilidad en agua del glifosato y su metabolito ha significado que el análisis sea difícil29.
En Antioquia, en un estudio realizado en el municipio de San Pedro, preocupa el uso de manera frecuente de plaguicidas de toxicidad alta como Lorsban (Clorpirifos), Ráfaga (Clorpirifos), Látigo (Clorpirifos), Neguvon (Metrifonato), Furadán (Carbofurán), Ganabaño y (Cipermetrina), que luego son arrastrados por las lluvias y van a parar a las aguas residuales y los ríos30.
En 1978, la Organización Mundial de la Salud (OMS) estableció una clasificación de los plaguicidas, basada en su peligrosidad o grado de toxicidad aguda31, definida esta como la capacidad del plaguicida de producir un daño agudo a la salud a través de una o múltiples exposiciones, en un período de tiempo relativamente corto32 (tabla 1).
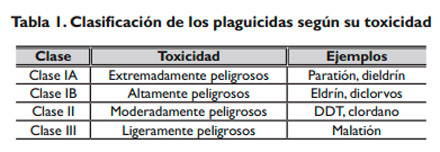 |
Por su vida media, los plaguicidas se clasifican en permanentes, persistentes, moderadamente persistentes y no persistentes33, 34, 35. Esta clasificación se muestra a continuación (tabla 2).
 |
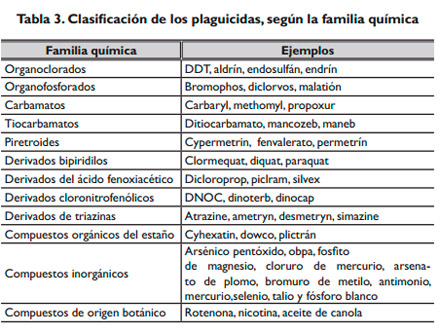
De acuerdo con su estructura química, los plaguicidas se clasifican en diversas familias, que incluyen desde los compuestos organoclorados y organofosforados hasta compuestos inorgánicos31. La tabla 3 muestra esta clasificación.
Son diversos los tipos de plaguicidas que en períodos prolongados, desde múltiples fuentes y a dosis bajas, penetran al organismo utilizando distintas vías. Las principales fuentes de exposición en la población son los alimentos de origen vegetal (frutas, verduras, cereales, leguminosas) o animal (carne bovina, porcina y sus derivados, pescado, productos lácteos, huevo, etc.)31, y en menor grado el agua, el aire, la tierra, la fauna y la flora contaminados. También lo son los productos industrializados de uso cotidiano que contienen o son plaguicidas en sí mismos y que afectan de manera directa o indirecta al ser humano. Se afirma que no hay segmento alguno de la población general exento de la exposición a estos compuestos y a sus potenciales efectos nocivos sobre la salud35, 36.
Es así, como algunos de los plaguicidas son relevantes por el daño que causan a la salud, por su gran demanda de uso y por considerarse como contaminantes emergentes en aguas residuales.
 |
Productos farmacéuticos
La presencia de productos químicos farmacéuticos en el medio acuático ha sido reconocida como una preocupación37. Las vías principales de productos farmacéuticos en el medio ambiente son a través de la excreción humana, la eliminación de los productos no utilizados y por el uso agrícola38. Una amplia gama de productos farmacéuticos se ha detectado en aguas superficiales y subterráneas, asociada con la eliminación de las aguas residuales39-42.Estos residuos farmacéuticos son transportados al ciclo del agua por diferentes rutas: las plantas de tratamiento de aguas residuales actúan como una puerta de entrada de estos productos a los cuerpos de agua, porque muchos de estos compuestos no son realmente retenidos en sus procesos y, además, porque muchos residuos farmacéuticos veterinarios son descargados directamente al ecosistema.
Lo que ha despertado una mayor preocupación con respecto a estos fármacos ha sido el hallazgo de algunos de ellos (como el ibuprofeno, el diclofenaco, la carbamacepina o el ácido clofíbrico) en aguas potables43.
Según las propiedades físico-químicas de los fármacos, sus metabolitos, productos de degradación, y las características de los suelos, estas sustancias pueden llegar a alcanzar las aguas subterráneas y contaminar los acuíferos o bien quedar retenidas en el suelo y acumularse pudiendo afectar al ecosistema y a los humanos a través de la cadena trófica1.
A escala mundial los fármacos más usados son analgésicos, antihipertensivos y antimicrobianos.
Analgésicos. Son uno de los fármacos de mayor consumo mundial y son considerados los de mayor automedicación44; el diclofenaco y el ASA se reportaron presentes en aguas residuales45, el naproxeno, el ibuprofeno y el acetaminofén se reportaron en aguas residuales hospitalarias46. De igual forma, se ha reportado la presencia de metabolitos del ibuprofeno47; lo anterior es indicador importante de la necesidad de conocer las rutas metabólicas de cada uno de los compuestos, para determinar o descartar el origen de su toxicidad48.
Antihipertensivos. Son usados frecuentemente ya que la hipertensión arterial es la enfermedad cardiovascular más común en el mundo. Constituyen un grupo muy amplio y dentro de ellos se destacan el calcio-antagonista, los inhibidores de la enzima convertidora de angiotensina y los betabloqueadores, entre otros. Algunos β-bloqueadores como el atenolol, el metoprolol y el propranolol han alcanzado niveles superiores a los 0.017µg/L en efluentes de aguas municipales49.
Antibióticos. Son fármacos de amplio uso en el mundo; su efecto contra microorganismos patógenos en animales y humanos, así como su uso para la preservación de alimentos, han incrementado su producción y consumo, permitiendo grandes descargas sobre los cuerpos de agua con manifestaciones de resistencia microbiana en las zonas de estudio. Hay evidencia de la presencia de residuos de antibióticos en el ambiente y su implicación en los mecanismos de defensa propios de los organismos vivos48. Entre los antibióticos con mayor reporte en los cuerpos de agua están las tetraciclinas50, los aminoglicósidos51, los macrólidos, los betalactámicos y la vancomicina52, entre otros53.
De otro lado, fármacos como disruptores endocrinos (asociados a la secreción de hormonas como la hormona estimulante de la glándula tiroides (TSH), la luteinizante (LH) y la estimulante del folículo (FSH)) no se remueven con facilidad en las plantas de tratamiento de agua residuales, y terminan en aguas superficiales y aguas para el consumo humano, exponiendo de forma crónica la especie humana a sus efectos tóxicos49, 54.
En Colombia, en una investigación realizada en el Hospital Universidad del Norte en Barranquilla, se encontraron, en los efluentes que se descargan al sistema de alcantarillado de la ciudad y este a su vez al río, sustancias de origen farmacéutico, que evidencian que los sistemas de tratamiento de aguas residuales deben ser repensados. Las sustancias de mayor uso en un hospital de esta categoría son los analgésicos, antinflamatorios como el diclofenaco, ibuprofeno y otros medicamentos como la aspirina, antisépticos como el triclosán, hormonas como el estriol y el estrona, estimulantes como la cafeína, y otras drogas de uso lícito en centros hospitalarios como la morfina. Asimismo, al realizar la caracterización química y biológica del agua residual del hospital se observó la presencia de metales pesados (mercurio, platino, gadolinio), anestésicos (alquilfenol, propofol), citostáticos, desinfectantes, analgésicos y antinflamatorios, medios de contraste y compuestos orgánicos adsorbibles55.
Las Instituciones Prestadoras de Salud (IPS) deben presentar su programa de reciclaje ante la Unidad Ejecutiva de Servicios Públicos y deben declarar ante la autoridad ambiental competente la lista de productos químicos peligrosos que utilizan. Los cuerpos hídricos del país son receptores de vertimientos de aguas residuales y su calidad se ve afectada principalmente por los vertimientos no controlados provenientes de diferentes actividades económicas; dentro de los parámetros que se utilizan para medir la contaminación del agua se pueden mencionar: metales pesados, sustancias peligrosas, Demanda Química de Oxígeno –DQO-, Demanda Bioquímica de Oxígeno -DBO5 – y Sólidos Suspendidos Totales –SST-. En cuanto a la generación de residuos infecciosos, las IPS deben formular el Plan de Gestión Integral de Residuos Hospitalarios; dicho plan debe incluir el análisis del riesgo, medidas de prevención y mitigación, protocolos de emergencia y contingencia y programa de rehabilitación y recuperación56.
Con respecto a los contaminantes emergentes relacionados con productos farmacéuticos, no se encuentra normativa ambiental ni estándares de vertimiento.
Drogas ilícitas Las drogas ilícitas y sus metabolitos son un gran grupo de contaminantes emergentes. Ellas entran a la red de aguas residuales como drogas inalteradas y/o sus metabolitos activos por excreción humana, saliva, y sudor, después del consumo ilegal o por la eliminación accidental o deliberada de los laboratorios clandestinos de drogas57.La disminución de la concentración, en los efluentes de aguas residuales y superficiales, depende de las tecnologías utilizadas en los distintos procesos de aguas residuales en las plantas de tratamiento; además, la eficiencia de remoción del tratamiento depende de la carga y la naturaleza molecular de los fármacos y sus metabolitos58.Tanto las drogas ilícitas como sus metabolitos, son muy recalcitrantes a la eliminación de tratamientos convencionales fisicoquímicos y biológicos; por lo tanto, es necesario utilizar procesos de oxidación avanzada, ozonización, osmosis, etc.; sin embargo, la mayoría de los tratamientos no los incluyen debido a sus altos costos, lo que significa que tanto las drogas como los metabolitos son liberados a las aguas superficiales e incluso en agua potable59, 60. Entre los contaminantes de drogas ilícitas más estudiadas están la anfetamina, la cocaína y su metabolitos benzoilecgonina, norcocaína; metanfetamina, heroína, (3,4-metilendioximetanfetamina) MDMA, además de la morfina61, 62. Las concentraciones de estos en el agua bajan de acuerdo con los días y horas; en las noches las concentraciones bajan, mientras en los fines de semana se ven incrementadas63. La determinación de su concentración en el ambiente es una herramienta indirecta para estimar los niveles de consumo en la comunidad y evaluar el potencial impacto ecotoxicológico.
Aunque las concentraciones de las diferentes drogas y sus metabolitos en las aguas superficiales se encuentran en el rango de nanogramos por litro, sus posibles efectos sobre la fauna y la salud humana no se pueden descartar, especialmente en las poblaciones vulnerables60.
Hormonas esteroides
Son encontradas en las aguas, ya que naturalmente el hombre las contiene, se producen en células específicas de los testículos, la corteza adrenal, ovarios y placenta. Los testículos serían los encargados de secretar, principalmente, testosterona (andrógenos), la corteza adrenal produce la aldosterona, cortisol y la DHEA (dehidroepiandrosterona), los ovarios producen los estrógenos que engloban el estradiol, 4-androsteno-3, 17-diona y la progesterona, y por último estaría la placenta que también secreta estradiol y progesterona, pero además produce otra sustancia, el estriol64. Igualmente existen hormonas sintéticas de amplio uso, entre las que se incluyen las píldoras anticonceptivas65. Tanto los estrógenos como los andrógenos se introducen al medio ambiente a través de los efluentes de aguas residuales de las plantas de tratamiento, donde no son eliminados completamente66, y actúan como disruptores endocrinos67. Los estrógenos son un grupo de compuestos esteroides, llamados así por su importancia en el ciclo de celo y en la función primaria de la hormona sexual femenina68, siendo un compuesto muy abundante y excretado constantemente por las mujeres65; entre los más estudiados están los estrógenos naturales estrone, 17-β-estradiol y estriol; y estrógenos sintéticos como el 17-α-etinilestradiol69-71; mientras entre los andrógenos, los compuestos naturales como testosterona y androstenoide66, además de los sintéticos como oxandrolona y nandrolona, son los más investigados, por su ocurrencia en las aguas superficiales y subterráneas65, 72.
Compuestos. “Estilo de vida”
La cafeína, la nicotina, y el metabolito de la nicotina han sido ampliamente detectados en el agua subterránea impactada por aguas residuales. Godfrey et al.73, Seiler et al74 y Teijón et al75 y Van Stempvoort et al76, encontraron altas concentraciones de los edulcorantes artificiales de acesulfame, sacarina, ciclamato y sucralosa en las aguas subterráneas afectadas por estanques de infiltración de aguas residuales, y Buerge et al77 mostraron acesulfamo a ser ampliamente detectada en el medioambiente debido a su uso, la movilidad y la persistencia.
En algunos estudios realizados en España en las Islas Canarias se encontró que la cafeína y la nicotina son frecuentemente detectadas en los acuíferos y también en el delta del río Llobregat (77,4% y 71,7%, respectivamente). Otros compuestos detectados, en porcentajes menores, fueron teobromina y la teofilina (50% cada uno en las Islas Canarias) y paraxantina (6% en el área de Llobregat)43.
Las fuentes comunes de cafeína incluyen tanques sépticos, así como el tratamiento de aguas residuales de descarga a las aguas superficiales y subterráneas de la superficie de intercambio de agua en los sistemas acuíferos aluviales,8,73,78.
Cuidado personal
Los productos de cuidado personal son producidos para uso directo sobre el cuerpo humano. En general estos productos están dirigidos a alterar el olor, el aspecto, el tacto, y no deben mostrar actividad bioquímica significativa. Muchos de estos productos son usados como ingredientes activos o preservativos en cosméticos, productos de baño o fragancias. En ocasiones estas sustancias son usadas en cantidades mayores a las recomendadas79. Los productos de cuidado personal que hacen parte de los contaminantes emergentes son: perfumes, fragancias, policíclicos y macrocíclicos; agentes de protección solar, Benzofenona, metilbenzilidenecambor; repelentes de insectos: N,N-dietiltoluamida80.
Los productos de cuidado personal se diferencian de los farmacéuticos ya que en grandes cantidades pueden ser directamente introducidos al ambiente; por ejemplo estos productos pueden ser liberados dentro de las aguas recreacionales o volatilizados en el aire76. Estos productos pueden afectar a los organismos acuáticos y a los humanos en ciertas concentraciones, estando presentes como: DEET-N, N-dietil-meta-toluamida, el ingrediente activo más común de los repelentes de insectos; parabenos -ésteres de alquilo del ácido p-hidroxibenzoico, utilizados desde los años 1930 como agentes bacteriostáticos y fungistáticos en medicamentos, cosméticos, y alimentos; bactericida y agentes antifúngicos-, triclosan ampliamente utilizado en productos domésticos, tales como rociadores de dientes, jabón y anti-microbianas; almizcles policíclicos -tonalide y galaxolide utilizados como fragancias en una amplia gama de agentes de lavado y de limpieza y de higiene personal-; filtros de protección solar UV/, compuestos principalmente por aromáticos conjugadoslipofílicos, detectados en medio acuoso81, filtros orgánicos que incluyen las benzofenonas y methoxycinnamates82. Adicionalmente, en un estudio realizado por Lindström et al, detectaron triclosán y un metabolito el metiltriclosán, en aguas superficiales en Suiza83. Asimismo, Heberer, en una de sus investigaciones, muestra los resultados de las concentraciones de almizcles sintéticos que se encuentran en las aguas residuales, en los lodos de estas, en las aguas superficiales y muestras de biota; estas investigaciones se centraron en estudiar cómo afecta la bioacumulación de estos productos el metabolismo de los peces, y la evaluación del riesgo ambiental y humano84.
Surfactantes
Comprende residuos de agentes tensoactivos, entre los cuales se incluyen dos grandes tipos de tensoactivos aromáticos, tales como: tensoactivos aniónicos del tipo sulfonato alquilbenceno lineal (LAS) y no aniónicos del tipo alquilfenolpolietoxilado (APEO)16. Estos se usan como detergentes, agentes adherentes, dispersantes, emulsificantes, solubilizantes y agentes espumantes. Asimismo, son importantes en aplicaciones industriales, como son: papel y celulosa, textiles, recubrimientos, pesticidas agrícolas, aceites combustibles y lubricantes, metales y plásticos85, por lo que muchos estudios han evaluado la concentración de estos en ríos, lagos y aguas costeras86-90. La producción de los surfactantes aniónicos representan alrededor del 55% de los surfactantes producidos anualmente en el mundo. Los surfactantes no iónicos están en el segundo rango por orden de importancia con un poco menos del 40% del total94. Los APEO pasan al ambiente directamente de las plantas de tratamientos de aguas residuales, donde son parcialmente degradados aeróbicamente y parcialmente absorbidos por los lodos residuales93. Se ha demostrado que los APEO presentan mayor toxicidad que los propios agentes tensoactivos que les dan origen; sus productos de degradación, principalmente nonil y octil fenoles, adsorben fácilmente los sólidos suspendidos, quedando con la propiedad para imitar hormonas naturales por interacción con el receptor de estrógenos, posiblemente unido a un recuento decreciente de esperma masculino y efectos cancerígenos; aunque hay más poco riesgo que cuando se utilizan tensoactivos aniónicos y catiónicos92.
Productos para tratamientos de aguas
Los procesos químicos de desinfección en el tratamiento para agua potable conducen a la formación de subproductos de desinfección que son indeseables, debido al potencial de toxicidad crónica93.
Por lo general, son el resultado de la oxidación de componentes de la mezcla en el agua. Existe un debate sobre la importancia de la desinfección por productos en comparación con el riesgo de enfermedades trasmitidas después del tratamiento94, ya que, aunque la desinfección reduce el riesgo de infección patógena, puede representar una amenaza para la salud humana, debido a los residuos de desinfectantes y sus subproductos (DSP)95, 96, los cuales se forman principalmente cuando los desinfectantes reaccionan con la materia orgánica, de origen natural, y los contaminantes antropogénicos, tales como bromuro y yoduro97, quedando presentes en el agua. Además, con el fin de asegurar la desinfección lo mejor posible, muchos proveedores han introducido múltiples metodologías, en las que combinan desinfectantes de uso común (cloro, ozono, dióxido de cloro y cloraminas) en las plantas de tratamiento, donde cada combinación puede interactuar con la materia orgánica disuelta para producir sus propios DSP en el agua98, 99. Más de 250 DSP han sido identificados, pero solo se conoce adecuadamente el comportamiento de 20 DSP96. Entre ellos tenemos el cloro, el cual es ampliamente usado para la desinfección de agua, porque es relativamente barato y eficaz en la eliminación de microorganismos patógenos, y proporciona protección residual en los sistemas de distribución de agua100. Sin embargo el cloro y sus especies relacionadas reaccionan para producir DSP. De estos, los trihalometanos (THM) y ácidos haloacéticos (AHA) se encuentran en mayores concentraciones en el agua potable tratada101; entre ellos, los que han sido investigados incluyen yodo-THM y yodo ácidos, que se encuentran en niveles más altos después de la cloración; subproductos de ácidos hipobromosos (producto de la reacción entre el bromuro y el ozono) con materia orgánica natural, aunque en menores cantidades97, 102, halonitrometanos y haloaldehídos, que son realzados por la pre-ozonización; un alto contenidos de compuestos mutagénicos MX, que se ven favorecidos por concentraciones de cloro, dióxido de cloro, cloraminas y nitrosaminas que se incrementan por la cloraminación97.
Aunque los resultados han sido un poco inconsistentes, algunos estudios epidemiológicos sugieren que puede existir una asociación entre la exposición de los DSP y mayor riesgo de resultados adversos del desarrollo, incluyendo bajo peso al nacer, retraso del crecimiento intrauterino103, 104, defectos congénitos tales como tubo neural, cardiovascular105 y aborto espontáneo106. Debido a que el conjunto epidemiológico de estos contaminantes necesariamente no es una casualidad, es necesario realizar estudios de toxicidad de cada subproducto en forma individual para poder determinar la forma de desinfección del conjunto total.
Aditivos industriales y subproductos
Hay una amplia gama de compuestos industriales que pueden ser liberados al medio ambiente. Muchos de estos causan problemas en la salud, tales como los disolventes clorados, hidrocarburos de petróleo, incluidos los hidrocarburos poliaromáticos y el combustible oxigenado de éter de metilo butilo terciario, y los plastificantes / bisfenoles resinas, adipatos y ftalatos107-109. La mayoría de estos compuestos industriales se clasifican como contaminantes prioritarios y algunos productos de degradación son considerados como contaminantes emergentes. Algunos de estos productos son: 1,4-dioxano, un estabilizador usado con 1,1,1-tricloroetano que es muy soluble en el agua subterrá- nea, resistente a los procesos de biodegradación de origen natural, no se unen fácilmente a los suelos, y se lixivia fácilmente a las aguas subterráneas110. En 2008, la prueba, patrocinada por una organización de consumidores independiente, encontró 1,4-dioxano en casi la mitad de los productos estudiados de cuidado personal, derivados de benzotriazol que se encuentran en productos farmacéuticos tales como medicamentos antifúngicos, antibacterianos, y antihelmíntico. Benzotriazoles son persistentes en el medio acuoso111, 112. Dioxinas se pueden producir como consecuencia de la degradación de otros microcontaminantes por ejemplo, del aditivo antimicrobiano triclosán113, 114. Otros como detergentes, plastificantes y retardantes de fuego han sido reportados. El bisfenol A se utiliza como plastificante y fuentes comunes incluyen agua residual tratada, así como los tanques sépticos y rellenos sanitarios115 117.
Otros compuestos usados industrialmente como estabilizadores incluyen disolventes, agentes tensoactivos e inhibidores de corrosión118.
Retardantes de llama/fuego
La prevención de incendios en la industria ha disminuido gracias a la aplicación de retardantes de llama químicos en muchos productos industriales, utilizados en los últimos años. Aunque aportan en prevenir incendios, salvar vidas, prevenir daños, reducir costo económico por incendios119, los retardantes de llama, así como muchos otros productos químicos, no son eliminados totalmente en las plantas de tratamiento, por lo tanto aportan a la contaminación emergente en el agua. Entre los retardantes de llama, se encuentran aquellos compuestos basados en organofosfatos, tales como el tris (cloro isopropil) fosfato (TCPP) y tris(2-cloro etil) fosfato (TCEP), usados en productos industriales y de consumo.
El TCPP ha sido encontrado con mayor frecuencia y mayor concentración que el TCEP119. Igualmente, también se han encontrado compuestos bromados entre los que se destacan, el polibromadodifenil éter (PBDEs), hexabromociclododecano (HBCD) y decabromodifeniletano (DBDFE) los cuales se aplican a una diversidad de compuestos o mezclas de compuestos químicos incorporados en plásticos, textiles, circuitos electrónicos, entre otros120, 121. En todo el mundo, aproximadamente 5.000.000 de toneladas de bromo, se producen cada año, y a partir del 2000, la cantidad de este tipo de retardante representa el 38% de demanda mundial de bromo, un incremento marcado comparado con el 8% en 1975119. Wu, et al., encontraron niveles de PBDE en la fauna silvestre, incluyendo invertebrados acuáticos, peces, aves y algunos mamíferos de especies marinas. Las concentraciones son crecientes a lo largo de la cadena alimenticia y de concentraciones más elevadas en fuentes de sitios cercanos de reciclaje de residuos electrónicos123. Estos compuestos se asocian con ciertos efectos en la salud, tales como la toxicidad sobre el comportamiento neurológico, disruptor endocrino y, posiblemente cáncer119, 122, 123.
Los aditivos alimentarios
El citrato de trietilo se usa como aditivo alimentario para estabilizar espumas, por ejemplo, la clara de huevo; también se utiliza en recubrimientos farmacéuticos y como plastificante. Hidroxianisolbutilado (BHA) e hidroxitoluenobutilado (BHT) se utilizan para prevenir el deterioro de la grasa en alimentos. Otros aditivos alimentarios incluyen alcanfor, 1,8-cineol (eucaliptol), citral, citronelal, cis- 3-hexenol, heliotropina, ácido hexanoico, mentol, alcohol feniletílico, triacetina, y terpineol. Algunos de estos pueden estar implicados como agentes oxidantes o disruptores endocrinos125.
Los aditivos alimentarios que se han detectado en las aguas subterráneas son el acesulfame edulcorantes, sacarina y sucralosa126, así como otros agentes de conservación, tales como parabenos. Este grupo de compuestos no han sido ampliamente estudiados en las aguas subterráneas, pero se considera que son de cuidado y se deben tener en cuenta en estudios futuros.
Algunos ftalatos (n-butilftalato, benzilbutilftalato) suelen usarse en la industria de envasado de alimentos, tratamientos de suelos, como antioxidantes alimentarios y como aditivos en plásticos para proporcionarles elasticidad, en productos tales como bolsas de transfusión de sangre, tetinas y mordedores infantiles. Estos sustancias incorporan compuestos catalogados como contaminantes emergentes1, 127.
Tratamientos de eliminación de contaminantes emergentes
Los tratamientos de aguas residuales empleando métodos convencionales no son del todo satisfactorios, al punto que se ha detectado que muchos compuestos persisten sin alteración alguna aún después de aplicar tratamientos terciarios128. Por tal razón, es importante identificar y evaluar la eficiencia de otras tecnologías para el tratamiento de aguas, con el fin de proponer alternativas que permitan minimizar la presencia de CEs un bajo costo económico, energético y ambiental.
Además, debemos ser conscientes de que los contaminantes disruptores endocrinos, productos farmacéuticos y de cuidado personal poseen una amplia gama de propiedades químicas y, por lo tanto, el éxito de su eliminación varía mucho en función de sus propiedades particulares. Es así como los métodos de tratamientos para la eliminación de CE se pueden clasificar en tres categorías: fisicoquí- micos, biológicos y avanzados124.
Tratamientos fisicoquímicos
Dentro de los tratamientos fisicoquímicos para remover CE, se encuentran procesos tradicionales de tratamientos de aguas tales como la coagulación y la floculación. Sin embargo, estos son incapaces de remover compuestos de rompimientos de endocrinas (nonilfenol, estrona (E1), estradiol (E2) y muchos otros), productos farmacéuticos y productos de cuidado personal, por sí solos124.
Ultrafiltración
Los procesos de separación fisicoquímicos que emplean membranas, tales como la ultrafiltración (UF), son tecnologías cuyo uso se está incrementando en el campo de los tratamientos de agua y aguas residuales que producen agua clara disponible para diferentes aplicaciones129. Sin embargo, la UF individual, algunas veces es inefectiva para la remoción de la mayoría de los CE, debido a la capacidad de retención limitada de las membranas de UF como también al fouling de la membrana130.
Por lo tanto, los procesos de filtración con membranas deben combinarse con pretratamientos o postratamientos para producir un permeado que pueda reutilizarse, tales como etapas de coagulación o adsorción, que permitan remociones adicionales de compuestos orgánicos que juegan un papel importante en el fenómeno de fouling. Específicamente el carbón activado de potencia (PAC) y el carbón activado granular (GAC) en combinación con la UF son tecnologías prometedoras para el tratamiento de agua. Los beneficios de la combinación PAC/UF se deben a la capacidad de adsorción del PAC y a la habilidad de la membrana de UF para retener compuestos y partículas de alto peso molecular (incluyendo las partículas de PAC). Por lo tanto, la combinación PAC/UF permite la remoción de compuestos de masa molar baja que no serían removidos por la membrana UF sola130.
Oxidación
De otro lado, la oxidación es un mecanismo de remoción prometedora especialmente cuando se emplea cloro u ozono. Sin embargo, se requiere hacer una selección cuidadosa, ya que la reacción de estos químicos produce bioproductos cuyos efectos se desconocen124.
El ozono ha sido ampliamente usado como un oxidante en el tratamiento de agua potable, y en repetidas ocasiones se ha propuesto para eliminar compuestos orgánicos en el tratamiento de aguas residuales. La molécula de ozono puede reaccionar con muchos compuestos orgánicos; particularmente aquellos insaturados o que contienen anillos aromáticos o heteroátomos también son capaces de descomponerse en agua para formar radicales hidroxilo131.
Empleo de adsorbentes
Los procesos de adsorción no generan subproductos no deseables al agua potable; sin embargo, se requieren altas tasas de consumo de absorbente en el caso de usar carbón activado para absorber contaminantes orgánicos polares. Varios estudios evaluaron la absorción de CE individuales sobre carbones activados en agua ultrapura y en competencia con materia orgánica natural; sin embargo, solo unos pocos han evaluado la remoción de una mezcla de contaminantes por medio de absorción con carbón activado132.
Rossner et al. 132 emplearon un carbón activado, una resina carbonácea y dos zeolitas de alto contenido de sílica con el fin de evaluar la efectividad de remoción de una mezcla de EC de agua de lago.
Tratamientos biológicos
Johnson y Sumpter mostraron que tratamientos como lodos activados y filtros de goteo biológico pueden convertir rápidamente compuestos orgánicos acuosos en biomasa que luego se puede separar de la fase acuosa por sedimentación135. Aun así, no todos los compuestos tales como esteroides o estrógenos son completamente degradados o convertidos a biomasa. En general, los tratamientos biológicos solo remueven una parte del amplio rango de CE, particularmente los polares124.
Tratamiento con membranas
La tecnología de biorreactores con membrana se considera como el desarrollo más prometedor en el tratamiento microbiológico de aguas residuales133. Esta tecnología combina un proceso de degradación biológico usando un lodo activado, con una separación sólido-líquido a través de un proceso de UF133. Es así como esta tecnología puede ser clave en el reciclaje directo e indirecto de aguas residuales, debido a dos de sus características: la baja carga de lodos en términos de DBO, de manera que las bacterias quedan forzadas a mineralizar pobremente compuestos orgánicos degradables y la larga vida de los lodos que da a las bacterias tiempo para adaptarse a sustancias resistentes al tratamiento133.
Aunque este tratamiento ha ganado popularidad y se han reportado varias de sus aplicaciones, existen pocos artículos en los que se describe el comportamiento de los CE durante el tratamiento por medio de biorreactores con membrana133, 134.
Tratamientos combinados
Rosal et al.131 evaluaron la efectividad de un proceso de tratamiento de aguas residuales para la remoción de una serie de sustancias con muestras tomadas antes y después de un proceso de lodo activado biológico con remoción de nutrientes. Esta investigación también trató de identificar el impacto de exposición de ozono sobre contaminantes individuales encontrados en el efluente secundario. Los compuestos incluyen principalmente farmacéuticos y productos de cuidado personal, como también algunos metabolitos.
Tratamientos avanzados
Entre los procesos que se han empleado para eliminar diversos tipos de CE, también se encuentran los procesos de oxidación avanzada, los cuales generan radicales hidroxilo en cantidades suficientes para ser capaces de oxidar la mayoría de compuestos químicos complejos presentes en aguas residuales. Entre estos proceso se incluyen la cavitación (generada tanto por medios de irradiación ultrasónica como por medio de constricciones del fluido empleando válvulas, orificios o venturis, entre otros), la oxidación fotocatalítica (usando radiación UV o luz solar en la presencia de catalizadores semiconductores) y química de Fenton (usando reacciones entre iones Fe y peróxido de hidrógeno)136.
Se reportan estudios de oxidación avanzada, que usan una combinación de ozono con otros agentes oxidantes (radiación UV, peróxido de hidrógeno, TiO2 ) para mejorar la degradación de productos farmacéuticos polares y metabolitos NPEO133.
Entre los métodos de oxidación avanzada, la fotocatálisis heterogénea es la más estudiada. Este proceso utiliza fotocatálisis nanoestructurada para maximizar la absorción de fotones y reactivos. Este proceso tiene ventajas tales como el bajo precio y la estabilidad química de la mayoría de los fotocatalizadores utilizados (TiO2). Sin embargo, su aplicación al tratamiento de grandes volúmenes de agua es difícil, debido al costo de la radiación artificial a través de lámparas UV eléctricas18.
Ternes et al, usaron una planta piloto para la ozonización y la desinfección UV de efluentes de una planta de tratamiento de aguas residuales que contenía antibióticos, beta bloqueadores, antiflogísticos, metabolitos reguladores de lípidos, fragancias de musk y medios de contraste de rayos X yodados; después de emplear entre 10-15 mg/L de ozono con tiempos de contacto de 18 min, no se detectaron compuestos farmacéuticos. Sin embargo, los compuestos de contraste de rayos X yodados exhibieron eficiencias de remoción no más altas del 14%137.
Nanofiltración con membranas
La tecnología de filtración por membranas tales como las ósmosis inversa y la nanofiltración ha mostrados ser una alternativa prometedora para eliminar contaminantes. En comparación, la nanofiltración es menos efectiva que la ósmosis inversa, ya que en esta última se puede tener una remoción casi completa de contaminantes pero su alto consumo energético la hace desfavorable123.
Conclusiones
En la actualidad, existe un creciente interés por conocer el efecto de los denominados contaminantes emergentes, los cuales no habían sido objeto de investigaciones profundas en épocas anteriores cercanas, debido al desconocimiento de su presencia en el ambiente, dada su baja concentración en el aire, el suelo y el agua.
Una amplia gama de CE está siendo estudiada en el medio acuático alrededor del mundo. Se incluyen los pesticidas, productos farmacéuticos, drogas ilícitas, compuestos de “estilo de vida”, de cuidado personal, surfactantes, aditivos industriales y subproductos, retardantes de llama, aditivos alimentarios, entre muchos, los cuales, por sus bajas concentraciones, no son eliminados eficazmente con los tratamientos de agua convencionales; estos pueden ser acumulados y causar un gran impacto en la salud y el medioambiente, y generar algunos problemas como disruptores endocrinos y problemas hormonales, entre otros.
Dado que a través del empleo de tratamientos de aguas convencionales, no se logra la remoción de CEs, los proyectos de investigación que se formulen y ejecuten en este campo deben dirigirse a la búsqueda del entendimiento de los mecanismos a través de los cuales los CEs se transforman en procesos de remoción biológica y avanzada, buscando siempre una relación entre la eficiencia de remoción y las propiedades fisicoquímicas del agente contaminante, así como las de los distintos medios reactivos propios de cada tratamiento.
Los procesos combinados, tales como la UF acompañada de la adsorción con carbón activado, se perciben como prometedores para el entorno local, dado que el control de propiedades que influyen en el rendimiento de remoción, tales como el volumen o tamaño de poro, está al alcance de centros de investigación en universidades e industria, a través de tecnologías que ya han sido probadas en el medio.
De manera similar, los tratamientos en biorreactores con membrana prometen lograr la recuperación de aguas con una calidad que, desde el punto de vista ecológico, son enriquecidas con respecto a las aguas tratadas convencionalmente. Por una parte, porque así se minimiza el empleo de otros agentes químicos y, de otro lado, porque las tecnologías de biorreactores también han sido probadas por centros de investigación e industrias en el entorno local.
En general, considerando que el país dispone de recursos para la construcción de plantas y reactores de tratamientos de agua residuales domésticas e industriales, la búsqueda de tratamientos eficaces para la remoción de los CEs carece del conocimiento de mecanismos de ocurrencia y transformación de estas sustancias. Es por ello, que las investigaciones que se planteen al respecto deben enfocarse en encontrar la manera de adecuar las tecnologías existentes de tratamientos de aguas en procesos avanzados de remoción de CEs avanzados.
Los estudios realizados sobre este tipo de sustancias en el ambiente, particularmente, en las aguas de tipos residual, subterránea y potable, se han reportado en contextos muy generales y por fuera del entorno colombiano. Es así como esta revisión, además de mostrar la importancia de conocer el efecto de los contaminantes emergentes sobre la salud humana, busca hacer un llamado a los entes reguladores de las normas de calidad de aguas para que lideren procesos de investigación encaminados a la construcción de un inventario de los contaminantes emergentes que puedan encontrarse en el contexto local.
Referencias bibliográficas
1. BARCELÓ, Damiá y LÓPEZ, María J. Contaminación y calidad química del agua: el problema de los contaminantes emergentes. En: Panel Científico- Técnico de seguimiento de la política de aguas. Instituto de InvestigacionesQuímicas y Ambientales-CSIC. 2007. Barcelona
2. STUART, Marianne; et al. Review of risk from potential emerging contaminants in UK groundwater. En: Science of the Total Environment. 2012. Vol. 416. p. 21
3. DAUGHTON, Christian. Non-regulated water contaminants: emerging research. En: Environ Impact Asses Rev. 2004. Vol. 24. p. 711-32.
4. FENT, Karl; WESTON, Ana y CAMINADA, Daniel. Ecotoxicology of human pharmaceuticals. En: Aquat Toxicol. 2006. Vol. 76. p.122-59
5. KOLPIN, Dana et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in US streams, 1999-2000: a national reconnaissance. En: Environmental Science and Technology. 2002. Vol. 36. p.1202-1211
6. KÜMMERER, Klaus. Drugs in the environment: emission of drugs, diagnostic aids and disinfectants into wastewater by hospitals in relation to other sources da review. En: Chemosphere. 2001. Vol. 45. p. 957-969.
7. WATANABE, Naoko; et al. Use and environmental occurrence of antibiotics in freestall dairy farms with manure forage fields. En: Environmental Science and Technology. 2010. Vol. 44. p. 6591-6600.
8. SWARTZ, Christopher; et al. Steroid estrogens, nonylphenolethoxylate metabolites, and other wastewater contaminants in groundwater affected by a residential septic systemon Cape Cod, MA. En: Environmental Science and Technology. 2006. Vol. 40. p. 4894-4902.
9. KAŠTELAN-MACAN, Marija; et al. Water resources and waste water management in Bosnia and Herzegovina, Croatia and the State Union of Serbia and Montenegro. En: Water Policy. 2007. Vol. 9, p. 319-43.
10. EGGEN, Trine; MOEDER, Monika y ARUKWE, Augustine. Municipal landfill leachates: A significant source for new and emerging pollutants. En: Science of the Total Enviroment. 2010. Vol. 408. N° 21. p. 5147-5157
11. GERZABEK, M. H.; et al. The integrated project Aqua-Terra of the EU sixth framework lays foundations for better understanding of river–sediment–soil–groundwater systems. En: J. Environ Manage. 2007. Vol. 84. p.237–43
12. PAL, A.; et al. Impacts of emerging organic contaminants on freshwater resources: review of recent occurrences, sources, fate and effects. En: Sci Total Environ. 2010. Vol. 408. p. 6062–6069.
13. MURRAY, K.E.; THOMAS, S.M. y BODOUR, A. A. Prioritizing research for trace pollutants and emerging contaminants in the freshwater environment. En: Environmental Pollution. 2010. Vol. 158. p. 3462–3471
14. HERRERO, O.; et al. Toxicological evaluation of three contaminants of emerging concern by use of the Allium cepa test. En: Mutation Research. 2012. Vol. 743. p. 20–24.
15. SMITAL, Tvrtko. Acute and Chronic Effects of Emerging Contaminants. En: Emerging Contaminants from Industrial and Municipal Waste: Occurrence, Analysis and Effects. 2008. Vol. 5. p.105-142
16. TERZIĆ, Senka; et al. Occurrence and fate of emerging wastewater contaminants in Western Balkan Region. En: Science of the total environment. 2008. Vol. 399. p. 66-67
17. YAO, Cong; et al. Selective extraction of emerging contaminants from water samples by dispersive liquid–liquid microextraction using functionalized ionic liquids. En: Journal of Chromatography A. 2011. Vol. 1218. p. 1556-1566
18. RODRÍGUEZ-PRIETO, L.; et al. Treatment of emerging contaminants in wastewater treatment plants (WWTP) effluents by solar photocatalysis using low TiO2 concentrations. En: Journal of Hazardous Materials. 2012. Vol. 211-212. p. 131-137
19. JARDIM, Wilson; et al. An integrated approach to evaluate emerging contaminants in drinking water. En: Separation and Purification Technology. 2012. Vol. 84. p. 3-8
20. LAPWORTH, D. J.; et al. Emerging organic contaminants in groundwater: a review of sources, fate and occurrence. En: Environ Pollut. 2012. Vol.163. p. 287–303
21. GEERDINK, R.B.; NIESSEN, W.M.A. y BRINKMAN, U.A.T. Trace-level determination of pesticides in water by means of liquid and gas chromatography. En: Journal of Chromatography A. 2002. Vol. 27, p. 65-93
22. SINCLAIR, C. J. y BOXALL, A. B. Assessing the Ecotoxicity of Pesticide Transformation Products. En: Environmental Science and Technology. 2003. Vol. 37. p. 4617-4625.
23. KOLPIN, Dana; BARBASH, Jack y GILLIOM, Robert. Occurrence of pesticides in shallow groundwater of the UnitedStates: Initial results from the National Water-Quality Assessment Program. En: Environmental Science and Technology. 1998. Vol. 32, p. 558-566
24. KOLPIN, Dana; SCHNOEBELEN, D. y THURMAN, E. M. Degradados dar una idea de las tendencias espaciales y temporales de los herbicidas en el agua subterránea. Agua Subterránea. 2004. Vol. 42, p. 601-608
25. LAPWORTH, D. J. y GOODDY, D. C. Source and persistence of pesticides in a semiconfined chalk aquifer of southeast England. En: Environmental Pollution. 2006. Vol. 144, p. 1031-1044
26. SINCLAIR C. J.; et al. A desk study on pesticide metabolites, degradation and reaction products to inform the Inspectorate’s position on monitoring requirements. Final Report for Drinking Water Inspectorate. En: Food and Environment Research Agency. 2010
27. ATSDR. Agencia para Sustancias Tóxicas y el Registro de Enfermedades. En: Reseña toxicológica de los DTT, DDE y DDD. Atlanta, GA: Departamento de Salud y Servicios Humanos de EE. UU. Servicio de Salud Pública. 2002
28. PARSONS, S.; et al. Pesticide degradates of concern to the drinking water community. En: AWWA Research Foundation, Denver. 2008
29. KOLPIN, D. W.; et al. Contribuciones urbanas de glifosato y AMPA a sustancias degradadas corrientes en los Estados Unidos. En: Sci Total de Medio Ambiente. 2006. Vol.354, p. 191-197
30. TOBÓN, F.; LÓPEZ., L. y PANIAGUA, R. Contaminación del agua por plaguicidas en un área de Antioquia: En: Rev. Salud Pública. 2010. Vol.12. N° 2. p. 300-307
31. LÓPEZ, C. L. Exposición a plaguicidas organofosforados. Perspectivas en Salud Pública Nº 18. México: Instituto Nacional de Salud Pública, 1993
32. ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS) – ORGANIZACIÓN PANAMERICANA DE LA SALUD (OPS). Plaguicidas y salud en las Américas. Washington: OMS/OPS, División Salud y Ambiente, 1993
33. ________. Plaguicidas organoclorados. México: OMS/OPS, Centro Panamericano de Ecología Humana y Salud, 1990. (Serie Vigilancia 9.)
34. BRIGGS, S. y CARSON, R. Basic guide to pesticides. Their characteristics and hazards. Washington: Taylor & Francis publishers. 1992
35. AL-SALEH, I. A. Pesticides: a review article. En: J Environ Pathol Toxicol Oncol. 1994. Vol. 13, p. 151-161
36. HILL, R.H.; et al. Determination of pesticide metabolites in human urine using an isotope dilution technique and tandem mass spectrometry. En: J Anal Toxicol. 1995. Vol. 19, p. 323- 329.
37. RICHARDSON, M. L., BOWRON, J. M. The fate of pharmaceutical chemicals in the aquatic environment. En: J Pharm Pharmacol. 1985. Vol. 37, p.1-12.
38. POYNTON, H. C. y VULPE, C. D. Ecotoxicogenomics: Emerging Technologies for Emerging Contaminants. En: Journal of the American Water Resources Association. 2009. Vol. 45, p. 83–96
39. BARNES, Kimberlee; et al. A national reconnaissance of pharmaceuticals and other organic wastewater contaminants in the United States – I) Groundwater. En: Sci Total Environ. 2008. Vol. 402, p. 192-200
40. MILLER, Kathleen y MEEK, Joseph. Helena Valley ground water: pharaceuticals, personal care products, endocrine disruptors (PPCPs) and microbial indicators of fecal contamination. Montana Bureau of Mines and Geology. Open- file report 532. 2006.
41. PÉREZ, Sandra y BARCELÓ, Damiá. Fate and occurrence of X-ray contrast media in the environment. En: Anal Bioanal Chem. 2007. Vol. 387, p. 1235-1246
42. WATKINSON, A. J.; et al. The occurrence of antibiotics in an urban water shed: From waste water to drinking water. En: Sci Total Environ. 2009. Vol. 407, p. 2711-2723
43. DELGADO, S. Evaluación de tecnologías potenciales de reducción de la contaminación de las aguas de canarias (tecnoagua). Proyecto Universidad de La laguna, 2011
44. ASHP. Therapeutic Position Statement on the Safe Use of Oral Nonprescription Analgesics. En: Am J Health Syst Pharm. 1999. Vol. 56, Nª. 11, p. 1126-1131
45. RICHARDSON, Susan. Water analysis: emerging contaminants and current issues. En: Anal. Chem. 2009. Vol. 81, N° 12. p. 4645-4677
46. GÓMEZ, M. Determination of pharmaceuticals of various therapeutic classes by solid-phase extraction and liquid chromatography-tandem mass spectrometry analysis in hospital effluent wastewaters. En: Journal of Chromatography. A. 2006. Vol. 1114, N° 2. p. 224-233
47. BUSER, H.; POIGER, T. y MÜLLER, M. Occurrence and environmental behavior of the chiral pharmaceutical drug ibuprofen in surface waters and in wastewater. En: Environ. Sci. Technol. 1999. Vol. 33, N° 15. p. 2529-2535
48. JIMÉNEZ, Claudio. Contaminantes orgánicos emergentes en el ambiente: productos farmacéuticos. En: Rev. Lasallista Investig. 2011. Vol. 8. N° 2, p. 143-153
49. TERNES, T. Occurrence of drugs in German sewage treatment plants and rivers. En: Water research. 1998. Vol. 32, N° 11. p. 3245-3260
50. DANG, H.; et al. Molecular determination of oxytetracycline-resistant bacteria and their resistance genes from mariculture environments of China. En: Journal of applied microbiology. 2007. Vol. 103, N° 6. p. 2580-2592
51. SHAKIL, S.; et al. Aminoglycosides versus bacteria-a description of the action, resistance mechanism, and nosocomial battleground. En: Journal of biomedical science. 2008. Vol. 15, N° 1. p. 5-14
52. ROBERTS, Marilyn; et al. Nomenclature for macrolide and macrolide-lincosamide-streptogramin B resistance determinants. En: Antimicrobial Agents and Chemotherapy. 1999. Vol. 43, N° 12. p. 2823.
53. AKINBOWALE, O.; PENG, H. y BARTON, M. P514 Class 1 integron mediates antibiotic resistance in Aeromonas spp. from rainbow trout farms in Australia. En: International Journal of Antimicrobial Agents. 2007. Vol. 29. p. S113.
54. TERNES, T.; BONERZ, M. y SCHMIDT, T. Determination of neutral pharmaceuticals in wastewater and rivers by liquid chromatography-electrospray tandem mass spectrometry. En: Journal of Chromatography A. 2001. Vol. 938, N° 1-2. p. 175-185
55. ARIAS, C.A. y ESCUDERO, A. Hacia la sustentabilidad: Los residuos sólidos como fuente de energía y materia prima. 2011. p. 275-280
56. COLOMBIA. MINISTERIO DE AMBIENTE Y DESARROLLO SOSTENIBLE. Portal Dirección de Gestión del Recurso Hídrico. Octubre de 2011
57. GONZÁLEZ-MARIÑO, Iria; et al. Screening and selective quantification of illicit drugs in wastewater by mixed mode solid phase extraction and quadrupole time-of-flight liquid chromatography mass spectrometry. En: Anal Chem. 2012. Vol. 84. p.1708-17.
58. ZUCCATO, E; et al. Illicit drugs, a novel group of environmental contaminants. En: Water Res. 2008. Vol. 42. p. 961-8.
59. PEDROUZO, Marta; et al. Drugs of abuse and their metabolites in waste and surface waters by liquid chromatography tandem mass spectrometry. En: J Sep Sci. 2011. Vol.34. p.1091–101
60. VALCÁRCEL, Y.; et al. Drugs of abuse in surface and tap waters of the Tagus river basin: heterogeneous photo-Fenton process is effective in their degradation. En: Environ Int. 2012. Vol. 41. p.35–43
61. VAN, Alexander; et al. Illicit drug consumption estimations derived from wastewater analysis: A critical review. En: Science of the Total Environment. 2011. Vol. 409. p. 3564-3577
62. KASPRZYK-HORDERN, Barbara; DINSDALE, Richard y GUWY, Alan. The occurrence of pharmaceuticals, personal care products, endocrine disruptors and illicit drugs in surface water in South Wales, UK. En: Water Research. 2008. Vol. 42. p. 3498-3518
63. GERRITY, Daniel; TRENHOLMB, Rebecca y SNYDER, Shane. Temporal variability of pharmaceuticals and illicit drugs in wastewater and the effects of a major sporting event. En: Water Research. 2011. Vol. 45. p. 5399-5411
64. GÓMEZ, Gregorio. Bases farmacológicas de la conducta. [En línea]. Copyright, 2011. [Citado el 2 de mayo de 2012]. Disponible en: http://www.biopsicologia.net/nivel-3-participacion-plastica-y-funcional/7.-hormonas-esteroides.html
65. VULLIET, Emmanuelle y CREN-OLIVÉ, Cécile. Screening of pharmaceuticals and hormones at the regional scale, in surface and groundwaters intended to human consumption. En: Environmental Pollution. 2011. Vol. 159. p. 2929-2934
66. KIM, S. D.; et al. Occurrence and removal of pharmaceuticals and endocrine disruptors in South Korean surface, drinking, and waste waters. En: Water Res. 2007. Vol. 41. p. 1013-1021
67. WRITER, Jeffrey; et al. Anthropogenic tracers, endocrine disrupting chemicals, and endocrine disruption in Minnesota lakes. En: Science of the Total Environment. 2010. Vol. 409. p. 100–111
68. JURADO, Ana; et al. Emerging organic contaminants in groundwater in Spain: A review of sources, recent occurrence and fate in a European context. En: Science of the Total Environment. 2012. Vol. 440. p. 82–94
69. KREIN, Andreas; et al. Determination of Estrogen Activity in River Waters and Wastewater in Luxembourg by Chemical Analysis and the Yeast Estrogen Screen Assay. En: Environment and Pollution. 2012. Vol.1, N° 2. p. 86-96
70. CARGOUËT, Maëlle; et al. Assessment of river contamination by estrogenic compounds in Paris area (France). En: Science of the Total Environment. 2004. Vol. 324, N° 1–3. p. 55–66
71. AYDIN, Egemen y TALINLI, Ilhan. Analysis, occurrence and fate of commonly used pharmaceuticals and hormones in the Buyukcekmeceatershed, Turkey. En: Chemosphere.2012. Article in press.
72. JOHNSON, A C; BELFROID, A. & DI CORCIA, A. Estimating steroid oestrogen inputs into activated sludge treatment works and observations on their removal from the effluent. En: The Science of the Total Environment. 2000. Vol. 256. p. 163-173
73. GODFREY, E.; WOESSNER, W. y BENOTTI, M. Pharmaceuticals in on-site sewage effluent and ground water, Western Montana. En: Ground Water. 2007. Vol. 45, p. 263–271
74. SEILER, R.; et al. Caffeine and pharmaceuticals as indicators of waste water contamination in wells. En: Ground Water. 1999. Vol. 37, p. 405-410
75. TEIJON, G.; et al. Occurrence of emerging contaminants, priority substances (2008/105/ CE) and heavy metals intreated wastewater and groundwater at Depurbaix facility (Barcelona,Spain). En: Science of the Total Environment. 2010. Vol. 408, p. 3584-3595
76. VAN STEMPVOORT, D. R.; et al. Artificial sweeteners as potential tracers in groundwater in urban environments. En: J Hydrol. 2011. Vol. 401. N° 1-2, p. 126-133.
77. BUERGE, I. J. ; et al. Ubiquitous occurrence of the artificial sweetener acesulfame in the aquatic environment: An ideal chemical marker of domestic wastewater in groundwater. En: Environ Sci Technol. 2009. Vol. 43. N° 12, p. 4381-4385
78. RABIET, Marion; et al. Consequences of treated water recycling as regards pharmaceuticals and drugs in surface and ground waters of a medium-sized Mediterranean catchment. En: Environmental Science and Technology. 2006. Vol. 40, p. 5282-5288
79. DAUGHTON, C. & TERNES, T.A. Pharmaceuticals and personal Care products in the Environment: Agents of Subtle Change?. En: Health perspect. 1999. Vol. 107. N° 6, p. 907-938
80. HENRÍQUEZ, D. Presencia de contaminantes emergentes en aguas y su impacto en el ecosistema. Estudio de caso: productos farmacéuticos en la cuenca del río Biobío, región del Biobío, Chile. Tesis, Santiago de Chile. 2010
81. JEON H-K, CHUNG, Y. & RYU, J-C. Simultaneous determination of benzophenone-type UVfilters in water and soil by gas chromatography–mass spectrometry. En: J Chromatogr A. 2006. Vol. 1131, p. 192–202.
82. HENRÍQUEZ, D. Presencia de contaminantes emergentes en aguas y su impacto en el ecosistema. Estudio de caso: productos farmacéuticos en la cuenca del río Biobío, región del Biobío, Chile. Tesis, Santiago de Chile. 2010
83. LINDSTRÖM, A.; et al. Occurrence and environmental behavior of the bactericide triclosan and its methyl derivative in surface waters and in wastewater. En: Environmental science & technology. 2002. Vol. 36. N° 1. p. 2322-2329
84. HEBERER, T. Tracking persistent pharmaceutical residues from municipal sewage to drinking water. En: Journal of Hydrology. 2002. Vol. 266, N° 3-4. p. 175-189
85. BECERRIL, José. Contaminantes Emergentes en el Agua. En: Revista Digital Universitaria. 2009. Vol. 10. N° 8. p. 1-7 86. FARRÉ, Marinella; et al. Achievements and future trends in the analysis of emerging organic contaminants in environmental samples by mass spectrometry and bioanalytical techniques. En: Journal of chromatography A. 2012. Vol. 1259. p. 86– 99
87. SANDERSON, H.; et al. Occurrence and weight-of-evidence risk assessment of alkyl sulfates, alkyl ethoxysulfates, and linear alkylbenzenesulfonates (LAS) in river water and sediments. En: Sci Total Environ. 2006. Vol. 368. p. 695–712.
88. GARCÍA, M. T.; et al. Biodegradability and toxicity of sulphonate-based surfactants in aerobic and anaerobic aquatic environments. En: Water Research.2009. Vol. 43. p. 295-302
89. QUIROGA, J.; et al. Biodegradation kinetics of surfactants in seawater. En: Chemosphere. 1999. Vol. 39. N° 11. p. 1957-1969
90. GIGER, Walter; BRUNNER, Paul y SCHAENER, Christian. 4-Nonylphenol in Sewage Sludge: Accumulation of Toxic metabolites from Nonionic Surfactants. En: Science. 1984. Vol. 225. p. 623-625
91. SALAGER, Jean. Surfactantes tipos y usos. Cuaderno FIRP S300-A. Modulo de enseñanza en fenómenos interfaciales. Universidad de los Andes. 2002. Version 2. Mérida-Venezuela.
92. SCOTT, Matthew y JONES, Malcolm. The biodegradation of surfactants in the environment. En: Biochimica et Biophysica Acta. 2000. vol. 1508. p. 235-251.
93. WHO. IARC Monographs on the evaluation of carcinogenic risks to humans. Geneva: World Health Organization, 1990.
94. AMES, B.; MAGW, R. y GOLD, L. Ranking possible carcinogenic hazards. En: Science. 1987. Vol. 236. N° 4799. p. 271-280.
95. COLMAN, Joan; et al. Identification of developmentally toxic drinking water disinfection byproducts and evaluation of data relevant to mode of action. En: Toxicology and Applied Pharmacology. 2011. Vol. 254, p. 100–126
96. SADIQ, Rehan y RODRÍGUEZ, Manuel J. Disinfection by-products (DBPs) in drinking water and predictive models for their occurrence: a review. En: Science of the Total Environment. 2004. Vol. 321, p. 21–46.
97. HEBERT, Armelle; et al. Innovative method for prioritizing emerging disinfection by-products (DBPs) in drinking water on the basis of their potential impact on public health. En: Water Research. 2010. Vol. 44. p. 3147-3165.
98. RICHARDSON, Susan. 1998. Drinking water disinfection by-products. En: Encyclopedia of Environmental Analysis and Remediation. 1998. Vol. 3. p. 1398-1421.
99. RICHARDSON, Susan; et al. Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: a review and roadmap for research. Mutation Research e Reviews. En: Mutation Research. 2007. Vol. 636. p. 178-242.
100. NIKOLAOU, A.D. ; et al. Factors effecting the formation of organic by-products during water chlorination: a bench-scale study. En: Water Air Soil Pollut. 2004. Vol. 159. p. 357–371.
101. RICHARDSON, Susan. Disinfection by-products and other emerging contaminants in drinking water. En: Trends Anal. Chem. 2003. Vol. 22. Nº 10, p. 666–884.
102. GUNTEN, Urs Von. Ozonation of drinkingwater: Part II. Disinfection and by-product formation in presence of bromide, iodide or chlorine. En: Water Research. 2003. Vol. 37. p. 1469–1487
103. LEWIS, C.; et al. Estimated effects of disinfection byproducts on preterm birth in a population served by a single water utility. En: Environ. Health Perspect. 2007. Vol. 115. N° 2, p. 290–295.
104. WALLER, K.; et al. Influence of exposure assessment methods on risk estimates in an epidemiologic study of total trihalomethanes exposure and spontaneous abortion. En: Journal of Exposure Analysis and Environmental Epidemiology. 2001. Vol. 11. p. 522-531.
105. DODDS, L.; et al. Trihalomethanes in public water supplies and risk of stillbirth. En: Epidemiology. 2004. vol. 15. N° 2, p. 179–186.
106. TOLEDANO, M. B.; et al. Relation of trihalomethane concentrations in public water supplies to stillbirth and birth weight in three water regions in England. En: Environ. Health Perspect. 2005. Vol. 113. N° 2, p. 225–232.
107. GARRETT, P. y MOREAU, M. MTBE as a ground water contaminant. NWWA/API conference on petroleum hydrocarbons and organic chemicals in ground water: prevention, detection and restoration. Dublin, Ohio, Houston, Texas. En: National Water Well Association. 1986. p. 227–238
108. MORAN, M. J.; ZOGORSKI, J. S. & SQUILLACE, P. J. Chlorinated solvents in groundwater of the United States. En: Environ Sci Technol. 2006. Vol. 41, p. 74–81.
109. VERLIEFDE, A.; et al. Priority organic micropollutants in water sources in Flanders and the Netherlands and assessment of removal possibilities with nanofiltration. En: Environ Pollut. 2007. Vol. 146, p. 281–289.
110. ABE, A. Distribution of 1,4-dioxane in relation to possible sources in the water environment. En: Sci Total Environ. 1999. Vol. 227, p. 41–47.
111. GIGER, G.; SCHAFFNER, C. & KOHLER, H. P. Benzotriazole and tolyltriazole as aquatic contaminants.1. Input and occurrence in rivers and lakes. En: Environ Sci Technol. 2006. Vol. 40, p. 7186–7192.
112. VOUTSA, D.; et al. Benzotriazoles, alkylphenols and bisphenol A in municipal wastewaters and in the Glatt River, Switzerland. En: Environ SciPollut Res. 2006. Vol. 13, p. 333–341.
113. ENDS. River dioxins increased by triclosan. En: The ENDS Report. Environmental Intelligence for professionals. 2010. p. 425 -432
114. MEZCUA, M.; et al. Evidence of 2,7/2,8-dibenzodichloro-p-dioxin as a photodegradation product of triclosan in water and wastewater samples. En: Anal Chim Acta. 2004. Vol. 524, p. 241–247.
115. OSENBRÜCK, K.; et al. Sources and transport of selected organic micropollutants in urban groundwater underlying the city of Halle (Saale), Germany. En: Water Res. 2007. Vol. 41, p. 3259–70.
116. BUSZKA, P.; et al. Waste-indicator and pharmaceutical compounds in landfill-leachateaffected ground water near Elkhart, Indiana, 2000–2002. En: Bull Environ ContamToxicol.2009. Vol. 82, p. 653–659.
117. MUSOLFF, A.; et al. Temporal and spatial patterns of micropollutants in urban receiving waters. En: Environ Pollut. 2009. Vol. 157, p. 3069–3077
118. LOOS, R.; et al. Pan-European survey on the occurrence of selected polar organic persistent pollutants in ground water. En: Water Res. 2010. Vol. 44, p. 4115–4126.
119. BIRNBAUM, Linda S. y STASKAL, Daniele F. Brominated Flame Retardants: Cause for Concern? En: Environmental Health Perspectives. 2004. Vol. 112, N° 1, p. 9-17.
120. REEMTSMA, Thorsten, et al. Polar pollutants entry into the water cycle by municipal wastewater: a European perspective. En: Environ Sci Technol. 2006. Vol. 40, p. 5451–8.
121. RAHMAN, Frank ; et al. Polybrominated diphenylether (PBDE) flameretardants. En: Sci Total Environ 2001. Vol. 275, p.1-17.
122. BARRERA, Juan; CASTRO, José y GAVILÁN, Arturo. Los retardantes de flama polibromados ¿nuevas sustancias de prioridad ambiental?. [En línea]. México D.F. Instituto nacional de ecología. Periférico 5000, Col. Insurgentes Cuicuilco, C.P. 04530, Delegación Coyoacán, 2007. [Citado el 30 noviembre de 2012]. Url disponible en: http://www2.ine.gob.mx/publicaciones/libros/438/cap4.html.
123. WU, Jiangping; et al. A review of polybrominateddiphenyl ethers and alternative brominated flame retardants in wildlife from China: Levels, trends, and bioaccumulation characteristics. En: Journal of Environmental Sciences. 2012. Vol. 24, N° 2, p. 183–194.
124. BOLONG, N.; et al. A review of the effects of emerging contaminants in wastewater and options for their removal. En: Desalination. 2009. Vol. 239. p. 229-246
125. JOBLING, S.; et al. A variety of environmentally persistent chemicals, including some phthalate plasticizers, are weakly estrogenic. En: Environ Health Perspect. 1995. Vol. 103, p. 582–587.
126. BUERGE, I. J. ; et al. Ubiquitous occurrence of the artificial sweetener acesulfame in the aquatic environment: an ideal chemical marker ofdomestic wastewater in groundwater. En: Environ Sci Technol. 2009. Vol. 43, p. 4381–4385.
127. FERNÁNDEZ, M. F. y OLEA, N. Sustancias químicas y repercusión en la salud. Disruptores endocrinos, Congreso Internacional Salud y Hábitat, Asociación de Estudios Geobiológicos (GEA), Barcelona, Noviembre, 2006.
128. TEIJON, Gloria; et al. Occurrence of emerging contaminants, priority substances (2008/105/ CE) and heavy metals in treated wastewater and groundwater at Depurbaix facility. En: Science of The Total Environment. 2004. Vol. 408, N° 17, p. 3584-3595.
129. ACERO, Juan. Retention of emerging micropollutants from UP water and a municipal secondary effluent by ultrafiltration and nanofiltration. En: Chemical Engineering Journal. 2010. Vol. 163, p. 264-272
130. ACERO, Juan; et al. Coupling of adsorption, coagulation, and ultrafiltration processes for the removal of emerging contaminants in a secondary effluent. En: Chemical Engineering Journal. 2012. Vol. 210, p.1-8
131. ROSAL, Roberto; et al. Ocurrence of emerging pollutants in urban wastewater and their removal through biological treatment followed by ozonation. En: Water Research. 2010. Vol. 44, N° 2, p. 578-588
132. ROSSNER, Alfred; SNYDER, Shane y KNAPPE, Detlef. Removal of emerging contaminants of concern by alternative adsorbents. En: Water Research. 2009. Vol. 43, p. 3787-3796
133. PETROVIĆ, Mira; GONZÁLEZ, Susana & BARCELÓ, Damià. Analysis and removal of emerging contaminants in wastewater and drinking water. En: Trends in Analytical Chemistry. 2003. Vol. 22, N° 10, p.685-696.
134. TAMBOSI, Jose Luis; et al. Removal of pharmaceutical compounds in membrane bioreactors (MBR) applying submerged membranes. En: Desalination. 2010. Vol. 261, p. 148-156
135. JOHNSON, Andrew & SUMPTER, John. Removal of endocrine-disrupting chemicals in activated sludgetreatment works. En: Enviroment Science Technology. 2001. Vol. 35, N° 24, p. 4697-4703
136. GOGATE, Parag & PANDIT, Aniruddha. A review of imperative technologies for wastewater treatment I: oxidation technologies at ambient conditions. En: Advances in Environmental Research. 2004. Vol. 8. p. 501–551
137. TERNES, T. A.; et al. Ozonation: a tool for removal of pharmaceuticals, contrast media and musk fragrances from wastewater?. En: Water Research. 2003. Vol.37, N° 8, p. 1976-1982
Por: Miriam Janet Gil, Adriana María Soto
Jorge Iván Usma, Omar Darío Gutiérrez
Fuente: Dialnet
VER ARCHIVO DE ARTÍCULO