Combustión catalítica de compuestos orgánicos volátiles – 2º Parte
b) Difracción de Rayos X
Los espectros de difracción de rayos X se obtuvieron en un difractómetro Shimadzu XD-D1, utilizando un anticátodo de Cu y una velocidad de barrido de 2 °C/min.
La caracterización de las muestras por difracción de rayos X tuvo como objetivo verificar si se conservaba la estructura cristalina. En todos los casos se observó que la estructura cristalina se conserva aún después de 3 intercambios sucesivos, como por ejemplo para la zeolita Y-Co
c) Determinación de acidez por desorción a temperatura programada de NH3.
Las propiedades ácidas se determinaron mediante desorción a temperatura programada (TPD) de NH3 . Las muestras fueron pretatadas en He a 500 °C durante 2 horas. Luego fueron enfriadas hasta 100 °C y a esta temperatura se llevó a cabo la adsorción de NH3. Previo a la
desorción de NH3, la muestra fue equilibrada a la misma temperatura durante 2 horas para eliminar el NH3 fisisorbido. La desorción se efectuó en flujo de He con una velocidad de calentamiento de 10 °C/min.
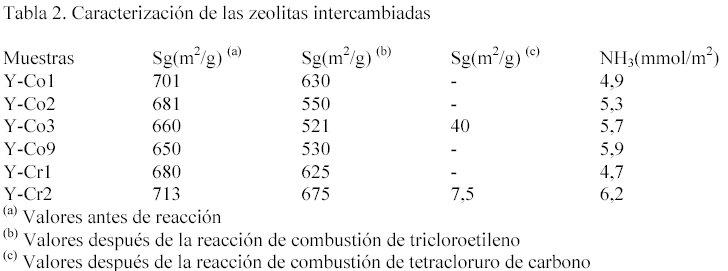
Los resultados obtenidos en la determinación de acidez se presentan en figura 1. La abcisa representa la temperatura y la ordenada es la cantidad de NH3 desorbido por gramo . el amoníaco es una molécula sonda adecuada para determinar acidez en zeolitas debido a su pequeño tamaño y fuerte basicidad. La posición del máximo de temperatura de desorción del amoníaco en función de la temperatura es una indicación cualitativa de la magnitud de la energía de activación de la desorción de amoníaco y en consecuencia de la fuerza ácida relativa de los sitios. Como se puede observar en las figuras 1 y 2, todas las curvas muestran un pico
Estos resultados indican que el reemplazo de iones monovalentes (Na+) por iones polivalentes (Cr, Co, Mn etc:) produce un aumento de la acidez por la creación de centros ácidos generados, por la hidrólisis de los cationes di y tripositivos.
![]()
Esta reacción se desplaza hacia la derecha cuando menor es el radio iónico y cuando aumenta el potencial electrostático del catión.
principal de desorción entre 180 y 220 °C. Este pico es indicativo de la presencia de sitios de acidez Bronsted débil, los cuales son más fácilmente accesibles a la adsorción del NH3. En algunas zeolitas intercambiadas se observó un pico de desorción a mayor temperatura (450- 500 °C), indicativo de la acidez Bronsted fuerte. El área bajo la curva de desorción permite estimar la cantidad relativa de sitios ácidos totales presentes. La cantidad total de sitios ácidos se presentan en la tabla 2 expresados por unidad de área superficial. En el caso de la muestra intercambiada con Co la cantidad de sitios ácidos aumenta con la cantidad de Co intercambiado. Mientras que las muestras intercambiadas con Co presentaron un solo pico de desorción a baja temperatura, indicativo de la acidez Bronsted débil, las muestras intercambiadas con Cr presentaron dos picos de desorción como se puede observar en la fig.2.
3. Evaluación Catalítica
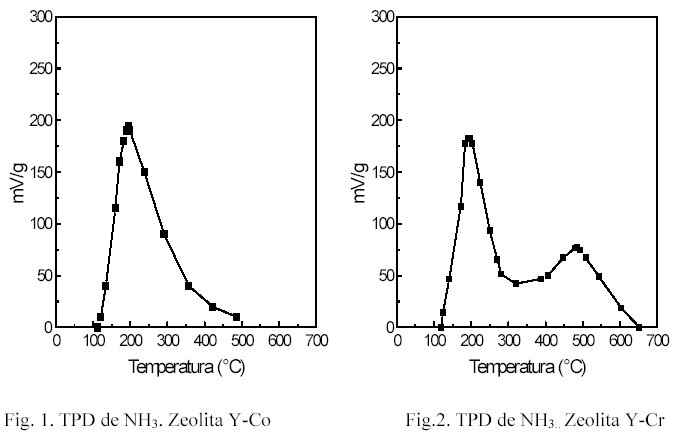
Las experiencias de actividad catalítica se llevaron a cabo en un equipo de flujo a presión atmosférica, alimentando una mezcla N2/O2/CVOC pudiéndose variar la concentración del compuesto orgánico clorado (CVOC) en la mezcla. Los compuestos orgánicos clorados utilizados en este trabajo fueron CCl4 y tricloroetileno. La concentración de estos compuestos fue siempre inferior a 1%. La reacción fue estudiada en el rango de temperatura comprendido entre 200 y 500 °C. El avance de la reacción fue seguido por cromatografía gaseosa en línea, utilizando un cromatógrafo Gow-Mac equipado con detector de ionización de llama y una columna rellena Chromosorb 102 de 3m de longitud. Previo a las experiencias de actividad catalítica las muestras fueron sometidas a un pretratamiento en mezcla N2/O2 a 500 °C durante dos horas y luego se enfrió hasta 200 °C. A partir de esta temperatura se comienza la inyección del compuesto clorado. Los valores de conversión obtenidos a cada temperatura resultan del promedio de 7 inyecciones. En la figura 3 se representa la conversión de tricloroetileno en función de la temperatura para una zeolita intercambiada con Co con distinto grado de intercambio. Se puede observar que para una misma temperatura a medida que aumenta el grado de intercambio mayor es la conversión.
Conversión (%)
combustión de tricloroetileno la combustión de tricloroetileno Las muestras de zeolitas intercambiadas también fueron evaluadas en la combustión
de tetracloruro de carbono. En este caso se observó una fuerte desactivación de la zeolita a temperaturas relativamente bajas. El análisis por difracción de rayos X de las muestras después de la reacción reveló que la estructura cristalina tipo faujasita fue completamente destruida durante la reacción. En este mismo sentido, los valores de la superficie específica despues de la reacción con tetracloruro de carbono, presentados en la tabla 2 mostaron que hay una destrucción total de la matriz de la zeolita.
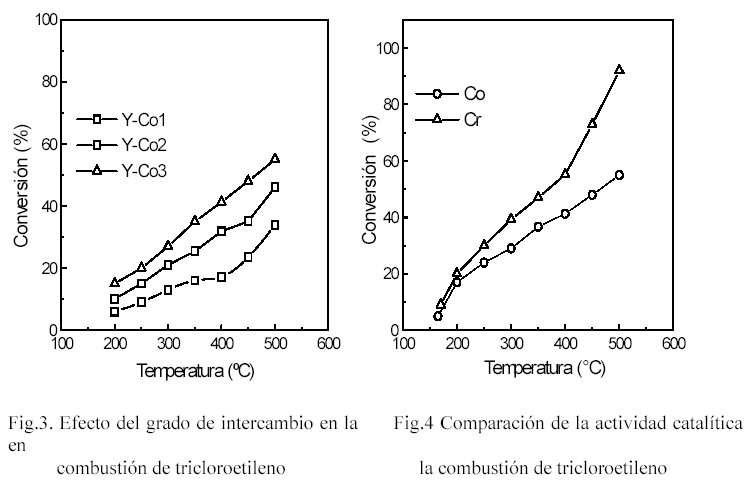
En la figura 4, se presentan las curvas de conversión-temperatura en la combustión de tricloroetileno, para las zeolitas intercambiadas con Cr y Co. Como se puede observar los catalizadores que presentan mayor conversión a una dada temperatura son las zeolitas intercambiadas con Cr y con Co. Estas dos muestras resultaron ser las mas activas para esta reacción. Luego de los ensayos de actividad catalítica, las muestra fueron analizadas por difracción de Rayos X, superficie específica y análisis químico. En todas las muestras se verificó que se conservaba la estructura zeolítica sin pérdida significativa de superficie específica Este comportamiento diferenciado de las zeolitas intercambiadas en la oxidación de tetracloruro de carbono y de tricloroetileno, estaría indicando que las reacciones ocurren a través de mecanismos diferentes y que los productos de reacción son diferentes.
REFERENCIAS
1. Spivey, J.J., Ind. Eng.Chem.Res., 26, 2165, 1987
2. Spivey, J.J., Catalysis, Vol.8, 1989
3. US Patent, 5,283,041 (1994)
4. US Patent, 5,653,949 (1997)
5. Chatterjee,S. and Greene, H.L., J.Catal.,130, 76, 1991.
6. Chatterjee,S. and Greene ,H.l. Appl.Catal. A.,98, 139,1993
7. Chatterjee,S. and Greene,H.L. and Park, Y.J. J.Catal., 138, 179, 1992.
Teresita F. Garetto y Armando Borgna
Instituto de Investigaciones en Catálisis y Petroquímica (INCAPE). FIQ-UNL-CONICET
Santiago del Estero 2654. 3000. Santa Fe. Argentina. E-mail: [email protected]