Biodegradación de 2-Clorofenol en reactores aeróbicos empleando microorganismos autoctonos
INTRODUCCION
Está ampliamente demostrado que los compuestos fenólicos, en particular los clorados, son sumamente persistentes en el medio ambiente. Si bien han sido aislados numerosos microorganismos capaces de biodegradarlos (1, 2), en general, esta velocidad de biodegradación suele ser muy lenta. Además, estos compuestos químicos son tóxicos, recalcitrantes y potencialmente carcinogénicos y/o mutagénicos. Es decir, son considerados residuos peligrosos y regulados como tales – por ejemplo, Ley Nacional N°24051/92 (Argentina).
Por otro lado, estos compuestos orgánicos tienen una enorme importancia económica ya que son usados como biocidas y empleados como precursores en la manufactura de productos farmacéuticos, pesticidas, productos químicos, etc. Es por ello que pueden hallarse en los líquidos residuales de industrias tales como: petroquímica, papelera, química, farmacéutica, siderúrgica y curtidora.
Además, en el pasado, éstos han sido la causa de enormes impactos ambientales – contaminando suelos y acuíferos – debido a su uso generalizado como preservantes en la industria de la madera. Actualmente, su uso para este fin está prohibido en casi todo el mundo, sin embargo, los problemas de contaminación persisten en muchos países madereros debido a su muy elevada vida media en el medio ambiente. Si bien existe una cantidad considerable de información respecto de la velocidad de degradación de los clorofenoles, a veces esta información es contradictoria. Sin embargo, de acuerdo a Hale et al. (3) pueden plantearse las siguientes generalizaciones:
- Los clorofenoles, comparados con los compuestos fenólicos no sustituidos, son mucho más estables en el medio ambiente.
- A medida que aumenta el número de unidades de cloro en la molécula, la tasa de descomposición aeróbica disminuye, mientras que lo contrario es generalmente verdadero para la degradación anaeróbica.
- Los compuestos conteniendo cloro en posición meta son más persistentes bajo condiciones aeróbicas comparados con aquellos que no tienen cloro sustituidos en posición meta respecto del grupo hidroxilo.
De todas maneras, contradiciendo algunas de estas reglas generales, Liu y Pacepavicius (4) comprobaron que el 2-CP es uno de los más persistentes. Ellos, demostraron que la biodegradabilidad de algunos de estos compuestos fenólicos presenta el siguiente orden: fenol > 2,4-diclorofenol > 4-clorofenol > 2,4,6- triclorofenol > 2-clorofenol. Asimismo, la Agencia de Ciencia y Tecnología Industrial del Japón (5) establece que la persistencia en sedimentos del 2-CP es unas tres veces superior a la del pentaclorofenol. Aquí, se describen los resultados obtenidos en ensayos de biodegradación de 2-CP, empleando reactores “batch” y de lecho fluidizado (LF), operados aerobiamente y con microorganismos autóctonos específicamente seleccionados y optimizados.
OBJETIVOS
Los objetivos de este estudio fueron: · Seleccionar e identificar microorganismos capaces de biodegradar 2-clorofenol en distintos procesos aerobios. · Determinar la cinética y la velocidad de degradación a escala laboratorio empleando reactores “batch”. · Establecer la efectividad de un reactor de lecho fluidizado aeróbico relleno con carbón activado granular para remover 2-CP como única fuente de carbono, suministrando como nutrientes un fertilizante foliar agrícola de uso comercial. · Evaluar la remoción de toxicidad a través de bioensayos.
MATERIALES Y METODOS
Selección y caracterización de microorganismos.
La selección se realizó por la técnica de enriquecimiento a partir de muestras de agua tomada de un río altamente contaminado, ubicado en el área de Buenos Aires, denominado Riachuelo. Para ello, se tomaron 10 ml de las mismas en 90 ml de medio mínimo (6). La suspensión se incubó durante 30 días a 28 °C en baño termostatizado con agitación (Primera adaptación). Posteriormente, se realizaron siembras sucesivas transfiriendo 2 ml de la primera adaptación a frascos Erlenmeyers conteniendo 100 ml de medio mínimo. Durante el proceso de adaptación la concentración de 2-CP se mantuvo en alrededor de 50 mg/l.
De este cultivo se aislaron, sobre placas de Petri con agar nutritivo (Merck) suplementadas con 2-CP, dos especies microbianas predominantes. Las mismas fueron identificadas mediante pruebas tintoriales y bioquímicas, de acuerdo al sistema API 20 NE (Bio Merieux) con reacciones adicionales según Manual Bergey’s (7).
Ensayos de biodegradación.
Microfermentador “batch”. Los ensayos de biodegradación en reactor “batch”, se llevaron a cabo en un microfermentador Multigen TA (New Brunswick) de 2 litros de capacidad conteniendo 1250 ml de medio mínimo (6), y cantidades apropiadas de solución de 2-CP de manera de obtener concentraciones finales de 100 y 200 mg/l del mismo. Se operó a 28 °C, con agitación (200 RPM), aireación y en condiciones de esterilidad. Se empleó un número inicial de microorganismos comprendido entre 1,0 x 106 y 4,0 x 106 UFC/ml. A diferentes intervalos de tiempo se tomaron muestras para determinar la cantidad de 2-CP remanente y la evolución de la biomasa de bacterias.
Lecho fluidizado – Unidad Experimental. Los ensayos de biodegradación en flujo continuo, se realizaron en un reactor lecho fluidizado (LF) aeróbico con recirculación – volumen efectivo 6 litros – relleno con carbón activado granular (CAG) CARVEGAT – Tipo ACCF (FACASA), construido empleando una columna de acrílico de 152 cm de longitud y 9,2 cm de diámetro interno (Figura 1). En las Fotos 1 y 2 se muestran el reactor LF y la unidad de medición de pH, y en la Foto 3 un detalle de la parte inferior del mismo. Las partículas de carbón utilizadas como medio soporte corresponden a los gránulos retenidos entre los tamices 16 y 20 ASTM. El reactor operó en “condiciones ambientales” (sin esterilidad). Para expandir el CAG se usó una bomba centrífuga MARCH, tipo MDX-3 capaz de erogar caudales de 3 a 25 l/min. Para controlar el nivel de expansión del lecho, el caudal de recirculación interna se mantuvo en aproximadamente 4 l/min mediante una válvula a diafragma de 1/2″ de diámetro. Para retener el carbón, que eventualmente pudiera escaparse a la línea de recirculación, se utilizó un filtro provisto con malla de acero inoxidable N°20 ASTM. El reactor LF fue alimentado continuamente con un líquido residual sintético preparado utilizando 2-CP calidad analítica (Merck) y fertilizante foliar de uso agrícola (BASF) libre de cloruros, relación N:P:K de 10:2:6. Se usó como agua de dilución el agua subterránea empleada como agua de bebida. La dosificación se realizó mediante una bomba peristáltica Masterflex, con cabezal 7016-20 y manguera de Norprene.
Puesta en marcha y operación del LF. Durante la puesta en marcha, el reactor LF fue inoculado con aproximadamente un litro de inóculo obtenido en los primeros ensayos “batch” con microfermentador. Luego de la inoculación, comenzó a dosificarse el reactor con solución de 2-CP y fertilizante foliar comercial. En una primera etapa, la concentración de 2-CP en el líquido residual sintético fue de aproximadamente 50 mg fenoles totales/l. Luego de unas tres semanas de la puesta en marcha, y debido a que la concentración en el efluente del sistema estaba por debajo del límite de detección de la técnica analítica empleada (0,05 mg/l), se duplicó la concentración de 2-CP. Actualmente, el LF está siendo operado con una concentración media de 2-CP de 223,2 mg fenoles totales/l, a temperatura ambiente (entre 14,8 y 31,4 °C), y con un tiempo de residencia hidráulico de @ 26 horas. En la Tabla 1, se resumen las condiciones de operación actuales de esta unidad experimental.
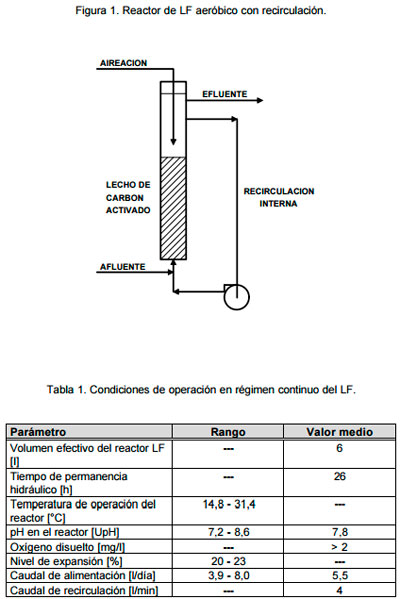 |
Determinaciones analíticas y parámetros de control. Durante el desarrollo del estudio se midieron en la alimentación y en la salida los siguientes parámetros: fenoles totales y DQO. Todas las determinaciones analíticas se realizaron siguiendo las recomendacio-nes del «Standard methods for the examination of water and wastewater» (8). La determinación del 2-CP se realizó siguiendo la metodología descripta por Stanlacke y Finn para compuestos fenólicos (9) y adaptada. Se realizaron lecturas espectrofotométricas a 292 nm en medio alcalino. El control de creci-miento microbiano se efectuó mediante el método de recuento en placas de Petri, en superficie de Agar nutritivo. Además, diariamente se midieron: caudales, temperaturas, nivel de expansión y el pH en la recirculación; y esporádicamente la concentración de oxígeno disuelto en el líquido del reactor.
Bioensayos de toxicidad. Los ensayos de toxicidad aguda empleando Daphnia magna, se llevaron a cabo conforme a la norma ISO (International Organization for Standardization) 6341(E) (10). El resultado de toxicidad se expresó como Concentración Efectiva 50 (CE 50): concentración/dilución que produce la inmovilidad del 50% de los organismos de la población testeada luego de un período de exposición de 24 ó 48 horas en condi-ciones controladas de laboratorio. Previo a la realización de los ensayos, se evaluó la sensibilidad de los organismos empleando dicromato de potasio (K2Cr2O7) como sustancia tóxica de referencia. Las condiciones generales de exposición se resumen en la Tabla 2.
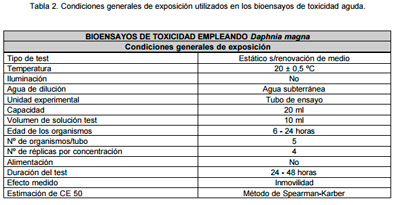 |
El agua subterránea utilizada como medio de cultivo de los organismos y dilución de las muestras de ensayo, fue previamente declorinada, filtrada por carbón activado y aireada. Su composición se detalla en la Tabla 3.
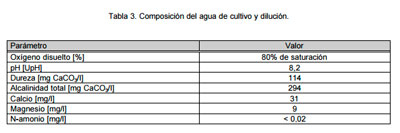 |
Toma de muestras. Los ensayos de toxicidad se llevaron a cabo en muestras tomadas al inicio y al final de cada ensayo “batch” y en la alimentación y salida del reactor de lecho fluidizado. Las muestras del reactor “batch” fueron previamente filtradas empleando papel de filtro de 0,22 mm de diámetro de poro, en condiciones de esterilidad.
RESULTADOS Y DISCUSION
Selección y caracterización de microorganismos. Por la técnica de enriquecimiento, descripta en materiales y métodos, se obtuvo una población bacteriana mezcla capaz de degradar 2-CP. De la misma, fueron aisladas dos especies microbianas predominantes capaces de degradar dicho compuesto. Las mismas fueron identificadas como pertenecientes al género Alcaligenes (C1) y Pseudomonas (C2), con una probabilidad del 91,3% y del 90% respectivamente. La cepa C1 degradó el 2-CP dentro de las 48 h de incubación, en cambio, la C2 metabolizó dicho compuesto mucho más lentamente. Por ello, el microorganismo C1 es el que fue empleado en los ensayos de biodegradación en condiciones «batch» y el que predominó bajo las condiciones de régimen del reactor LF que se describen en este estudio.
Ensayos de biodegradación con reactor “batch”. Los ensayos de biodegradación en microfermentador fueron realizados con 100 y 200 mg/l de 2-CP como única fuente de carbono. En la Figura 2, se observa que – con una concentración de 100 mg/l de 2-CP – el microorganismo, luego de un período de latencia de aproximadamente 12 h, creció exponencialmente, con una velocidad de crecimiento específico (m) de 0,12 h-1, degradando el 2-CP dentro de las 40 horas. Cuando la concentración de 2-CP fue incrementada a 200 mg/l, se demostró un aumento en el período de latencia, siendo el compuesto degradado dentro de las 48 h, con una m también de 0,12 h-1. El proceso se ajustó convenientemente al modelo cinético de Monod (11). La remoción de toxicidad en estos ensayos fue relativamente baja. En la Tabla 4 y en la Figura 2 se presentan los resultados de dos de los ensayos realizados.
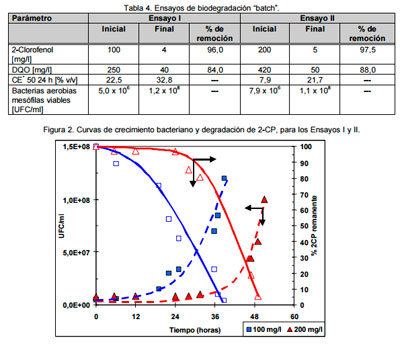 |
Ensayos con reactor LF. En la Tabla 5, se presenta un resumen de los resultados obtenidos durante los ensayos en el reactor LF en condiciones estacionarias. Como puede observarse, se lograron remociones de 2-CP del 98,8% y de DQO del 90,8%, con remociones prácticamente totales de toxicidad (CE 50 24 horas expresada en % v/v no detectables). Si bien se observó un importante aporte de bacterias “ambientales” a través de la alimentación al sistema (@ 105 UFC/ml), en este estudio se ha demostrado a partir de ensayos realizados en condiciones “batch” que dichos microorganismos son incapaces de degradar este compuesto.
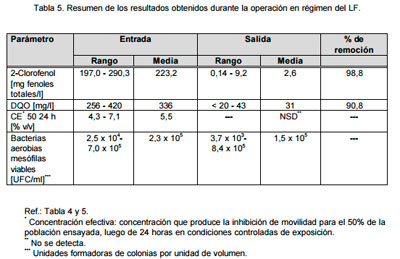 |
Es importante destacar que la biomasa de microorganismos degradadores en el reactor se mantuvo constante y que ésta se desarrolló a partir de un solo inóculo inicial, siendo innecesaria una reinocula-ción del sistema.
En las paredes del reactor, mangueras y gránulos de carbón activado se desarrollaron microalgas y otros organismos. Esto estaría corroborando las condiciones de muy baja toxicidad obtenidos empleando Daphnia magna.
En la primera etapa de funcionamiento del LF se observó la presencia de algas Cloroficeas con predominancia casi absoluta de dos especies de Chlorococales del género Scenedesmus (Fotos 4, 8 y 9). Luego, a partir del aumento de la concentración de 2-CP en la alimentación del reactor se observó que las mismas fueron desplazadas por algas diatomeas con predominancia de Navicula sp. y Pinularia sp. (Fotos 5, 6 y 11). Asociado a estas algas, se ha podido identificar la presencia de algunos rotíferos con predominancia de especies del género Vorticella sp. (Fotos 10 y 13), además de varias especies de nematodes (Foto 7), amebas y ciliados. La Foto 12, muestra un conglomerado de microorganismos adheridos a una partícula de carbón activado. En próximos estudios se prevé realizar experiencias de laboratorio que permitan explicar el rol de estos organismos en el proceso de biodegradación.
Bioensayos de toxicidad. Respecto a la evaluación toxicológica, cabe señalar que tanto la alimentación del LF como la condición inicial del reactor “batch” (operados con concentraciones superiores a 200 mg/l de 2-CP), mostraron elevados niveles de toxicidad, con valores medios de CE 50 24 horas de 14,4 y 15,8 mg/l, respectivamente. En concordancia, Kuhn et al. (12) y Keen et al. (13) informan para Daphnia magna valores de CE 50 24 horas de 6,3 mg/l y 3,9 mg/l, respectivamente. Por otro lado, Le Blanc et al. (14), informaron valores de CE 50 24 horas mayor a 22 mg/l.
Si bien todos estos valores indican que se está en presencia de un compuesto altamente tóxico para estos organismos acuáticos, debe tenerse en cuenta que estas variaciones son explicables por las diferentes condiciones de exposición de los organismos en los ensayos (temperatura, iluminación, alimentación de los cultivos, tipo de agua de dilución, etc.), además de las diferencias en la realización de los ensayos empleando concentraciones nominales ó reales, y/o la aplicación de diferentes tratamientos estadísticos de los resultados.
A pesar de los elevados porcentajes de remoción del 2-CP, las muestras tomadas del reactor “batch” al finalizar cada ensayo, resultaron muy tóxicas (< 25% v/v) de acuerdo a la clasificación empleada por CETESB (15) para efluentes industriales (Tabla 6). En cambio a la salida del reactor continuo no se detectó toxicidad. Sin duda, la heterogeneidad de los organismos presentes en el sistema continuo en equilibrio, resulta ventajosa analizada en términos de remoción de toxicidad respecto al sistema “batch”. Los resultados obtenidos en el reactor LF, adquieren singular importancia si se tiene en cuenta que conforme a lo establecido por la Ley de Residuos Peligrosos (Ley 24051/92) y su Decreto Reglamentario (Dec. 830/93), la toxicidad es una de las características que identifican a un residuo como peligroso.
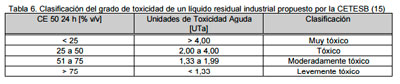 |
CONCLUSIONES
Se ha demostrado que:
- La remoción de 2-CP en los dos sistemas ensayados fue superior, en todos los casos, al 97%.
- Esta degradación la realiza principalmente un microorganismo autóctono perteneciente al género Alcaligenes.
- Durante la puesta en marcha del reactor LF no se produjo “lavado” por arrastre hidráulico de los microorganismos. Siendo innecesaria la reinoculación del sistema.
- Pudo comprobarse que en los ensayos de biodegradación “batch” lograron obtenerse remociones de 2-CP y DQO similares a los obtenidos en el reactor LF. Sin embargo, en el reactor “batch”, a diferencia del proceso de flujo continuo, la remoción de la toxicidad fue relativamente baja. Esto estaría indicando que, desde este punto de vista, la biodegradación sería más eficiente en sistemas de flujo continuo como el ensayado. Probablemente, esto podría deberse a la presencia de otros organismos en el proceso (algas, rotíferos, ciliados, etc.).
- Aunque el reactor LF operó en “condiciones ambientales” (sin esterilidad), con un ingreso constante de microorganismos “ambientales” con la corriente de alimentación (@ 105 UFC/ml), en las condiciones de régimen siguieron predominando las bacterias del género Alcaligenes. La presencia de otros microorganismos, diferentes al Alcaligenes sp., no afectaron la efectividad de la degradación del 2-CP. Esto estaría indicando que esta bacteria sería el principal microorganismo responsable del proceso de biodegradación, no siendo desplazado por otros organismos presentes en el sistema.
- Cabe aclarar que tanto el reactor “batch” como el de lecho fluidizado, operaron con elevadas concentraciones iniciales o de alimentación de 2-CP, del orden de los 200 mg/l. Sin embar-go, debido a la condición de estado estacionario y a la muy elevada recirculación interna, la concentración de 2-CP en el interior del reactor LF permaneció muy baja y similar a los niveles de salida. A pesar de ello, predominó la bacteria Alcaligenes, esto señalaría que esta bacteria es probablemente uno de los pocos microorganismos capaces de biodegradar el 2-CP como única fuente de carbono en las condiciones ensayadas.
- La cepa seleccionada podría ser utilizada para acelerar la degradación del 2-CP en las plantas de tratamiento de líquidos residuales industriales o en acciones de remediación.
- Es importante hacer notar, que de acuerdo a la norma para vertido de los establecimientos industriales o especiales que contengan sustancias peligrosas de naturaleza ecotóxica, los límites de contaminación tolerados para fenoles es de 0,5 mg/l (Ley de Residuos Peligrosos N°24051/92 – Resolución 242/93). Esta concentración es compatible con la detectada en el reactor LF en las actuales condiciones de operación.
REFERENCIAS
1. Chitra S., Sekaran G. Padmavathi S. y Chandrakasan G. (1995). Removal of phenolic compounds from wastewater using mutant strain of Pseudomonas pictorum. J. Gen. Appl. Microbiol. 41, 229-237.
2. Saharsbudhe S.R. y Modi V.V. (1987). Degradation of chlorinated aromatic compounds. Microbiological Sciences, 4, 300-303.
3. Hale D.D., Reineke W. y Wiegel J. (1994). Biological degradation and bioremediation of toxic chemicals (Chapter 4). G. Rasul Chaudry Ed. Chapman & Hall.
4. Liu D. y Pacepavicius G. (1990). A systematic study of the aerobic and anaerobic biodegradation of 18 chlorophenols and 3 cresols. Toxicity Assessment: An Intel. J., 5, 367- 387.
5. Agencia de Ciencia y Tecnología Industrial (Japón). Research Information Data Base. http://www.aist.go.jp/RIODB/db021/nirefate/bio/RCPs_E.html.
6. Korol S., Orsingher M., Santini P., Moretton J. y D’Aquino M. (1989). Biodegradation of phenolic compounds II. Effects of inoculum, xenobiotic concentration and adaptation on Acinetobacter an Pseudomonas phenol degradation. Rev. Lat. Amer. Microbiol. 31, 117-120.
7. Bergey’s Manual of systematic bacteriology (1984). Williams & Wilkins, Baltimore.
8. APHA, AWWA y WEF (1992). Standard methods for the examination of water and wastewater. 18th Edition, American Public Health Association, Washington.
9. Stanlacke G.J. y Finn R.K. (1982). Isolation and characterization of pentachlorophenol degrading bacterium. Appl. Environ. Microbiol. 40, 1421-1427.
10. ISO (1989). Water Quality. Determination of the inmobility of Daphnia magna Strauss Crustacea, Cladocera 6341(E).
11. Monod J. (1949). The growth of bacterial cultures. Ann.Rev.Microbiol. III, 371.
12. Kuhn R., Pattard M., Penak K.D. y Winter A. (1989). Results of the harmful effects of selected water pollutants (Anilines, Phenols, Aliphatic Compounds) to Daphnia magna. Water Research, 23, 4, 495-499.
13. Keen R., Baillod R. (1985). Toxicity to Daphnia of the end products of wet oxidation of phenol and substituted phenols. Water Research 19, 6, 767-772.
14. Le Blanc G.A. (1982). Laboratory investigation into development of resistance of Daphnia magna to environmental pollutants. Environmental Pollution (Serie A) 27, 4, 309-322.
15. CETESB (1987). Toxicidade aguda de effluentes das industrias da Bacia Do Rio Paraiba Do Sul, no Estado de Sao Paulo, Brasil. CETESB, Programa Regional sobre Evaluación y Control de Sustancias Tóxicas en Aguas Superficiales. Lima, Perú.
Gallego A. , Molina Tirado L.B. ,
Fortunato M.S. , Bevilacqua S. ,
Camardella H. , Kabbas S. , Cenzano M.L. ,
Gómez C.E. , D’Aquino M. , Korol S.2 y Higa L.E.