Benceno y derivados aromáticos: influencia, reactividad de algunos radicales sencillos unidos al anillo bencénico
ABSTRACT
Los átomos de carbono del benceno son homogéneos frente a los anillos bencénicos sustituidos, los cuales pueden ser atacados en distintas posiciones dependientes de la naturaleza y colocación de los sustituyentes, en el caso que nos ocupa solo hay uno (tolueno, etilbenceno, estireno), éste dirigirá el grupo entrante a la posición meta o bien de tal forma que dé una mezcla de productos orto y parasustituidos. Se estudiará desde el punto de vista químico, la influencia de estos sustituyentes frente al benceno haciendo uso de indicadores biológicos y los Valores Límite Biológicos.
Palabras clave: sustitución aromática, efecto inductivo y resonante, indicadores biológicos, VLB.
INTRODUCCIÓN
Los compuestos aromáticos son los constituidos por el benceno y los compuestos de comportamiento químico similar. Las propiedades aromáticas son las que distinguen al benceno de los hidrocarburos alifáticos. La molécula bencénica es un anillo: de un tipo muy especial.
Los hidrocarburos aromáticos se caracterizan por su tendencia a la sustitución electrofílica. Además, estas reacciones de sustitución son características de anillos aromáticos dondequiera que aparezcan, independiente de los otros grupos funcionales que la molécula pudiera contener. Estos últimos afectan a la reactividad de los anillos aromáticos, y viceversa.
Comentaremos la cualidad fundamental de la aromaticidad: cómo difieren en comportamiento los compuestos aromáticos de los alifáticos, y qué hay en sus estructuras que los hace diferentes. Y más profundamente veremos un punto de vista opuesto y analizaremos los notables efectos que ejercen los anillos aromáticos, actuando como sustituyentes, sobre reacciones que ocurren en otras partes de la molécula.
Estudiar ver desde el punto de vista químico algunos arenos, la influencia de algunos radicales alifáticos unidos al benceno; en concreto el propio benceno el etilbenceno, el tolueno y el estireno, y ver si afectan en los metabolitos finales
encontrados en fluidos biológicos.
BENCENO. REACCIONES DE SUSTITUCIÓN ELECTROFÍLICA
Dada la definición de compuesto aromático, es evidente que todo estudio de su química debe comenzar con un análisis del benceno.
El benceno es un líquido incoloro de aroma dulce y sabor ligeramente amargo, similar al de la hiel. Se evapora al aire rápidamente y es poco soluble en agua. Es sumamente inflamable, volátil y se forma tanto en procesos naturales como en actividades humanas.
La estructura del benceno se conoce desde 1825, y sus propiedades físicas y químicas son mejor conocidas que la de cualquier otro compuesto orgánico, su estructura no pudo ser determinada de forma satisfactoria hasta 1931. El principal problema era debido no a la complejidad de la molécula en sí, sino que era consecuencia del limitado desarrollo de la teoría estructural alcanzado en aquella época.
En lugar de reacciones de adición (características de alquenos), el benceno experimenta con facilidad un conjunto de reacciones, todas de sustitución.
En cada una de estas reacciones se ha sustituido un átomo, o grupo, por uno de los átomos de hidrógeno de benceno. A su vez, el producto puede sufrir sustitución posterior del mismo tipo. El hecho de que hayan retenido las propiedades características del benceno indica que ha mantenido también su estructura característica.
Concluyendo, las reacciones características del benceno implican sustitución, en las que se conserva el sistema anular estabilizado por resonancia, no es de extrañar que en sus reacciones típicas, el anillo bencénico sirva como fuente de electrones, esto es, que actúe como base y los compuestos con los que reaccionan son electrónicamente deficientes, es decir, reactivos electrofílicos o ácidos. Siendo las reacciones típicas del anillo bencénico las de sustitución electrofílica.
La sustitución aromática electrofílica no solo es típica del benceno mismo, sino del anillo bencénico donde se encuentre. Constituyendo la vía de acceso inicial para casi todos los compuestos aromáticos, pues permite la introducción directa de ciertos grupos sustituyentes que luego pueden convertirse en otros.
HIDROCARBUROS AROMÁTICOS-ALIFÁTICOS. ARENOS
El anillo aromático ejerce, como la unión doble, efectos poderosos, que se parecen a los del doble enlace: son el resultado de una conjugación.
Conocemos lo que debe esperarse del benceno (como hidrocarburo aromático matriz). Sin embargo, muchos compuestos importantes no son alifáticos o aromáticos, sino contienen unidades tanto alifáticas como aromáticas; los hidrocarburos de este tipo se denominan colectivamente arenos. El etilbenceno, el tolueno (metilbenceno) y estireno (vinilbenceno), que son los compuestos objeto del estudio, todos con un anillo bencénico y una cadena lateral alifática.
¿Qué tipo de propiedades químicas esperamos de uno de estos hidrocarburos mixtos aromáticos-alifáticos? En primer lugar, es de suponer que presentan dos conjuntos de propiedades químicas. El anillo del etilbenceno debería sufrir la sustitución aromática electrofílica característica del benceno, y la cadena lateral, la sustitución de radicales libres característica del etano. En segundo lugar, las propiedades de cada parte de la molécula deberían sufrir modificaciones por presencia de la otra: el grupo etilo debería modificar las propiedades del anillo y éste, a su vez, propiedades alifáticas de la cadena lateral.
Reacciones de los alquilbencenos
Estas reacciones implican sustitución aromática electrofílica en el anillo, o bien sustitución de radicales libres en la cadena lateral alifática, excepto para la hidrogenación y oxidación.
Consideraremos, en primer lugar el modo en que las condiciones experimentales determinan parte de la molécula –aromática o alifática- que es atacada, y en segundo lugar la manera en que cada parte de la molécula modifica las reacciones de la otra.
Las reacciones de los alquilbencenos son la hidrogenación, la oxidación, la sustitución en el anillo (sustitución aromática electrofílica) y la sustitución en la cadena lateral.
EFECTOS DE GRUPOS SUSTITUYENTES
Del benceno se derivan otros hidrocarburos, como hemos visto en el apartado anterior, entre los que veremos el tolueno, etilbenceno y estireno.
Como el benceno, el tolueno, etilbenceno y estireno sufren la sustitución aromática electrofílica. Cuando esto se produce en estos alquilbencenos se originan tres productos disustituidos, pero en realidad esta reacción solo da cantidades apreciables de dos de ellos, los isómeros orto y para.
El estudio de la nitración, Halogenación y alquilación de Friedel-Craft da resultados análogos. De alguna manera, el grupo alquilo hace más reactivo al anillo bencénico, en comparación con el benceno y dirige al reactivo atacante a las posiciones anulares orto y para.
Por otra parte, y para considerar un ejemplo diferente, se ha encontrado que el nitrobenceno se sustituye en forma más lenta que el benceno y que produce, principalmente, el isómero meta.
Como el metilo o el nitro, cualquier grupo unido a un anillo bencénico lo afecta en su reactividad y determina la orientación de la sustitución. Cuando un reactivo electrófilo ataca aun anillo aromático, el grupo ya enlazado determina lo fácil que será el ataque, y dónde sucederá.
Cuando un grupo hace que un anillo sea más reactivo que el benceno, se llama grupo activante; si es lo contrario, se conoce como grupo desactivante.
Un grupo que motiva un ataque en las posiciones orto y para, es un director orto-para; uno que ocasiona lo mismo en la posición meta se llama director meta.
Teoría de la orientación
La determinación de un grupo sobre la orientación es simple. El benceno que contiene este grupo se somete a sustitución y, luego se determina la proporción de los tres isómeros en el producto (orto, meta y para).
Se ha encontrado que cada grupo puede colocarse en una de dos categorías: directores orto-para y directores meta. Por lo general, la identificación de cada isómero orto, meta o para, implica compararlo con una muestra auténtica preparada por otro método, desde una sustancia de estructura conocida.
Tanto la orientación orto-para como la meta surgen de la misma forma: el efecto de cualquier grupo –sea activante o desactivante- es más intenso en las posiciones orto y para.
Para apreciar si esto es lo esperado, compararemos los carbocationes generados por el ataque en las posiciones para y meta del tolueno, un compuesto con un grupo activante. La carga positiva se encuentra ubicada en el carbono que tiene el metilo –CH3. Aunque este libera electrones para todas las posiciones del anillo, lo hace más intensamente hacia el carbono más cercano. Por consiguiente la estructura, el la que la carga + recae obre el carbono que soporta al grupo CH3, es particularmente estable. Debido a la contribución de esta estructura, el carbocatión híbrido que resulta del ataque a la posición para es más estable que el resultante del ataque a la posición meta. Por tanto, la sustitución es más rápida en para que en meta.
Consecuentemente, en el tolueno, la sustitución orto-para es más rápida que la meta, porque la liberación de electrones por –CH3, es más efectiva durante el ataque a las posiciones orto y para con respecto a él.
Concluyendo, tanto la orientación orto, para por grupos activantes, como la meta por desactivantes, son consecuencia lógica de la estructura del carbocatión intermediario.
Teoría de la reactividad
La determinación de la reactividad relativa: Un grupo se clasifica activante, si el anillo al que sustituye es más reactivo que el benceno, y desactivante, si ocurre lo contrario. Las reactividades del benceno y de uno sustituido y se comparan.
Midiendo el tiempo que necesitan las reacciones bajo condiciones idénticas. Por ejemplo, el tolueno reacciona con ácido sulfúrico fumante entre un décimo y un vigésimo de tiempo requerido por el benceno: el tolueno es más reactivo que el benceno, por lo que el –CH3 es un grupo activante. Siendo, sin embargo, el nitrobenceno menos reactivo que el benceno, por lo que el grupo nitro –NO2, es desactivante.
Para comparar la velocidad de sustitución en el benceno, tolueno y nitrobenceno confrontaremos las estructuras de los carbocationes que genera cada uno de los tres compuestos:
El grupo metilo tiende a neutralizar la carga positiva, liberando electrones y haciéndose, por tanto, más positivo a sí mismo. Esta dispersión de la carga estabiliza al carbocatión. El efecto inductivo estabiliza de la misma forma la carga positiva que se desarrolla en el estado de transición, y la reacción se acelera.
Si en lugar de un grupo metilo fuese un grupo nitro –NO2, éste ejerce un efecto inductivo de atracción de electrones: esto tiende a intensificar la carga positiva, desestabiliza al carbocatión y hace que la reacción sea más lenta.
En consecuencia la reactividad en la sustitución aromática electrofílica depende de la tendencia de un grupo sustituyente a la liberación o atracción de electrones. Un grupo que libera electrones, activa el anillo; uno que los atrae, lo desactiva.
Otros grupos alquilo liberan electrones igual que el -CH3 y, como éste, activan el anillo.
Todos los sustituyentes activantes orientan a orto y para. Casi todos los sustituyentes desactivantes orientan a meta.
CLASIFICACIÓN DE GRUPOS SUSTITUYENTES
La tabla siguiente muestra casi todos los grupos que se dividen en dos clases: activantes y directores orto, para, o desactivantes y directores meta. Y los halógenos forman una clase especial, pues son desactivantes, pero directores orto, para.
 |
VALORES LÍMITES DEL BENCENO Y ALGUNOS ALQUILBENCENOS
Reflejar los valores de referencia VLA, agentes químicos cancerígenos y mutágenos y los VLB de los compuestos que vamos a estudiar. Para ello haremos uso de los Límites de Exposición Profesional para Agentes Químicos en España. 2010. Los compuestos que vamos a estudiar son:
Benceno (EINECS: 200-753-7, CAS: 71-43-2), el estireno (EINECS: 202-851-5 y CAS: 100-42-5), el Etibenceno (EINECS: 202-849-4 y CAS: 100-41-4) y el tolueno (EINECS: 203-625-9 y CAS: 108-88-3).
Comenzaremos por los Valores Límite Ambientales (VLA):
Los VLA son valores de referencia para los agentes químicos en el aire, y representan condiciones a las cuales se cree, basándose en los conocimientos actuales, que la mayoría de trabajadores pueden estar expuestos día tras día, durante su vida laboral, sin sufrir efectos adversos para su salud.
Sirven exclusivamente para la evaluación y el control de los riesgos por inhalación de los agentes químicos incluidos en la lista de valores. Para los compuestos de estudio podemos obtener información de la tabla siguiente, Tabla 2.
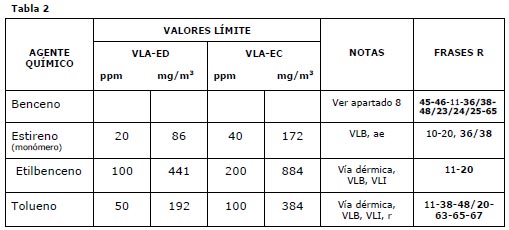 |
Seguiremos con los agentes químicos cancerígenos y mutágenos.
Lo primero es definir qué son agentes químicos carcinógenos y mutagénicos:
Carcinogénicos: las sustancias y preparados que, por inhalación, ingestión o penetración cutánea puedan producir cáncer o aumentar su frecuencia.
Mutagénicos: las sustancias y preparados que, por inhalación, ingestión o penetración cutánea, puedan producir alteraciones genéticas hereditarias o aumentar su frecuencia.
Los conocimientos científicos actuales no permiten identificar niveles de exposición por debajo de los cuales no exista riesgo de que los agentes mutágenos y la mayoría de los cancerígenos produzcan sus efectos característicos sobre la salud. No obstante, se admite la existencia de una relación exposición-probabilidad del efecto que permite deducir que cuanto más baja sea la exposición a estos agentes menor será el riesgo. En estos casos, mantener la exposición por debajo de un valor máximo determinado no permitirá evitar completamente el riesgo, aunque sí podrá limitarlo.
La consideración anterior es el motivo por el que en estas tablas no se incluyen las sustancias carcinogénicas de categoría C3, al no serles de aplicación las disposiciones del Real Decreto 665/1997, y sí las sustancias mutagénicas de categoría 1 y 2.
En el caso que nos ocupa de nuestros compuestos anteriores solo tenemos el benceno (los demás de categoría C3) al tratarse de un compuesto cancerígeno de categoría C1 y mutágeno de categoría M2, que veremos en la tabla 3.
 |
Notas de las Tablas 2 y 3:
Apartado 8: Agentes químicos cancerígenos y mutágenos, ver Tabla 3.
ae: Alterador endocrino. De los seres humanos y de los animales, que son causantes de perjuicios para la salud como el cáncer, alteraciones del comportamiento y anomalías en la reproducción.
r: sustancia con restricciones a la fabricación, la comercialización o el uso en los términos especificados en el ―Reglamento CE 1907/2006 sobre Registro, Evaluación, Autorización y Restricción de sustancias y preparados químicos‖ (REACH).
C1: Sustancia carcinogénica de primera categoría. «Sustancias que, se sabe, son carcinogénicas para el hombre. Se dispone de elementos suficientes para establecer la existencia de una relación de causa/efecto entre la exposición del hombre a tales sustancias y la aparición del cáncer‖. Le es de aplicación el RD 665/1997.
M2: Sustancia que puede considerarse mutagénica para el hombre. ―Se dispone de suficientes elementos para suponer que la exposición del hombre a tales sustancias puede producir alteraciones genéticas hereditarias. Dicha presunción se fundamenta generalmente en estudios apropiados en animales. Le es de aplicación el RD 665/1997.
V: Real Decreto 1124/2000, de 16 de junio (BOE nº 145 de 17 de junio de 2000), por el que se modifica el Real Decreto 665/1997.
VLB: Agente químico que tiene Valor Límite Biológico específico.
VLI: Agente químico que tiene establecido un valor límite indicativo por la UE.
Concluiremos con los Valores Límite Biológicos (VLB):
Son los valores de referencia para los Indicadores Biológicos asociados a la exposición global a los agentes químicos. Los VLB son aplicables para exposiciones profesionales de ocho horas diarias durante cinco días a la semana.
Los VLB representan los niveles más probables de los Indicadores Biológicos en trabajadores sanos sometidos a una exposición global a agentes químicos, equivalente,en términos de dosis absorbida, a una exposición exclusivamente por inhalación del orden del VLA-ED.
Los indicadores biológicos medidos en orina son habitualmente analizados en muestras puntuales y la medida cuantitativa de la exposición a partir de estas muestras puede verse afectada por la variabilidad en la producción de orina, debido a factores como la ingestión de líquidos, la temperatura excesiva, la carga de trabajo, el consumo de medicamentos, etc.
En algunas ocasiones, los resultados de los indicadores se refieren a la concentración de creatinina (sustancia que se elimina por filtración glomerular, como la mayoría de los contaminantes y sus metabolitos) medida en la misma muestra, expresándose los resultados en peso del indicador por unidad de peso de creatinina.
A continuación veremos la lista de Valores Límite Biológicos (Tabla 4) para los agentes químicos que estamos estudiando, especificándose en la columna Indicador la matriz biológica en donde se determina el agente químico.
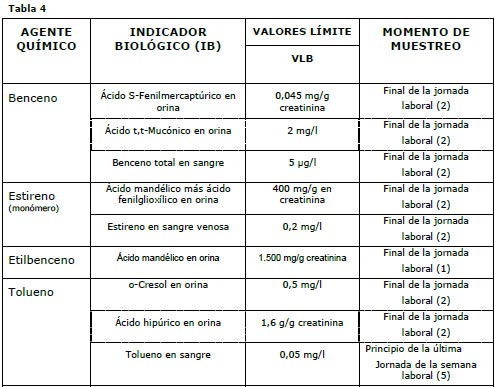 |
Hay propuestas de modificación referidas a los valores límite Biológicos, en la tabla siguiente (Tabla 5) veremos al etilbenceno como agente químico propuesto, de los que nos ocupan.
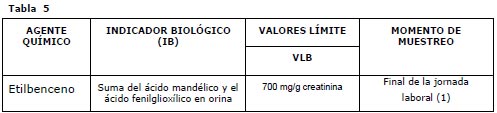 |
Notas de las Tablas 4 y 5:
(1) Significa después de cuatro o cinco días consecutivos de trabajo con exposición, lo antes posible después del final de la última jornada, dado que los indicadores biológicos se eliminan con vidas medias superiores a las cinco horas.
(2) Cuando el final de la exposición no coincida con el final de la jornada laboral, la muestra se tomará lo antes posible después de que cese la exposición real.
Control biológico humano en algunos compuestos químicos industriales
El control biológico es una de las más prometedoras herramientas para llevar a cabo un programa de prevención efectivo de los potenciales efectos tóxicos del ambiente laboral, su característica más interesante es la posibilidad de detectar intoxicaciones en un estado muy inicial, por medio de indicadores de dosis y de efecto.
La evaluación de la exposición de los trabajadores a los agentes peligrosos es una de las medidas que aseguran la mejor protección para la salud, esta evaluación se denomina control. Hay dos aproximaciones posibles para realizar el control, el control ambiental y el biológico.
El control ambiental es la medida y valoración de los agentes en el puesto con el fin de calcular la exposición ambiental y el riesgo para la salud comparado con un valor asignado de referencia.
El control biológico es la medida y valoración de los agentes en el puesto de trabajo o de sus metabolitos, con el fin de evaluar la exposición y el riesgo para la salud comparado con un valor asignado de referencia. El control biológico mide o evalúa la exposición ocurrida por todas las vías de entrada. Tiene en cuenta la variabilidad de los individuos, el impacto de factores tales como la actividad personal, las características biológicas y el estilo de vida de los individuos.
Es esencial conocer con detalles el metabolismo del agente tóxico en el organismo humano y las alteraciones que ocurren en el órgano crítico a la hora de seleccionar el parámetro que se va a utilizar como indicador.
BENCENO
Haremos una revisión del benceno líquido en relación con la exposición laboral y las posibilidades de control biológico de la exposición.
La absorción de éste ocurre principalmente por inhalación de los vapores y en segundo lugar por contacto, en su forma líquida, a través de la piel. Éste puede producir anemia aplásica, leucemia y eritroleucemia.
Puede producir anemia aplástica, leucemia y eritroleucemia. Su toxicidad, en su etapa inicial, puede manifestarse como una alteración paradójica del tejido sanguíneo, en los trabajadores: policitemia y anemia, leucocitosis y leucopenia, trombocitosis y trombocitopenia, sin embargo la exposición continua la tendencia es hacia la disminución de los niveles de eritrocitos, leucocitos y trombocitos circulante.
Metabolismo. Rutas metabólicas
La absorción ocurre principalmente por inhalación de los vapores y en segundo lugar a través del contacto con la piel. Debido a su elevada lipofilia, los niveles más altos de benceno se han encontrado en tejido adiposo y médula ósea. Una primera fracción del benceno absorbido se excreta inalterado en el aire exhalado.
La biotransformación metabólica “in vivo” del benceno.
La primera reacción, catalizada por el sistema de oxidasas microsomales de función mixta de varios tejidos, es la transformación del benceno en epóxido de benceno, éste es un compuesto muy activo que, o bien se une al ADN, proteínas, o se transforma posteriormente en otro derivados del benceno. El epóxido de benceno se sospecha que sea el responsable de la acción mielotóxica del benceno (acción perjudicial para el tejido nerviosos, actúa sobre la médula ósea). La acción mielotóxica del tolueno hoy en día es muy discutida, ya que los compuestos que lo contienen raramente están exentos de benceno, que seria, en realidad el agente mielotóxico.
El epóxido puede ser transformado no enzimáticamente en fenol, conjugándose después con el ácido glucurónico o con el anión sulfato. Sus derivados (los glucuronos y sulfoconjugados del fenol) se excretan por la orina. El fenol (libre o conjugado) constituye el principal metabolito urinario del benceno.
El epóxido también puede reaccionar con el glutation formándose el compuesto S(1,2-dihidro-2-hidroxifenil)glutation. La acción siguiente de una glutationasa, en la presencia de un receptor de glutamina, una peptidasa y acetil CoA acetiltransferasa, da lugar a la formación de ácido premercaptúrico, es decir, S(1,2-dihidro-2-hidroxifenil) acetil-L-cisteína, que se excreta como tal en la orina. Cuando la orina se trata con ácidos minerales, el ácido premercaptúrico se transforma en ácido mercaptúrico.
La acción de la enzima epóxido hidrasa transforma el benceno en trans-1,2-dihidroxibenceno que se convierte rápidamente en catecol. Se ha aislado de las bacterias una enzima (cis-benceno glicol dehidrogenasa) que cataliza la conversión de cis-bencenoglicol en catecol en presencia de NAD+. Se han identificado pequeñas cantidades de hidraquinol y 1,2,4-trihidroxibenceno en orina.
La ruptura del anillo de catecol da lugar al ácido trans,trans-mucónico que se excreta en la orina y a dióxido de carbono que se excreta en el aire exhalado.
Tras experimentación con voluntarios, se encontró que del 74-87 % de benceno absorbido se excretaba como fenol, y el 12 % se excretaba inalterado. Sin embargo todas las investigaciones coinciden con que el ácido Fenilmercaptúrico, catecol, hidroquinol y ácido mucónico son metabolitos menores del benceno.
Como la mayoría de las sustancias orgánicas volátiles, la eliminación del benceno y sus metabolitos es rápida, la excreción de los metabolitos se realiza dentro de las 24-48 horas después de una exposición única.
Contrariamente a los derivados sustituidos del benceno, tolueno, xilenos…, que se metabolizan principalmente en la cadena lateral, el benceno se transforma en fenol «in vivo»
TOLUENO
Actualmente, los efectos crónicos en los humanos, se sabe que al contrario del benceno, el tolueno no es mielotóxico y no modifica la composición de la sangre. Los estudios anteriores que sugerían para el tolueno propiedades mielotóxicas eran el resultado de investigaciones en trabajadores que manipulaban tolueno contaminado con benceno.
Es importante recordar que si el tolueno purificado contiene generalmente menos del 0,01 % de benceno, el de grado industrial puede superar el 25% de benceno.
Se han atribuido cambios biológicos no específicos al tolueno el cual ejerce su acción tóxica principalmente sobre el sistema nervioso central y secundariamente en el hígado y los riñones.
Metabolismo. Rutas metabólicas
La absorción del tolueno tiene lugar principalmente por la inhalación de los vapores y por contacto con la piel cuando está en forma líquida. El tolueno ejerce su principal acción tóxica en el sistema nervioso central.
Se producirán reacciones que implican sustitución aromática electrofílica en el anillo, o bien sustitución de radicales libres en la cadena lateral alifática.
Las condiciones experimentales determinan parte de la molécula –aromática o alifática- que es atacada, y la manera en que cada parte de la molécula modifica las reacciones de la otra.
El tolueno hace aumentar el ácido hipúrico in vivo por lo tanto la medida de éste tiene cierta aplicación práctica en la evaluación de la exposición actual a tolueno.
Aproximadamente se absorbe un 40% del tolueno inhalado. Una fracción (25%) del tolueno absorbido se excreta inalterado en el aire exhalado y el resto de tolueno (75%) se oxida principalmente por transformación del radical metilo a radical carboxilo (por el sistema monooxigenasa microsomal) el cual se conjuga después con glicina para dar ácido hipúrico.
La concentración media de ácido hipúrico en orina al final de la jornada se mide calculando los g/g de creatinina. Otra opción es la determinación de la concentración media de tolueno en sangre venosa (mg/l).
Normalmente, la determinación de o-cresol en orina no parece que ofrezca más ventajas con respecto al análisis de ácido hipúrico.
Contrariamente al benceno, sólo una pequeña fracción de tolueno (menos del 1%) se oxida en el anillo aromático dando orto-, meta- y para-cresol. Esta diferencia en el metabolismo oxidativo del benceno y tolueno probablemente explica las propiedades mielotóxicas diferentes de ambos disolventes.
El tolueno sufre la sustitución aromática electrofílica, obteniéndose como isómeros más favorecidos el orto y el para, con cantidades apreciables, ya que la cantidad de meta es despreciable. Se estudiará al final de la jornada laboral el o-Cresol en orina (ml/l).
o-cresol en orina
Solo una pequeña fracción de vapor de tolueno inhalado se oxida en el anillo aromático con producción de cresoles. Dado que el isómero o-cresol no es un constituyente principal de la orina normal (< 0.3 mg/l), se propone su determinación como un método de control biológico.
Conclusiones
La determinación de la concentración media de ácido hipúrico en las orinas recogidas al final de la jornada es el método más práctico de evaluar si las condiciones higiénicas globales son satisfactorias (límite de 1,6 g/g de creatinina). Actualmente, la determinación de la concentración de o-cresol en orina, es otro indicador biológico, para su determinación.
Las reacciones de sustitución de radicales libres en la cadena lateral alifática son más favorables que las que implican sustitución aromática electrofílica en el anillo. De estas últimas, sabemos que el grupo metilo, actúa como un grupo activante y orto y para- dirigente, con producto mayoritario en orto.
ETILBENCENO
El etilbenceno es irritante para la piel y las mucosas. La exposición de humanos a concentraciones de 1000 y 2000 ppm conduce rápidamente la irritación severa de ojos y lagrimeo. Como la mayoría de disolventes lipofilicos, también ejerce un efecto depresor sobre el sistema nervios central, cuando la exposición excede de 100 ppm se ha relatado vértigo, somnolencia y dolor de cabeza.
Metabolismo. Rutas metabólicas
En la industria, la absorción del etilbenceno se produce a través de la inhalación de los vapores y en segundo término a través del contacto con la piel en su forma líquida.
El etilbenceno tiende a acumularse en tejido adipososo, una pequeña fracción (<10%) del etilbenceno absorbido es eliminado sin cambio alguno en el aire expirado y el resto es eliminado en la orina.
La fracción principal (sobre un 90%) es biotransformada y sus metabolitos son excretados por la orina. La conversión metabólica transcurre principalmente a través de la oxidación de la cadena lateral la oxidación del anillo es de menor importancia. Varios autores han relatado el hallazgo de varios metabolitos urinarios (libres o conjugados) en el hombre y animales expuestos a etilbenceno: ácido mandélico, ácido fenilglioxílico, ácido hipúrico, ácido benzoico, ácido fenilacético, metilfenilcarbinol o 1-feniletanol, 4-etilfenol y 2-etilfenol, 1-fenil-1,2-etanodiol, acetofenona, ώ-hidroxiacetofenona, m-hidroxiacetofonona, p-hidroxiacetofenona.
La biotransformación del etilbenceno en el hombre, está bien establecido que, en el hombre, los dos metabolitos urinarios principales son los ácidos mandélico y fenilglioxílico que representan aproximadamente un 90% de los metabolitos urinarios del etilbenceno. Su mayor concentración es al final del turno de trabajo; el tiempo biológico medio de excreción del ácido mandélico es de unas 5 horas.
En las reacciones propias del anillo aromático se observa la oxidación del anillo y se produce el 4-etilfenol (en un 4%) y el 2-etilfenol (en menos de un 1%), de los metabolitos urinarios.
Una exposición combinada de sujetos voluntarios a etilbenceno y m-xileno producía una inhibición mutua del metabolismo del etilbenceno y el m-xileno, lo cual se demostraba por la excreción retardada y el descenso de las cantidades de metabolitos excretados.
Indicadores biológicos
Los indicadores biológicos que se pueden considerar para la valoración de la exposición a etilbenceno son ácido mandélico en orina.
Actualmente se ha propuesto la ampliación del indicador biológico que pasaría de ácido mandélico en orina a la suma del ácido mandélico y el ácido fenilglioxílico en orina, disminuyendo a la vez el VLB de 1500 mg/g a 750 mg/g de creatinina
Conclusiones
Los estudios de experimentación animal y humana ponen de manifiesto que las reacciones de sustitución de radicales libres en la cadena lateral alifática son más favorables que las que implican sustitución aromática electrofílica en el anillo. De estas últimas, sabemos que el grupo etilo, actúa como un grupo activante y orto y para- dirigente, con producto mayoritario en para.
ESTIRENO
El estireno es un líquido volátil que penetra en el organismo por inhalación y el contacto dérmico con la forma líquida.
Se han identificado tres metabolitos en la orina de los trabajadores expuestos a estireno, que en orden decreciente de importancia son: ácido mandélico (85%), ácido fenilglioxílico (18%) y 4-vinilfenol (menos del 1 %).
El indicador biológico actual de la exposición a estireno, corresponde a la suma de las concentraciones de los ácidos mandélico y fenilglioxílico en las muestras de orina después del turno de trabajo o en las de la mañana siguiente.
El efectos en los humanos es principalmente un neurotóxico que daña la función del sistema nervioso central.
Como cualquier otro disolvente, el estireno puede afectar a las funciones psicológicas. Se estudió a un trabajadores expuestos a estireno en la fabricación de productos plásticos de poliéster, encontraron que la concentración elevada de ácido mandélico en la orina al final del turno de trabajo (> 1,7 g/l), se relacionaba estadísticamente significativa con la inexactitud de la visión motora, deficiencia psicomotora y disminución en la observación.
También se han citado cambios hematológicos en los trabajadores expuestos a los vapores de estireno.
El estireno es mutágeno» in vitro»; e «in vivo» probablemente por su biotransformación en óxido de estireno, se ha encontrado un incremento del número de aberraciones cromosómicas en los linfocitos de los trabajadores expuestos a estireno.
Se ha sugerido un efecto teratógeno del estireno en el hombre, después de la observación de malformaciones en el sistema nervioso central en dos niños de madres que habían estado expuestas a estireno durante el embarazo.
Metabolismo. Rutas metabólicas
En la industria, la absorción del estireno tiene lugar por la inhalación de los vapores (retenciones del 45 al 80%) y a través de la piel por contacto con la forma líquida.
Una fracción del estireno absorbido se elimina inalterado en el aire espirado, y el resto se oxida a óxido de estireno que se hidroliza a estireno glicol. Este metabolito se oxida después a ácido mandélico. En el hombre el ácido mandélico, o se excreta como tal en la orina, o continúa oxidándose a ácido fenilglioxílico, que también se excreta por los riñones.
Cuando la exposición es intensa (concentración ambiental superior a 100 ppm), la concentración in vivo de ácido mandélico es suficiente para estimular significativamente otro camino de biotransformación, es decir, la descarboxilación del ácido mandélico en alcohol bencílico, precursor del ácido hipúrico.
La vida media biológica del ácido fenilglioxílico en orina es mayor que la del ácido mandélico, y es función de la intensidad de la exposición.
Un pequeño porcentaje de estireno (< 1%) también se oxida en el anillo aromático dando 3,4-óxido de estireno, convirtiéndose en 4-vinilfenol que se excreta en la orina.
Indicadores biológicos
Los parámetros biológicos siguientes para evaluar la exposición a estireno, son la concentración de estireno en sangre, la suma de la excreción del ácido mandélico y el ácido fenilglioxílico en orina.
Conclusiones
Entre las determinaciones biológicas que se han propuesto para evaluar la intensidad de la exposición a estireno dos parecen ser las de valor práctico, que son la excreción urinaria de los ácidos mandélico y fenilglioxílico.
Actualmente el mejor parámetro de la exposición es la suma de las concentraciones de los ácidos mandélico y fenilglioxílico en las muestras de orina después del turno de trabajo o en las de la mañana siguiente.
El pequeño porcentaje de estireno (< 1%) que se oxida para dar el 3,4-óxido de estireno, convirtiéndose en 4-vinilfenol que se excreta en la orina, no es suficientemente importante como para considerarlo como indicador biológico.
Por lo que se deduce que en el estireno, desde el punto de vista químico la reactividad más importarte dentro del organismo humano se origina en la cadena lateral unida al benceno, en el grupo vinilo, lógico por la presencia del doble enlace. Siendo este grupo vinilo en el compuesto minoritario, 4-vinilfenol, sería un grupo activante para-dirigente.
CONCLUSIONES
Las reacciones de sustitución de radicales libres en la cadena lateral alifática son más favorables que las que implican sustitución aromática electrofílica en el anillo. De estas últimas, sabemos que los grupos alquilo actúan como un grupos activantes y orto y para- dirigentes, con producto mayoritario en orto o para, dependiendo del areno de que se trate. Sus metabolitos se producen en bajas proporciones, en algunos alquilbencenos no suficientes, como para poder considerarlos como indicadores biológicos.
AGRADECIMIENTOS
Recordar a mi compañero y amigo Antonio Baixauli Edo, por su fuerza, profesionalidad y empuje que siempre me inculcó y agradecérselo para siempre.
REFERENCIAS
- Límites de Exposición Profesional para Agentes Químicos en España. 2010. INSHT.
- Química Orgánica. Allinger. Cava. de Johgh. Jonson. Lebel. Stevens. Ed. Reverté, S.A.
- Química orgánica, John McMurry. Ed. Thomson
- Control biológico humano en una serie de compuestos químicos industriales: Benceno (EUR 8476 EN). Tolueno (EUR 8476 EN). Etilbenceno. Estireno(EUR 8903 EN). Xileno.. R. Lauwerys. Editado por la Generalitat Valenciana, Conselleria de Sanitat i Consum, Direcció General de Salut Pública.
- Bethlehem Steel Corporation: ―Comparison of benzene leveis from urine phenol and air sample data, TABLE XIl-12, NIOSH (1974). Criteria for a recommended standard, Occupational exposure to benzene‖. National Institute for Occupational Safety and Health, US Department of Health, Education and Welfare. Washington, D. C., 133.63
- Sherwood, R. J. (1976): ―Comparative methods of biologic monitoring of benzene exposure‖. Artículo presentado en el Workshop on Toxicology of Benzene. Paris, November 9-11, 1976.
- Chin B.H., McKalvey J.A., Calisti U. et al., A compari son of in vivo and in vitre (tissue explant) techniques: metabolic profile of ethylbenzene in the rat and the dog. Buli. Environ. Contam. Toxicol. 25, 241, 1980.
- Gromiec J.P., Piotrowski J.K., Urinary mandelic acid as an exposure test for ethylbenzene. mt. Arch. Occup. Environ. Health 55, 61, 1984
- Van Haaften, A. B.; Sie, S. T. (1965): ―The measurement of phenol in urine by gas chromatography as a check benzene exposure‖. Amer. Industr. Hyg. Ass. J., 26, 52.
- Bardodej, Z., and Bardodejova, E. (1970): ―Biotransformation of ethylbenzene, styrene and alpha-methylstyrene in man‖. Amer. Ind. Hyg. Assoc. J, 31, 206.
- Fiserova-Bergerova, V., and Teisinger, J. (1965), ―Pulmonary styrene retention”. Industr. Med. Surg., 43,620
Por: Mª Josefa Zafra Barranco
Centro Territorial del INVASSAT de Valencia (Higiene Industrial)/ Técnico de Análisis Instrumental (Valencia), España