Adsorción de SO2 sobre la superficie de óxidos de metales de transición
Selección de un óxido metálico para adsorción de SO2
Abstract
Son bien conocidos los efectos nocivos del SO2 sobre la salud de la población. El objetivo de este trabajo es reducir el nivel de este contaminante mediante su adsorción sobre óxidos de metales de transición del primer período, desde el vanadio al níquel, soportados en alúmina.
1- Introducción
La contaminación del aire es una de las problemáticas ambientales más críticas a nivel mundial y una de las que más esfuerzos demanda a la comunidad científica para su reducción a niveles permitidos por la normalidad internacional sobre calidad de aire.
El SO2 es el contaminante gaseoso que más se emite a la atmósfera. Los procesos industriales que más contribuyen a la presencia de compuestos SOx en la atmósfera son la calcinación de minerales de azufre, la refinación del petróleo, la producción de H2SO4 y la de coque a partir de carbón.
Los óxidos de azufre se eliminan del aire mediante su conversión en ácido sulfúrico y sulfatos. En esta forma terminan depositándose sobre la tierra o el mar, ya sea con la precipitación pluvial osedimentando en forma de partículas.
Los métodos generales de reducción de los niveles de SO2 en gases de chimeneas industriales se dividen endesechables, regenerativos y procesos secos. Como el SO2 es un gas ácido casi todos los procesos de depuración utilizan una solución acuosa o una lechada de un material alcalino. Los diseños desechables se deshacen del azufre formadoeliminándolo en forma de algún lodo residual del tipo de calcio. El producto de los procesos regenerativos es azufre o ácido sulfúrico, y la solución alcalina se recircula. En la depuración en seco se remueve el SO2 poniéndolo en contacto con una solución absorbente adecuada, generándose sulfitos y sulfato
El presente trabajo propone una metodología de reducción, a escala de laboratorio, de los niveles de dióxido de azufre basándose en la adsorción del mismo sobre la superficie de algunos óxidos de metales de transición.
La elección de los elementos de transición de la primera serie se realizó en función de sus capacidades para interactuar con ligandos, que poseen electrones no combinados, debido a la presencia de orbitales d parcialmente ocupados y que poseen una mayor capacidad de unión debido a que estan bloqueados los orbitales p por los orbitales d presentes. No se utilizaron los primeros y últimos elementos de la serie dado que no se dan las particularidades mencionadas anteriormente. El anión utilizado es el óxido debido a la estabilidad térmica de estos compuestos.
Las temperaturas elegidas para la experimentación están en función de las que operan chimeneas reales.
2- Experimentación
Para nuestra experimentación utilizamos un reactor de lecho fijo. El mismo es de cuarzo, con forma tubular, de 6 mm de diámetro interno y 100 cm de largo, que presenta dos muescas internas para soportar el relleno y que se mantiene por completo dentro de un horno vertical de sección circular, con temperatura regulable hasta 1200 ºC por medio de una termocupla de hierro – constantán y con aberturas superior e inferior, las que permiten extraer el tubo de reacción para proceder a su limpieza., cambio de catalizador, etc.
El reactor consiste de tres zonas: la más interna y más larga o zona de precalentamiento del gas ingresante, la zona de reacción, sección del tubo que presenta las dos muescas internas sobre las que se ubica, entre lana de cuarzo, el óxido soportado en alúmina solo o íntimamente mezclado con CSi y la zona más externa o de descarga conectada a un registrador de concentración de dióxido de azufre que es un analizador de celda electroquímica específica, SafeLog 100, Quest technologies.
El dióxido de azufre, de concentración 10 ppm en nitrógeno, se suministra mediante una manguera de conexión desde un cilindro de gas comprimido y a través de su correspondiente válvula reguladora de caudal. Después de la válvula reguladora el flujo gaseoso es controlado por un rotámetro con un rango de flujo de 0 – 50 ml/min o de 0 – 500 ml/min según el caso. Otro rotámetro colocado entre el reactor yel registrador de concentración de dióxido de azufre mide el flujo de la corriente gaseosa que sale del reactor.
Cuando abandona el reactor, y previo paso por el registrador, se hace burbujear a la corriente gaseosaen un frasco lavador con agua destilada para verificar la posible presencia de trióxido de azufre. A continuación, se lo hace burbujear en una solución de hidróxido de potasio diluída a los efectos de retener el dióxido de azufre remanente y así evitar la contaminación del laboratorio.
Los óxidos empleados fueronpreparados por el método de impregnación a partir de los nitratos de los siguientes metales: cromo (CrN3O9.9H2O, marca FLUKA), manganeso (Mn(NO3)2.4H2O, marca PANREAC), hierro (Fe(NO3)3.9H2O, marca ALDRICH) y níquel (Ni(NO3)2.6H2O, marca MERCK), de metavanadato de amonio (NH4VO3, marca ALDRICH) y de acetato de cobalto (Co(OOCCH3)2.4 H2O, marca VENTRON) .No se utilizan sulfuros en lugar de óxidos debido a su labilidad térmica.
La alúmina es de marca Puralox – Condea. Se utiliza gamma – alúmina en lugar de alfa – alúmina porque la primera tiene mayor superficie específica.
En todos los casos la masa final del metal sobre alúmina se calculó en 10 %.
Los óxidos metálicos obtenidos se caracterizaron por difracción de rayos X ( XRD ), superficie específica ( BET ), reducción a temperatura programada ( TPR ) y análisis químico ( absorción atómica ).
Todos los resultados obtenidos se sintetizan en la siguiente tabla:
|
Oxido
|
Análisis Químico
|
Difracción de Rx
|
TPR
|
BET
|
| Vanadio | 7,79 % (como V) | V2O5 | V2O5 a VO2 | 160 m2/g |
| Cromo | 7,62 % (como Cr) |
Cr2O3 |
Cr2O3 a CrO | 165 m2/g |
| Manganeso | 9,91% (como Mn) | Mn2O3 | Mn2O3 a MnO + Mn3O4 | 153 m2/g |
| Hierro | 8,49 % (como Fe) | Fe2O3 | Fe2O3 a FeO | 154 m2/g |
| Níquel | 9,87 % (como Ni) | NiO | NiO a Ni2O | 152 m2/g |
| Cobalto | 10,40 % (como Co) | Co3O4 | Co3O4 a CoO | 146 m2/g |
El estudio de la adsorción de dióxido de azufre se llevó a cabo según un plan de trabajo que incluyó:
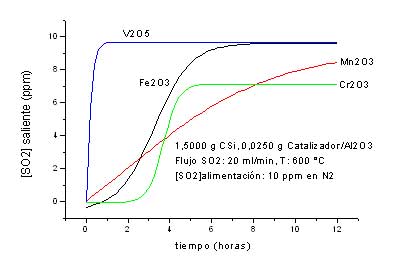
- Una primera serie de determinaciones para cada óxido soportado en alúmina, en la cual semantuvieron constantes la masa del óxido soportado ( 0,2000 g ), la masa del carburo de silicio (1,5000 g ) y el flujo de dióxido de azufre ( 200 ml/min ), y se varió la temperatura del horno entre 600 y 900 ºC.
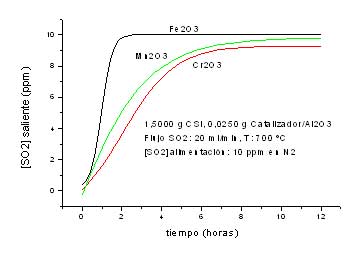
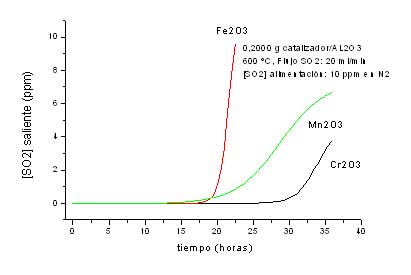
- Una segunda serie,por cada óxido soportado en alúmina, empleando 0,025 g de óxido soportado mezclados con 1,5000 g de CSi (600 – 700 ºC) o 0,2000 g de óxido soportado sin diluir en CSi (600 ºC), manteniendo en todos los casos constante el flujo de SO2 en20 ml/min.
3- Discusión de los resultados
Los resultados obtenidos en la serie uno se encuentran graficados en el anexo I. Si hacemos una comparación de los mismos podemos notar variaciones significativas respecto a su capacidad de adsorción,para cada óxido a diferentes temperaturas (Tabla I). Se observa un incremento en la cantidad del SO2 adsorbido al operar a 600 ºC, respecto atemperarturas superiores, cualquiera sea el óxido utilizado.
Tabla I: variación del SO2 adsorbidopara cada óxido a diferentes temperaturas
Los resultados obtenidos en la serie dos se encuentran graficados en el anexo II. Se observa que la cantidad de SO2 adsorbida es significativamente mayor en la medida que aumenta la masa de óxido y la influencia de la temperatura es análoga a la registrada en la primera serie, es decir es mayor a 600 ºC. Con referencia a la variación de flujo observamos que para flujos altos si bien se incrementa la masa de SO2 adsorbida la eficiencia del óxido disminuye como producto del menor tiempo de contacto (Tabla II).
Tabla II: Variaciones de SO2 adsorbido en función de masa de óxido a distintos flujos.
En el anexo III se sintetizan los resultados obtenidos en los anexos I y II con fines comparativos. Bajo las diferntes condiciones operativas se observa que la eficiencia de adsorción es en orden decreciente: Oxido de cromo, hierro, manganeso, cobalto, niquel y vanadio. También se verifica que sobre alúmina, sin agregado de los óxidos en cuestión,la adsorción es nula. En el caso del óxido de hierro a 900 ºC la adsorción es muy baja y de corta duración debido a desorción.
Si hacemos pasaraire a razón de 20 ml/min a 800 ºC sobre los óxidos soportados utilizados se logra una rápida desorción del SO2 retenido quedando un pequeño remanente que desorbe a través del tiempo lentamente.
Sobre estas muestras, luego de desorberlas, se repitieron las experiencias originales, manteniendo las mismas condiciones de flujo de SO2 y temperatura de reacción, obteniéndose resultados similares.
En base a estos resultados podemos decir que la adsorción del SO2 sobre elóxido es principalmente física.
4- Conclusiones
En función de los resultados obtenidos surge que el óxido de cromo (Cr2O3) es el que mejor se comporta como adsorbedor del SO2 en las condiciones operativas. Las condiciones operativas óptimas se establecen en 600 ºC, un flujo de 20 ml/min y una masa de óxido de ……
La justificación de los distintos comportamientos la podemos basar en la estructura de los óxidos en estudio.
Si bien en todos los casos existen en el metal orbitales d incompletos, en aquellosen los que la configuración del óxido es octaédrica (óxidos de cromo, hierro y manganeso) la gran diferencia de energía entre los distintos subniveles d hace que los electrones del metal permanezcan en su nivel más bajo dejando dos subniveles d, de mayor energía, libres. Solo en el óxido de cromo quedan libres para interactuar con el azufre los dos orbitales d de mayor energía dado que en los óxidos de hierro y manganeso se han ocupado total o parcialmente con el oxígeno del óxido. La interacción metal – azufre se verifica a través de el orbital d del metal y el s del azufre que no forma parte de su reacción con el oxigeno (electrones n).
La configuración tetraédricahace que la menor diferencia de energía entre los subniveles d permita encontrar en el metal electrones en los distintos subniveles, inferior y superior, y por lo tanto no se encuentren totalmente libres para poder interactuar. Los óxidos de niquel y de cobalto presentan una estructura cúbica. Como la disposición cúbica está formada por dos tetraedros complementarios, el patrón es el mismo que para un tetraedro pero la energía de separación es dos veces mayor. Aún así es menor que la octaédrica.
Por otro lado, la diferencia entre la energía de estabilización de campo cristalino entre las geometrías octaédrica y tetraédrica se conoce como el exceso de energía de estabilización octaédrica y el valorpara el Cr 3+ (158 Kjoule/Mol –1) es el más alto de los iones de la primera serie de transición y permite que los iones tripositivos se mantengan en sitios octaédricos dandole gran estabilidad a la estructura. Como la configuración octaédrica presenta un tercio de los huecos octaédricos sin ocupar por el metal, es en estos lugares donde con mayor facilidad se adsorbe el SO2.
El óxido de vanadio presenta una estructura octaédrica muy distorsionada, con un O distante, similar a una geometría pentacoordinada regular bpt(para la cual se establecen tres niveles de energía para los subniveles d estando dos de ellos próximos y uno bastante separado dz2).
En síntesis: el óxido de cromo presenta ventajas comparativas respecto a los otros estudiados por tener una configuración octaédrica muy estable que permite la incorporación de la sustancia a adsorber en los huecos de su estructura. Esta situación se presenta como optima cuando el flujo de gas es bajo, la masa de óxido es … y la temperatura es de 600 ºC.
   |
Por: Dr. Ignacio Daniel Coria y Lic. Silvina Medina