Técnicas de Bio-remediación: Ensayos de tratabilidad – Nivel 1
RESUMEN
Cuando se pretende aplicar una técnica de bio-remediación en suelo, los ensayos del Nivel-I comprenden la caracterización del residuo y del sitio disponible para el tratamiento. Estos ensayos permitirán decidir la potencialidad de aplicación de la técnica y los parámetros a ser controlados en etapas posteriores.
Se desarrollaron, implementaron y evaluaron ensayos microbiológicos, analíticos y toxicológicos que permitieron abordar estudios de tratabilidad de Nivel-I sobre 9 residuos industriales con hidrocarburos.
La ausencia de toxicidad en los bioensayos bacterianos y la presencia de microorganismos en los residuos determinaron que todos podrían ser tratados por métodos biológicos, justificando la realización de estudios de Nivel-II. No obstante todos los residuos presentaron algunas características de riesgo debiéndose controlar la
desaparición de las mismas durante la bio-remediación.
PALABRAS-CLAVE: Bio-Remediación, Residuos Industriales, Hidrocarburos.
INTRODUCCION
En la naturaleza, los hidrocarburos son eliminados del suelo por cualquiera de los siguientes procesos: biodegradación, emisión, percolación y drenaje superficial. En los últimos años se ha prestado mucha tención a los métodos biológicos tanto para el tratamiento de residuos industriales como para la recuperación de sitios contaminados. Estos métodos se conocen genéricamente como procesos de bioremediación y tienen como objetivo el aprovechamiento y optimización de las capacidades biodegradadoras naturales.
La bio-remediación de suelos contaminados con hidrocarburos es un proceso dinámico en el que contaminante, suelo, clima y actividad biológica interactuan para degradar, transformar e inmovilizar los constituyentes del contaminante.
No hay metodologías estandarizadas para la evaluación y seguimiento de procesos de bio-remediación de mezclas de hidrocarburos en una matriz sumamente compleja como el suelo.
En nuestra experiencia científico-tecnológica hemos aplicado los siguientes lineamientos para la implementación de un proceso de bio-remediación.

Cuando se pretende aplicar una técnica de bio-remediación en suelo, los ensayos del Nivel-I comprenden la caracterización del residuo y del sitio disponible para el tratamiento. La evaluación conjunta de los resultados
permitirán decidir la potencialidad de aplicación de la técnica junto con los parámetros que deben ser controlados en etapas posteriores de laboratorio y/o durante el proceso.
El objetivo del presente trabajo fue desarrollar,, implementar y evaluar ensayos microbiológicos,, analíticos y toxicológicos que permitan abordar estudios de tratabilidad de Nivel–I..
El mayor problema en el análisis de hidrocarburos en residuos y suelos contaminados es la presencia simultánea de cientos de compuestos diferentes, tanto alifáticos como aromáticos. Generalmente, es necesaria la pre-separación de los constituyentes en clases de estructura similar antes de su identificación. Muchos esquemas de fraccionamiento involucran una combinación de procedimientos de separación, requieren grandes volúmenes de solventes y tiempos de proceso largos que no se ajustan a la rapidez requerida para el análisis de rutina (Vecchioli y col., 1997).
Se muestra la implementación de técnicas y procedimientos gravimétricos y cromatográficos para la caracterización de mezclas complejas de hidrocarburos en distintas matrices.
La determinación de la toxicidad de una mezcla compleja de hidrocarburos se basa en el conocimiento de los procesos que llevaron a su producción y en la caracterización biológica y química de la misma (Brown y col., 1983). No existe una única especie biológica o un único ensayo que pueda indicar los efectos tóxicos de todos los compuestos químicos o mezclas, por lo tanto se recomienda utilizar una batería de bioensayos. Muchos aspectos de la toxicidad de mezclas pueden ser evaluados usando test bacterianos, debido a que su aplicación resulta práctica (ya que los microorganismos tienen un ciclo de vida corto, son estables y fáciles de mantener); y a que la actividad bacteriana es esencial en los procesos de biodegradación. En este trabajo se presenta una batería de ensayos cortos que permiten evaluar distintos aspectos de la toxicidad de residuos y ambientes contaminados.
Los distintos ensayos y determinaciones implementados se presentan aplicados al estudio de distintas mezclas complejas de hidrocarburos que generan problemas de contaminación ambiental en el país.
MATERIALES Y METODOS
Residuos Industriales:
Se trabajó con 9 residuos originados en distintos procesos de industrias petroleras y petroquímicas.
Ensayos realizados sobre los Residuos:
1. Caracterización fisico-química:
pH de una solución acuosa saturada, volátiles a 105ºC, contenido de agua por Dean-Stark y cenizas por calentamiento a 900°C (Vecchioli, 1998).
Análisis de hidrocarburos
Determinaciones cromatográficas cualitativas (Vecchioli y col., 1997).
– Extracción de residuos: una porción de la muestra se coloca en un frasco con el solvente de extracción. La extracción se efectúa por agitación manual a temperatura ambiente (10 minutos). El extracto obtenido se filtra por papel antes de realizar el análisis cromatográfico.
– Extracción de tierra: la muestra de suelo contaminado se mezcla con Na2SO4 anhidro y se extrae en Soxhlet durante 6 hs, usando n-hexano como solvente de extracción. Luego, se efectúa una concentración hasta un volumen de 5 ml. Este concentrado es analizado por cromatografía gaseosa (CG).
La identificación de los hidrocarburos presentes en las muestras se efectúa por comparación con los tiempos de retención de una mezcla estándar (44 hidrocarburos).
Determinaciones cuantitativas.
– Gravimétricas: La cuantificación de residuos y tierras contaminadas se efectúa mediante la metodología y técnicas descriptas por Dibble & Bartha (1979).– Cromatográficas (Vecchioli y col., 1997):– Extracción de residuos: la forma de extracción es la descripta en la determinación cualitativa, pero agregando estándar interno. Para poder expresar el contenido de hidrocarburos en peso seco de residuo, una porción del residuo parcialmente deshidratado se coloca en un desecador con Cl2Ca durante 12 hs.– Extracción de tierra: la muestra se procesa de la misma forma que la indicada en determinaciones cualitativas, adicionando estándar interno antes de la extracción.
Método cromatográfico: Se utiliza un cromatógrafo Perkin-Elmer autosystem con columna capilar (50 m – 0.25 mm ID) no polar (95 % metilo, 5 % fenilo) con sistema detector FID. Gas carrier nitrógeno. Programa
de temperatura:
T1= 50ºC t1= 4 min r1= 4 K/min T2= 150ºC t2= 4 min r2=10 K/min T3= 300ºC t3= 15 min Ti= 280ºC Td= 300 ºC
2. Indicio de tratabilidad por métodos biológicos:
2.1. Presencia de bacterias (Vecchioli, 1998): Se colocan 10g de residuo en un erlenmeyer de 250 ml que contiene 100ml de caldo nutritivo, se incuba a 37ºC con agitación durante 72hs. Luego se toman 10 ml de este cultivo y se repica en otro erlenmeyer con caldo nutritivo, este paso se repite nuevamente a las 72 hs. La aparición de turbidez luego de la incubación del tercer repique indica la presencia de bacterias cultivables en el residuo.
2.2. Recuento de bacterias heterótrofas viables (Vecchioli, 1998): Se pesan 10 g de muestra en un erlenmeyer de 250 ml, se agregan 90 ml de SF y se agita a 400 rpm durante 30 minutos. Se toma el sobrenadante y se realizan diluciones seriadas en SF. La superficie del medio de cultivo Plate Count Agar (PC) (Difco) se cubre con 0,1ml de dilución con ayuda de una espátula de Drigalski. Los resultados son promedio de tres determinaciones.
3. Impacto sobre los organismos del suelo (Morelli, 1999):
3.1. Toxicidad sobre la flora bacteriana del suelo: Se preparan mezclas tierra-residuo conteniendo 0; 0,05; 0,25 y 0,5 g de residuo por g de tierra. Cada concentración se prepara por triplicado. Todos los tubos se incuban durante 24hs. a temperatura ambiente. Luego de la incubación se colocan 9ml de SF en cada tubo y se realiza el recuento de bacterias heterótrofas viables. Se calcula el número de Unidades Formadoras de Colonias (ufc) en PC.
3.2. Inhibición de la germinación de semillas de L. sativa y elongación de raíces: Los residuos se dejan decantar durante 48hs. Se separa el sobrenadante y se realizan los ensayos sobre éste. Se realiza con semillas de Lactuca sativa. Se ensaya la muestra y diluciones. Las diluciones se preparan con agua bidestilada. En la tapa invertida de una placa de Petri se coloca papel de filtro Whatman Nº 3 o equivalente y se agregan 5,5 ml de la dilución correspondiente. Luego se colocan 20 semillas. Como control se utiliza agua bidestilada. Cada dilución se ensaya por duplicado. Las placas se incuban a temperatura ambiente y en la oscuridad durante 5 días. Se determina el número de semillas que germinaron. Se calcula el porcentaje de inhibición de la germinación y se grafica en función de la concentración de manera de obtener el valor de EC50 (concentración que causa una disminución o incremento del 50% en el efecto medido). Se mide el largo de cada raíz, se calcula la media de la elongación de la raíz para cada dilución, de ser posible se calcula gráficamente el valor de EC50, de lo contrario los resultados son analizados por ANOVA de manera de obtener el valor NOEC (concentración a la cual no se observa efecto adverso).
4. Caracterización toxicológica (Morelli y col.,,1995):
4.1. Inhibición del crecimiento de B..cereus:: La resazurina es un indicador de óxido-reducción que reacciona cuantitativamente con las deshidrogenasas y puede ser usada para determinar la toxicidad de una variedad de compuestos químicos. La disminución en la reducción de la resazurina indica el grado de inhibición de la actividad deshidrogenasa.
Se realizan tres repiques sucesivos de B. cereus en el medio líquido descripto por Liu y col. (1989) (MLL). Cada repique se incuba a temperatura ambiente, con agitación durante 16hs. Con el último repique se siembra la superficie de cajas de Petri conteniendo el medio sólido descripto por Liu y col. (1989) (MSL). La muestra ensayada se disuelve en DMSO-glicerol (80:20) y se realizan diluciones. Se colocan alícuotas de 10µl en cilindros de acero inoxidable dispuestos en la superficie sembrada. Cada dilución se ensaya por triplicado. Como control positivo se utiliza una solución de ClHg2 de 2 µg/10 µl y como control negativo DMSO-glicerol (80: 20). Luego de 12 a 24 hs de incubación se mide el diámetro de la zona de inhibición y se grafica el log de la concentración en función del diámetro de la zona de inhibición, se obtiene gráficamente el valor EC50.
4.2. Inhibición de la actividad deshidrogenasa en B.. cereus:: Se realizan tres repiques sucesivos de B. cereus en MLL. Cada repique se incuba a temperatura ambiente, con agitación durante 16hs. En tubos con tapa a rosca de 25ml de capacidad se mezclan 5ml de MLL, 150 µl de DMSO, 100 µl de la muestra o diluciones de la misma en DMSO, 1ml del cultivo de Bacillus cereus y 1ml de la solución de resazurina. Cada dilución se ensaya por triplicado. Para determinar el 100% de inhibición se utiliza un sistema sin B. cereus (A) y para el 0% de inhibición se utiliza un sistema con 250 µl de DMSO (B). Se incuban a temperatura ambiente (21ºC) durante 30 minutos. La reacción se detiene con el agregado de 10 ml de alcohol amílico y 1ml de una solución de biftalato de potasio de pH 3, se agita vigorosamente. Se centrifuga a 5000 rpm durante 5 minutos. La fase alcohólica se transfiere a un tubo que contiene 2,5 g de bicarbonato de sodio, se agita y luego se mide la DO610 de la fase amílica.
El porcentaje de inhibición de la reducción de la resazurina se calcula con la siguiente fórmula.
![]()
Se grafica el log del porcentaje de inhibición de la reducción de la resazurina en función del log de la concentración de mezcla y se calcula el valor de EC50.
4.3. Test de Ames: Se colocan 2 ml de la muestra a ensayar en una ampolla de decantación, se agregan 3 ml de ciclohexano. Luego de mezclar y homogeneizar se agregan 10 ml de DMSO. Se agita manualmente cada 5 minutos durante 30 minutos. Se extrae la fase DMSO y se guarda en la heladera al abrigo de la luz hasta el momento del ensayo. Se utiliza un cultivo de la cepa TA98 en caldo Difco suplementado con 0,5% de ClNa de 16 hs de Incubación a 37ºC con agitación. En un tubo estéril, que se mantiene en baño de hielo, se ponen en contacto 0,1 ml del cultivo con 0,5 ml de buffer pH 7,4 (mutagenicidad directa) o con 0,5 ml de S9 mix (mutagenicidad indirecta) y de 10 a 200 µl de la muestra o diluciones de la misma. Luego la mezcla se mantiene 20 minutos a 37ºC, con agitación (preincubación). Terminada la preincubación se le agrega 2 ml de Top Agar (0,5% de ClNa, 0,6% de Agar y trazas de histidina) y se vuelca en cajas de Petri que contienen el medio mínimo. Se incuba a 37ºC durante 72hs y se cuenta el número de colonias que aparecen (revertantes). La sustancia se considera mutagénica cuando existe una relación lineal entre concentración de la sustancia ensayada y el número de revertantes por placa y por lo menos en alguna concentración se dobla el número de revertantes espontáneos.
RESULTADOS
1– Caracterización fisico-química::
Se evidenciaron amplias diferencias entre los residuos estudiados. Residuos provenientes de industrias petroquímicas:
API-1 y API-2: son barros residuales del sistema de tratamiento primario de efluentes (separador aceiteagua API). Son semisólidos, de color marrón oscuro y de olor penetrante. Si se los deja decantar se separa una fase acuosa.
Ambos residuos fueron almacenados en playas de barros, el residuo API-1 tiene de 10 a 25 años de antigüedad, en cambio el residuo API-2 esta constituido por los barros producidos durante los últimos 10 años.
Los hidrocarburos aromáticos polinucleares son los constituyentes mayoritarios de estos residuos. Además los residuos contienen otros hidrocarburos peligrosos como tolueno, etilbenceno y xilenos.
A modo de ejemplo se muestran los resultados obtenidos con el residuo API-2, Tablas 1 y 2.
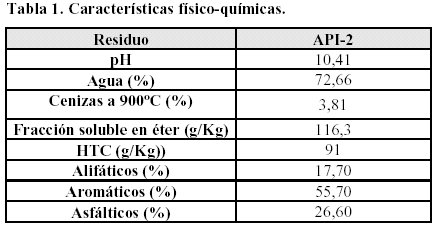
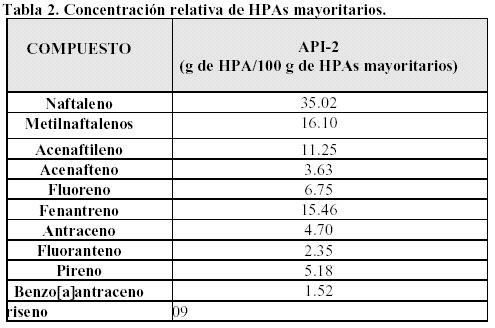
Los resultados cromatográficos (HTC) son coincidentes con los 93 g/Kg obtenidos usando métodos termoanalíticos en combinación con extracción convencional y fluída supercrítica (Vecchioli y col., 1997). Los valores obtenidos por la técnica gravimétrica, 116 g/Kg, también son similares si se tiene en cuenta que estos valores incluyen la fracción asfáltica no detectable por CG.
API-2N: es un barro residual del sistema de tratamiento primario de efluentes (separador API). Tiene el mismo origen que los residuos API-1 y API-2 pero no ha sufrido almacenamiento previo. Es un residuo con más cantidad de agua (92,54%) y un menor porcentaje de extractable en éter (1,48%) que los residuos API-1 y API-2.
Q: es un barro formado por el conjunto de compuestos residuales originados en una torre de enfriamiento. Normalmente es incorporado al sistema de tratamiento de efluentes, por lo que sólo se obtuvo una muestra pequeña.
Es un residuo neutro (pH=7,15). De todos los residuos estudiados es el que contiene mayor concentración
de extractables en éter (25,27%), con un 83,31% de hidrocarburos aromáticos.
P-5 y P-6: son barros provenientes de tratamientos de recuperación de hidrocarburos y de clarificación de efluentes provenientes de piletas API. Son barros de color negro y olor penetrante. A diferencia de los otros residuos, en ellos no es posible separa una fase acuosa por decantación.
Son residuos de pH ácido (5,7) y con un bajo porcentaje de extractables en éter (P-5: 1,935% y P-6: 0,79%). Tienen gran proporción de hidrocarburos volátiles. Los constituyentes cromatografíables mayoritarios de los residuos son: tolueno, o-xileno, m/p-xileno, etilbenceno, n-C10.
Residuos provenientes de industrias petroleras:
RBT: es un barro que proviene del sistema de tratamiento biológico de una refinería de petróleo. Es un residuo semisólido, de color marrón oscuro, con un olor muy característico y penetrante. Por decantación es posible separar una fase acuosa. El barro no fue almacenado previamente a la toma de muestra. Es un residuo neutro (pH=7,00) y tiene 3,36 % de extractables en éter.
ECO: proviene del proceso de extracción de crudo, almacenado durante años en piletas. Tiene un porcentaje de extractables en éter de 18,75%. Como característica principal tiene un Ph francamente alcalino (11,5). Es un residuo sólido, con baja concentración de agua, del que no puede separarse una fase acuosa.
TRCC: tierra del recinto de tanques de almacenamiento de crudo. Tierra contaminada de aspecto heterogéneo y muy difícil de manipular. Se secó a temperatura ambiente hasta poder tamizarla (4mm) para obtener un material homogéneo. Tiene una concentración de hidrocarburos totales cromatografiables del 2%.
2. Indicio de tratabilidad por métodos biológicos:
2.1 Todos los residuos producen turbidez en caldo nutritivo luego de tres repiques sucesivos.
2.2 La mayoría de los residuos contiene un número significativo de bacterias (> 1000 ufc/g) capaces de mantenerse viables en los residuos.
Los recuentos de los residuos se muestran en la Tabla 3.
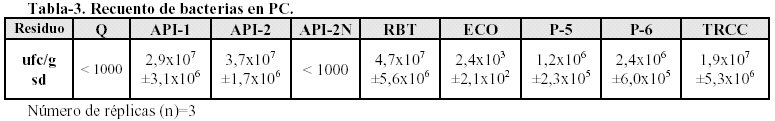
El residuo RBT tiene el recuento de bacterias mayor, este resultado coincide con su origen, ya que proviene de una planta de tratamiento biológico.
3. Impacto sobre los organismos del suelo:
3.1 En todos los residuos se comprueba la ausencia de efectos tóxicos sobre la población heterótrofa mayoritaria del suelo.
La incorporación de cualquiera de los residuos en tierra nunca causó una disminución importante en el número de bacterias heterótrofas viables, ni siquiera cuando se incorporaron en un 50 %(p/p) como se muestra en la figura-1.
El gran incremento en el número de bacterias heterótrofas viables, detectado en el suelo luego de la incorporación de RBT, puede en parte ser atribuido a la alta concentración de bacterias que posee el residuo.
Esto explicaría el hecho de que el aumento en los recuentos guarda relación directa con la concentración de residuo incorporado.
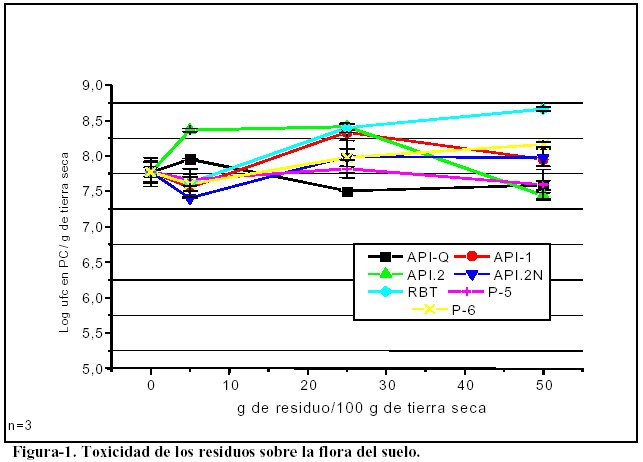
No se realizó el ensayo sobre los residuos ECO y TRCC por tratarse de tierra contaminadas.
3.2 En todos los residuos se comprueba el efecto inhibitorio sobre la germinación y elongación de raíces de L. sativa.
Los residuos API-1, API-2, API-2N y RBT se dejaron decantar durante 48 h y se realizó el ensayo usando la fase acuosa de los mismos.
En los residuos P-5 y P-6 no se separaba fase acuosa. Al residuo P-5 se le agregó 10 ml de agua bidestilada cada 10 g de residuo y luego de ser agitados durante 3 hs se dejó decantar y se separó la fase acuosa. Al residuo P-6 fue necesario agregar el doble de agua destilada cada 10 g de residuo. En el caso del residuo ECO y TRCC se utilizó un extracto acuoso obtenido luego de agitar 40 g de tierra con 40 ml de agua bidestilada durante una hora.
Los resultados de la inhibición de la germinación se muestran en la figura-2.
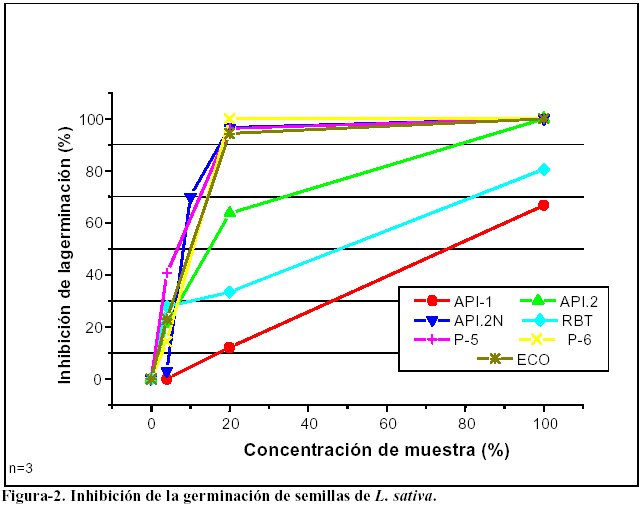
En la figura se puede observar que:
-
Las fases acuosas de los residuos API-2, API-2N y los extractos acuosos P-5, P-6 y ECO inhiben totalmente la germinación de las semillas cuando se ensayan puros.
-
La fase acuosa del residuo API-1 fue la que mostró menor efecto inhibitorio sobre la germinación de las semillas.
-
Las curvas de inhibición de la germinación de las fases acuosas de los residuos API-1, API-2 y RBT uestran una correlación lineal con la concentración (R entre 0,99939 y 0,89933). Esto también se umple con los otros residuos, pero sólo a bajas concentraciones (R entre 0,99901 y 0,97017), ya que alcanzan el 100% de inhibición a partir de una concentración del 20% de FA. La Tabla 4 muestra los valores de EC50 calculados usando las rectas de regresión obtenidas.
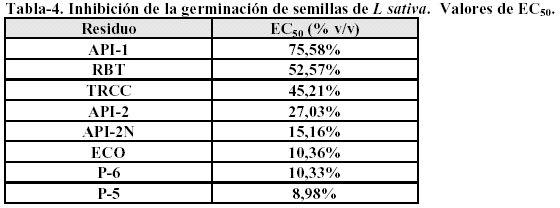
Como se puede observar los residuos P-5, P-6, ECO y API-2N son los que muestran un mayor efecto inhibitorio sobre la germinación de las semillas.
Los resultados del ensayo de inhibición de la elongación de la raíz se muestran en la Tabla 5.
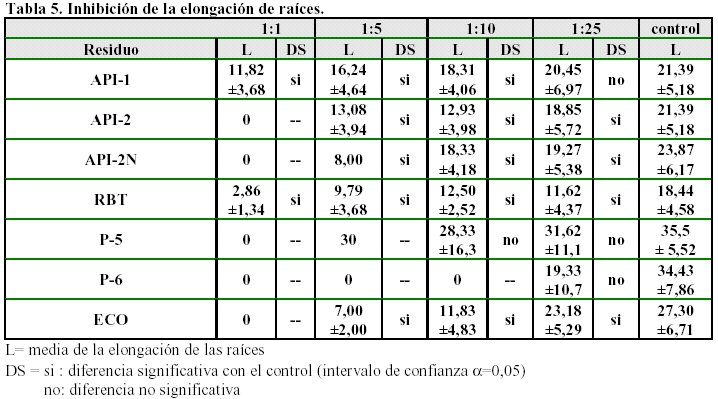
-
Los residuos API-2, API-2N, RBT y ECO inhiben la elongación de la raíz en todas las diluciones ensayadas.
-
Los residuos P-5 y P-6 si bien muestran un gran efecto inhibitorio sobre la germinación de las semillas, cuando se ensayan concentraciones bajas no se observan efectos sobre la elongación de las raíces.
4. Ensayos toxicológicos:
4.1 En todos los residuos se comprueba la ausencia de toxicidad sobre el crecimiento de B. cereus.
Cuando se ensayaron los residuos (puros y diluciones 1:2, 1:5, 1:10, 1:25 y 1:100), en ningún caso se obtuvo halo de inhibición del crecimiento.
Los controles positivos (HgCl2 y fenol) mostraron los halos de inhibición esperados. No se obtuvo halo de inhibición con el control negativo.
4.2 En todos los residuos se comprueba la ausencia de inhibición de la actividad de deshidrogenasa en B. cereus.
Cuando se ensayaron los residuos se obtuvieron los siguientes resultados:
-
Los residuos P-5 y P-6 inhiben la reducción de la resazurina a las concentraciones más bajas ensayadas y luego al aumentar la concentración disminuye el efecto inhibitorio.
-
Los residuos API-2N y RBT estimularon la reducción de la resazurina, pero presentan un pico de inhibición cuando la concentración alcanza los 150 mg/l en el caso del residuo RBT y 500 mg/l para el API-2N, luego comienza nuevamente un efecto de estimulación.
-
La incorporación de distintas concentraciones de los residuos Q, API-1 y API-2 mostraron valores de estimulación de la reducción de la resazurina mayores al 100% e independientes de la concentración.
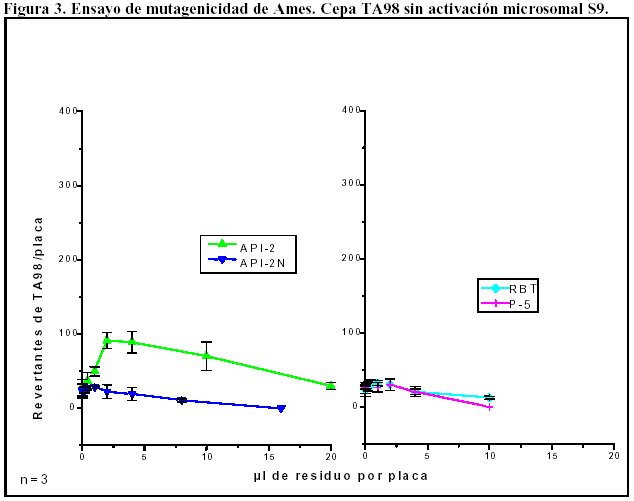
En residuos mayoritariamente alifáticos se determinó la ausencia de efecto genotóxico.
En residuos mayoritariamente aromáticos se determinó genotoxicidad indirecta.
La figura 3 muestra los resultados obtenidos con estos residuos en ausencia de activación microsomal.
En estas gráficas podemos observar que:
-
El único residuo que mostró mutagenicidad directa (en ausencia de S9) es el API-2, ya que duplica por lo menos en alguna concentración el número de revertantes espontáneos.
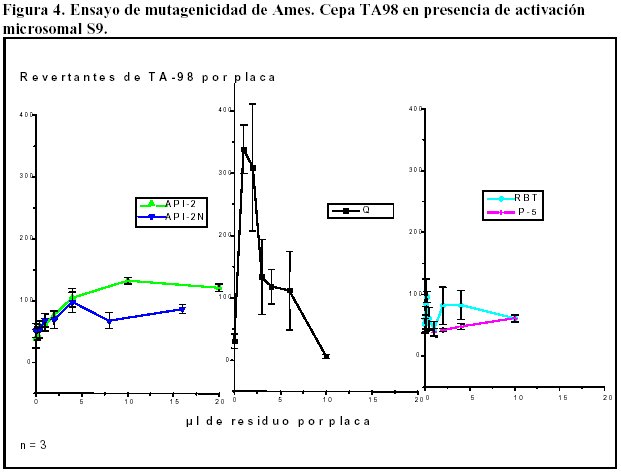
La figura 4 muestra los resultados obtenidos en presencia de activación microsomal.
-
El residuo Q fue el que mostró mayor efecto mutagénico sobre esta cepa, en presencia de activación microsomal.
-
Los residuos API-2 y API-2N tienen un comportamiento muy semejante a concentraciones bajas, pero al aumentar la concentración el residuo API-2 se evidencia el efecto mutagénico, en cambio el residuo API- 2N evidencia un mayor efecto tóxico sobre la cepa.
-
Los residuos RBT y P-5 no muestran evidencias de mutagenicidad a las concentraciones ensayadas.
CONCLUSIONES
El exhaustivo análisis realizado permitió obtener un conocimiento integral de los residuos, hecho fundamental para poder seleccionar un método de tratamiento adecuado.
La ausencia de toxicidad en los bioensayos que utilizan bacterias y la presencia de microorganismos en los residuos determinaron que todos podrían ser tratados por métodos biológicos, justificando la realización de estudios de Nivel- II.
Los ensayos realizados permitieron demostrar que todos los residuos analizados presentan por lo menos alguna característica de riesgo (toxicidad sobre semillas, genotoxicidad, presencia de sustancias peligrosas).
Se debería establecer un plan de monitoreo riguroso para asegurar la desaparición de estas características.
Irma Susana Morelli(1) Dra en Bioquímica
María T. Del Paño Lic. en Ciencias Bioquímicas.
Oscar R. Costanza Bioquímico.
Graciela I. Vecchioli Dra en Ciencias Bioquímicas.
María T. Painceira Dra en Ciencias Bioquímicas.