Determinación de metales pesados en agua residualen proceso de Galvanoplastia
Resumen.
Los residuos industriales líquidos (RIL), constituyen, junto con los contaminantes atmosféricos, el mayor problema en el manejo de las emisiones industriales.
Los residuos que contaminan el agua provienen de la actividad industrial, son dañinos y tóxicos en general, para controlar la calidad de estas aguas residuales, se establece una metodología, aplicable de uso normal y rutinario, reproducible y útil para el análisis cuantitativo de elementos pesados10, Cromo, Plomo, Níquel y Zinc.
Introducción.
En las industrias de transformación el uso del agua tiene funciones diversas en las diferentes etapas del proceso. Casi todo proceso industrial requiere hacer uso del agua en una u otra operación. Así, en cada proceso, las sustancias contenidas en el agua, ya estén presentes naturalmente o se hayan agregado, pueden causar perturbaciones fisicoquímicas. En el proceso de galvanoplastia, para recubrir una superficie es costumbre limpiarla con soluciones acuosas, primero de un álcali y luego de un ácido. Después se hace el depósito electrolítico del metal mediante otra solución acuosa; luego ya formada la cubierta metálica, se lava bien con agua para eliminar toda la solución de galvanoplastia; los principales componentes de este desecho industrial son ácidos, álcalis, metales pesados, cianuros y sólidos1. En los desechos generados por la industria de la galvanoplastia, el 20 % son sólidos yel 80 % agua 2.
Debido a que la matriz de la muestra es desconocida e irregular en cuanto a composición, existe incertidumbre en la determinación de metales pesados en una matriz ambiental utilizando materiales de referencia certificados.
El propósito de este trabajo es determinar si una matriz ambiental de agua residual de proceso de galvanoplastia causa interferencia en la cuantificación de metales pesados por espectroscopia de emisión atómica en Plasma Acoplado Inductivamente (PAI).
La selección de un método adecuado ayuda a garantizar que el análisis será exacto3. Sin embargo no garantizaque su resultado bastará para resolver el problema que se investiga o que la respuesta propuesta sea la correcta. Estos aspectos se solucionan con una obtención cuidadosa de las muestras a analizar.
Metales pesados.
Fuentes de metales pesados y su toxicología.
Los metales pesados normalmente aparecen en el agua superficial procedentes de las actividades comerciales e industriales y tienen que eliminarse si el agua residual se va a reutilizar.
Metales pesados son elementos metálicos con gran peso atómico, por ejemplo: mercurio, cromo, cadmio, arsénico, plomo, cobre, zinc y níquel. A bajas concentraciones pueden afectar a los seres vivos y tienden acumularse en la cadena alimentaria.
Los metales pesados son elementos que tienen pesos atómicos entre63.546 y 299.590 con una gravedad específica mayor a 4.011.
La mayoría de los elementos de la tierra están ampliamente distribuidos en la litósfera, la hidrósfera y la atmósfera. El hombre está expuesto a estos elementos cuando come sus alimentos, bebe agua y respira el aire. Algunos de esoselementos son benéficos y esenciales para sus procesos vitales, aunque solo se encuentran en cantidades muy pequeñas en los tejidos del cuerpo en cantidades trazas como cobalto, cobre, hierro, manganeso, molibdeno, vanadio, estroncio y zinc; otros son muy tóxicos. Los metales pesados no esenciales de interés particular para los sistemas acuíferos superficiales son cadmio, cromo, mercurio, plomo arsénico y antimonio etc.
Todos los metales pesados existen en las aguas superficiales en forma coloidal, de partículas y en fases disueltas, pero, las concentraciones en disolución son bajas generalmente. El metal en partículas y coloidal puede encontraseen 1) hidróxidos, óxidos, silicatos o sulfuros, o 2) adsorbidos en la arcilla, en el síliceo en la materia orgánica. Las formas solubles generalmente son iones, quelatos o complejos organometálicos no ionizables. La solubilidad de trazas de metales en las aguas superficiales esta controlado predominantemente por elpH, por el tipo de concentración de los ligandos en los cuales el metal puede absorberse, y por el estado de oxidación de los componentes minerales el ambiente rédox del sistema.
Todos los metales tienen niveles óptimos de concentración, por encima de los cuales resultan tóxicos. La toxicidad de un metal depende de su vía de administración y del compuesto químico al que esta ligado. La combinación de un metal con un compuesto orgánico puede aumentar o disminuir sus efectos tóxicos sobre las células. En cambio, la combinación de un metal con el azufre, en forma de sulfuro, da lugar a un compuesto menos tóxico que el hidróxido u óxido correspondiente, debido a que el sulfuro es menos soluble en los humores corporales que el óxido.
La toxicidad suele resultar:
- Cuando el organismo se ve sometido a una concentración excesiva del metal durante un periodo prolongado.
- Cuando el metal se presenta en una forma bioquímica.
- Cuando el organismo lo absorbe por vía inusitada.
Ha ido aumentando la exposición del hombre a contaminantes metálicos introducidos en su medio ambiente por la producción industrial.
El problema esencial que plantean los metales pesados es el de que muchos de ellos se han utilizado durante siglos y son fundamentales para industria importantes, pero pueden perjudicar la salud humana y transformar el equilíbrio de los sistemas ambientales si se permite que alcancen concentraciones excesivas en el agua, suelo y aire.
Existen tres tipos principales de fuentes de emisión de metales en el medio ambiente. El más evidente es el proceso de extracción y purificación:minería, fundición y refinación. El segundo, menos conocido, es la emisión de metales al quemarse combustibles fósiles como: el carbón. Tales combustibles contienen cadmio, plomo, mercurio, níquel, vanadio, cromo y cobre. La tercera fuente, la más diversa, es la producción y utilización de productos industrialesque contienen metales, que aumenta al descubrirse nuevas tecnología y aplicaciones.
Los metales siguen muchas vías y ciclos en el medio ambiente, y algunos de ellos experimentan transformaciones. Algunas plantas y animales invertebrados acumulan metales hasta niveles potencialmente tóxicos. Cuando se formulan juicios sobre la inocuidad de una determinada descarga con contenido metálico en el medio ambiente, es preciso considerar la posibilidadde que se produzca tal acumulación y transformación
Plomo.
El plomo (Pb) que es un metal pesado como el mercurio, constituye un elemento tóxico que se acumula en el cuerpo conforme se inhala del aire o se ingiere con los alimentos y el agua. El plomo se ha empleado durante muchos siglos para fabricar tuberías de agua y utensilios de cocina. En realidad, el plomo es un elemento bastante raro en la litosfera. El porcentaje de plomo en la corteza terrestre es de alrededor de 0.00002 %13. Sin embargo, los depósitos de mineral de plomo presentes en la galena, PbS, se utilizan como fuentes para obtener este elemento. El plomo tiene un bajo punto de fusión y es un metal bastante suave. Esta maleabilidad permite que se vacíe y se le dé forma con suma facilidad. Se puede mezclar con otros metales para formar aleaciones útiles. Este metal se usa en una gran variedad de productos incluyendo baterías de almacenamiento, compuestos químicos antidetonantes para la gasolina, pigmentos, pinturasy vidriados cerámicos, La mayor parte de este metal se emplea en baterías y en gran parte se recupera, de tal manera que el plomo se puede reutilizar. La amenaza ambiental proviene de la que se usa en los compuesto químico14.
La dosis mortal de plomo absorbido se calcula en 0.5. La acumulación y toxicidadaparecen si se absorben más de 0.5 mg por día. La vida media del plomo en los huesoses de 32 años y en el riñón de 7 años. El límite de exposición para el plomo en la atmósfera es de 0.15 mg/m3. El límite de exposición del plomo en la comida es de 2.56 mg/Kg12.
Desde 1972, a 3350000 niños de 1 a 5 años de edad, se les ha determinado las concentraciones sanguíneas de plomo. De estos, 6.6 % tienen una concentración sanguínea de plomo en el rango tóxico. La causa principal era la exposición a pinturas a partir de plomo y pigmentos. Las principales manifestaciones de la intoxicación con plomo son trastornos gastrointestinales y anemia12.
Envenenamiento agudo (por ingestión de compuestos de plomo solubles o rápidamente absorbidos): sabor metálico, dolor abdominal, vomito, diarrea, evacuaciones, colapso y coma12.
Envenenamiento crónico (por inhalación de partículas que contienen plomo, ingestión o absorción cutánea): el diagnóstico debe ser considerado y se presentan síntomas tempranos, más avanzados y/o intensos, con manifestaciones desde la pérdida de peso, vómitos, falta de coordinación, parálisis de nervios craneales, convulsiones y coma. El riesgo de encefalopatía es mayor con valores sanguíneos de plomo superiores a 80 g/100ml; un valor de 100 g/100ml deberá considerarse como una emergencia, y un valor de 200 a 250 g/100ml puede causar hasta la muerte. El envenenamiento debido al plomo constituye una posibilidad si la concentración de este en la sangre es de 0.8 partes por millón en los adultos o 0.4 partes por millón en los niños12.
Puesto que el plomo es un veneno acumulativo, es importante investigar continuamente las cantidades de este metal que entran al medio ambiente, que constituye una amenaza para la salud humana14.
Cromo
El cromo (Cr) es usado en síntesis en la industria del acero, en galvanoplastia, en el curtido del cuero y como anticorrosivo en radiadores12.
La evaluación nutricional del cromo se dificulta por el hecho de que no todo se encuentra presenteen los alimentos, en una forma biológicamente activa. La bioasimilación del cromo inorgánico en ellos es muy baja. El cromo trivalente es la forma útil nutricionalmente, mientras que el exavalenteno lo es. Por ello, el contenido total de cromo en los alimentos constituye un indicador válido de la contribución que los mismos hacen a los requerimientos nutricionales del hombre. De igual forma, su contenido en los tejidos del organismo es impreciso por lo inadecuado de los métodos analíticos. Es generalmente aceptado, no obstante, que las concentraciones son muy bajas13.
La ingestión estimada como adecuada es de 50-200 microg/día. Su toxicidad esta en correspondencia con sus valencias; al cromo en forma trivalente no se le atribuye efectos tóxicos,mientras que es reconocida la toxicidad de la forma hexavalente, la que es causa de irritación y corrosión13.
Se han reportado niveles de cromo en agua que oscilan entre 0.45 y 112 microg/L como valor medio, por lo que su contribución puede ser desde insignificante hasta de 224 microg/dia. Se estima una contribución diaria probable de 17 microg de cromo, o sea, un 22 % de los requerimientos. En ocasiones, cuando el agua contiene 50 microg de cromo por litro, el aporte puede ser superior al brindado por los alimentos. En todos los casos es necesario, siempre que se detecte su presencia en el agua, identificar si se trata de la forma nutricionalmente útil o de cromo hexavalente13.
La dosis letal de un cromo soluble, como el cromato de potasio, el bicromato de potasio o del ácido crómico, es de aproximadamente 5 g. La toxicidad de los compuestos de cromo depende de la valencia del metal. El límite de exposición al polvo metálico y a las sales de cromo de valencia 2 o 3 es de 0.5 mg/m3. Los compuestos más solubles e insolubles de valencia 6 tienen un límite de exposición de 0.05mg/m3, e incluyen el ácido crómico, cromatos, bicromatos, cromato de cinc, cromato de plomo y cromito mineral12.
El cromo y los cromatos son irritantes y destructores para todas las células del organismo. En las muertes por envenenamiento agudo, se encuentra nefritis hemorrágica12.
La manifestación principal del envenenamiento con cromo es la irritación o corrosión.
Envenenamiento agudo (por ingestión): vértigo, sed intensa, dolor abdominal, vómito. La muerte es por uremia12.
Envenenamiento crónico (por inhalación o contacto cutáneo): El contacto cutáneo repetido produce dermatítis que cicatriza con lentitud. La inhalación de vapores de cromo por largos periodos causa ulceración indolora, hemorragia y perforación del tabique nasal. También se han observado conjuntivitis, lagrimo y hepatitis aguda12.
La frecuencia del cáncer pulmonar se halla incrementada hasta 15 veces más que lo normal, en trabajadores expuestos al polvo de cromita, óxido crómico y minerales de cromo. Todos los compuestos en los cuales el cromo tenga valencia de 6 son considerados como carcinógenos12.
El límite de exposición se debe observar constantemente. Los polvos y vapores crómicos deben ser controlados. Las soluciones de cromatos no deben tener contacto con la piel12.
Zinc
El zinc (Zn) es un metal que tiene muchos usos en la industria. Puede encontrarse en forma pura o mezclado con otros metales para formar aleaciones como bronce. También puede encontrarse combinado con otras sustancias químicas, como el cloro (cloruro de zinc).
Los compuestos de zinc se encuentran en forma natural en el aire, el suelo y el agua, y están presentes en todas las comidas. El zinc es un elemento esencial en la comida que necesita el cuerpo en dosis bajas. El no consumir suficiente zinc en la dieta puede provocar una salud pobre y una respuesta inmune baja. El zinc también puede ser dañino si se ingiere mucho11.
La exposición a cantidades pequeñas de compuestos de zinc sucede en forma natural cada día cuando comemos alimentos que los contienen. El zinc también se encuentra como mineral natural en muchas aguas para beber. La exposición a niveles altos de zinc puede ocurrir del agua para beber o de otros líquidos que se almacenan en recipientes de metal galvanizados, flujo a través de tuberías galvanizadas, o que están contaminadas por desechos de zinc provenientes de fuentes industriales o sitios de desechos tóxicos. También pueden ocurrir exposiciones a niveles altos de zinc por la toma de mucho zinc en los suplementos alimenticios.
El zinc entra al cuerpo a través del tracto digestivo cuando una persona come alimento o bebe agua conteniéndolo. También puede entrar a los pulmones cuando se inhala el polvo de zinc o humos de los fundidores de zinc o de las operaciones de soldado en las áreas de trabajo. La cantidad de zinc que pasa directamente a través de la piel es relativamente pequeña. La ruta más importante de exposición cerca de los sitios de desechos parece ser a través del agua contaminada con zinc. Normalmente, el zinc abandona el cuerpo mediante la orina y en las heces.
La importancia del zinc en la nutrición humana fue reconsiderada a partir de 1962, cuando se observaron deficiencias nutricionalas atribuidas al mismo.
El zinc esta muy difundido en los alimentos comúnmente consumidos, en especial en los de origen animal, particularmente de procedencia marina. La recomendación dietética admisible (RDA) del zinc es de 15 mg/día. En estudios realizados por la EPA se han encontrado niveles de zinc en agua que oscilan entre 100 y 245 microg/L13.
Los mecanismos de absorción de este nutriente son insuficientemente conocidos, pero aparentemente pueden ser regulados. El zinc posee una baja toxicidad oral; los mayores efectos tóxicos se asocian con una insuficiente ingestión de cobre. Se ha reportado que el zinc disminuye la toxicidad del cadmio, y que en presencia del calcio la bioasimilación del zinc13.
Si asumimos una concentración media de 200 microg/L en el agua de bebida, por esa vía se aportaría 0.4 mg, o sea, aproximadamente el 3 % de los requerimientos diarios, lo que representa un aporte mínimo. No obstante, cuando existe una deficiente ingestión en la dieta, este potencial no debe ser ignorado. En aguas con concentraciones máximas, el aporte a la nutrición mineral puede llegar alcanzar hasta un 20 %de los requerimientos13.
Los niveles de zinc que producen efectos a la salud son generalmente mucho mayores que los recomendados para una dieta normal, para el zinc es de 15 mg/día (para hombres) y 12 mg/día (para mujeres). Si se ingieren dosis grandes de zinc (de 10 a 15 veces mayor a lo recomendado), aun por corto tiempo, pueden ocurrir problemas estomacales y digestivos. Demasiado zinc puede también interferir con el sistema inmune del cuerpo y con la habilidad del cuerpo para asimilar y usar otros minerales esenciales como el cobre y el hierro. Cuando se inhalan grandes cantidades de zinc (como polvo de zinc o humos de fundición o soldado), puede ocurrir una enfermedad o síndrome específico a corto plazo llamado fiebre de humo del metal. Se conoce muy poco acerca de los efectosa largo plazo de respirar polvos o humos. Se desconoce si el zinc puede o no causar cáncer o defectos de nacimiento11.
Níquel
El níquel (Ni) es un elemento metálico de color blanco plateadoperteneciente al grupo VIII b de la Tabla Periódica, resistente a los álcalis, pero, que generalmente se disuelve en ácidos oxidantesdiluidos. La solubilidad de los compuestos de níquel en agua, que es un importante factor en todas las rutas de absorción, es variable, así los cloruros, sulfatos y nitratos de níquel son solubles en agua, mientras que los carbonatos, sulfuros y óxidos de níquel no lo son. El carbonilo de níquel, que es el compuesto más rápido y extensamente absorbido por las membranas biológicas es un líquido volátil que se descompone a 50 °C. En los sistemas biológicos el níquel disuelto, puede formar complejos y ligarse a la materia orgánica. Este elemento y sus diferentescompuestos, se encuentran ampliamente distribuidos en el ambiente, incluyendo plantas y animales usados para el consumo humano13.
Diversos efectos tóxicos han sido relacionados con la exposicióna níquel o sus compuestos. Estos pueden ser de tipo agudo o crónico, relacionados con el tipo de compuestos y las características de la exposición.
El contacto dérmico puede dar lugara dermatitisen los sitios de piel descubierta y la inhalación ocasiona irritación del tracto respiratorio y asma. Aunque algunas,y quizás todas las formas de níquel pueden ser carcinógenas, con los niveles normales de exposición en muchos sectores de la industria de este metal hay un riesgo pequeño o no detectable, entre ellos se encuentranalgunos procesos que en el pasado estaban asociadoscon un riesgo elevado de cáncer pulmonar y nasal. Se ha reportado que exposiciones prolongadas a níquel solublea concentraciones del orden de 1 mg/m3 puede causar marcado incremento en el riesgo relativo de cáncer pulmonar, pero el riesgo relativo en trabajadores expuestosa niveles medios de níquel metálico de cerca de 0.5 mg/m3 es de aproximadamente 1.013.
El riesgo de cáncer, para un nivel de exposición dado, parece ser superior para los compuestos de níquel metálico y posiblemente para otras formas.
El níquel es un elemento que se encuentra por doquier, los suelos típicos contienen entre 10 y 100 mg de níquel por Kg. Muchas sales de níquel son solubles en el agua, por lo que puede dar origen a la contaminación de este recurso; ha habido problemas importantes relacionados con la descarga industrial de efluentes que contienen compuestos de níquel, en cursos de agua. Se tienen informes de niveles de níquel que han alcanzado hasta 1 mg/L en aguas superficiales.
El tratamiento convencional del agua remueve algo de níquel, de manera que los niveles de agua tratada son generalmente más bajos que los de agua sometida a tratamiento. En algunos estudios globales se han podido identificar los niveles de níquel, especialmente cuando las instalaciones interiores se emplean piezas niqueladas. En muy raras ocasiones se hallaron niveles en el agua potable que llegaron a los 0.5 mg/L. Si se supone que el consumo de agua es de 2 litros al día, la exposición humana al níquel por esta vía no excedería de ordinario de 10-20 microg/día13.
El níquel es un elemento relativamente tóxico, pero el nivel que suelen hallarse en los alimentos y el agua no se consideran como una amenaza seria para la salud. Sin embargo, en estudios preliminares realizados con animales, se ha comprobado que las dosis elevadas (1600 mg/Kg en la dieta) producían efectos tóxicos mínimos (disminuyo él número de crías de ratones destetados). Dichos efectos no pudieron ser verificados en otros estudios posteriores efectuados sobre la reproducción de tres generaciones, durante las cuales las ratas y ratones bebieron agua potable que contenía 5 mg de níquel por litro durante todo su ciclo vital, sin que se presentaran efectos adversos13.
Seha comprobado que ciertos compuestos de níquel son carcinógenos, en experimentos con animales. No obstante, normalmente no se considera que los compuestos solubles de níquel sean carcinógenosni para las personas ni para los animales. Al igual que ocurre con otros cationes bivalentes, el níquel puede reaccionar con el DNA, y cuando las concentraciones son altas, puede producirse daño que afecte a este. Como quedo demostrado en pruebas de mutagenicidad realizadas en vitro13.
En 1987-1988, en la región de Moa, extremo oriental de Cuba, se estudiaron las concentraciones de níquel en el agua de cinco fuentes de abasto para consumo de la población. Las medianas de las concentraciones detectadas fueron de 0.017-0.045 mg/L. La norma vigente en el país establece una CMA = 0.02 mg/L, por lo que los niveles, en general, fueron altos13.
Tabla 4.1Contaminantes inorgánicos comunes que causan enfermedades.
|
Contaminante inorgánico |
Fuente principal |
Esfera más |
Efectos primarios en la salud |
|
Plomo |
Gasolina con plomo, Baterías Soldaduras Aleaciones no ferrosas |
Aire, Alimentos, Agua |
Daña el sistema nerviosos y la síntesis |
|
Cromo |
Industrias del acero Fundiciones |
Agua |
Envenenamiento agudo |
|
Zinc |
Fundiciones |
Agua |
Lesiones en vías respiratorias |
|
Níquel |
Fundiciones |
Aire |
Dermatitis |
Métodos y materiales.
Una estrategia adecuada de recogida de muestra permite garantizar que éstas serán representativas del material del que proceden. Las muestras sesgadas o no representativas y la contaminación de las muestras durante o después de su obtención constituyen dos fuentes de error de muestreo que pueden dar lugar a errores significativos. Los errores de muestreo son independientes de los errores del análisis. Por tanto, no pueden corregirse mediante una valoración con blancos de reactivos.
El plan con los lineamientos y recomendacionespara el muestreo de las aguas residuales del proceso de galvanoplastia seestablecen en la NMX-AA-003-1980 y en la NOM-002-ECOL-1996 4,5.
Se realizaron experimentos con muestra de matriz ambiental de agua residual de proceso de galvanoplastia en la cual se hicieron pruebas de fortificación. En las fortificaciones, la fórmula usada en el cálculo para obtener el porcentaje de recuperación de metales cromo, plomo, níquel y zinc es6:
|
|
Valores de fortificación entre límites de 70 – 130 % de recuperación.
El equipo utilizado es Espectrómetro de Emisión de Plasma Acoplado Inductivamente, marca Thermo Elemental, modelo Iris Intrepid.Computadora y software: Microsoft Windows 2000 Profesional, modelo OptiPlex GX150. Versión: TEVA 1.11.01.0. Por el laboratorio del CEPA. Sistema de introducción de muestra: nebulizador neumático con cámara de spray cónica. Antorcha fija de cuarzo, bomba peristáltica integrada con humidificador de argón y sistema de drenaje. Sistema de extracción de gases: turbina extractora.
El método de prueba utilizado es: Method 6010B. Inductively Coupled Plasma-Atomic Emission Spectrometry. EPA7. Aplicable a la matriz de agua residual de proceso de galvanoplastia, la cual requiere digestión previa al análisis debido a su complejidad y variabilidad8.
Procedimiento para la operación de PAI.
El analista debe verificar que la configuración del instrumento y las condiciones de operación satisfagan los requerimientos analíticos y mantener datos del control de calidad que confirmen el desempeño del instrumento y los resultados analíticos.
Los pasos generales para analizar en PAI son:
- Encendido.
- Creación de método.
- Auto ajuste de pico.
- Calibración.
- Análisis de muestras.
- Apagado.
- Análisis estadístico de los datos.
 |
Figura 1. Realización de las mediciones analíticas de los metales pesados cromo, plomo, níquel y zinc en agua residual de proceso de galvanoplastia en el Plasma Acoplado Inductivamente.
Se utilizó como herramienta estadística el programa Excel© 9, con la cual se realizaron cálculos de incertidumbre; cálculos de fortificacionesy porcentajes de recuperación en los datos de muestras de agua residual de proceso de galvanoplastia.
Resultados y discusión.
Aplicando las pruebas de hipótesis en las muestras de agua residual de proceso de galvanoplastia fortificadas con metales pesados Cromo, Plomo, Níquel y Zinc, se obtuvieron resultados que demuestran que no hay evidencia estadística para aceptar la igualdad de la fortificación con el valor certificado, los datos se describen en la tabla 1.
Tabla 1. Pruebas de hipótesis aplicadas a muestras de en agua residual de proceso de galvanoplastia fortificadas con metales pesados Cromo, Plomo, Níquel y Zinc cuantificados por el laboratorio del CEPA.
|
Muestra |
Adición mg/L |
Lecturaen Plasma mg/L |
% Recuperación |
Prueba de hipótesis |
|
CROMO |
1,001 |
1,152 |
115,09 |
Rechazado |
|
PLOMO |
2,001 |
1,506 |
70,76 |
Rechazado |
|
NÍQUEL |
1,998 |
2,204 |
110,31 |
Rechazado |
|
ZINC |
1,999 |
1,534 |
76,70 |
Rechazado |
Nota: La adición se realizó con MRC.
Se retiene = “hay evidencia estadística para aceptar la igualdad con el valor certificado”
Se rechaza = “No hay evidencia estadística para aceptar la igualdad con el valor certificado”
Esto significa que el porcentaje de recuperación en la fortificación de las muestras de agua residual de proceso de galvanoplastia con cromo, plomo, níquel y zinc causa interferencia en la cuantificación de los metales, pues el porcentaje de recuperación aunque está dentro del rango de 70 y 130 % que establece la Agencia de Protección Ambiental de los Estados Unidos de Norteamérica6, no se acerca al 100 %, como se observa en la figura 2.
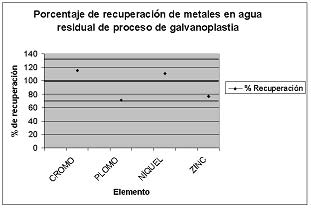 |
Figura 2. Porcentaje de recuperación de metales pesados cromo, plomo, níquelzinc en agua residual de proceso de galvanoplastia.
Conclusiones.
En base a las pruebas de hipótesis realizadas se concluye que existen interferencias significativas al realizar determinaciones de metales pesados cromo, plomo, níquel y zinc en efluentes de agua residual de proceso de galvanoplastia, los porcentajes de recuperación que se obtuvieron en las muestras fortificadas no se acercaron al 100 % debido a interferencia de la matriz de la muestra en la cuantificación de los metales. No es posible hacer equiparación a la matriz debido a que es desconocida e irregular en cuanto a composición; por lo que se deben tomar estas consideraciones al revisar los límites máximos permisibles en la normatividad mexicana.
Los métodos de recirculación y recuperación de metales pesados en agua residual en proceso de galvanoplastia, pueden reducir la calidad de materia sólida generada y frecuentemente pueden proporcionar ahorros en los costos químicos como son: evaporación, electrolíticos, intercambio iónico osmosis inversa, otros métodos menos comúnmente utilizados son. Absorción en carbón, cristalización y electrodialisis.
Bibliografía.
- Kirk-Othmer. Enciclopedia de la tecnología química. UTEHA. 1985.
- Kushner and Kushner. 1994. Water and Waste Control For The Plating Shop. Gardner Publications inc. Cincinnati, OH. United States of America.
- Harvey, David. 2002. Química Analítica Moderna.McGraw-Hill / Interamericana. Madrid, España.
- Norma Oficial Mexicana NOM-002-ECOL-1996. Que establece los límites máximos permisiblesde contaminantes en las descargas de aguas residuales a los sistemas de alcantarillado urbano o municipal. Diario Oficial de la Federación, 3 de junio de 1998.
- Norma mexicana NMX-AA-003-1980. Aguas residuales – Muestreo.Dirección General de Normas.
- Standard Operating Procedure for the Determination of Metals and Trace Metals in Water and Wastes by Inductively Coupled Plasma-Atomic Emission Spectroscopy. 2003. Environmental Protection Agency, SOP I -1-30, Revision 3-28-03, Page 21 of 42. USA.
- Method 6010B. 1996. Inductively Coupled Plasma-Atomic Emission Spectrometry. U.S. Environmental Protection Agency. Las Vegas, Nevada. Revision 2, December.
- Varna, Asha.1991. Handbook of Inductively Coupled Plasma Atomic Emission Spectroscopy. CRC PRESS. Boca Raton, Florida, United States of America.
- Microsoft Excel (10.6501.6714) SP3. Copyright© Microsoft Corporation.
- Vega de Kuyper, J.C. Manejo de Residuos de la Industria Química y Afín, Alfa Omega. 1999.
- Ramírez, M.W. 1999. Diseño de un modelo de saneamiento de suelos contaminados con metales pensados derivados de la explotación minera. Tesis Profesional, Maestría en Ingeniería de Proyectos, Universidad de Guadalajara, México.
- Robertson, W. O., Dreishbach, R.h. 1988. Toxicología clínica. Editorial Manual Moderno, México.
- INHEM. 1992. Agua y salud. Editorial Ciencias Médicas. Instituto Nacional de Higiene Epidemología y Microbiología, La Habana, Cuba.
- Dickson, T.R. 1999. Química y enfoque ecológico. Editorial Limusa, México.
Por: M. del Rio Anaya1, J. A. Luna Encinas2
1. Departamento de Ingeniería de Proyectos, CUCEI, Universidad de Guadalajara
2. Escuela Politécnica de Guadalajara, SEMS, Universidad de Guadalajara