Integración energética de un ciclo de producción y purificación de hidrógeno a partir de etanol para una celda de combustible tipo PEM
Introducción
Con el propósito de reducir las emisiones de los gases responsables del efecto invernadero, en particular el CO2, se están realizando grandes esfuerzos en todo el mundo con la intención de introducir en el mercado vehículos que utilicen hidrógeno como combustible y una celda de combustible en reemplazo de los motores de combustión interna convencionales.
Las pilas de combustible de membrana polimérica (PEM) son adecuadas para fuentes móviles debido, entre otras razones, a que operan a temperaturas relativamente bajas (80 – 100 ºC). Como desventaja, operar a estas temperaturas facilita la adsorción de CO en el electrodo de platino de la pila, disminuyendo su eficiencia. Por esta razón, el hidrógeno que ingresa al ánodo debe tener una concentración de CO menor a 20 ppm.
El hidrógeno obtenido de la electrólisis tiene la ventaja de estar libre de CO. Sin embargo, para que el vehículo tenga suficiente autonomía y debido a su muy baja densidad energética en base volumétrica en relación a los combustibles fósiles, el hidrógeno debe ser almacenado en tanques a muy alta presión (60000 kPa) o, en forma líquida, a muy bajas temperaturas (- 253 ºC). Ambas alternativas son costosas, peligrosas y consumen energía.
Por otra parte, si el hidrógeno es producido a partir de hidrocarburos o alcoholes por el proceso de reformado con vapor, es necesaria una purificación posterior con el objeto de reducir la concentración de CO a los niveles exigidos por la pila.
En nuestro diseño, este proceso de purificación consta de dos etapas: una, consistente de dos reactores WGS y otra denominada de oxidación selectiva o COPROX en la que la concentración de CO es disminuida por oxidación a menos de 20 ppm utilizando tres lechos adiabáticos en serie.
Si bien el hidrógeno es actualmente producido por reformado con vapor de derivados del petróleo, en particular del gas natural, este procedimiento incrementa la concentración de dióxido de carbono en la atmósfera. La posibilidad de utilizar alcohol en lugar de gas natural se ha transformado en una alternativa promisoria y es objeto de una creciente atención a nivel mundial, debido especialmente a que un vehículo debería entonces contar con un tanque con alcohol en lugar de un tanque con hidrógeno [1-5] .
El etanol presenta ventajas respecto al metanol en cuanto a seguridad de manipulación y almacenamiento debido a su casi nula toxicidad; además es una materia prima renovable ya que puede obtenerse de la caña de azúcar, maíz, etc. De modo que, la producción de hidrógeno a partir de bio-etanol tiene la ventaja de ser neutro en dióxido de carbono ya que el CO2 producido es consumido por la biomasa en crecimiento generando prácticamente un ciclo cerrado de carbono.
En conclusión, entre los diferentes procesos y materias primas propuestos para la obtención de hidrógeno y su aplicación en pilas de combustible, el reformado de etanol con vapor es una de las alternativas más atractivas.
Objetivos
En el presente trabajo se analizará desde el punto de vista termodinámico un sistema de producción de hidrógeno a partir del reformado de etanol con vapor de agua.
Se propondrá una expresión para evaluar el rendimiento del sistema, incluyendo también a la celda de combustible, en el que se tendrán en cuenta todos aquellos factores que introduzcan no idealidad.
Finalmente se propondrá una red de intercambios de calor que mejoren el aprovechamiento de la energía calórica puesta en juego.
Sistema de reacciones
El proceso consta de tres etapas de reacción:
– reformado de etanol con vapor
– conversión de CO (WGS)
– oxidación preferencial de CO (COPROX)
Luego de la tercera etapa de reacción, el hidrógeno producido está en condiciones de ingresar en la celda de combustible.
La etapa de reformado puede ser modelada mediante las siguiente reacciones
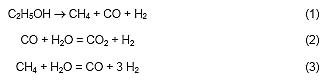 |
La reacción (1) es completa, mientras que las dos restantes alcanzan el equilibrio. Asimismo, la primera y la tercera son reacciones endotérmicas, y la segunda, conocida como water gas shift reaction (WGS) es exotérmica [6,7]. El sistema en su conjunto tiene un carácter endotérmico.
En esta etapa ocurre esencialmente la producción de hidrógeno, por lo que debe optimizarse su operación.
La reacción de conversión de CO fue introducida como una de las participantes en la etapa anterior (reacción (2)). Como esta reacción es exotérmica, se debe operar a temperaturas bajas. Sin embargo, si bien las bajas temperaturas favorecen la conversión de equilibrio, la cinética se ve perjudicada; habrá que tener en cuenta estos dos aspectos a la hora de diseñar el reactor [8]. Por esta razón, se utilizarán dos lechos fijos adiabáticos en serie con intercambio de calor entre ambos.
Esta reacción cumple un doble rol: purificación de la mezcla y producción de hidrógeno adicional.
Finalmente, en la etapa de oxidación preferencial de CO, ocurren las siguientes reacciones
|
|
Como puede verse, la reacción (5) debe inhibirse, ya que consume hidrógeno (la corriente de gas que ingresa al reactor es rica en hidrógeno). Además ambas reacciones son exotérmicas, lo que genera un aumento indeseable de la temperatura. En este caso, las reacciones pueden “dispararse”. Para evitar este “runaway” se ha dividido el reactor en tres lechos fijos adiabáticos en serie con intercambio de calor entre ellos.
Esta etapa tiene como fin reducir la cantidad de CO a menos de 20 ppm, valor tolerado por el electrodo de la pila de combustible [9,10].
En cuanto al intercambio calórico con el medio, las dos últimas etapas son consideradas adiabáticas, mientras que, por el contrario, la etapa de reformado es considerada isotérmica.
Esto se debe a que si una reacción marcadamente endotérmica se operara adiabáticamente, la temperatura descendería a lo largo del reactor, siendo esto perjudicial tanto desde el punto de vista cinético como termodinámico. En cambio, en las etapas WGS y COPROX, la temperatura aumenta, aumentando también la velocidad de reacción, si bien en la etapa WGS el efecto de la temperatura es desfavorable desde el punto de vista termodinámico (ocurre lo mismo con la COPROX, pero tanto la oxidación del H2 como la del CO pueden considerarse irreversibles).
Integración energética
Para analizar la integración energética, es necesario identificar algunas variables. A continuación se listan algunas de ellas, sin hacer mención de cuán fuertes son:
- Presiones de operación
- Temperaturas de operación
- Utilidades fría y caliente
- Relación etanol/agua en la alimentación
- Relación aire/CO en la etapa COPROX
- Aproximación de temperaturas en los intercambiadores
Nótese que los caudales no son incluidos como variables, ya que el presente es un estudio termodinámico. Algunas especificaciones sobre las variables del proceso serán discutidas a continuación.
Presiones de operación
La operación de la celda de combustible impone que la mezcla de entrada a la pila tenga alrededor de 4,5 atm, de modo que deberá considerarse la presencia de bombas y/o compresores. Asimismo, deberá tenerse en cuenta que la compresión aumenta la temperatura del gas.
La etapa de reformado es sensible a la presión, ya que hay generación de moles. De esta forma, al aumentar la presión, disminuye la conversión. Por su parte, desde un punto de vista termodinámico, la etapa WGS no se ve afectada por la presión. En cuanto a la COPROX, como ambas reacciones son prácticamente irreversibles, tampoco se ve afectada por la presión.
Temperaturas de operación
La operación de la celda de combustible impone que la mezcla de entrada a la pila tenga una temperatura de 80ºC. Por lo tanto, la corriente de hidrógeno deberá enfriarse desde la temperatura de reformado hasta la de operación de la pila.
En la etapa de reformado, la formación de metano constituye un problema que se acentúa conforme la temperatura decrece [6, 7]. Es necesario entonces operar el reformador a altas temperaturas. Esto es una desventaja desde el punto de vista constructivo y desde el de la obtención del calor necesario para mantener una elevada temperatura, ya que, además, la reacción global de reformado de etanol es endotérmica.
En cuanto a la WGS, la desactivación por sinterizado del catalizador de cobre impone que no se superen los 250ºC. Por otro lado, por consideraciones cinéticas no es conveniente operar el reactor a menos de 180ºC [11].
La etapa COPROX tiene como límite inferior de temperatura aquella a la que el agua de la mezcla comienza a condensar, alrededor de los 130ºC a 5 atm [9, 10]. No se establece un límite superior de trabajo, aunque en estudios cinéticos deberá analizarse la posibilidad de “runaway”. Dado que esta reacción es exotérmica, la corriente efluente de este reactor deberá ser acondicionada para ingresar a la celda de combustible.
Utilidades calientes y frías
Se entiende por utilidad caliente a aquella fuente de calor que no es ninguna corriente de proceso. Del mismo modo, una utilidad fría es aquella que es sumidero de calor pero no es una corriente de proceso. Éstas se utilizan cuando, según el segundo principio de la Termodinámica, no puede lograrse el intercambio calórico entre dos corrientes de proceso.
La utilidad caliente será la corriente efluente de gas de un quemador que puede ser alimentado con:
a) Etanol;
b) gas de síntesis, o
c) corriente enriquecida en hidrógeno
Esto agrega una nueva variable para el análisis: la relación aire/combustible.
Hay que tener en cuenta que la utilidad caliente proviene de la combustión de una parte de una de las corrientes de proceso, con lo cual podría discutirse si efectivamente es una fuente externa. Sin embargo, consideraremos que el sistema es la porción de la corriente de alimentación que no se quema. Surge aquí otra nueva variable: la fracción de corriente de proceso quemada. Cuanto mayor sea la fracción quemada, menor será el rendimiento global del sistema (ver definición de rendimiento).
En cuanto a la utilidad fría, puede ser agua, un refrigerante o aire. Sin embargo, las dos primeras terminarán reduciendo su temperatura para volver a ser utilizadas contra el aire del medio ambiente.
Relación agua/etanol en la alimentación
Estudios cinéticos demuestran que una alta relación agua/etanol mejora la conversión a hidrógeno en las dos primeras etapas de reacción (reformado y WGS), mientras que la tercera (COPROX) no es sensible a la abundancia de agua [4-12]. Sin embargo, desde el punto de vista energético, la evaporación de agua representa un gran gasto de energía, de manera que la eficiencia del sistema disminuye. Existe pues una solución de compromiso entre el aumento de la producción de hidrógeno y el gasto energético en la evaporación del agua.
Relación aire/CO en la etapa COPROX
En la etapa de oxidación preferencial se oxidan tanto el CO como el hidrógeno. Un defecto de aire produce una mala operación del equipo, ya que la concentración de CO no alcanza a disminuir hasta el valor de especificación. Por otro lado, un exceso de aire produce una excesiva combustión de hidrógeno [9, 10, 13]. Una vez más, debe encontrarse la solución de compromiso.
Debe también considerarse que el aire entrará comprimido a la presión de la corriente de proceso, por cuanto un exceso de aire provoca un exceso en el gasto de energía eléctrica (producida en la celda) en el compresor.
Aproximación de temperaturas en los intercambiadores
A lo largo del equipo, la aproximación de las temperaturas de las corrientes que intercambian calor debe ser la mayor posible, para obtener equipos pequeños. Esto es importante si se tiene en cuenta que el equipo completo deberá ser transportado en un vehículo.
Relación aire/combustible en el quemador
Es necesario encontrar la relación que produzca una corriente con un contenido calórico suficiente para mantener la temperatura en el reformador. En este caso, a diferencia de la COPROX, no se requiere aire comprimido, por cuanto no se computa el gasto de compresión.
Fracción de corriente de proceso quemada
Hay que definir cuál de las corrientes (etanol, gas de síntesis o hidrógeno enriquecido) es más conveniente utilizar para generar una cantidad conveniente de calor, y minimizar esta fracción quemada.
Rendimiento y potencia de la pila PEM
Se propone la siguiente expresión para el rendimiento porcentual η del sistema donde F es la constante de Faraday (96485 coulomb/mol); FH2 el flujo molar real de hidrógeno que llega a la celda PEM; FH2 e el flujo molar estequiométrico de hidrógeno que llega a la celda PEM; ΔV(FH2) la tensión real entre bornes de la pila; ΔVtd el potencial termodinámico de la pila PEM; Wc y Wd son los trabajos que consumen la bomba y el compresor respectivamente.
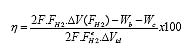 |
La ecuación (6) tiene en cuenta la performance de los tres reactores en el flujo real de hidrógeno. Las variables que afectan al flujo de hidrógeno que llega a la celda son:
- temperatura del reformado: las bajas temperaturas favorecen la producción de metano, que captura el equivalente a dos moles de hidrógeno por mol de metano producido
- fracción de mezcla quemada: parte de la mezcla es quemada con aire para producir calor suficiente para sostener la reacción del reformado y para acondicionar la mezcla de entrada al reactor; cuanto mayor sea la fracción quemada, menor será el flujo real de hidrógeno en la celda
- temperatura de entrada de la WGS: cuanto menor sea ésta, mayor será la conversión de equilibrio, lo cual conlleva a una mayor producción de hidrógeno y una menor carga en la etapa siguiente (la COPROX), con lo cual se evita sobredimensionarla
- relación aire/CO en la COPROX: una gran cantidad de aire puede producir una combustión excesiva de hidrógeno
El potencial termodinámico ( ΔVtd = 1.24 V) está dado por la ecuación
|
|
donde G es el potencial termodinámico de Gibbs.
La tensión real entre bornes de la pila, ΔV(FH2), se considera constante e igual a 0.8 V [14].
La potencia real que produce la pila (P) se estima a partir de la siguiente ecuación:
|
|
en la que la intensidad de corriente está dada por:
|
|
La tensión de la celda está afectada por sobrepotenciales: el potencial termodinámico dado por la ecuación de Nernst se ve reducido por la circulación de corriente y por la difusión de reactivos y productos en la tensión real de la celda. Los distintos sobrepotenciales que pueden ocurrir son:
– sobrepotencial de activación
– sobrepotencial por corriente límite
– sobrepotencial por resistencia óhmica
Los consumos de energía eléctrica en la bomba y el compresor son provistos por la misma celda. Por lo tanto, producen una disminución en su rendimiento.
La base de cálculo es la potencia que se obtendría si la reacción de reformado de etanol fuera ideal y la tensión no se viera afectada por los sobrepotenciales. La cantidad de hidrógeno obtenida en estas condiciones estaría dada por:
|
|
que se obtiene por combinación lineal de las reacciones (1), (2) y (3). Como puede verse, el flujo ideal de hidrógeno sería, en este caso, seis veces el flujo de etanol en la alimentación.
Diseño de la red de intercambios
Dentro de un mismo proceso, algunas corrientes deben ser enfriadas y otras calentadas. Aprovechando esta circunstancia en la que una corriente tiene un exceso de energía térmica y la otra un déficit, se trata de acoplar dichas corrientes, reduciendo de esta manera el intercambio de calor con el medio.
Para diseñar la red de intercambios, hay que conocer “a priori” los valores de algunas de las temperaturas del sistema. Según el segundo principio de la Termodinámica, no podrá transferirse calor desde una fuente fría hacia una fuente caliente como único resultado de un proceso.
Puede entonces efectuarse la integración energética de cualesquiera dos corrientes de proceso, teniendo en cuenta que es conveniente que el intercambio de calor se efectúe entre dos corrientes cuyas temperaturas no sean muy lejanas entre sí. Cuanto menor sea la diferencia de temperaturas entre ambas corrientes, menor será el aumento de la entropía del sistema.
Según las corrientes que se consideren para intercambiar calor puede no llegar a cumplirse con los requerimientos. El segundo principio establece un orden en el que deberán darse los intercambios de calor ya que el primer principio no impone ningún orden en este sentido. Para la integración energética hay que cuidar que las temperaturas no se crucen, es decir, que la corriente a enfriar no tenga una temperatura menor que la corriente a calentar. A los efectos de construir una red de intercambios, habrá que analizar a priori cómo serán los saltos térmicos. Dado que el calor que gana una de las corrientes es el que pierde la otra
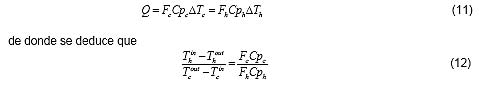 |
siendo Q el calor intercambiado, F el flujo molar de la corriente, Cp, la capacidad calorífica a presión constante y Tin y Tout las temperaturas de entrada y salida al intercambiador, respectivamente.
De la ecuación (12) puede deducirse que el mayor salto de temperatura se producirá en la corriente cuyo producto (F.Cp) sea el menor.
Entonces, si se necesita producir un gran salto térmico en una dada corriente, conviene que ésta tenga el menor (F.Cp). Esto se logra principalmente manejando los flujos. Desde otro punto de vista, si se tiene una corriente con un elevado valor de (F.Cp), puede bifurcarse la corriente, pudiéndose disponer de este modo de dos corrientes “clonadas” del mismo nivel térmico. En el presente estudio se aprovecha este efecto para bifurcar la corriente de alimentación, ya que ésta es la única corriente de bajo nivel térmico.
De acuerdo a las consideraciones citadas anteriormente, se obtiene el diseño que se muestra en la figura, en el cual se tiene en cuenta que:
- la corriente fría intercambia calor primeramente con las corrientes calientes de menor nivel térmico (las más cercanas a la celda de combustible)
- la corriente fría se bifurca para conseguir dos corrientes de bajo nivel térmico, ya que se dispone de pocas fuentes frías
- las etapas WGS y COPROX son divididas para poder efectuar un intercambio de calor entre lechos catalíticos, de manera de restringir la temperatura de salida
Simulación
La simulación se llevó a cabo bajo las siguientes suposiciones:
- El aire comprimido que se utiliza en la etapa COPROX no es llevado a la temperatura de la mezcla enriquecida en hidrógeno.
- La última etapa de COPROX se simula como las dos anteriores, salvo en el caso en que la corriente de salida supere la temperatura correspondiente al equilibrio (en este caso se considerará esta etapa como de equilibrio, sin tomar en cuenta la reacción de oxidación de hidrógeno).
- No se considera un problema que la temperatura de salida de la mezcla enriquecida en hidrógeno sea menor a la especificada (80ºC), ya que puede efectuarse la integración energética con el escape.
- Se considera que la eficiencia adiabática del compresor y la bomba es de 75%.
- El quemador opera a presión atmosférica y se asume cambustión completa del CO, CH4 y H2.
- En el caso de la WGS y de la COPROX, las temperaturas de entrada son las mismas.
- Se considera que la temperatura ambiente es de 20ºC.
- Se descartaron todos los casos en los que en algún intercambiador, las corrientes fría y caliente tuvieran un ΔTappr<5ºC.
- Se consideró que el potencial real de la pila es constante, cuando en verdad es función del flujo de corriente (y éste, del flujo molar de hidrógeno)
Los resultados más relevantes obtenidos se presentan en la tabla. Se analizaron dos variables consideradas claves en la integración energética, como son la relación etanol/agua, R, y la temperatura de operación del reactor (Tref).
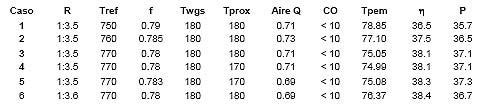 |
Siendo:
R: relación molar etanol/agua
Tref: temperatura del reactor de reformado [ºC]
F: fracción no quemada de gas de síntesis que sale del reformador de etanol
Twgs,in: temperatura de entrada de la WGS [ºC].
Tprox,in: temperatura de entrada de las etapas COPROX [ºC]
Aire Q: flujo molar de aire al quemador [kmol/h]
CO: concentración de CO que ingresa a la celda de combustible [ppm]
Tpem: temperatura de ingreso de los gases a la celda PEM [ºC].
η: rendimiento (%)
P: potencia entregada por la celda de combustible (kW)
Análisis y Conclusiones
En este trabajo se ha demostrado que es posible realizar la integración energética del sistema producción de hidrógeno -purificación -pila PEM empleando etanol como materia prima, con rendimientos superiores al 36%. Efectivamente, se observa que para los cinco casos estudiados, se obtienen rendimientos superiores al de un motor de combustión interna, con la ventaja adicional que no se incrementa la concentración de CO2 en la atmósfera.
Quemando cerca del 20% del efluente del reformador de etanol, es posible lograr un sistema energéticamente autosustentable, es decir un sistema al que ingresa etanol, agua y aire y egresa electricidad, calor y agua.
Para todos los casos analizados se consigue un flujo de hidrógeno con la pureza que la pila PEM requiere (< 20 ppm). Altas temperaturas en el reformador de etanol aumentan el rendimiento y la potencia debido a que se produce en mayor medida el reformado de metano, que incrementa la producción de H2. La potencia de la pila disminuye al disminuir la relación etanol/agua en la alimentación, debido a que se debe consumir mas energía para evaporar la mayor cantidad de agua que ingresa al reformador. Nótese que la fracción no quemada de gas de síntesis disminuye al disminuir R. Los resultados aquí presentados, como así también los obtenidos en el Laboratorio de Procesos Catalíticos de la UBA [2, 4, 8, 11-13] y en el INGAR de la provincia de Santa Fe [15], indican que la tecnología de producción de hidrógeno “grado celda” a partir de bioetanol es una alternativa más que interesante a aquella que utiliza hidrocarburos fósiles. Las razones para que asi sea son básicamente dos: 1) el uso de bioetanol no incrementa el CO2 en la atmósfera, uno de los principales gases responsable del efecto invernadero; 2) el aumento del precio del petroleo y el agotamiento inevitable de sus reservas. Agradecimientos
A UBACYT, ANPCYT y CONICET por los subisidios otorgados
Referencias:
[1] Klouz V, Fierro V, Denton P, Katz H, Lisse J.P, Bouvot-Mauduit S, Mirodatos C. Ethanol reforming for hydrogen production in a hybrid electric vehicle: process optimization. Journal of Power Sources, 2001, 4549 1-9.
[2] Mariño F.J, Boveri M, Baronetti G, Laborde M. Hydrogen production from steam reforming of bioethanol using Cu/Ni/K/γ-Al2O3. Effect of Ni. Int. J. Hydrogen Energy 2001, 26(7) 665-668.
[3] Auprêtre F, Descorme C, Duprez D. Bio-ethanol catalytic steam reforming over supported metal catalysts. Catalysis Communications 2002, 3 263-267.
[4] Comas J, Mariño F, Laborde M, Amadeo N. Bio-ethanol steam reforming on Ni/Al2O3 catalyst. Chem. Eng. J. 2004, 98 61-68.
[5] Fatsikostas A.N, Verykios X. E, Reaction network of steam reforming of ethanol over Nibased catalysts. J. of Catalysis 2004, 225 439-452
[6] Garcia E.Y, Laborde M.A. Hydrogen Production by the Steam Reforming of Ethanol: Thermodynamic Analysis. Int. J. Hydrogen Energy 1991, 16 (5) 307-312
[7] Thermodynamic analysis of ethanol/water system with the stoichiometric method. V. Mas, R. Kipreos, N. Amadeo, M. Laborde. Aceptado para su publicación en Int. J Hydrogen Energy, 2005
[8] Giunta P, Amadeo N, Laborde M. Simulation of a low temperature water gas shift reactor using the heterogeneous model. Application to a PEM fuel cell. Aceptado para su publicación en J. Power Sources, 2005.
[9] Mariño,F., Descorme,C., Duprez,D. “Noble metal catalysts for the preferential oxidation of carbon monoxide in the presence of hydrogen (PROX)”. Appl.Catal.B: Environmental 2004, 54 59.
[10] Mariño,F., Descorme,C., Duprez,D. “Supported base metal catalysts for the preferential oxidation of carbon monoxide in the presence of hydrogen (PROX)”. Appl.Catal.B: Environmental 2005, 58 175.
[11] Low temperature water gas shift reaction: catalyst, kinetics and reactor design and optimization. N. Amadeo, M. Laborde. Trends in Chemical Enginnering 1996, 3 159-183.
[12] Hydrogen production by ethanol steam reforming. A reaction mechanism. J. Comas, V. Mas, G. Baronetti, M. Laborde, N. Amadeo. Hypothesis VI, La Habana, Cuba, 8-12 de mayo 2005. Vol.1, 277-283.
[13] Oxidación selectiva de CO sobre un catalizador de Pt/Al2O3 para su aplicación en pilas de combustible. S. Larrondo, J. Comas, G. Alvaro, B. Schönbrod, F. Mariño, M. Laborde, N. Amadeo. XIX Simposio Iberoamericano de Catálisis, Mérida, México, septiembre 5-11, 2004, pags. 1175-1182 en CD
[14] Fisicoquímica de materiales y el desarrollo de miniceldas de combustibles. H. R. Corti. En “Hidrógeno y la energía del futuro”, editores: R. Dubois, R. Perazzo y W. Triaca, ANCEFN y ANI, páginas 109-118, Buenos Aires, 2004.
[15] Proyecto EOS-Greencell CONICET, Res. 1030/03, 2003, 2004, Buenos Aires, Argentina.
Por: Pablo Giunta1,(*), Carlos Mosquera2, Miguel Laborde1
(1) Facultad de Ingeniería – UBA, Laboratorio de Procesos Catalíticos
(2) Facultad de Ingeniería – UBA, Departamento de Física
(*) Autor a quien dirigir correspondencia. E-mail: [email protected]
Fuente: Revista Petroquímica