El quinto jinete
Respirar oxígeno es quizás lo que pone límite a la vida de la mayoría de los animales. Aún en las ideales condiciones actuales, el oxígeno muestra su toxicidad.
La Plata, 15 de abril de 2006
“Vi otra bestia que subía de la tierra y tenía dos cuernos semejantes a los de un cordero, pero hablaba como un dragón.” Apocalipsis 13-14
EL QUINTO JINETE
Introducción.
En la última década del siglo XV, un año después del descubrimiento de América, nacía en Suiza Auroleus Phillipus Theofrastus Bombastus von Hohenheim, mejor conocido como Paracelsus[1]. Este alquimista, durante los 48 años de su existencia breve, se dedicó a la ciencia de los venenos. Lo hizo de tal suerte, que sus trabajos lo convirtieron en el padre de la toxicología moderna.
Un resumen de su legado, aún vigente, lo encontramos en un comentario suyo, convertido en lema de la disciplina: “Todas las sustancias son venenos; no hay una que no lo sea. Es la dosis correcta lo que diferencia el veneno del remedio”.
El sabio criterio de Paracelsus es frecuentemente olvidado, y cada vez que se descubre la toxicidad de una nueva sustancia, rápidamente surgen voces exigiendo fijar nivel cero para su emisión. Este criterio es obviamente equivocado, innecesario y podría ser peligroso.
El oxígeno (O2) es imprescindible para la vida de muchos integrantes de la biota actual. Sin embargo, es terriblemente tóxico para la todavía abundante, e imprescindible, biota anóxica.
Si el sistema regulatorio de la Tierra [2] fallara y la cantidad de oxígeno subiera por encima de los niveles actuales, la vida para los respiradores de oxígeno (O2) se complicaría. Si por el contrario, su nivel disminuyera por debajo del 21% del aire que respiramos, también estaríamos en problemas.
Respirar oxígeno es quizás lo que pone límite a la vida de la mayoría de los animales. Aún en las ideales condiciones actuales, el oxígeno muestra su toxicidad. Especies muy reactivas, derivadas de ese elemento, son generadas en el organismo: ión peróxido, ión superóxido y otras especies de oxígeno activadas. Todas estas ellas son de una muy alta toxicidad y, aunque el organismo humano posee mecanismos para su destrucción, aquellas igualmente ejecutan su deletéreo trabajo, incluyendo el de carcinogénesis. Sin embargo, fijar a nivel cero el oxígeno para prevenir el cáncer sería algo totalmente equivocado, un grave error sin duda.
EMERGE LA BESTIA
El incidente ocurrió en 1976, en Seveso al norte de Italia. Se debió a la explosión de un reactor durante la producción de 2,4,5-triclorofenol [3]. Se liberó allí una nube tóxica que contenía cerca de 3000 kg de varias sustancias químicas, entre las cuales había entre 30 y 100 kg de dioxina tetraclorada.
Fue aquel episodio el que, probablemente, despertó la alarma y dio origen al relato del Quinto Jinete, la dioxina, capaz de iniciar un ciclo de catástrofes que completaría, seguramente, el buen trabajo realizado hasta entonces por los otros cuatro jinetes bíblicos.
Desde entonces, incentivada por otro par de hechos accidentales, la búsqueda de dioxina obtuvo resultados definitivamente positivos, hallándola en casi todas partes. De tal forma se desarrollaron los acontecimientos que algún científico americano escribió [4], en 1998,: “La exposición, de una gran proporción de la población de U.S., a la dioxina del “background” en los niveles actuales, está ya, probablemente, causando una crisis sanitaria nacional”.
¿QUÉ SON LAS DIOXINAS?
Son compuestos orgánicos aromáticos (Poseen anillos formados por átomos de carbono [C] unidos entre sí con uniones simples y dobles). En estas, dos de tales anillos están, a su vez, unidos por dos átomos de oxígeno [O]. Si además los átomos de hidrógeno, unidos a los carbonos, son sustituídos por átomos de cloro [Cl], tenemos las dioxinas cloradas.
La figura nos muestra la dioxina tetra clorada. En los carbonos donde no hay Cl, hay hidrógenos [H], excepto en aquellos carbonos que son compartidos por dos anillos.
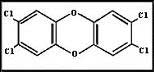 |
Esta dioxina, poli-clorada, cuyo nombre es 2,3,7,8-tetraclorodibenzo-p-dioxina(2,3,7,8-TCDD), donde los números indican la posición de los átomos de cloro en la molécula, es un compuesto tóxico y cancerígeno. No hay evidencia de que induzca cáncer en humanos. Sin embargo, de su probada capacidad para producirlo en animales de laboratorio se le atribuye la propiedad de generarlo en las personas. Sin embargo, cuando el número de átomos de cloro presentes en la molécula disminuye, su toxicidad cae drásticamente a cero [5].
La dioxina penta-clorada (1,2,3,7,8-PCDD) tiene la misma toxicidad que la 2,3,7,8-TCDD. No obstante, si aumenta el número de Cl, aún más, la toxicidad disminuye, siendo para la dioxina con ocho átomos de cloro (OCDD) 10.000 veces menor que la atribuida a la TCDD.
Existe otro grupo de compuestos parientes, derivados del dibenzo furano. Esta es una sustancia parecida a la dioxina, pero con un solo “puente” oxígeno. Entre ambos grupos, dioxinas y furanos clorados, suman más de doscientos congéneres. Entonces, cuando hablamos de dioxinas nos referimos a todos estos compuestos.
Las dioxinas poli-cloradas son hidrófobas (no se encuentran cómodas en medio del agua) por lo cual, en ríos y lagos, se refugian en el sedimento donde encuentran un medio hidrófugo confortable. Tal ubicación hace que, en principio, aunque el agua no contenga dioxinas, estas sean incorporadas por la biota del sedimento y luego por los peces que se alimentan de ella. En los peces, debido a su carácter hidrófobo, las dioxinas se acumularán en las grasas y algunos órganos como el hígado. Es a través de la ingesta frecuente de peces que el hombre puede incorporarlas a su organismo.
¿DE DONDE PROVIENEN LAS DIOXINAS?
Si, como hemos visto, las dioxinas se encuentran en todas partes: ¿de dónde provienen, entonces?.
La EPA (Environmental Protection Agency – USA) ha realizado un inventario de las fuentes de tales compuestos y ha cuantificado la contribución que hace cada una. En la tabla 1, [6] pueden verse las principales fuentes de dioxinas y como, a raíz de algunas regulaciones, la producción total ha ido disminuyendo con los años. Además, se observa que el 70% proviene de actividades no industriales y que, en el estimado para 2004, la industria de la celulosa y papel sólo contribuye con 1%. Esto significa que del total de dioxinas producidas esta actividad aporta apenas 15g-TEQ, en 2000, cuando en 1987 su aporte era de 372 g-TEQ. En la actualidad, tal contribución ha caído aún más, a medida que la industria se ha reconvertido, eliminando el blanqueado de la pulpa con gas cloro (Cl2).
Por otra parte, si se tiene en cuenta que los incendios forestales, en USA, aportan una cantidad superior a la proveniente de todas las otras fuentes, la contribución de todas las industrias no superaba el 15% del total, en el año 2004.
TABLA 1
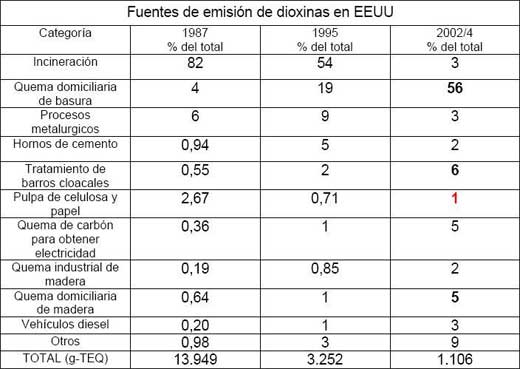 |
Del análisis de estos datos surgen, evidentes, dos conclusiones: a) el total de dioxinas de origen industrial es menor comparado con las otras fuentes y b) el aporte de la industria de la celulosa es bajo y tendiendo a cero, siguiendo el ritmo de aplicación de los nuevos métodos de blanqueado de pulpa.
¿CÓMO SE GENERAN LAS DIOXINAS?
Para su producción hacen falta sustratos adecuados (Una estructura orgánica compleja: lignina, madera, papel o plásticos) y una fuente proveedora de átomos de cloro (Cl), como Cl2 , NaCl (cloruro de sodio = sal de cocina), cloruro de hidrógeno (HCl) o el plástico PVC (poli-vinilo clorado). A ello hay que agregar una temperatura suficientemente alta como la que se obtiene al quemar madera,.papel o plásticos.
En el proceso de blanqueado de pulpa con cloro tenemos todos los componentes necesarios.
El proceso de blanqueado implica la destrucción de la lignina, por oxidación con cloro. La lignina es un polímero complejo que es degradado a compuestos separables, por lavado, de la fibra de celulosa. En este proceso la mitad de los Cl0 oxidan la lignina y se convierten en iones cloruro (Cl1-).
Lignina + Cl0 —-> productos de oxidación + Cl1-
En tanto la otra mitad de los Cl0 reemplazan hidrógenos en algunas moléculas aromáticas (el proceso se llama: sustitución electrofílica) y dan origen a las indeseables TCDD o TCDF. Por ejemplo:
Dioxina no clorada + 4Cl0 —-> 2,3,7,8-TCDD
Si se disminuye la cantidad de átomos de cloro en el reactor de blanqueado, es posible impedir la formación de dioxinas tetra o penta cloradas. Sólo se forman, entonces, compuestos mono, di o tri-clorados que tienen dos ventajas: a) no son tóxicos y b) se degradan con cierta rapidez en el medio ambiente. Es bueno aclarar que la presencia de cloro en los anillos bencénicos produce el efecto de disminuir su reactividad. Así, al aumentar el número de Cl en la molécula, las dioxinas se hacen más resistentes a la degradación natural.
Para disminuir la formación de dioxinas tetracloradas a niveles por debajo de los valores permitidos, la industria celulósica ha reemplazado el gas Cl2 por el gas ClO2 (dióxido de cloro), en el proceso de blanqueado.
¿Cómo es posible lograr ese propósito con una sustancia que también tiene cloro?. Pues, es posible porque el ClO2 tiene una capacidad de oxidación varias veces mayor y, además, porque el mecanismo de acción hace que la posibilidad de tener Cl (cloro elemental) en el medio es mucho menor.
Al oxidar la lignina el dióxido de cloro se convierte en el ión (ión es una especie química con carga) clorito:
Lignina + ClO2 —> productos de oxidadación de la lignina + ClO21- (clorito)
Otros productos de la reducción del ClO2 (dióxido de cloro) son el Cl1-( ión cloruro) y el ión hipoclorito (ClO1-). Este último se encuentra en equilibrio con otras especies (se pueden interconvertir):
ClO1- + H+ —> ClOH
ClOH + ClH —> Cl2 + H2O
De esta manera tenemos presentes las especies ClOH (acido hipocloroso) y Cl2 que tienen la capacidad de clorar. Sin embargo, si se mantiene el medio alcalino (lo contrario de ácido) la especie predominante será ClO1- que es oxidante y no clorante. Se disminuye así, aún más, la posibilidad de tener poli-clorados.
Por otra parte, si el proceso de blanqueado con ClO2 es precedido de un pre-deslignificado con oxígeno o H2O2 se disminuye la cantidad de oxido de cloro necesario y, por consiguiente, la posibilidad de formación de organoclorados.
Esta descripción, aunque ultra simplificada, no deja de ser pura teoría. La única forma de asegurarse de que lo que decimos es cierto es ver que ha ocurrido con el contenido de dioxinas en los efluentes líquidos emitidos por los molinos de pulpa. Veamos la siguiente figura datos sobre Canadá. En ella se observa como la cantidad de dioxinas ha disminuido a medida que los molinos han ido reemplazando el Cl2 por el ClO2.
Actualmente, en Canadá y USA, esos niveles se mantienen por debajo de los niveles permitidos.
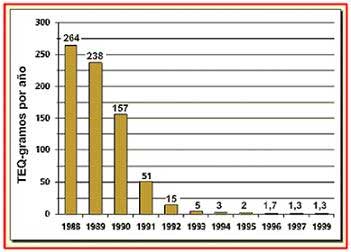 |
CANADÁ: Eliminación de Dioxinas de los cursos de
agua de los molinos de celulosa
Para completar el cuadro podemos agregar que, en USA, los avisos de peces conteniendo dioxinas fueron decreciendo con los años y, desde 2004, no se recibe ningún aviso. Este hecho es muy importante ya que, a pesar de la persistencia de los aromáticos policlorados, estos igualmente desaparecen progresivamente de los peces rompiendo la cadena de bioacumulación.
En definitiva, no parece que vayan a cumplirse las predicciones apocalípticas de hace algunos años y que en estos días se repiten, por aquí, como si nada hubiese cambiado. Muy por el contrario los resultados de la investigación científica y tecnológica, las correctas regulaciones y los adecuados controles muestran que se pueden mantener los efectos, de algunas actividades humanas que pudieron ser peligrosas, en niveles francamente inofensivos.
Terminemos recordando los dichos del panel de expertos, encabezado por el biólogo Wayne Dwernychuk, que revisara, recientemente, el posible impacto ambiental de las plantas de Fray Bentos: “El panel no encontró ninguna razón que diera sustento a las predicciones de daño ambiental catastrófico en el entorno receptor, que han sido presentadas por varios actores”.
REFERENCIAS
[1] www.alchemylab.com
[2] Las Edades de Gaia, James Lovelock. Ed.Metatemas.
[3] Polychlorinated dibenzo-p-dioxins (PCDD), dibensofurans (PCDF) and polychlorinated biphenyls (PCB): main sources, environmental behaviour and risk to man and biota. M.de Souza Pereyra. Química Nova, 27(6), 2006.
[4] Jonathan Campbell. ATSDR 1998.
[5] ATSDR 13(6)1997. Varios autores.
[6] DioxinFacts.com
Por: Dr.Mario R.Féliz
Profesor Titular
Instituto de Investigaciones Fisicoquímicas Teóricas y Aplicadas (INIFTA)
Universidad Nacional de La Plata
[email protected]
Fuente: Ambiente y Desarrollo