Uso Racional de la Energía
1. Marco teórico
Durante muchos años ha existido la preocupación por reducir el desperdicio de energía que se genera al tener que desechar agua sobrecalentada mediante la purga, con el propósito de mantener las condiciones fisicoquímicas del agua en el interior de las calderas.
Debemos recordar que el origen de este problema radica en la imposibilidad de reutilizar el 100% del vapor generado y que por lo tanto en el agua de alimentación que se inyecta a las calderas, se transportan algunos contaminantes los cuales incluyen gases disueltos , sólidos en suspención, y sólidos disueltos que provienen del agua de reposición (MAKE UP) e incluso de las impurezas o contaminaciones que se arrastran en el agua condensada durante el proceso de utilización del vapor.
La calidad del agua de alimentación por lo tanto dependerá de la fuente primaria de donde se obtenga el agua de reposición y de los pretratamientos a que sea sometida tales como, floculación, filtración, intercambio iónico, deaireación, etc.
Ante la imposibilidad de suministrarle a las calderas agua 100% pura, nos vemos entonces obligados a utilizar productos químicos que eviten los efectos de los contaminantes tales como corrosión, formación de incrustaciones, espuma, acumulación de lodos ,etc.
Según la calidad del agua de alimentación y el tratamiento químico que se escoja debemos de mantener los parámetros fisicoquímicos recomendados por el fabricante para garantizarnos los resultados esperados . Esto se logra mediante una correcta dosificación de los productos químicos y la purga de la caldera.
Por regla general el tratamiento químico incorpora al agua de alimentación una cantidad de sólidos disueltos mayor que la proveniente en la misma agua a tratar y en algunos casos para abaratar los productos algunas compañías recurren a «rellenos» o materias primas con muy poco porcentaje de ion activo ( la parte del producto que se aprovecha).
Como ejemplo podemos citar el caso del ion fosfato el cual se utiliza para precipitar el calcio en forma de fosfato tricálcico , este puede obtenerse mediante la disolución del fosfato trisódico, tripolifosfato de sodio o hexametafosfato de sodio .En el orden citados el aporte de ion fosfato va de menor a mayor y el precio de la materia prima también !.
Como resultado podemos asegurar entonces que la cantidad de agua que debemos purgar de una caldera depende de : La calidad del agua alimentada, el régimen de evaporación y del tipo de tratamiento químico que se escoja.
En relación al agua de alimentación su calidad puede ser mejorada mediante los tratamientos externos antes mencionados y eliminando al máximo las fugas de vapor y/o condensados con el propósito de reducir la demanda de agua de reposición ( Make-up) ya que esta es la entrada de contaminantes al sistema.
En cuanto al régimen de evaporación lo único que normalmente se puede hacer para reducir el consumo de vapor ( y energía) , es mejorar los aislamientos , usar máquinas más eficientes, eliminar fugas y mejorar los procesos. Por regla general esto implica fuertes erogaciones y un buen estudio para evaluar los gastos y la rentabilidad de la inversión en base al tiempo de retorno.
Por regla general un cambio de la tecnología en el tratamiento de aguas interno puede lograr un ahorro muy importante en los costos de generación del vapor si con esto se logra una reducción del régimen de purga.
Si hacemos un estudio de los costos del vapor generado por una caldera nos encontraremos siempre que más de un 75 % proviene del costo de combustible , en energía eléctrica , agua y gastos de mantenimiento los costos serán del orden de 18 a 22 % y en tratamiento químico interno sólo se gastará entre un 2 a 5 % !.
No obstante lo anterior la mayoría de las empresas al tomar la decisión del tratamiento de agua a utilizar solo se fijan en el costo de los productos y aunque algunas veces también toman en cuenta el consumo para determinar el costo de los productos utilizados nunca toman en cuenta el costo de la purga y por utilizar un tratamiento más económico ahorran centavos en los productos pero botan miles en la purga. Esto es una realidad pero para demostrarla hay que medir el volumen de agua purgada en un tiempo determinado para luego calcular la cantidad de energía que se pierde multiplicando la masa por su contenido calórico pero .. Quien tiene instalado el equipo para medir el volumen de agua purgada ? La respuesta es casi siempre la misma , NADIE !
Por lo anterior, para poderle demostrar y cuantificar los «Costos escondidos en la purga de las calderas» a los usuarios y » Los beneficios económicos de las nuevas tecnologías» ; recomiendo utilizar el método de cálculo que a continuación desarrollo en forma completa , en lugar de dar la «FÓRMULA FINAL» ,con el propósito de sustentar el método.
DESARROLLO MATEMÁTICO (Para estado estable)
|
Nombre de las variables
|
Unidades
|
|
| A | Agua de alimentación | Litros (Kg.) / Hr. |
| C | Ciclos de concentración | |
| E | % de eficiencia térmica medida en la chimenea | % |
| F | Fugas y consumo de vapor en el proceso | Litros (Kg.) / Hr. |
| G | % del calor de combustión que se pierde en los gases | % |
| M | Agua de «Make Up» ( relleno ) | Litros (Kg.) / Hr. |
| P | Agua purgada | Litros (Kg.) / Hr. |
| Z | Masa de combustible | Kg. |
| Hc | Poder calórico superior del combustible | Kcal / Kg. |
| Hf | Entalpía del agua | Kcal / Kg. |
| R | % del calor de combustión que se pierde por radiación | % |
| %ZP | Porcentaje de combustible perdido en la purga | % |
Nota: Aunque la densidad del agua varía según la temperatura , por ser realmente una variación muy pequeña . En nuestro caso consideraremos que su densidad se mantendrá siempre en 1 Kg. / Litro.
GRAFICO DEL SISTEMA
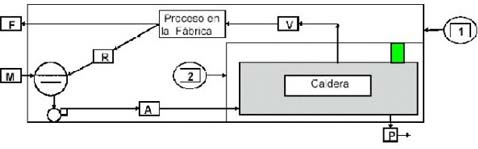 |
|---|
Fórmulas a partir de los volúmenes de observación
M = P + F (1)
A= V+ P (2)
En este caso se escoge el NaCl como «Key Element» por no sufrir ninguna transformación dentro del sistema y estar presente en todas las aguas.
A * [ NaCl ] a = V * [NaCl] e + P * [NaCl] p
Por definición C = [NaCl]p / [NaCl]a
Entonces A = P * [NaCl]p / [NaCl]a = P * C (3)
Si sustituimos en (2) entonces P * C = V + P
De donde entonces P = V / (C – 1) (5)
Balance de energía calórica en el Volumen de observación N° 2
 |
|---|
En el gráfico anterior tenemos que:
Q1= Calor generado por el combustible al quemarse
Q2= Calor latente en el agua de alimentación
Q3= Calor latente en el vapor generado
Q4= Calor latente en los gases de escape
Q5= Calor latente en el agua purgada
Q6= Calor perdido por radiación y convección a través de las paredes de la caldera que según el diseño de la caldera , la presión de trabajo y el régimen de carga puede variar entre un 1.5% y un 3% del calor de combustión generado.
* Q1= Z * Hc
* Q2= A * hfA
* Q3= E * V gv
* Q4=Z * Hc * G / 100
* Q5= P * hfp
* Q6 = R * Z*Hc/100
Balance de energía
Q1 + Q2 = Q3 + Q4 + Q5 + Q6
* Sustituyendo los valores correspondientes
Z * Hc + A * hfA = V * hgv + Z * Hc * G / 100 + P * hfp + Z*Hc * R / 100 (6)
* Sustituyendo (4) y (5) en (6) y reordenando
Z * Hc – Z * Hc * G / 100 – Z*Hc* R / 100 = P ( C – 1 ) * hgv + P * hfp – P * C * hfA
Despejando «P»
P = Z * Hc * [ ( 1- ( G + R) ) / 100 ]
—-—————————————–
———— hgv * ( c-1 ) + hfp – hfA
* En términos de porcentaje la cantidad de combustible que se pierde por la purga estaría dedo por la fórmula :
%ZP = P * hfp * 100 / (Z * Hc) (7)
* Por lo tanto si sustituimos en la fórmula (7) el valor de «P» obtenido en la fórmula (6)
%Z = hfp * [100 – ( G+R) ] / { hgE * ( C – 1 ) + hfp + C * hfA} (8)
* Por definición tenemos que el porcentaje de eficiencia térmica de la caldera es el porcentaje del calor de combustión que se retiene en el agua y entonces tenemos que equivale a :
%E = 100 – ( G+R )
* Sustituyendo este valor en (8) entonces obtenemos una ecuación donde eliminamos la necesidad de medir «G» y » R»
%Zp = [ hfp * E ] / { hgV * ( C – 1 ) + hfP – hfA * C} (10)
Tómese nota de que la gran utilidad de la fórmula anterior consiste en que para calcular el % de combustible que se pierde en la purga Ud. sólo necesita conocer los ciclos de concentración la presión de trabajo a que opera la caldera y la temperatura del agua de alimentación, para buscar las entalpías en una tabla de vapor. Con esos datos Ud. puede calcular las pérdidas en las condiciones actuales y luego en las condiciones que permitan aumentar los ciclos de concentración y la diferencia entre ambos cálculos le dará el ahorro.
Es muy común que los ahorros que Ud. pueda lograr sean superiores al costo del tratamiento químico el cual permitirá el cambio en las condiciones de operación y si eso se cumple será muy difícil que el cambio propuesto no sea aceptado.
En el caso de que no disponga a mano de unas tablas de vapor , podrá tener resultados de muy buena precisión si utiliza las fórmulas siguientes para calcular las entalpías entre 10 y 200 PSIG.
Fórmulas para el cálculo de las entalpías
hgV = 0.140565 * P ( PSIG ) + 1172.23
hfP = 0.646042 * P (PSIG ) + 231.456
hfA = 0.9987 * T ( ° F ) – 31.8891
Por: Jorge Vieto
Fuente: Desarrollo Sostenible