Química Ambiental – 1º Parte
|
Introducción
|
En este tema, consideramos algunos aspectos de la química de nuestro ambiente, en especial sobre la atmósfera de la Tierra.
Tanto la atmósfera como la hidrosfera de nuestro planeta hacen posible la vida. El manejo de este entorno con el objetivo de mantener y reforzar la calidad de vida, es una de las preocupaciones más importante de nuestro tiempo. Es evidente que se requieren reformas drásticas y normas mucho más estrictas si queremos conservar la calidad de vida en el mundo. Como ciudadanos debemos participar en la instauración de leyes y reglamentos que tengan un impacto sobre nuestra salud, así como sobre la seguridad económica de nuestro país. Aun nuestras decisiones más sencillas como consumidores, requieren que valoremos los costos y los beneficios de nuestras acciones. Desafortunadamente, los impactos ambientales de nuestras decisiones no son evidentes en muchas ocasiones.
Cuánto mejor comprendamos los principios químicos que fundamentan las leyes fundamentan las leyes ambientales, mayores serán las oportunidades de formar juicios sólidos sobre temas económicos y políticos que afectan a nuestro entorno.
|
La atmósfera de la tierra
|
Debido a que la mayoría de nosotros no hemos estado muy alejados de la superficie terrestre, tendemos a dar por hecho las muchas formas en que la atmósfera determina el entorno en que vivimos. En esta sección examinaremos los aspectos más importantes de la atmósfera de nuestro planeta.
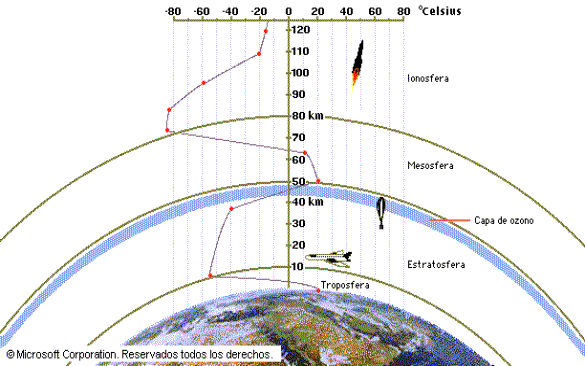
La temperatura de la atmósfera varía de un modo complejo de acuerdo con la altitud, como se ilustra en la figura 1.1. La atmósfera se divide en cuatro regiones, según este perfil de temperaturas. Justamente sobre la superficie, en la tropósfera, la temperatura decrece al aumentar la altitud hasta alcanzar un mínimo de 215K a 12Km. Casi toda la vida se manifiesta en la tropósfera. Vientos huracanados y brisas suaves, lluvia, cielos soleados, todo lo que consideramos como «clima» ocurre en esta región. Aún cuando volemos en un moderno jet supersónico entre ciudades distantes, no nos salimos de la tropósfera, aunque podemos llegar a estar cerca de su límite superior, llamado tropopausa.
Sobre la tropopausa, la temperatura aumenta con la altitud, alcanzando un máximo de 275K a los 50Km. Esta región se llama la estratosfera. Más allá de la estratosfera están la mesósfera y la termósfera. Observe en la figura 1.1que las temperaturas extremas en los límites son importantes porque la mezcla de la atmósfera a través de ellos es un proceso relativamente lento. Por ejemplo, los gases contaminantes generados en la tropósfera encuentran en su camino hacia la atmósfera con gran lentitud.
(Para ver el gráfico faltante haga click en el menú superior «Bajar Trabajo»)
En contraste con los cambios de temperatura que ocurren en la atmósfera, la presión disminuye de un modo regular al aumentar la altitud como se ilustra en la figura 1.2. Vemos que la presión atmosférica disminuye con más rapidez a menores que a mayores altitudes. La explicación de esta característica de la atmósfera está en su compresibilidad. Como resultado de la compresibilidad de la atmósfera, la presión disminuye del valor promedio de 760mm Hg a nivel del mar a 2.3×10-3 mm Hg a 100Km y a solamente 1.0×10-6 mm de Hg a 200Km. La tropósfera y la estratosfera juntas constituyen el 99.9% de la masa de la atmósfera; el 75% la constituye la masa de la tropósfera.
|
Composición de la atmósfera terrestre
|
La atmósfera es un sistema extremadamente complejo. Su temperatura y presión cambian dentro de amplios límites con la altitud, como acabamos de ver. La atmósfera esta sujeta al bombardeo de radiación y de partículas con gran energía provenientes del sol y de la radiación cósmica del espacio exterior. Esta energía tiene efectos químicos importantes, especialmente en los limites exteriores de la atmósfera. Además, debido al campo gravitacional de la Tierra, los átomos y las moléculas más ligeros tienden a elevarse. Como resultado de setos factores, la composición de la atmósfera no es uniforme.
En la tabla 1.1 se muestra la composición del aire seco a nivel del mar. Aunque existen trazas de muchas sustancias, N2 y O2 constituyen alrededor del 99% de la atmósfera. Los gases nobles y el CO2 constituyen la mayor parte del resto. Observe que la contribución de cada componente de la atmósfera, enunciando en la tabla 1.1, está dado en términos de su fracción molar. Esto es simplemente el número total de moles de todos los componentes en la muestra.
Tabla 1.1 Composición del aire seco cerca del nivel del mar
|
Componente *
|
Contenido(Fracción mol)
|
Peso Molecular
|
| Nitrógeno |
0.78084
|
28.013
|
| Oxígeno |
0.20948
|
31.998
|
| Argón |
0.00934
|
39.948
|
| Bióxido de carbono |
0.000330
|
44.0099
|
| Neón |
0.00001818
|
20.183
|
| Helio |
0.00000524
|
04.003
|
| Metano |
0.000002
|
16.043
|
| Kriptón |
0.00000114
|
83.80
|
| Hidrógeno |
0.0000005
|
02.0159
|
| Oxido Nitroso |
0.0000005
|
44.0128
|
| Xenón |
0.000000087
|
131.30
|
* El ozono, bióxido de azufre, bióxido de nitrógeno, amoniaco y monóxido de carbono, existen como gases traza en cantidades variables.
Al hablar de constituyentes traza de las sustancias, utilizamos comúnmente partes por millón (ppm) como unidad de concentración. Cuando se aplica a sustancias en solución, partes por millón se refiere a gramos de las sustancia por millón de gramos de solución. No obstante, al tratar con gases, una parte por millón se refiere a una parte por volumen en 1 millón de unidades de volumen y fracción molar son equivalentes. Así, 1ppm de un constituyente traza de la atmósfera indica que hay 1mol de ese constituyente en 1 millón de moles del gas total; es decir, la concentración en ppm es igual a la fracción molar multiplicada por 106 . Observe que en la tabla 1.1 se enuncia la fracción molar de CO2 en la atmósfera como 0.000330. Su concentración en ppm es 0.000330×106 =330ppm.
Antes de considerar los procesos químicos que ocurren en la atmósfera, revisemos algunas de las propiedades químicas importantes de sus dos componentes principales, N2 y O2. . Sabemos que la molécula de N2 tiene un enlace triple entre los átomos de nitrógeno. Esta unión es muy fuerte y es la responsable de la baja radiactividad del N2, , que sólo experimenta reacciones en condiciones extremas. La energía de unión O -O en O2 es mucho menor que para el N2 (tabla 1.4), y el O2 es, por consiguiente, mucho más reactivo que el N2 . El oxígeno reacciona con muchas sustancias para formar óxidos. Los óxidos de los no metales -por ejemplo SO2 -suelen formar soluciones ácidas cuando se disuelven en agua. Los óxidos de los metales activos y de otros metales en estado de oxidación bajo, -por ejemplo- forman soluciones básicas cuando se disuelven en agua.
|
Las regiones exteriores de la atmósfera
|
Aunque la porción exterior de la atmósfera, más allá de la estratosfera, contiene solamente una pequeña fracción de la masa de la atmósfera, juega un papel importante en la determinación de las condiciones de vida en la superficie terrestre. Esta capa superior forma el bastión de defensa externo contra el peligro de la radiación y las partículas de alta energía que bombardean continuamente al planeta. A medida que esto sucede, las moléculas y los átomos de la atmósfera superior experimentan cambios químicos.
Fotodisociación
El sol emite energía radiante dentro de límites muy amplios de longitudes de onda. Mientras más corta es la longitud de onda, más alta es la energía de las radiaciones en la zona del ultravioleta del espectro y tienen suficiente energía para ocasionar cambios químicos. Sabemos que la radiación electromagnética se puede representar como un flujo de fotones. La energía de cada fotón está dada por la relación E=hv, en donde h es la constante de Plank y v es la frecuencia de la radiación. Para que ocurra un cambio químico cuando la radiación llega a la atmósfera de la Tierra, se deben de satisfacer dos condiciones. Primero, debe haber fotones con suficiente energía para llevar a cabo un proceso químico determinado. Segundo, las moléculas deben absorber estos fotones. Este requisito significa que la energía de los fotones se convierte en otra forma de energía dentro de la molécula.
La ruptura de un enlace químico que resulta de la absorción de un fotón por una molécula se llama fotodisociación. Uno de los procesos más importantes que ocurren en la atmósfera superior, por arriba de los 120Km, es la fotodisociación de la molécula de oxígeno:
O2(g) + hv 2O(g) [1.1]
La energía mínima requerida para causar este cambio está determinada por la energía de disociación de O2 , 495kJ/mol.
La segunda condición que se debe satisfacer antes de que la disociación se lleve a cabo, es que el fotón debe ser absorbido por O2 . Afortunadamente para nosotros, el O2 absorbe gran parte de la radiación de alta energía de longitud de onda corta, proveniente del espectro solar, antes de que llegue a la atmósfera inferior. Al hacerlo se forma el oxígeno atómico, O. Agrandes altitudes, la disociación del O2 es muy importante. A 400 Km, solamente el 1% del oxígeno está en forma de O2; el otro 99% está en forma de oxígeno atómico. A 130Km, O2 y O son igualmente abundantes. Por debajo de esta altura, O2 es más abundante que O.
Debido a la energía de disociación del enlace de N2 , que es muy elevada (tabla 1.1), solamente los fotones de longitud de onda muy corta poseen suficiente energía para disociar está molécula. Además, N2 no absorbe fácilmente los fotones, aun cuando éstos tengan suficiente energía. El resultado general es que en la atmósfera superior se forma muy poco nitrógeno atómico debido a la disociación de N2 .
Fotoionización
En 1901, Guillermo Marconi llevó a cabo un experimento sensacional. Recibió en San Luis, Newfoundland, una señal de radio transmitida desde Land’s End, Inglaterra, a 2900Km de distancia. Como se creía que las ondas de radio viajaban en línea recta, se supuso que la comunicación por radio sobre la Tierra era imposible a grandes distancias. El exitoso experimento de Marconi sugirió que en alguna la atmósfera terrestre afectaba sustancialmente la propagación de las ondas de radio. Su descubrimiento dio lugar al estudio de la atmósfera superior. Hacia 1924, mediante estudios experimentales se estableció la existencia de electrones en la atmósfera superior.
Por cada electrón que existe en la atmósfera superior, hay un ion correspondiente con carga positiva. Los electrones en la atmósfera superior se deben principalmente a la fotoionización de moléculas, causada por la radiación solar. Para que se efectúe la fotoionización, un fotón debe ser absorbido por una molécula, y este fotón debe tener energía suficiente para remover al electrón de energía más elevada. Algunos de los procesos más importantes de ionización que se efectúan en la atmósfera superior, por arriba de los 90Km, aparecen en la tabla 1.2, junto con las energías de ionización y la l máx , la longitud de onda máxima de un fotón capaz de causar la ionización. Los fotones con energías suficientes para causar ionización, tienen longitudes de onda en la región de alta energía del ultravioleta. Estas longitudes de onda son filtradas completamente de la radiación que llega a la Tierra, como resultado de su absorción por la atmósfera superior.
Tabla 1.2 Procesos de ionización, energías de ionización, y longitudes de onda capaces de causar ionización
|
Proceso Energía de ionización
(kJ/mol) l máx(nm) |
|
N2 + hv N2+ + e- 1495 80.1
O2 + hv O2+ + e- 1205 99.3 O + hv O+ + e- 1313 91.2 NO +hv NO+ + e- 0890 134.5 |
|
Capa de ozono en la atmósfera superior
|
En contraste con el N2 , el O2 y el O, que absorben fotones con longitudes de onda menores de 240nm, el ozono es la sustancia más importante que absorbe fotones con longitudes de onda de 240 a 310nm. Consideremos cómo se forma el ozono en la atmósfera superior y cómo absorbe los fotones.
A altitudes inferiores a los 90 Km, la mayor parte de la radiación de longitud de onda corta capaz de producir fotoionización ha sido absorbida. La radiación capaz de disociar la molécula de O2 es tan intensa, sin embargo, que provoca la disociación de O2 (Ecuación 1.1) por debajo de los 30Km. Los procesos químicos que ocurren después de la fotodisociación de O2 en la región por debajo de 90Km, son muy diferentes de los procesos que ocurren a mayores altitudes.
En la mesósfera y la estratosfera, la concentración de O2 es mucho mayor que la de oxígeno atómico. Por consiguiente, los átomos de O que se forman en la mesósfera y la estratosfera sufren colisiones frecuentes con moléculas de O2 . Estas colisiones llevan a la formación del ozono, O3 :
O(g) + O2(g) O*3(g) [1.2]
El asterisco sobre O3 significa que la molécula de ozono contiene un exceso de enrgía. La reacción de O con O2 para formar O3 da como resultado la liberación de 105kJ/mol. Esta energía se debe eliminar de la molécula de O3 en un tiempo muy corto, o simplemente separa de nuevo la molécula en O2 y O. Esta descomposición es el proceso inverso del que formó el O3 . Las moléculas de O3 pueden liberar la energía en exceso chocando con otro átomo u otra molécula y transfiriendo el exceso de energía a ellas. Representemos el átomo o la molécula con la cuál choca el O3 como M. (Normalmente M es N2 u O2 debido a que éstas son las moléculas más abundantes). La formación de O3 y la transferencia de la energía excedente a M se resume en las ecuaciones siguientes:
O(g) + O2(g) Þ O*3 [1.3]
O*3(g) + M(g) » O3(g) + M*(g) [1.4]
O(g)+O2(g) + M(g) » O3(g) + M*(g) (neto) [1.5]
La velocidad a la que se forma el O3 depende de las velocidades relativas de las colisiones de estabilización entre O*3 y M (Ecuación 1.4) y la disociación de O*3 de nuevo a O2 y O (El proceso inverso de la ecuación 1:3). Las colisiones frecuentes favorecen la formación de O3 (Ecuación 1.4). Debido a la concentración de moléculas, que es mayor a altitudes menores la mayor parte de la radiación con suficiente energía para disociar O2 ha sido absurda. Por consiguiente, la mayor velocidad de formación de O3 ocurre alrededor de 50Km de altitud.
La molécula de ozono, una vez formada, no dura mucho. El ozono es capaz de absorber la radiación solar, lo que resulta en su descomposición en O2 y O. Debido a que solamente se requieren 105kJ/mol para este proceso, los fotones de longitud de onda menor de 1140nm tienen suficiente energía para disociar el O3 . Las absorciones más fuertes y más importantes, sin embargo, son las de fotones de 200 a 310nm. Sino fuera por la capa de ozono en la estratosfera, estos fotones de alta energía penetrarían a la superficie de la Tierra. La vida vegetal y animal como la conocemos no podía sobrevivir en presencia de esta radiación de energía tan elevada. El «escudo ozono» es, por consiguiente, para nuestro bienestar. Se debe notar, sin embargo, que las moléculas de ozono que forman este escudo indispensable contra la radiación para nuestro bienestar. Se debe notar, sin embargo, que las moléculas de ozono se que forman este escudo indespensable contra la radiación, representa solamente una fracción de los átomos de oxígeno que existen en la estratosfera. Esto se debe a que las moléculas de ozono destruyen continuamente a medida que se forman.
La fotodescomposición del ozono invierte la reacción que origina su formación. Tenemos así un proceso cíclico de formación y descomposición de ozono, que resume como sigue:
O2(g) + hv O(g) + O8g)
O(g) + O2(g) + M(g) O3(g) + M*(g) (Se libera calor)
O3(g) + hv O2(g) + O(g)
O(g) + O(g) + M(g) O2(g) + M*(g) (Se libera calor)
El primero y tercer procesos son fotoquímicos; utilizan un fotón solar para iniciar una reacción química. El segundo y cuarto procesos son reacciones químicas exotérmicas. El resultado neto de los cuatro procesos es un ciclo en el cuál la energía radiante solar se convierte en energía térmica. El ciclo de la atmósfera en la estratosfera es responsable del aumento de temperatura que llega a su máximo en la estratopausa, como se ilustra en la figura 1.1.
El esquema descrito arriba para la formación y la destrucción de las moléculas de ozono explica algunos hechos conocidos respecto a al capa de ozono. Sin embargo, se efectúan muchas reacciones químicas que implican otras sustancias y no sólo al oxígeno. Además, se deben considerar los efectos de la turbulencia y los vientos que mezclan la estratosfera. El panorama general es muy complicado. El resultado general de la formación de ozono y reacciones de remoción, acopladas con la turbulencia atmosférica y otros factores, es un perfil de ozono en la atmósfera superior como se muestra en la figura 1.3.
|
Disminución de la capa de ozono
|
En 1874, F Sherwood Rowland Y Mario Molina, de la Universidad de California en Irvine, propusieron que el cloro de los clorofluorcarbonos (CFCs) puede agotar la capa de ozono. Estas sustancias, principalmente CFI3 (Freón 11) y CF2Cl2 (Freón 12), se han usado en demasía como propelentes en latas de aspersores, como gases refrigerantes y acondicionadores de aire, y como agentes espumantes para plásticos. Son prácticamente no reactivos en la atmósfera inferior. Además, son relativamente insolubles en agua y por ello no son removidos de la atmósfera por la lluvia, ni se disuelven en los océanos. Desafortunadamente, la falta de reactividad que los hace comercialmente útiles, también les permite sobrevivir en la atmósfera y difundirse ocasionalmente en la estratosfera. Se estima que existen varios millones de toneladas de clorofluorcarbonos en la atmósfera.
A medida que los clorofluorcarbonos se difunden en la estratosfera, sufren la acción de la radiación de alta energía. Las longitudes de onda entre los 190 a 225nm causan la fotolisis, o ruptura inducida por la luz, de un enlace de carbono-cloro de los clorofluorcarbonos:
CFXCL4-X(g) + hv CFXCl3-X(g) + Cl(g) [1.6]
Los cálculos sugieren que la formación de átomos de cloro se efctúa a mayor velocidad a una altitud de 30Km.
El cloro atómico es capaz de llevar a cabo una reacción rápida con ozono para formar óxido de cloro, CLO, y oxígeno molecular. El CLO puede reaccionar con oxígeno atómico para formar nuevamente cloro atómico:
Cl(g) + O3(g) ClO(g) + O2(g) [1.7]
ClO + O(g) Cl(g) + O2(g) [1.8]
O3(g) + O(g) 2O2(g) neto [1.9]
El resultado neto de estas reacciones es la conversación de ozono en O2. Debido a que se utiliza el Cl en la primera etapa de este mecanismo y se forma en la segunda etapa, funciona como un catalizador. Se estima que cada átomo de Cl destruye alrededor de 100,000 moléculas de ozono antes de que él mismo sea destruido en otras reacciones.
Aunque las velocidades de difusión de las moléculas de la superficie de la tierra hacia la estratosfera parece muy lenta, se ha observado una pérdida de ozono que se cree causada por los clorofluorcarbonos. Desde fines de los setenta, los investigadores han encontrado una disminución anual de la capa de ozono sobre el Polo Sur, lo cual ocurre durante la primavera austral (Hemisferio del sur). Los niveles de ozono en octubre, tanto de 1987 como de 1989, disminuyeron a casi el 60% de los niveles en agosto. Ahora, los científicos han encontrado evidencia de que el Polo Norte sufrió una pérdida de ozono, similar, pero menos pronunciada durante el último invierno. Hay también indicaciones preliminares de disminución de la capa de ozono a latitudes menores.
Sergio Arteaga Segovia
IngenieroAmbiental