Optimización energética y degradación catalítica de materiales plásticos
La creciente producción y demanda de materiales plásticos de baja biodegradabilidad ha tenido como consecuencia que la acumulación de sus desechos sea un problema ambientalmente relevante. Una manera eficiente de solucionarlo es el desarrollo de catalizadores capaces de optimizar energéticamente el proceso de degradación o pirólisis de materiales plásticos. Además, esta degradación catalítica puede direccionar el craqueo molecular generando compuestos específicos de alto valor añadido.
El objetivo de este estudio es analizar una serie de catalizadores zeolíticos (particularmente un catalizador nanométrico sintetizado en laboratorio y otro micrométrico) que sean capaces de disminuir la temperatura de degradación del polietileno, permitiendo además generar selectivamente compuestos de alta demanda comercial. De los resultados obtenidos se constata que los catalizadores nanométricos tienen un mejor comportamiento al compararlos con las zeolitas micrométricas.
El estudio arroja como conclusión que si se controlan las propiedades del catalizador zeolítico, es posible disminuir la energía necesaria para la degradación térmica de polietilenos y optimizar así el craqueo de la cadena polimérica en forma controlada, obteniéndose compuestos gaseosos de alto valor agregado.
Debido a sus buenas propiedades y bajos costos, la demanda de materiales plásticos ha reflejado durante las últimas décadas un crecimiento constante no encontrado en otros materiales tradicionales[1]. En Europa y en Sudamérica se estima un crecimiento anual de entre el 4 y el 8%[2].
Esta gran demanda ha estado liderada por las poliolefinas, como por ejemplo polietileno (PE) o polipropileno (PP), ya que su rango de aplicaciones se ha extendido crecientemente, logrando reemplazar a otras clases de materiales.
Esta versatilidad ha permitido que hoy en día las poliolefinas sean los polímeros más importantes en la industria del plástico, llegando a representar más del 60% del volumen total de comercialización de este sector[1]. Actualmente la producción volumétrica de PE en el mundo es cercana a los 90 millones de toneladas métricas, representando cerca del 34% del mercado[3]. Se estima que una persona promedio en Europa consume anualmente 100 kilogramos de material plástico, lo que arroja un consumo total anual de 40 millones de toneladas[4,5]. Este elevado consumo tiene como consecuencia la existencia proporcional de grandes cantidades de desechos plásticos que, debido a su baja biodegradabilidad, han llegado a ser un problema ambiental de gran magnitud. Por ejemplo, Europa consumió 40 Mton de materiales plásticos en el año 2000, lo que se tradujo en 30 Mton de desechos[6].
Los desechos plásticos, al ser más voluminosos que los desechos orgánicos tradicionales, ocupan un gran volumen en los vertederos o basureros. Actualmente, en Europa cerca del 62% de todos los residuos plásticos son depositados en estos basureros[5]. Sin embargo, esta solución ha llegado a ser poco aceptada por la sociedad y existen crecientes presiones legislativas-medioambientales, como aquellas que esperan reducir en un 35% este tipo de desechos para 2020[7].
Además, los costos de este proceso, que genera gases explosivos y tóxicos, han aumentado. Una de las primeras medidas tomadas para tratar de disminuir este gran volumen de desechos plásticos fue el reciclado energético o la incineración directa para generar energía. Hoy en Europa se reutiliza el 23% del desecho original de esta manera[5]. Sin embargo, este tipo de reciclaje tiene una gran oposición social debido a la generación de gases tóxicos, sumado al hecho de que muchas veces no se logra una eficiente recuperación de la energía liberada.
Por otro lado, el reciclado mecánico, que involucra el fundido y el remoldeo de los materiales termoplásticos de desecho para producir un nuevo producto, tiene una alta aceptación social. Desafortunadamente, este tipo de material reciclado tiene una utilización muy limitada por su baja calidad, debido a las reacciones de degradación durante el proceso, la diferente calidad y naturaleza de los desechos plásticos, y la presencia de aditivos e impurezas provenientes del plástico original[ 8]. Además, muchas veces este tipo de producto es más costoso que el material virgen[7]. En el Reino Unido solo el 17% de los desechos plásticos es mecánicamente reciclado; el resto es dejado en vertederos o incinerado[7].
Dadas las complicaciones de los procesos tradicionales para reducir el volumen de desechos plásticos, recientemente se ha desarrollado una tecnología basada en la transformación de los residuos plásticos en hidrocarburos de alto valor agregado, los cuales sirven como productos químicos y/o combustibles. Una primera aproximación se basa en la degradación térmica controlada, que consiste en una descomposición del plástico a alta temperatura en atmósfera inerte para la generación de hidrocarburos de menor peso molecular que el polímero original, aunque con la limitación de que se necesitan temperaturas entre 500 y 800ºC, resultando productos de altos pesos moleculares y poco homogéneos. La degradación térmica de polímeros hacia materiales de bajo pesos molecula-tecnolores, por otro lado, tiene la desventaja de producir una distribución muy amplia de residuos[2]. Además, las reacciones son altamente endotérmicas, por lo que se requiere un alto consumo de energía[ 9]. De esta manera, la utilización de catalizadores sólidos parece ser una buena aproximación para resolver estos problemas. En particular, la temperatura de reacción es considerablemente menor (entre 350 y 550º C), reduciendo el consumo energético del proceso[6,10]. Además, mediante este método es posible controlar la fracción de productos con una reducción significativa en la distribución de los mismos, haciendo materiales de mayor valor agregado[11].
 |
Los catalizadores utilizados para optimizar el proceso de degradación térmica suelen ser sólidos porosos ácidos, tales como sílica-alumina amorfa, materiales mesoporosos ordenados y zeolitas[ 8], siendo estos últimos los más estudiados. Las zeolitas son aluminosilicatos microporosos cristalinos (naturales o sintéticos) con una estructura muy definida formada por unidades tetraédricas de SiO4o AlO4 que están unidas entre sí por puentes de oxígeno, generando una red de canales, cavidades y microporos de tamaño molecular muy preciso. Debido tanto a estas propiedades como a su inherente acidez, la zeolita es el componente principal en los catalizadores industriales usados en el proceso de craqueo catalítico del petróleo para la producción de gasolina.
 |
El craqueo catalítico aplicado a la degradación de poliolefinas ha estado enfocado principalmente hacia la transformación del polímero en productos gaseosos y líquidos de interés. En el caso del PE, por ejemplo, se ha reportado que el material mesoporoso Al-MCM-41 produce hidrocarburos dentro de la fracción de gasolinas, mientras que la zeolita ZSM- 5 dirige el craqueo hacia compuestos livianos con gran producción de hidrocarburos gaseosos y aromáticos[8]. En el caso del uso del catalizador Al-MCM-41, el craqueo ocurre por un mecanismo de escisión aleatoria debido a su gran tamaño de poro y mediana acidez. En contraste, en la zeolita HZSM-5 el mecanismo es por término de cadena producto de su pequeño tamaño de poro y su muy alta acidez[8]. Se ha demostrado que el tamaño de partícula del catalizador es importante, lo cual se confirmó analizando nanocristales de la zeolita ZSM-5, los cuales muestran una alta actividad de craqueo debido a su alta área superficial externa, produciendo una baja restricción difusional[8]. Resultados similares han sido encontrados estudiando zeolitas beta, donde se demostró que aquellas partículas con tamaño de cristal más pequeño (~ 100 nm) presentan la mejor actividad debido a su mayor área superficial, junto con una mayor producción de compuestos líquidos[12].
Pese a la evidencia reportada anteriormente, aún existe la necesidad de seguir profundizando el estudio de diferentes catalizadores zeolíticos en la degradación de poliolefinas. En particular, el efecto del uso de catalizadores nanométricos sobre la temperatura y la actividad catalítica de degradación de materiales plásticos es una variable que ha sido poco estudiada, y que a su vez presenta grandes potencialidades industriales. Por otro lado, dado el impacto ambiental de estas tecnologías, se requieren estudios que permitan la posibilidad de utilizar catalizadores naturales que faciliten el uso económico de esta tecnología para resolver un problema de gran magnitud en nuestros países. De esta manera, el objetivo de este artículo es estudiar el efecto del tipo de catalizador zeolítico en el proceso de degradación de desechos plásticos. En particular, se estudiará el efecto del tamaño de la partícula y su acidez sobre la temperatura de degradación y sobre los productos de degradación. Un esquema general de la idea conceptual detrás de nuestra investigación, es decir, del reciclaje químico de plásticos, se muestra en la figura 1.
Materiales y metodología
Preparación de zeolitas ácidas
La zeolita micrométrica (Nat) fue sometida a un intercambio iónico con una solución de HCl para obtener su forma protonada (H-Nat). El intercambio con Lantano se logró contactando la H-Nat con una solución de La(NO3)3, obteniéndose La-H-Nat.
La zeolita nanométrica estudiada es una ZSM-2 (NZeo) y fue obtenida utilizando la siguiente composición molar 0.53Li2O:0.5Al2O3:6TMAOH:3.4SiO2:315H2O, de acuerdo a lo reportado previamente [13]. Esta zeolita posee un diámetro de poro (dp) de 7,4 Å y al igual que la zeolita micrométrica, fue protonada (H-NZeo) y modificada con Lantano (La-H-NZeo). Micrografías por microscopia electrónica muestran que su tamaño de partícula promedio es de 100 nm.
Ensayo de degradación
Se llevó a cabo la degradación catalítica de PE en un reactor semibatch de Pyrex que fue calentado por un horno tubular con controlador programable. Luego se mezcló una cantidad definida de PE con el catalizador dentro del reactor.
El sistema se calentó a 400, 450 o 500° C en una rampa de aproximadamente 6°C/min, bajo un flujo de nitrógeno, y se dejó reaccionar durante 40 minutos una vez alcanzada la temperatura de estudio. Los productos gaseosos fueron capturados en bolsas de recolección de gases, y los líquidos recuperados en una trampa de frío de hielo y NaCl (-20º C), y posteriormente pesados. Los gases recolectados fueron analizados mediante un cromatógrafo de gases.
 |
La fracción gaseosa fue analizada mediante un cromatógrafo de gases (Perkin Elmer Clarus 500) equipado con un detector de llama ionizada (FID) y una columna capilar HP-Plot/Al2O3 (Agilent), lo que permitió determinar la presencia y concentración de diferentes hidrocarburos (C1-C6). Además, se utilizó una columna empacada 60/80 Carboxen 1000 (Supelco) en línea con un detector de conductividad termal (TCD) para el análisis de la cantidad de CO2.
El PE utilizado en el estudio es lineal, con un peso molecular promedio en peso de 120.000 g/mol, y fue sintetizado en nuestro laboratorio empleando un catalizador metalocénico Et(Ind)2ZrCl2 en presencia del co-catalizador metillaluminoxano en concentraciones de 3,5 x 106 mol de catalizador, razón Al/Zr de 3000, 2 bar, y 60º C. Los análisis termogravimétricos (TGA) fueron realizados en un equipo Netzsch TG 209 F1 Iris bajo ambiente de nitrógeno con un flujo de 25 ml/min desde temperatura ambiente hasta los 600º C a una velocidad de calentamiento de 20º C/min. Para cada experimento se mezclaron 4.7 mg de polímero (<120 mesh) con la cantidad deseada de catalizador (típicamente 2 mg, 30% de la masa total).
Resultados
Optimización de la degradación térmica
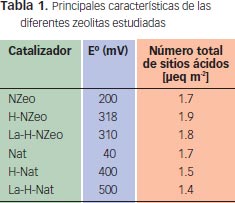
La tabla 1 presenta un resumen de los catalizadores estudiados y sus respectivas modificaciones químicas. Se destaca que la zeolita nanométrica (~100 nm) sin ningún tipo de modificación presenta una alta acidez si se compara, por ejemplo, con la zeolita micrométrica. Por otro lado, las modificaciones realizadas con protones y con lantano son efectivas para aumentar la acidez del catalizador, en especial la del catalizador micrométrico, donde se incrementa en más de un orden de magnitud. Es interesante notar que si bien el catalizador nanométrico puro presenta una alta acidez en comparación con el catalizador micrométrico, este último logra la más alta acidez cuando es modificado.
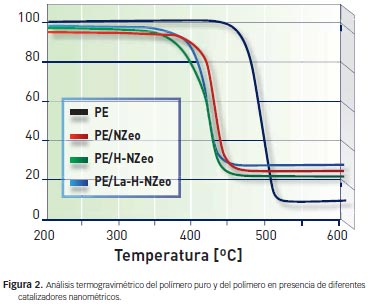
Cuando el polímero es degradado térmicamente sin ningún tipo de catalizador presenta una temperatura de máxima velocidad de degradación (Tmax) de 492.5º C. Sin embargo, cuando la degradación ocurre en presencia del catalizador nanométrico, se observa un marcado descenso en Tmax, llegando a valores de 418.7º C. No solo disminuye Tmax, sino también la temperatura inicial de degradación. Ejemplos de las curvas obtenidas por termogravimetría se muestran en la figura 2. En particular, se reflejan los resultados para el polímero puro y para el polímero en presencia de los diferentes catalizadores nanométricos.
 |
La tabla 2 muestra un resumen del efecto del tipo de partícula y su acidez sobre Tmax. También se muestra el valor de Tmax para el sistema sin catalizador. De esta tabla se deduce el marcado efecto de la acidez del catalizador y del tamaño del cristal. La zeolita micrométrica sin modificar no produce ningún efecto significativo en la degradación debido a su baja acidez. Sin embargo, cuando su acidez aumenta debido a las modificaciones realizadas, se logra disminuir Tmax en más de 50º C. Estos resultados muestran el fuerte impacto de la acidez del catalizador sobre los procesos de degradación.
Sin embargo, nuestros resultados también reflejan que el tamaño del catalizador es otra variable relevante, como se observa al comparar el catalizador NZeo con Nat. La partícula micrométrica modificada presenta una acidez que es considerablemente mayor a la acidez de la nanopartícula, pero esta última muestra el mayor descenso en Tmax. Estos resultados confirman que los catalizadores de menor tamaño, y por lo tanto mayor área superficial, actúan más eficientemente en los procesos de degradación de polímeros.
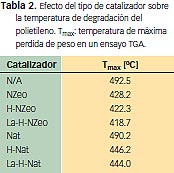 |
La marcada disminución de las temperaturas de degradación (tabla 2) tiene como consecuencia directa que la temperatura necesaria en un reactor para llevar a cabo la degradación térmica puede llegar a ser hasta 70º C menor que la necesaria en el caso de pirólisis directa. Por lo tanto, tal como se discutió en la introducción de este trabajo, el uso de este tipo de catalizadores puede reducir el consumo energético necesario para degradar térmicamente materiales poliméricos.
|
|
Productos de la degradación
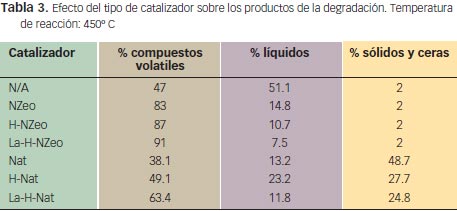
La tabla 3 presenta un resumen del efecto del catalizador sobre los productos de degradación. En particular se muestra el porcentaje en peso de los compuestos volátiles (gaseosos) con respecto a los líquidos o de mayor peso molecular. Esta tabla confirma que el tipo de partícula y su acidez no solo modifican la temperatura de degradación, sino también los productos de degradación. En particular, la zeolita nanométrica produce la mayor cantidad de compuestos gaseosos, y a mayor acidez mayor actividad catalítica para producir elementos volátiles. Adicionalmente, mediante una columna cromatográfica se pudo analizar la composición de los productos gaseosos, encontrándose que estos catalizadores son altamente selectivos hacia propileno (~ 70%) y propano (~ 15%). Este dato demuestra que la utilización de catalizadores zeolíticos promueve la selectividad hacia productos específicos de alto valor agregado.
 |
Discusión
Los resultados de este trabajo permiten discutir en detalle el efecto de dos variables relevantes en los procesos de degradación catalítica de materiales plásticos: tamaño de partícula y acidez. En particular, el efecto del uso de catalizadores nanométricos sobre la actividad catalítica de la degradación de materiales plásticos es una variable que ha sido poco estudiada, y que a su vez presenta grandes potencialidades. El uso de zeolitas nanométricas de mayor diámetro de poro (dp=7.4 Å para ZSM-2) que la nanozeolita ZSM-5 (dp~ 5.5 Å) mejora considerablemente la eficiencia del proceso, como se observa en este trabajo. Este efecto se ve reflejado en las temperaturas de degradación donde los catalizadores formados a partir de una estructura nanométrica logran la mayor disminución. Sin embargo, nuestros resultados confirman que la acidez no es el único parámetro que controla estos procesos, ya que el catalizador de mayor acidez no logra la mayor actividad. De esta manera, aunque los dos catalizadores estudiados en este trabajo permiten disminuir la temperatura de degradación, optimizando la energía necesaria para su procesamiento, la mayor área específica de NZeo lo hace más activo.
El efecto de la estructura nanométrica se ve confirmado analizando los compuestos de degradación. En la literatura científica es difícil encontrar rendimientos de compuestos volátiles mayores a 80% w/w [14,15,16,17], incluso en otros catalizadores nanométricos. Sin embargo, en nuestro caso los catalizadores basados en NZeo logran hasta un 90% de gases. Este resultado muestra que el tamaño del cristal y del poro del catalizador, junto con su acidez y su estructura cristalina, puede controlar la producción de compuestos gaseosos, como en el caso de la partícula
NZeo[18]. Esto se confirma analizando la zeolita micrométrica, ya que a pesar de tener una mayor acidez que la NZeo, produce una menor cantidad de compuestos gaseosos. Incluso el catalizador La-HNat, con mayor acidez, no logra la cantidad de compuestos gaseosos de la NZeo.
Nuestros resultados muestran la complejidad de estos sistemas, ya que diferentes reacciones compiten simultáneamente y cada una tendrá su propia cinética dependiendo de las propiedades de cada catalizador. En particular, la competencia entre la pirólisis térmica respecto al craqueo catalítico que se busca en el sistema puede hacer que se privilegien ciertas reacciones de deposición o de crecimiento de cadena, acumulándose compuestos pesados o livianos según el área específica del catalizador y su acidez[15,19].
 |
La elevada producción de compuestos gaseosos en las zeolitas estudiadas en este trabajo, especialmente la NZeo, se debe al proceso de sobrecraqueo, el cual se produce en ambientes muy ácidos[17]. De esta manera, los fragmentos iniciales del craqueo pueden difundirse a través de los poros del catalizador y seguir reaccionando en estas cavidades, produciendo más compuestos gaseosos[15,21].
Así, un catalizador de mayor área específica, como las partículas nanométricas, puede realizar mejor este proceso. Este modelo se ve confirmado analizando la menor cantidad de gases producidos por la zeolita micrométrica de tamaño micrométrico al compararla con el catalizador nanométrico, a pesar de que ambas poseen tamaños de poro similares (dp ~ 7.4 Å para la NatZeo). La disminución de las reacciones secundarias en las partículas de zeolitas producto de las limitantes estéricas asociadas al pequeño tamaño de poro explica la formación de hidrocarburos de tamaño mayor. De esta manera, se inhibe la reacción de los alquenos, lo que explica la selectividad de estos sistemas hacia la formación de propileno y otras moléculas de alquenos[16].
Es importante señalar que otras variables tales como el tamaño de poro pueden hacer que otras nanopartículas de zeolitas (e.g. beta) generen mayoritariamente compuestos líquidos, como se ha reportado recientemente[12].
Conclusiones
Nuestros resultados permiten concluir que la utilización de zeolitas es un método viable para optimizar el proceso de degradación de polietilenos. Modificando las características de la zeolita, en particular el tamaño de partícula y su acidez, es posible controlar las reacciones de degradación. Las zeolitas nanométricas presentan el mayor descenso en la temperatura de degradación y la mayor promaneducción de compuestos gaseosos cuando se comparan con las zeolitas micrométricas. Esta mejor actividad catalítica se explica por la mayor área superficial específica externa de los compuestos nanoestructurados, facilitando los procesos de craqueo superficial. Por otro lado, mediante modificaciones ácidas, las zeolitas micrométricas pueden presentar buena actividad para la degradación del polietileno, lo que permitiría su uso en aplicaciones industriales debido a su bajo precio. Por lo tanto, la utilización de estos catalizadores puede ser aplicada a nivel industrial para reducir el consumo energético en los procesos de degradación de desechos plásticos, generando a su vez compuestos volátiles de alto valor comercial, como, por ejemplo, propileno.
AGRADECIMIENTOS
Los autores agradecen el apoyo de FUNDACIÓN MAPFRE (Ayudas a la Investigación) y del Dr. Raúl Quijada durante la realización de esta investigación.
PARA SABER MÁS
[1] Galli P.,Vecellio G. Polyolefins: The most promising large-volume materials for the 21st century J. Polym. Sci. Part A: Polymer Chemistry. 2004;42:396-415.
[2] Neves I.C., Botelho G., Machado A.V., Rebelo P. The effect of acidity behaviour of Y zeolites on the catalytic degradation of polyethylene. Eur. Polym. J. 2006;42:1541- 1547.
[3] Chum P.S., Swogger K.W. Olefin polymer technologies-History and recent progress at The Dow Chemical Company. Progress in Polymer Science 2008;33:797–819.
[4] Association of Plastic Manufacturers in Europe (APME), Summary Report: An analysis of plastics consumption and recovery in Europe 2002&2003, Brussels, Belgium, 2004.
[5] Aguado J., Serrano D.P., San Miguel G., Escola J.M., Rodríguez J.M. Feedstock recycling of polyethylene in a two-step thermocatalytic reaction system. J. Anal. Appl. Pyrol. 2007;78:153-161.
[6] Hwang E.Y., Kim J.R., Choi J.K., Woo H.C., Park D.W. Performance of acid treated natural zeolites in catalytic degradation of polypropylene. J Anal. Appl. Pyrol. 2002;62:351-357.
[7] Garforth A.A., Ali S., Hernández- Martínez J., Akah A. Feedstock recycling of polymer wastes. Current Op. Sol. Stat. Mat. Sci. 2004;8:419-425.
[8] García R.A., Serrano D.P., Otero D. Catalytic cracking of HDPE over hybrid zeolitic-mesoporous materials J. Anl. Appl. Pyrol. 2005;74:379-386.
[9] Durmus A., Koc S.N., Pozan G.S., Kasgoz A. Thermal-catalytic degradation kinetics of polypropylene over BEA, ZSM-5 and MOR zeolites. Appl. Cat. B: Env. 2005;61:316-322.
[10] Fernandes G.J.T., Fernández V.J., Araujo A.S. Catalytic degradation of polyethylene over SAPO-37 molecular sieve. Cat. Today. 2002;75:233-236.
[11] Filho J.G.A.P., Graciliano E.C., Silva A.O.S., Souza M.J.B., Araujo A.S. Thermo gravimetric kinetics of polypropylene degradation on ZSM-12 and ZSM-5 catalysts. Catal. Today 2005;107:507-512.
[12] Lee, Y.J., Kim J.H., Kim S.H., Hong S.B., Seo G. Nanocrystalline beta zeolite: An efficient solid acid catalyst for the liquid-phase degradation of high-density polyethylene. Appl. Cat. B: Env. 2008; 83:160–167.
[13] Covarrubias C., Quijada R., Rojas R. Synthesis of nanosized ZSM-2 zeolite with potential acid catalytic properties. Microp. Mesop. Mat. 117 2009; 117:118-125.
[14] Manos G., Garforth A., Dwyer J. Catalytic degradation of highdensity polyethylene over different zeolitic structures. Ind. Eng. Chem. Res. 2000;39:1198-1202.
[15] Mastral J.F., Berrueco C., Gea M., Ceamanos J. Catalytic degradation of high density polyethylene over nanocrystalline HZSM-5 zeolite. Polym. Deg. Stab. 2006;91:3330-3338.
[16] Manos G., Garforth A., Dwyer J. Catalytic degradation of high-density polyethylene on an ultrastable- Y zeolite. Nature of initial polymer reactions, pattern of formation of gas and liquid products, and temperature effects. Ind. Eng. Chem. Res. 2000;39:1203-1208.
[17] Manos G., Yusof I.Y., Papayannakos N, Gangas NH. Catalytic cracking of polyethylene over clay catalysts. Comparison with an ultrastable Y zeolite. Ind. Eng. Chem. Res. 2001;40:2220-2225.
[18] Covarrubias C., Gracia F., Palza H. Catalytic degradation of polyethylene using nanosized ZSM-2 zeolite. Appl. Cat. A: General 2010;384:186-191.
[19] Singh B., Sharma N. Mechanistic implications of plastic degradation. Polym. Degrad. Stab. 2008;93: 561-584.
[20] Seo Y.H., Lee K.H., Shin D.H. Investigation of catalytic degradation of high-density polyethylene by hydrocarbon group type analysis. J. Anal. Appl. Pyrol. 2003;70:383-398.
Por: Francisco Contreras, Francisco Gracia y Humberto Palza*
Departamento de Ingeniería Química y Biotecnología, Facultad de Ciencias Físicas y Matemáticas, Universidad de Chile Santiago, Chile
*Investigador Principal. Dirección de Contacto: Beauchef 850, Santiago Chile
Cristian Covarrubias
Departamento de Ciencias Básicas, Facultad de Odontología, Universidad de Chile
Fuente: mapfre