El agua como agente extintor
Resumen
El agua presenta grandes propiedades fisicoquímicas con respecto a otras sustancias como el calor específico y de vaporización que le otorgan cualidades especiales, haciéndola un recurso además de abundante y económico, ideal y bondadoso para la extinción de incendios; por lo que se deben favorecer todas las condiciones necesarias para que la totalidad del agua empleada en esta labor, sea calentada y en especial evaporada por el calor del incendio, ya que en este cambio de fase se da el mayor consumo de calor.
Palabras claves: Enlace químico, puentes de hidrógeno, propiedades físicoquímicas, vapor, calor específico y de vaporización.
INTRODUCCIÓN
Todos los servicios de protección contra incendios del mundo emplean el agua como agente extintor predilecto en la mayoría de los procedimientos para la extinción de incendios, aunque para algunos solo es abundante y económica; este recurso posee otras cualidades que se deben tener en cuanta a la hora de emplearse en este trabajo. Por lo tanto con este documento se busca enriquecer la información de aquellos que han basado sus labores en este agente extintor sin otro concepto adicional ó soportado con argumentos de conocimiento organizado; además cuando se conoce con profundidad la herramienta con que se trabaja, se puede obtener la máxima eficiencia de esta; para esto se requiere entonces hacer uso de los números, conocimiento básico y cuantificación de las propiedades fisicoquímicas importantes del agua, por ser este el agente extintor más empleado en la labor de extinción de incendios.
El proceso de cuantificar nuestra interacción con la naturaleza se denomina medición y su importancia se puede ver en las palabras de Lord Kelvin “ Cuando uno puede medir aquello de lo que está hablando y expresarlo en números, sabe algo acerca de ello; pero cuando no puede medirlo, cuando no puede expresarlo en números, su conocimiento es escaso e insatisfactorio; podrá ser un principio de conocimiento, pero escasamente ha avanzado su conocimiento a la etapa de una ciencia” [1] ; por lo tanto se busca brindar al lector un conocimiento general sobre las propiedades y bondades del agua como agente extintor, además de abundante y económica; haciendo uso de los valores medidos y reportados para las propiedades de esta.
ESTADOS FÍSICOS Ó FASES DE LA MATERIA
Las moléculas que componen la materia se pueden encontrar agrupadas en tres estados físicos fundamentales o también llamados fases (sólido, líquido y gaseoso); las mezclas entre estados, dan lugar a la fase o estado coloidal como son las dispersiones de las moléculas de un líquido como el agua en un gas como el aire dando lugar a las neblinas; generadas por la modificación de chorros de fluidos a presión, con un accesorio como una boquilla; estas son un ejemplo típico de las dispersiones líquido / gas de la materia; esta es la forma más adecuada para trabajar con el fluido como agente extintor en el servicio de protección contra incendios, debido al aumento del área total de intercambio de calor. Los humos también son ejemplo de las dispersiones, en los cuales un sólido es dispersado en un gas como el aire, por ejemplo el carbón producto de la combustión incompleta. Los estados o fases que se involucran principalmente en este trabajo son el estado líquido, como se almacena y transporta el agua en los vehículos de incendio, el estado gaseoso ó mejor vapor† en el cual se transforma el agua líquida después de haber recibido energía en forma de calor por parte del incendio.
ESTRUCTURA MOLECULAR DEL AGUA
|
Figura Nº1. Modelo grafico de las |
La molécula tiene como formula química H2O, es decir esta compuesta por dos átomos de hidrógeno, unidos cada uno por un enlace químico covalente‡ a un átomo de oxígeno, el cual es muy electronegativo ó afín por los electrones de otro átomo; dando propiedades muy especiales al agua, ya que este es el responsable de la formación de los llamados puentes de hidrógeno§ entre las moléculas presentes en una masa** de este fluido; organizando las moléculas de agua con una orientación espacial adecuada, la cual provee a este fluido cualidades especiales como su punto de ebullición y la densidad en fase sólida.
La figura Nº1 muestra un modelo grafico de la orientación espacial para tres moléculas de agua; nótese que tan solo es un “modelo”, es decir, que este se usa para esquematizar el agua y no se esta expresando que esta disposición sea así en la realidad a nivel atómico. ! los átomos no son bolas y mucho menos están unidos por barras¡.
PROPIEDADES FÍSICO-QUÍMICAS DEL AGUA
Densidad
Las características especiales del agua se deben básicamente a las interacciones entre una molécula de agua y sus vecinas mediante puentes de hidrógeno, brindando al agua una estabilidad térmica adicional, haciendo entonces que el calor†† requerido para la transformación de agua líquida a vapor sea muy grande con respecto a muchos otros líquidos; además esta
cualidad también es la responsable de la variación en la densidad‡‡ del agua sólida ( hielo ) con respecto a la líquida; ya que este tipo de interacción entre las moléculas aumenta la separación entre ellas por un nuevo acomodamiento de toda la estructura y disposición de los átomos en el espacio, incrementando así el volumen ocupado por el grupo de moléculas y por lo tanto disminuyendo la densidad; diferencia por la cual un trozo de hielo flota sobre el agua líquida; es decir, que la densidad del agua sólida es menor a la líquida. Un ejemplo más ilustrativo es lo que sucede con un iceberg; cuando un témpano de hielo de gran tamaño flota sobre el agua del mar, con la característica de tener el mayor volumen sumergido bajo el agua o no visible para un observador que se encuentre en la superficie del mar, lo que ha causado grandes accidentes como en el famoso caso del Titanic. El autor espera que este ejemplo ilustre al lector no solo en la variación de la densidad del agua, sino también que siempre se tenga en cuanta para no despreciar algo por pequeño que se vea a primera vista; lo oculto puede ser más grande y traer un gran potencial de ayuda o peligro en una situación de emergencia, es decir, a su llegada al lugar, evalúe y contemple todas las posibilidades y con ellas tome las decisiones iniciales más adecuadas, las cuales podrá ir variando según la información que vaya obteniendo de la situación y los recursos con cuente en el lugar; pero siempre dando la prioridad a la seguridad de todas las personas y equipo a su cargo y demás involucrados en el incidente.
! El mundo esta hecho de pequeños detalles y muchos de ellos son la base de grandes logros para la humanidad¡.
INTERCAMBIO DE CALOR
Las leyes universales de conservación de la masa y energía, plantean en pocas palabras que la materia y la energía ni se crean, ni se destruyen, solo se transforman. Con base en la ley de conservación de la energía en el caso de los incendios, podemos decir que esta en forma de calor generado por una reacción de combustión§§, tiene que ser recibida por otro medio ó cuerpo cercano, incrementando la temperatura de los alrededores ó haciendo un trabajo sobre estos, por ejemplo calentando otros materiales y favoreciendo la degradación de estos para la formación de nuevos focos de fuego ( propagación por convección, conducción y radiación ); lo que se presenta como un fenómeno de transferencia de calor debido al gradiente*** de temperatura entre el incendio y un agente extintor como el agua o los alrededores; por lo tanto esta energía recibida realizará un trabajo sobre el agua o el material cercano. En el caso del agua líquida esta será calentada desde la temperatura inicial ( Ti ) hasta el punto de ebullición que tiene un valor de 100ºC (Tf ) a una de presión de un bar†††; el incremento de la temperatura se lleva a cabo a una velocidad que es función del calor específico ( Ce ) ( 1 cal. g
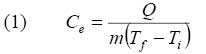 |
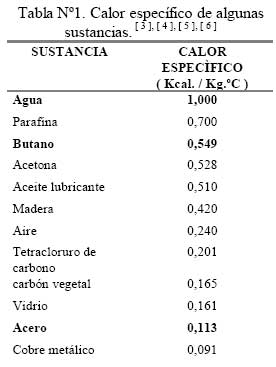
Por ejemplo para incrementar la temperatura de un gramo de agua ( m ) en un grado centígrado, se requiere una cantidad de calor ( Q ) de una caloría ó 4,18 Joule‡‡‡. En la tabla Nº1 se pueden observar los valores típicos para algunas sustancias.
 |
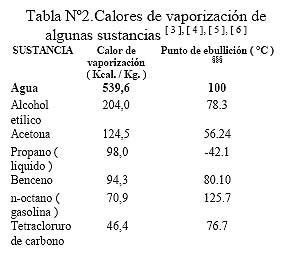
Cuando el agua líquida alcanza la temperatura de ebullición, otra cantidad de energía en forma de calor es requerida para llevar a cabo la transición o cambio de fase líquida a vapor, fenómeno que se conoce como vaporización y se da a la ††† Unidad de presión. 1 bar = 1,01325 atmósferas = 14,88 PSI ‡‡‡ Joule es la medida de energía del sistema internacional de unidades y 4,18 Joule = 1 caloría = 0,00396 BTU temperatura de ebullición; al calor requerido en este cambio de fase, se le denomina calor de vaporización ( Cv ), para el agua el valor es de 539,6 calorías por gramo. En la tabla Nº2 se pueden observar los valores típicos de calor de vaporización para algunos líquidos.
 |
Como se puede observar la cantidad de calor necesaria para evaporar un gramo de agua es 540 veces mayor al calor para subir la temperatura de ese mismo gramo de agua en un grado centígrado ó 6,75 veces el calor requerido para calentar un gramo de agua desde 20ºC hasta 100ºC ( 80 calorías ), como lo que sucedería en la extinción de incendios ; nótese que estos
valores implican que se debe dar prioridad a las condiciones de presión y caudales necesarios para que se evapore la mayor cantidad del agua que se esta empleando como agente extintor, en otras palabras, entre mayor sea la facilidad de evaporar el agua, mayor será la cantidad de calor retirado del incendio, además el flujo de calor es proporcional al área superficial total de intercambio, es decir, el área de contacto entre el incendio con los alrededores; esta puede ser incrementada por la cantidad de líneas de manguera (chorros ) con flujo permanente y de gran caudal que se usen en la extinción. Otra manera es variando el tamaño de la gota de agua a uno más pequeño, incrementando así el área superficial total de una masa de agua, mediante la modificación de presiones y tipos de accesorios en el final de la descarga de agua, en pocas palabras entre más pequeña sea la gota, con mayor facilidad se dará la evaporación; por lo tanto la combinación de estos parámetros permitirá disminuir el tiempo de extinción y aumentar la eficiencia del procedimiento.
Obsérvese que la masa de agua empleada, es la que recibe el calor generado por el incendio y adicionalmente la forma de empleo y/o área superficial total de intercambio de calor del agua utilizada, modifica el tiempo de extinción, reduciéndolo cuando se tiene un menor tamaño de la gota.
El vapor de agua que se genera en los incendios cuando se hace la extinción; presenta otra bondad de este fluido muy importante como desplazar los gases del lugar, por ejemplo el oxígeno presente en el ambiente y necesario para la combustión, eliminando entonces otro componente requerido para la continuación del incendio; fenómeno que se conoce como ventilación hidráulica; el cual se presenta por una convección forzada de los gases generados en el incendio y vapor de agua.
En este momento el agua se encuentra en fase de vapor a 100ºC y en menor cantidad esta misma masa de agua puede recibir calor adicional del incendio para llevar el vapor hasta una temperatura final ( Tf ) que depende de las condiciones del lugar del incendio, obteniéndose entonces vapor de agua calentado o sobre calentado; este último se presenta en condiciones muy extremas de confinamiento, temperaturas elevadas y presiones de saturación altas para el agua. Es importante tener en cuenta que el vapor calentado o sobrecalentado, es el causante de muchas quemaduras en bomberos que no usan la protección personal necesaria para estas situaciones y/o por exceso de confianza.
Como un modelo simple, ideal y de acuerdo con lo mencionado en el presente documento, para la aplicación general de los conceptos básicos; se plantean los siguientes ejercicios hipotéticos.
EJERCICIO Nº1
Situación :
En una planta química ó industria, se almacena gas butano comprimido ó licuado en un aunque que contiene una tonelada métrica del gas ( mb = 1000 Kg de butano ); construido en lamina de acero y con una masa de 1000 kg ( mt ). El sistema**** anterior de tanque-butano, fue sometido ó se vio involucrado en una situación de incendio, en la cual este alcanzó una temperatura de 500ºC ( Ti,t-b ). Se requiere entonces hacer el enfriamiento del sistema tanque-butano hasta una mínima temperatura de seguridad de 90ºC ( Tf,t-b ), sumergiendo†††† de alguna manera el sistema en el agua usada como agente refrigerante, la cual proviene de una de las operaciones de la planta a una temperatura de 50ºC; prefiriendo esta con el fin de amortiguar en parte el choque térmico generado por la gran diferencia de temperatura entre el sistema y los alrededores, minimizando una potencial fractura del material del tanque por esta causa.
Calcular la cantidad de agua requerida para el enfriamiento del sistema tanquebutano en estas condiciones; de tal manera que la temperatura final de la totalidad del agua sea 90ºC, es decir, que no se presente evaporación significativa.
Solución
Por conservación de la energía ( primera ley de la termodinámica ), el calor ( Qt-b ) que perderá ( – ) el sistema tanquebutano ( t-b ) para su enfriamiento hasta una temperatura segura de 90ºC ( Tf,t-b ) ; será igual al calor ( Qa ) recibido ( + ) por la masa de agua ( ma ) empleada para la refrigeración, balance energético que se representa con la siguiente expresión.
|
|
colocando la ecuación (2) en términos de la definición de calor específico (1) para cada componente del sistema butano, acero, agua y despejando la masa de agua que se requiere para realizar el enfriamiento, tenemos que (3):
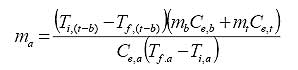 |
Reemplazando en la expresión (3) los valores para las temperaturas y masas disponibles y usando los calores específicos de la tabla Nº1 para el agua, butano y acero, la cantidad de agua a 50ºC requerida para el enfriamiento del sistema tanque-butano hasta 90ºC y sin que esta se evapore significativamente, es de 6785,5 Kg. (1795 galones )‡‡‡‡
EJERCICIO Nº2
Situación:
Supóngase el mismo sistema tanquebutano y condiciones del ejercicio Nº1 ; pero en este otro modelo de emergencia, se permitirá que el agua liquida a 50ºC se caliente hasta 100ºC ( Tf,a ) y luego se evapore ( vapor de agua a 100ºC ), es decir, se calculará la cantidad total de agua que será evaporada y necesaria para el enfriamiento del sistema hasta la temperatura de seguridad.
Solución
Las consideraciones conceptuales en este modelo son las mismas del anterior, solo que ahora se involucrará en el lado derecho de la expresión (3) la cantidad de calor necesario para evaporar toda el agua usada en el enfriamiento. Con el valor para el calor de vaporización del agua ( Cv,a ) de la tabla Nº2 ( 539,6 Kcal./Kg ), tenemos que (4):
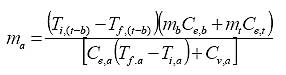 |
Sustituyendo en la expresión (4) los valores de las condiciones del ejercicio Nº1 y el calor de vaporización para el agua, se obtiene que la cantidad de agua a 50ºC que será evaporada para el enfriamiento del sistema, es de 460,3 Kg. ( 122 galones ); nótese que la cantidad de agua que debe ser usada para llevar el sistema tanque-butano hasta una temperatura segura, es tan solo el 6,8 % de la cantidad empleada para esta misma labor cuando la máxima temperatura alcanzada por el agua es de 90ºC, es decir, sin evaporarse.
CONCLUSIONES
Cuando se usa agua como agente extintor, la energía en forma de calor generado por el incendio, primero eleva la temperatura del agua hasta el punto de ebullición, luego y en la mayor proporción para el cambio de líquido a la fase vapor y tercero para elevar la temperatura del vapor.
Finalmente se puede concluir en general; que se deben favorecer todas las estrategias y mecanismos necesarios en la extinción de incendios cuando se emplea agua como agente extintor, para facilitar la evaporación de la mayor cantidad de este recurso; el cual presenta otras cualidades y propiedades fisicoquímicas !además de abundante y económica¡ que lo hacen valioso e indispensable en nuestro trabajo como bomberos.
Quedando entonces abierta la invitación a que todos llevemos nuestra labor y comunidad de bomberos, hacia una profesión que base sus procedimientos en el conocimiento de todos los fundamentos y propiedades de la materia, haciendo uso de los números y mediciones de los sistemas que trabajamos, para iniciarnos en el camino hacia una “ciencia de la protección contra incendios”.
! La extinción de incendios ideal, sería aquella en la cual los bomberos solo empleáramos la cantidad de agua necesaria para retirar el calor generado por el fuego, sin inundar el lugar ò mojar lo que no se ha quemado ¡
BIBLIOGRAFÌA
- [ 1 ] Trujillo.C.A; Sánchez R.J “Manual de procedimientos básicos de un laboratorio de química”; Universidad Nacional de Colombia. 2000. Pàgina 26
- [ 2 ] Brown, Lemay, Bursten; “Chemistry The Central Science”, Eighth edition, ( 2000 ), pàgina 159, Printice hall.
- [ 3 ] Tuve. Richard. L “Principios de la química de protección contra incendios” capítulo 5, 1993; Cepreven (NFPA NºTXT-2, 1976 )
- [ 4 ] Lide.D.R“Handbook of chemistry and Physics”, 6-3, 84th edition (2003-2004), CRC Press. Washington; DC
- [ 5 ] Susan B. “The Merck Index” eleventh edition 1822, ( 1989 ), Merck Co.
- [ 6 ] Lange N.A “Lange Manual de Química”, tomo III ( 1988 ). McGraw Hill
REFERENCIAS
† Entiéndase como vapor, al fluido que es susceptible de condensación, es decir, que este puede volverse líquido por acción de presión o disminución en la temperatura.
‡ Un enlace químico es la interacción entre dos átomos mediante los electrones de estos y se dice que esta unión es covalente cuando cada uno de los átomos aporta un electrón para la formación del enlace.
§ Un puente de hidrógeno es la interacción electrostática entre un hidrógeno y un átomo de oxigeno, nitrógeno ò fluor y se podría ver como un pseudoenlace, pero la energía requerida para el rompimiento de este es menor a la de un enlace químico.
** El término masa hace referencia a la cantidad de materia y no a la expresión que comúnmente se maneja como peso, el cual es físicamente la fuerza gravitacional que ejerce la tierra sobre la masa de los cuerpos.
†† Calor se entiende como la energía que es transferida de un cuerpo caliente a uno frío.
‡‡ Entièndase por densidad, la relación entre la masa de una sustancia y el volumen ocupado por esta.
§§ Una reacción es simplemente la transformación de la materia y en ocasiones esta transformación va acompañada del desprendimiento de calor cuando esta es exotérmica; por ejemplo la reacción de combustión en la que un combustible (agente reductor) reacciona con el oxigeno (agente oxidante) en presencia de energía para producir otros compuestos diferentes a los originales, generalmente gas carbónico, monóxido de carbono, agua, etc.
*** Entiéndase por gradiente, la fuerza impulsora para que se de el fenómeno de transporte de calor y para que se presente, tan solo se necesita que exista una diferencia de temperatura entre el sistema y los alrededores.
††† Unidad de presión. 1 bar = 1,01325 atmósferas = 14,88 PSI
‡‡‡ Joule es la medida de energía del sistema internacional de unidades y 4,18 Joule = 1 caloría = 0,00396 BTU
§§§ A una presión de 1 bar
**** Sistema es aquella porción del universo que se esta estudiando y esta definido por unos límites o fronteras.
†††† Esta labor se puede llevar a cabo mediante la inmersión del sistema en una piscina conteniendo el agua ò inundando el área del tanque, previamente diseñada para esto.
‡‡‡‡ 1 galón = 3,785 litros
Por: Jorge A. Garcés B.* Cuerpo de Bomberos Voluntarios de Sevilla Valle (Colombia)
* Departamento de química, Universidad Nacional de Colombia.
[email protected] ; [email protected]; [email protected]